Способ выявления микобактерий с поверхностей
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Способ выявления микобактерий с поверхностей предусматривает сбор исследуемого материала с поверхности смоченным физиологическим раствором тампоном и обработку его дезинфицирующим средством «Септустин» в виде 1%-ного водного раствора. При этом «Септустин» смешивают с суспензией исследуемого материала в соотношении 1:4 в течение 30 мин. Причем в общую экспозицию входят 15 мин центрифугирования при 3000 об/мин. Исследуемый материал центрифугируют в течение 15 мин при 3000 об/мин и осадок двукратно отмывают физиологическим раствором с помощью центрифугирования при том же режиме. Из осадка проводят посевы на плотную питательную среду при температурном и временном оптимуме с последующим выделением колоний и их идентификацией. Изобретение позволяет повысить точность лабораторных исследований и сократить сроки исследований. 12 табл., 6 пр.
Реферат
Способ выявления микобактерий с поверхностей
Изобретение относится к микробиологии и может быть использовано в эпидемиологических целях для выявления массивного загрязнения поверхностей микобактериями и контроля качества дезинфекционных мероприятий.
Туберкулез выделен в отдельную группу болезней, при которых объекты внешней среды имеют большое значение в возникновении и распространении данной инфекции. Развитие инфекционного и характер эпизоотического процесса определяются целым комплексом факторов, включая механизм передачи инфекции. Основными путями заражения туберкулезом являются аэрогенный и алиментарный. Учитывая, что при туберкулезе локализация возбудителя происходит во всем организме, то и его выделение происходит множественно (с мокротой при кашле, фекалии, молоко), а микобактерии, выделенные из организма больного животного, сохраняют свою вирулентность и жизнеспособность: в навозе - до 7 месяцев; в трупах - до года; в почве - более двух лет; в мясе - до года /1/, что обусловлено строением клеточной стенки и высоким содержанием в ней липидов и восков. Поэтому контаминированные объекты внешней среды - воздух, почва, вода, корма и продукты животноводства - играют важную роль в возникновении новых очагов туберкулеза. Микобактерии с утраченной вирулентностью при наличии восприимчивых животных приводят к проявлению инфекции /2, 3/. Атипичные микобактерии свободно размножаются в окружающей среде (почве, воде), их выделяют из почвы лугов, пастбищ, скотоводческих угодий, проб соломы, силоса, сена и сенажа, комбикорма, с овощей, из проб торфа, деревьев, а также водоемов, колодцев и водопроводной воды. При определенных условиях атипичные микобактерии, попадая в организм животных, могут приживаться в нем, вызывая сенсибилизацию к туберкулину, что объясняется антигенным родством их с возбудителем туберкулеза, тем самым давая перекрестную реакцию с туберкулином, и подтверждается выделением их из патологического материала от убитых животных, реагирующих на туберкулин /4, 5/. В естественных условиях происходит сенсибилизация крупного рогатого скота атипичными микобактериями /6/. В отдельных случаях некоторые виды атипичных микобактерий могут вызвать классические туберкулезные поражения (MAIS).
Все известные способы выявления микобактерий с поверхностей основаны на взятии смыва с поверхности смоченным тампоном, обработке исследуемого материала перед посевом для устранения посторонней микрофлоры и посеве на питательные среды. О наличии микобактерий и их количестве на исследуемых поверхностях судят на основании их роста на питательной среде /7/.
Выявление микобактерий с объектов окружающей среды осложняется чрезвычайной степенью загрязненности проб с объектов животноводческих помещений механическими примесями и банальной микрофлорой. Для подавления роста посторонней микрофлоры и выделения чистых культур возбудителей туберкулеза применяют различные методы его обработки кислотой, щелочью или другими химическими веществами различной концентрации при различной экспозиции в зависимости от степени загрязненности.
В практике микробиологических лабораторий в настоящее время используют растворы едкого натра (метод флотации О.В. Мартова, 1971), гипохлорита кальция и других растворов, растворы серной (А.Ф. Коржинская, 1926; К.К. Креслинг, 1929; А.Н. Маккавейская, 1956), соляной (Ю.А. Юденич, 1928), щавелевой кислот (метод Гона-Левенштейна-Сумиоши, который рассматривается нами в качестве аналога, предусматривает применение для предпосевной обработки исследуемого материала растворов серной кислоты концентрацией 3-5 или 6% или раствора щавелевой кислоты концентрацией 5 или 10% в соотношении: на 1 объемную часть материала 4 части кислоты, центрифугирование в течение 10-15 минут с частотой вращения 3000 мин, отмывание осадка 2-3 раза физиологическим раствором с помощью центрифугирования и последующее культивирование на плотной питательной среде /8/.
К недостаткам перечисленных способов следует отнести губительное, в некоторой степени, действие кислот и щелочей на микобактерии. Однако процент загрязнения остается высоким, особенно при обработке проб, снятых с объектов внешней среды. Растворы кислот в малых концентрациях для обработки исследуемого на наличие микобактерий материала не обеспечивают освобождение его от сопутствующей микрофлоры. Так, применение 3% растворов серной и соляной кислот и 5% раствора щавелевой кислоты при экспозиции 20-40 минут не обеспечивает стерильность посевов в 56% случаев, использование 2-4% растворов едкого натра неэффективно из-за небольшого процента высеваемости микобактерий. Используемые в медицинской практике детергенты для обработки непригодны, так как в 70-87,5% случаев не обеспечивают подавление роста сопутствующей микрофлоры в пробах, снятых с объектов внешней среды, и в гомогенатах биоматериала, полученного от животного /9/. При обработке материала 5%-ным раствором щавелевой кислоты без последующего промывания физиологическим раствором, как рекомендует Банникова Б.Н. (1980), рост микобактерий на средах Левенштейна-Йенсена, Финн II не происходит, так как рН среды в ней изменяется ниже 6, 8 /10/.
Цель изобретения - повышение точности лабораторной диагностики путем снижения количественных потерь и сохранения жизнеспособности микобактерий туберкулеза в исследуемом материале при сокращении времени лабораторных исследований.
Поставленная цель достигается оптимизацией условий предпосевной обработки применением дезинфицирующего средства «Септустин».
Дезинфицирующее средство «Септустин» (изготовитель ООО «Уралстинол БИО», Россия) рекомендовано для дезинфекции объектов ветеринарного надзора. Данный препарат из группы катионных ПАВ содержит в качестве дезинфицирующего вещества катамин АБ, а также спирт изопропиловый, неионогенное ПАВ, гидрокарбонат натрия и бромфеноловый синий, обладает широким спектром действия в отношении возбудителей инфекционных болезней бактериальной (включая туберкулез), вирусной и грибковой этиологии /11/.
Способ осуществляется следующим образом.
Пробы-смывы с поверхностей объектов окружающей среды обрабатывают дезинфицирующим средством «Септустин» в виде водного раствора 1,0% концентрации, который смешивают с суспензией исследуемого материала в соотношении 1:4 в течение 30 минут, причем в общую экспозицию входят 15 минут центрифугирования с частотой вращения 3000 об/мин, с последующей двукратной отмывкой физиологическим раствором центрифугированием при том же режиме.
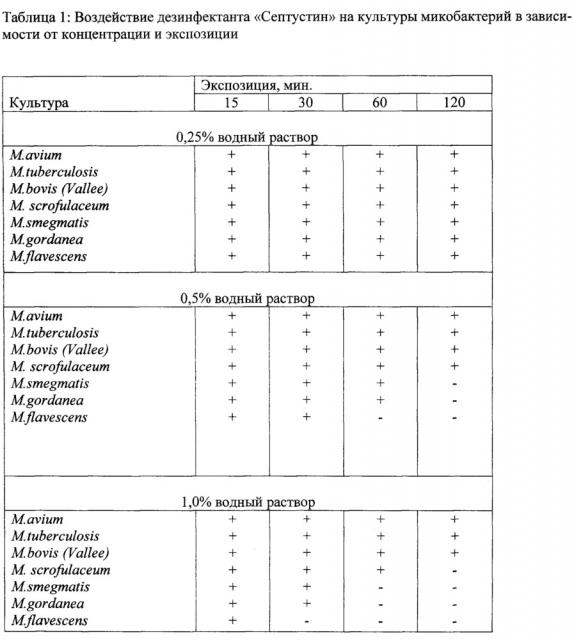
Параметры способа отрабатывались в процессе предварительных исследований по определению воздействия водных растворов дезинфицирующего средства «Септустин» различных концентраций на выживаемость и высеваемость микобактерий с объектов внешней среды, а также на банальную микрофлору (таблицы 1, 2).
Осуществимость и эффективность заявленного способа определяли на 5 пробах смывов с различных поверхностей животноводческого помещения (таблица 3).
Сущность способа поясняется примерами.
Пример 1. С поверхностей (1 кв. м) стены животноводческого помещения стерильным ватно-марлевым тампоном, увлажненным физиологическим раствором, отбирали 5 проб-смывов, которые объединяли в одну пробу.
Объединенную пробу делили на 5 образцов по 5 мл суспензии. Исследуемые образцы в объеме 5 мл центрифугировали в течение 25 минут с частотой вращения 3000 об/мин, после центрифугирования надосадочную жидкость сливали, центрифугат доводили стерильным физиологическим раствором до 1 мл (суспензия). Обработку исследуемого материала проводили дезинфицирующим средством «Септустин» в виде водного раствора 1,0% концентрации, который смешивают с суспензией исследуемого материала в соотношении 1:4 в течение 30 минут, затем исследуемый материал центрифугировали в течение 15 минут с частотой вращения 3000 об/мин (время центрифугирования входило в общую экспозицию воздействия 1,0% водного раствора «Септустина» на суспензию), после центрифугирования надосадочную жидкость сливали, осадок отмывали 2 раза стерильным физиологическим раствором с помощью центрифугирования при том же режиме. Из осадка проводили посевы на среду Левенштейна-Йенсена и Финн-2. Посевы инкубировали в термостате при 37°С и просматривали в течение 90 дней на наличие роста колоний микобактерий. На протяжении всего периода исследования по мере появления колоний готовили мазки с последующей окраской по Грамму и Цилю-Нильсену. Идентификацию выделенных культур проводили методом газожидкостной хроматографии (ГЖХ) на приборе Хромос ГХ 1000. Учитывали сроки появления роста, количество выделенных культур микобактерий. Контроль - метод Гона-Левенштейна-Сумиоши. Результаты представлены в таблице 4.
Как видно из таблицы 4, в опытных пробах на 10 сутки, а в контрольной пробе - на 12 сутки появились колонии желтого цвета. При окраске мазков по Цилю-Нильсену обнаружили тонкие палочки бледно-розового цвета, которые идентифицировали как M. gordonae, что подтвердили методом газожидкостной хроматографии (отсутствие туберкулостеариновой кислоты (С19 разв.), пик С14 и С14 разв. - двойной, полностью не разветвленный). Рост по всей поверхности отмечали в четвертой пробе, обработанной заявленным способом.
Пример 2. Выявление микобактерий с поверхности пола животноводческого помещения проводили, как в примере 1. Результаты представлены в таблице 5.
Как видно из таблицы 5, в третьей пробе на 10 день появились желтые блестящие колонии. В мазках, окрашенных по Цилю-Нильсену, обнаруживали тонкие палочки бледно-розового цвета. Культура идентифицирована методом газожидкостной хроматографии как M. scrofulacium (наличие высших миколовых кислот с числом углеродных атомов больше 20, пик C24:0 больше С22:0, пик С26:0 - отсутствует).
Пример 3. Выявление микобактерий с поверхности трубы животноводческого помещения проводили, как в примере 1. Результаты представлены в таблице 6.
Как видно из таблицы 6, в третьей и четвертой опытных пробах на 8 сутки выросли слизистые блестящие колонии желтого цвета. По результатам окраски по Цилю-Нильсену и по морфологическим признакам их идентифицировали как микобактерии, что подтверждено исследованием жирно-кислотного спектра клеток методом газожидкостной хроматографии. По хемотаксономическим характеристикам (четко выражены пики кислот с 17 и 19 атомами углерода и ненасыщенных жирных кислот с числом атомов углерода больше 20, преобладала бегеновая кислота С22:0, пик С26:0 отсутствовал), микобактерии идентифицировали как M. vaccae. Во всех пробах на 12 сутки появились колонии желтого цвета. При окраске мазков по Цилю-Нильсену обнаружили тонкие палочки бледно-розового цвета, которые идентифицировали как M. gordonae, что подтвердили методом газожидкостной хроматографии (отсутствие туберкулостеариновой кислоты (C19 разв.), пик С14 и С14 разв. - двойной, полностью не разветвленный).
Пример 4. Выявление микобактерий с поверхности навозного прохода животноводческого помещения проводили, как в примере 1. Результаты представлены в таблице 7.
Как видно из таблицы 7, на 10 день в третьей пробе появились желтые блестящие колонии. В мазках, окрашенных по Цилю-Нильсену, обнаруживались тонкие палочки бледно-розового цвета. Культура идентифицирована методом газожидкостной хроматографии как M. scrofulacium (наличие высших миколовых кислот с числом углеродных атомов больше 20, пик С24:0 больше С22:0, пик С26:0 отсутствует). В других пробах микобактерии не выявлялись.
Пример 5. Выявление микобактерий с поверхности кормушки животноводческого помещения проводили, как в примере 1. Результаты представлены в таблице 8.
Пример 6. Выявление микобактерий с поверхности поилки животноводческого помещения проводили, как в примере 1. Результаты представлены в таблице 9.
Как видно из таблицы 9, во всех пробах смывов с поверхности поилки появились колонии с бледно-желтым пигментом. В мазках при окраске по Цилю-Нильсену обнаружили мелкие тонкие кислотоустойчивые палочки и кокки. На хроматограммах пиков С26:0 отсутствовал, высота пика С24:0 значительно выше С22:0, пик C19:0 в значительном количестве, микобактерию идентифицировали как М. avium.
Результаты исследований обобщены в таблицах 10 и 11.
Пример 7. Провели выявление микобактерий в условиях хозяйства, неблагополучного по туберкулезу. Отбирали пробы с поверхностей объектов внешней среды (кормушек, стен, поилок). Результаты представлены в таблице 12.
Проведенные исследования подтвердили, что 1,0% водный раствор дезинфицирующего средства «Септустин» при 30 минутной экспозиции сдерживал развитие сопутствующей микрофлоры в материалах с поверхностей объектов внешней среды. Заявленный способ повышает достоверность результатов за счет повышения информативности исследований по выявлению микобактерий, отвечает современным требованиям при работе с заразным материалом, безопасный и эффективный при работе.
Источники информации
1. Кузин А.И. Туберкулез сельскохозяйственных животных и его профилактика. - М.: Росагропромиздат, 1992. - 189 с.
2. Деканосидзе Т.В. Устойчивость микобактерий туберкулеза крупного рогатого скота к аэрозолям дезинфицирующих средств и режимы их применения: автореф. дис. … канд. вет. наук: 16.00.03 / Деканосидзе Тамара Владимировна. - М., 1989. - 24 с.
3. Дудницкий, И.А. Дезинфекция на фермах, неблагополучных по бруцеллезу и туберкулезу / И.А. Дудницкий, В.Ф. Бричко, И.Д. Беляев и др. // Ветеринария. - 1989. - №6. - С. 7-11.
4. Тупота С.Г. Комплексная сравнительная оценка эпизоотической ситуации туберкулеза животных и методов его диагностики в сельхозпредприятиях и личных подсобных хозяйствах: дис. … канд. вет. наук: 06.02.02 / Тупота Сергей Григорьевич. ИЭВСиДВ. - Новосибирск, 2010 - 149 с.
5. Шаров А.Н. Эффективность методов прижизненной диагностики туберкулеза / А.Н. Шаров, Л.А. Ерошенко, И.П. Суханов и соавт. // Ветеринария. - 2002. - №2. - С. 16-18.
6. Щуревский В.Е. Быстрорастущие атипичные микобактерии и их значение в патологии крупного рогатого скота / В.Е. Щуревский, Н.П. Овдиенко, A.M. Кадочкин, В.Н. Кудяков // Ветеринария. - 1984. - №9. - С. 29-30.
7. Приказ МЗ РФ 109 от 21 марта 2003 года «О совершенствовании противотуберкулезных мероприятий в Российской Федерации», Приложение 11 «Инструкция по унифицированным микробиологическим исследованиям при выявлении, диагностике и лечении туберкулеза» с. 205-206.
8. ГОСТ 26072-89 (СТ СЭВ 3457-81) Животные и птица сельскохозяйственные. Методы лабораторной диагностики туберкулеза.
9. Щуревский В.Е., Косенко В.И., Тажгалиев Н.М. Использование различных химических веществ для обработки патологического материала и влияние их на высеваемость микобактерий. / Бюллетень ВИЭВ. - 1987. - В. 64. - С. 15-19.
10. Колычев Н. характеристика микобактерий, изолированных из объектов звероводческих и животноводческих ферм. / Сб. н.т. Сиб. НИВИ. - 1976. - С. 47-55.
11. Наставление по применению препарата «Септустин» для дезинфекции объектов ветнадзора. Уралстинол. - БИО. – 2002.
Способ выявления микобактерий с поверхностей, включающий сбор исследуемого материала с поверхности смоченным в физиологическом растворе тампоном, обработку исследуемого материала перед посевом для устранения посторонней микрофлоры, посев на плотную питательную среду с последующим культивированием при температурном и временном оптимуме, отличающийся тем, что в качестве средства, ингибирующего развитие посторонней микрофлоры, используют дезинфицирующее средство «Септустин» в виде водного раствора 1,0% концентрации, который смешивают с суспензией исследуемого материала в соотношении 1:4 в течение 30 минут, причем в общую экспозицию входят 15 минут центрифугирования при 3000 об/мин, с последующей двукратной отмывкой физиологическим раствором центрифугированием при том же режиме.