Новое индансульфамидное производное
Иллюстрации
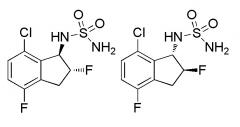
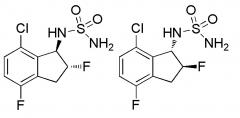
Показать всеНовые индансульфамидные производные, или их фармацевтически приемлемая соль, такие как N-[(1S)-2,2,5,7-тетрафтор-2,3-дигидро-1H-инден-1-ил]сульфамид, N-[(1S)-2,2,4,7-тетрафтор-2,3-дигидро-1H-инден-1-ил]сульфамид, (+)-N-(2,2,4,6,7-пентафтор-2,3-дигидро-1H-инден-1-ил)сульфамид, характеризуются действием улучшения индекса тяжести припадка (балл) на мышиной модели киндлинга. Таким образом, соединения или их соль предполагаются в качестве лекарственного средства для лечения эпилепсии. 8 н.п. ф-лы, 10 табл., 3 ил., 31 пр.
Реферат
Область техники
[0001] Настоящее изобретение относится к новым индансульфамидным производным и противоэпилептическому лекарственному средству, содержащему их.
Уровень техники
[0002] Эпилепсия представляет собой одно из наиболее распространенных расстройств центральной нервной системы, и в мире насчитывается более 50 миллионов больных. Согласно определению ВОЗ эпилепсия представляет собой "хроническое заболевание головного мозга различной этиологии, характеризующееся повторяющимися припадками (эпилептическими припадками), вследствие избыточных электрических разрядов нейронов головного мозга, которые сопровождаются рядом клинических и лабораторных проявлений".
[0003] В качестве эпилептических припадков известны, например, парциальные припадки, такие как простые парциальные припадки, сложные парциальные припадки, и вторичные генерализованные припадки, абсансы, миоклонические припадки, тонические припадки, клонические припадки, тонические припадки, тонико-клонические припадки, атонические припадки, синдром Уэста и синдром Леннокса-Гасто.
Основным направлением лечения эпилепсии является фармакотерапия с применением противоэпилептических средств (AED). Целью лечения эпилепсии является устранение припадков и предупреждение побочных действий в ходе лечения. Лечение с помощью противоэпилептических средств начинают, в основном, с одного лекарственного средства.
Для терапии с помощью одного лекарственного средства обычно подбирают два или три вида лекарственных средств по очереди. Если монотерапия не является успешной, применяется политерапия.
У приблизительно 70% пациентов с вновь развившейся эпилепсией при применении монотерапии ожидается ремиссия припадков.
Однако известно, что у оставшихся 30 процентов пациентов фармакотерапия, в том числе политерапия, не может контролировать эпилептические припадки.
[0004] Примерами выпускаемых противоэпилептических средств является карбамазепин, этосуксимид, фенобарбитал, фенитоин, примидон, вальпроат натрия, зонисамид, фелбамат, габапентин, ламотриджин, топирамат, тиагабин, леветирацетам, окскарбазепин, эсликарбазепин, прегабалин, лакозамид, руфинамид, триметадион, сультиам, ацетазоламид, вигабатрин, производные бензодиазепина (клоназепам, клобазам, нитразепам, диазепам), перампанел, ретигабин и т.д. (непатентная литература 1).
Эти известные противоэпилептические средства оказывают воздействие путем ингибирования гипервозбудимости нейронов.
Одной из серьезных проблем при терапии с помощью противоэпилептических средств является токсичность вследствие их ингибиторного воздействия на неврологическую функцию (головокружение, нистагм, диплопия, сонливость, рвота, атаксия, психологический симптом, усталость и безволие и т.д.).
Большинство этих традиционных противоэпилептических средств характеризуются побочными действиями с дозозависимым эффектом, и это является серьезной проблемой, ведущей к ограничению выбора терапевтических средств и их дозы.
Побочные действия также ухудшают качество жизни пациентов с эпилепсией, поскольку требуют долгосрочного введения дозы.
[0005] Таким образом, востребованы лекарственные средства, которые являются лучшими в разнице между эффективной дозой и нейротоксическими дозами.
Что касается 1-индансульфамидов, то низкомолекулярные соединения известны в следующей патентной литературе 1 и 2, а также непатентной литературе 2.
Перечень библиографических ссылок
Патентная литература
[0006] Патентная литература 1: патент США №3383414.
Патентная литература 2: патент США №3709677.
Непатентная литература
[0007] Непатентная литература 1: Shrivastava et al., "An overview on antiepileptic drugs" Drug Discoveries & Therapeutics., Vol. 6, No. 4, pp. 178-193, 2012.
Непатентная литература 2: Claudiu T. Supuran et al., "Novel sulfamides as potential carbonic anhydrase isoenzymes inhibitors", Bioorg. Med. Chem., Vol. 21, 1379-1385, 2013.
Краткое описание изобретения
Техническая проблема
[0008] Целью настоящего изобретения является получение нового соединения, характеризующегося действием по улучшению индекса тяжести припадка (балла) на мышиной модели киндлинга.
Решение проблемы
[0009] Мышиная модель корнеального киндлинга известна как простая и эффективная экспериментальная модель эпилепсии. (Epilepsy Research Vol. 92, 2010, p163-169). Авторы настоящего изобретения продолжают скрининг с использованием модели животных с киндлингом в качестве модели эпилепсии. При этом авторы настоящего изобретения также продолжают интенсивные исследования по снижению нейротоксического эффекта.
В результате этих исследований авторы настоящего изобретения обнаружили, что новые 1-индансульфамидные соединения характеризуются сильным ингибиторным эффектом в отношении эпилепсии, и достигли целей настоящего изобретения.
[0010] А именно настоящее изобретение относится к:
[1] соединению, или его фармацевтически приемлемой соли, выбранному из группы:
1) N-[(1S)-2,2,5,7-тетрафтор-2,3-дигидро-1H-инден-1-ил]сульфамида,
2) N-[(1S)-2,2,4,7-тетрафтор-2,3-дигидро-1H-инден-1-ил]сульфамида,
3) (+)-N-(2,2,4,6,7-пентафтор-2,3-дигидро-1H-инден-1-ил)сульфамида,
4) N-[(1S*)-5-циано-2,2-дифтор-7-метил-2,3-дигидро-1H-инден-1-ил] сульфамида,
5) (-)-N-(7-хлор-2,2,5-трифтор-2,3-дигидро-1H-инден-1-ил)сульфамида,
6) (-)-N-(7-хлор-2,2,4-трифтор-2,3-дигидро-1H-инден-1-ил)сульфамида,
7) (-)-N-(7-хлор-2,2-дифтор-2,3-дигидро-1H-инден-1-ил)сульфамида,
8) (-)-N-(7-хлор-2,2,6-трифтор-2,3-дигидро-1H-инден-1-ил)сульфамида,
9) (+)-N-(5-хлор-2,2,7-трифтор-2,3-дигидро-1H-инден-1-ил)сульфамида,
10) N-[(1S)-2,2-дифтор-7-метил-2,3-дигидро-1H-инден-1-ил]сульфамида,
11) N-[(1S)-2,2,5-трифтор-7-метил-2,3-дигидро-1H-инден-1-ил]сульфамида,
12) N-[(1S*)-2,2,4-трифтор-7-метил-2,3-дигидро-1H-инден-1-ил]сульфамида,
13) N-[(1S*)-7-(дифторметил)-2,2-дифтор-2,3-дигидро-1H-инден-1-ил]сульфамида,
14) N-[(1R*,2R*)-2,4,7-трифтор-2,3-дигидро-1H-инден-1-ил]сульфамида,
15) (-)-N-[(1R*,2R*)-7-хлор-2,4-дифтор-2,3-дигидро-1H-инден-1-ил]сульфамида,
16) (+)-N-[(1R*,2R*)-7-хлор-2,4-дифтор-2,3-дигидро-1H-инден-1-ил]сульфамида,
17) (-)-N-[(1R*,2R*)-7-хлор-2,5-дифтор-2,3-дигидро-1H-инден-1-ил]сульфамида,
18) (+)-N-[(1R*,2R*)-4-хлор-7-фтор-2-метокси-2,3-дигидро-1H-инден-1-ил]сульфамида,
19) (+)-N-(7-хлор-4-фтор-2,3-дигидро-1H-инден-1-ил)сульфамида,
20) (±)-N-(5-фтор-7-метил-2,3-дигидро-1H-инден-1-ил)сульфамида,
21) (-)-N-(4-фтор-7-метил-2,3-дигидро-1H-инден-1-ил)сульфамида,
22) (+)-N-(4-фтор-7-метил-2,3-дигидро-1H-инден-1-ил)сульфамида,
23) (+)-N-(7-метил-2,3-дигидро-1H-инден-1-ил)сульфамида,
24) (±)-N-(5-хлор-7-метил-2,3-дигидро-1H-инден-1-ил)сульфамида,
25) (-)-N-(4-хлор-7-фтор-2,3-дигидро-1H-инден-1-ил)сульфамида,
26) (+)-N-(7-хлор-5-циано-2,3-дигидро-1H-инден-1-ил)сульфамида,
27) (-)-N-(7-хлор-5-циано-2,3-дигидро-1H-инден-1-ил)сульфамида,
28) (-)-N-(5-хлор-7-фтор-2,3-дигидро-1H-инден-1-ил)сульфамида,
29) N-[(1S)-4,7-дифтор-2,3-дигидро-1H-инден-1-ил]сульфамида,
30) (+)-N-(7-хлор-2,3-дигидро-1H-инден-1-ил)сульфамида,
31) (+)-N-(5-циано-7-метил-2,3-дигидро-1H-инден-1-ил)сульфамида,
32) (-)-N-(5-циано-7-метил-2,3-дигидро-1H-инден-1-ил)сульфамида,
33) N-[(1S)-7-хлор-5-фтор-2,3-дигидро-1H-инден-1-ил]сульфамида
и
34) (-)-N-(4,6,7-трифтор-2,3-дигидро-1H-инден-1-ил)сульфамида;
[2] соединению, или его фармацевтически приемлемой соли, выбранному из группы:
1) N-[(1S)-2,2,5,7-тетрафтор-2,3-дигидро-1H-инден-1-ил]сульфамида,
2) N-[(1S)-2,2,4,7-тетрафтор-2,3-дигидро-1H-инден-1-ил]сульфамида,
3) (-)-N-(7-хлор-2,2,5-трифтор-2,3-дигидро-1H-инден-1-ил)сульфамида,
4) (-)-N-(7-хлор-2,2-дифтор-2,3-дигидро-1H-инден-1-ил)сульфамида,
5) N-[(1S)-2,2-дифтор-7-метил-2,3-дигидро-1H-инден-1-ил]сульфамида,
6) N-[(1S)-2,2,5-трифтор-7-метил-2,3-дигидро-1H-инден-1-ил]сульфамида,
7) N-[(1S)-4,7-дифтор-2,3-дигидро-1H-инден-1-ил]сульфамида,
8) N-[(1S)-7-хлор-5-фтор-2,3-дигидро-1H-инден-1-ил]сульфамида
и
9) (-)-N-(4,6,7-трифтор-2,3-дигидро-1H-инден-1-ил)сульфамида;
[3] N-[(1S)-2,2,5-трифтор-7-метил-2,3-дигидро-1H-инден-1-ил]сульфамиду или его фармацевтически приемлемой соли;
[5] (-)-N-(7-хлор-2,2,5-трифтор-2,3-дигидро-1H-инден-1-ил)сульфамиду или его фармацевтически приемлемой соли;
[6] N-[(1S)-2,2,5,7-тетрафтор-2,3-дигидро-1H-инден-1-ил]сульфамиду или его фармацевтически приемлемой соли;
[7] N-[(1S)-2,2-дифтор-7-метил-2,3-дигидро-1H-инден-1-ил]сульфамиду или его фармацевтически приемлемой соли;
[8] N-[(1S)-4,7-дифтор-2,3-дигидро-1H-инден-1-ил]сульфамиду или его фармацевтически приемлемой соли; и
[9] фармацевтической композиции для лечения эпилепсии, содержащей соединение или его фармацевтически приемлемую соль согласно любому из вышеприведенного [1]-[3] и [5]-[8].
Полезные эффекты изобретения
[0011] Соединения или их фармацевтически приемлемая соль согласно настоящему изобретению характеризуются эффектом подавления припадка (ED50) на мышиной модели киндлинга. Таким образом, соединения по настоящему изобретению можно применять в качестве терапевтического средства для лечения эпилепсии.
Краткое описание графических материалов
[0012] Фиг. 1 представляет собой график, показывающий результат тестового примера 2 при введении соединения из примера 1.
Фиг. 2 представляет собой график, показывающий результат тестового примера 2 при введении соединения из примера 11.
Фиг. 3 представляет собой график, показывающий результат тестового примера 2 при введении соединения из примера 6.
Описание вариантов осуществления
[0013] Настоящее изобретение описано подробно ниже.
[0014] Хотя могут присутствовать полиморфы кристаллов, соединение не ограничено каким-либо из полиморфов и может присутствовать в виде монокристаллической формы или смеси монокристаллических форм. Соединение также включает некристаллическую форму.
Кроме того, соединение согласно настоящему изобретению может образовывать фармацевтически приемлемую соль или различные сольваты.
[0015] Далее объясняются значения выражений, символов и т.п., описанных в настоящем описании.
[0016] "Фармацевтически приемлемая соль" в настоящем описании конкретно не ограничена, кроме того, что она образует соль соединения и является фармацевтически приемлемой.
[0017] Сольват означает состояние, при котором растворитель, используемый в реакции или в кристаллизации, включается в кристалл без образования ковалентной связи с молекулой или ионом соединения. Примеры сольвата представляют собой гидрат, этанолат и т.п.
[0018] Соединения исходных веществ, промежуточные соединения и различные реагенты, используемые при получении соединения, могут образовывать соли или сольваты, при этом все они варьируют в зависимости от исходного вещества, используемого растворителя и т.п., и они конкретно не ограничены, кроме того, что они не ингибируют реакцию. Также используемый растворитель варьирует в зависимости от исходного вещества, реагента и т.п. и конкретно не ограничен, кроме того, что он не ингибирует реакцию и, безусловно, растворяет исходное вещество в определенной степени. Когда соединения получают в виде свободных форм, их можно превращать в приемлемые соли или сольваты с помощью традиционных способов.
[0019] Различные изомеры соединений или промежуточных соединений по настоящему изобретению (такие как геометрические изомеры, оптические изомеры, ротамеры, стереоизомеры, таутомеры и т.п.) можно очищать и выделять с применением обычных способов разделения, например, перекристаллизации, образования диастереоизомерных солей, ферментативного разделения и различных хроматографических способов (таких как тонкослойная хроматография, колоночная хроматография и газовая хроматография).
[0020] Соединения или их фармацевтически приемлемые соли можно составлять с помощью традиционных способов, а примеры готовых лекарственных форм включают пероральные составы (такие как таблетки, гранулы, порошки, капсулы и сиропы), инъекционные растворы (для внутривенного введения, внутримышечного введения, подкожного введения и внутрибрюшинного введения) и препараты для наружного применения (такие как составы для трансдермальной абсорбции (такие как мази и пластыри), назальные препараты и суппозитории).
[0021] Пероральные твердые составы, такие как таблетки, капсулы, гранулы и порошки, обычно могут содержать от 0,001 до 99,5 масс. %, предпочтительно от 0,01 до 90 масс. % и т.п. соединений или их фармацевтически приемлемых солей.
[0022] При производстве пероральных твердых составов таблетки, гранулы, порошки и капсулы можно получать путем добавления разбавителей, связующих, разрыхлителей, скользящих веществ, красителей и т.п. к соединениям или их фармацевтически приемлемым солям, при необходимости, и обработки с помощью традиционных способов. Эти составы при необходимости также можно покрывать пленкой.
[0023] Примеры разбавителей включают лактозу, кукурузный крахмал и микрокристаллическую целлюлозу, примеры связующих включают гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу, а примеры разрыхлителей включают карбоксиметилцеллюлозу кальция и кроскармелозу натрия.
[0024] Примеры скользящих веществ включают стеарат магния и стеарат кальция, а примеры красителей включают оксид титана.
[0025] Примеры средств для пленочного покрытия включают гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу и метилцеллюлозу.
[0026] Безусловно, любые наполнители, описываемые выше, не ограничены этими примерами.
[0027] При производстве инъекционных растворов (для внутривенного введения, внутримышечного введения, подкожного введения и внутрибрюшинного введения) их можно производить путем добавления регуляторов pH, буферов, суспендирующих средств, солюбилизирующих средств, антиоксидантов, консервантов (антисептиков), средств для регуляции тоничности и т.п. к соединениям или их фармацевтически приемлемым солям, при необходимости, и обработки с помощью традиционных способов. Также путем лиофилизации можно получать лиофилизированные составы, подлежащие растворению перед применением. Эти инъекционные растворы можно вводить, например, внутривенно, подкожно или внутримышечно.
[0028] Примеры регуляторов pH и буферов включают органические кислоты или неорганические кислоты и/или их соли, примеры суспендирующих средств включают метилцеллюлозу, полисорбат 80 и карбоксиметилцеллюлозу натрия, примеры солюбилизирующих средств включают полисорбат 80 и полиоксиэтиленсорбитан монолаурат, примеры антиоксидантов включают α-токоферол, примеры консервантов включают метилпарагидроксибензоат и этилпарагидроксибензоат, а примеры средств для регуляции тоничности включают глюкозу, хлорид натрия и маннит; однако, безусловно, наполнители не ограничены этими примерами.
[0029] Эти инъекционные растворы обычно могут содержать от 0,00001 до 99,5 масс. %, предпочтительно от 0,0001 до 90 масс. % соединений или их фармацевтически приемлемых солей.
[0030] При производстве препаратов для наружного применения составы для трансдермальной абсорбции (такие как мази и пластыри), назальные капли, суппозитории и т.п. можно производить путем добавления основных материалов и, при необходимости, эмульгаторов, консервантов, регуляторов pH, красителей и т.п., описанных выше, к соединениям или их фармацевтически приемлемым солям и обработки с помощью традиционных способов.
[0031] В качестве основных материалов можно применять традиционно используемые различные сырьевые материалы для фармацевтических препаратов, квазилекарственных средств, косметических средств и т.п., и примеры включают сырьевые материалы, такие как животные и растительные масла, минеральные масла, сложноэфирные синтетические масла, воски, высшие спирты и очищенная вода.
[0032] Эти препараты для наружного применения обычно могут содержать от 0,00001 до 99,5 масс. %, предпочтительно от 0,0001 до 90 масс. % соединений или их фармацевтически приемлемых солей.
[0033] Дозировка лекарственного препарата согласно настоящему изобретению, как правило, варьирует в зависимости от симптома, возраста, пола, массы тела и т.п., но считается приемлемым, если эта дозировка достаточна для получения требуемого эффекта. Например, для взрослого используют дозировку от приблизительно 0,1 до 5000 мг (предпочтительно от 0,5 до 1000 мг, более предпочтительно от 1 до 600 мг) в день в виде одной дозы в течение одного или нескольких дней или в виде 2-6 разделенных доз за один день.
[0034] Настоящее изобретение также включает меченные изотопом соединения, и такие соединения являются такими же, как соединения, за исключением того, что один или несколько атомов замещены атомом (атомами) с атомной массой или массовым числом, отличным от атомной массы или массового числа, обычно обнаруживаемых в природе. Изотопы, которые можно включать в соединения, представляют собой, например, изотопы водорода, углерода, азота, кислорода, фосфора, фтора, серы и хлора, и они включают 2H, 3H, 11C, 14C, 13N, 15O, 18F, 32P и 35S.
[0035] Соединения или их фармацевтически приемлемые производные (такие как соли), содержащие вышеописанные изотопы и/или другие изотопы находятся в пределах формулы изобретения настоящего описания. Меченные изотопом соединения по настоящему изобретению, например, соединения, в которые включены радиоизотопы, такие как 3H и/или 14C, пригодны для анализов по распределению в тканях в качестве лекарственных препаратов и/или субстратов. Считается, что применимыми являются 3H и 14C вследствие легкости их получения и обнаружения. Считается, что изотопы 11C и 18F применимы для PET (позитронно-эмиссионной томографии), и все эти изотопы применимы для визуализации мозга. Замещение тяжелыми изотопами, такими как 2H, дает определенные терапевтические преимущества, такие как повышение времени полужизни in vivo из-за более высокой метаболической стабильности или снижение требуемой дозы, и, следовательно, считается, применимым при определенных обстоятельствах. Меченные изотопом соединения можно постоянно получать путем осуществления процедур, раскрытых в примерах, с применением легкодоступных меченных изотопом реагентов вместо реагентов, не меченных изотопом.
[0036] Соединения можно применять в качестве химических зондов для захвата целевых белков среди биоактивных низкомолекулярных соединений. А именно соединение можно превращать в зонд для аффинной хроматографии, фотоаффинный зонд и т.п. путем введения маркирующей группы, линкера и т.п. в фрагмент, не являющийся структурным фрагментом, необходимый для проявления активности соединения, при помощи методики, описанной в J. Mass Spectrum. Soc. Jpn., Vol. 51, No. 5, 2003, pp. 492-498 или WO 2007/139149 и т.д.
[0037] Примеры маркирующих групп, линкеров и т.п., используемых для химических зондов, включают группы, показанные в группе, состоящей из (1)-(5) ниже:
(1) белок-маркирующих групп, таких как фотоаффинные маркирующие группы (такие как бензоильная группа, бензофеноновая группа, азидогруппа, карбонилазидогруппа, диазиридиновая группа, еноновая группа, диазогруппа и нитрогруппа) и химические аффинные группы (такие как кетоновая группа, в которой α-углеродный атом замещен атомом галогена, карбамоильная группа, сложноэфирная группа, алкилтио-группа, акцепторы Михаэля, такие как α,β-ненасыщенные кетоны и сложные эфиры, и эпоксидная группа),
(2) расщепляемых линкеров, таких как -S-S-, -O-Si-O-, моносахариды (такие как глюкозная группа и галактозная группа) или дисахариды (такие как лактоза), и олигопептидные линкеры, расщепляемые с помощью ферментативных реакций,
(3) групп-меток для fish-анализа, таких как биотин и 3-(4,4-дифтор-5,7-диметил-4H-3a,4a-диаза-4-бора-s-индацен-3-ил)пропионильная группа,
(4) обнаруживаемых маркеров, таких как группы с радиоизотопной меткой, такой как 125I, 32P, 3H и 14C; группы для флуоресцентного мечения, такие как флуоресцеин, родамин, дансил, умбеллиферон, 7-нитрофуразанил и 3-(4,4-дифтор-5,7-диметил-4H-3a,4a-диаза-4-бора-s-индацен-3-ил)пропионильная группа; хемилюминесцентные группы, такие как люциферин и люминол; и ионы тяжелых металлов, такие как ионы металлов-лантаноидов и ионы радия; или
(5) групп, связанных с твердофазными носителями, такими как стеклянные гранулы, стеклянные подложки, титрационные микропланшеты, агарозные гранулы, агарозные подложки, полистирольные гранулы, полистирольные подложки, полиамидные гранулы и полиамидные подложки.
[0038] Зонды, полученные путем введения маркирующих групп и т.п., выбранных из группы, состоящей из (1)-(5) выше, в соединения в соответствии со способом, описанным в вышеприведенных документах и т.п., можно использовать в качестве химических зондов для обнаружения меченых белков, применимых, например, для поиска целей для новых лекарственных средств.
Примеры
[0039] Соединения можно получать, например, при помощи способов, описанных в примерах ниже, и эффекты соединений можно подтверждать при помощи способов, описанных в тестовых примерах ниже. Однако эти способы являются иллюстративными, и их можно менять без отступления от объема настоящего изобретения, и настоящее изобретение, в любом случае, не огранено следующими конкретными примерами.
[0040] Соединения, с которыми связаны названия публикаций и т.д., были получены в соответствии с этими публикациями и т.д.
[0041] Все аббревиатуры, используемые в данном описании, являются традиционными, известными специалистам в данной области. В нижеследующих примерах использованы следующие аббревиатуры.
AcOEt: этилацетат
BAST: бис(2-метоксиэтил)аминосеры трифторид
Bn: бензил
Boc: трет-бутоксикарбонил
DCM: дихлорметан
DMF: N,N-диметилформамид
DMSO: диметилсульфоксид
1H-ЯМР: спектрометрия протонного ядерного магнитного резонанса
ВЭЖХ (HPLC): высокоэффективная жидкостная хроматография
I.D.: внутренний диаметр
LC-MS: жидкостная хроматография с масс-спектрометрией
м-: мета-
н-: нормальный-
NBS: N-бромсукцинимид
o-: орто-
п-: пара-
PPTS: п-толуолсульфонат пиридиния
SelectfluorTM: N-фтор-N'-хлорметил-триэтилендиамин-бис(тетрафторборат)
т-: третичный-
TBS: трет-бутилдиметилсилил
TEA: триэтиламин
THF: тетрагидрофуран
THP: тетрагидропиран
Z(Cbz): бензилоксикарбонил
[0042] “Комнатной температурой” в следующих примерах и примерах получения, как правило, называется от приблизительно 10°C до приблизительно 35°C. "%" обозначает масс. %, если не указано иное. Соотношение растворителей при хроматографии на силикагеле показывает объемное соотношение растворителей, подлежащих смешиванию.
[0043] Химические сдвиги в спектрах протонного ядерного магнитного резонанса регистрировали в единицах δ м.д. (ppm) относительно тетраметилсилана, а константы взаимодействия записывали в герцах (Гц). Паттерны обозначены как с: синглет, д: дублет, т: триплет, кв: квартет, м: мультиплет, шир.с: широкий синглет.
[0044] Оптическое разделение соединений осуществляли при помощи ВЭЖХ-системы GILSON (насос; основной насос модели 305, дополнительный насос модели 306, головка насоса 50SC, динамический миксер модели 811D/A, манометрический модуль модели 806, УФ-детектор; детектор ультрафиолетового и видимого диапазонов модели 155, инжектор, устройство для отбора фракций; модель 215, колонка; выбранная из DAICEL CHIRALPAK® AD-H, IA, IB, IC, ID, IE, IF, DAICEL CHIRALCEL®, OD-H, OJ-H, 20 мм I.D.×250 мм).
После обнаружения фракций с помощью УФ-детектора оптическое вращение (+/-) измеряли с использованием детектора оптического вращения (OR-2090, JASCO, ртутно-ксеноновая (Hg-Xe) лампа, 150 Вт).
Что касается хроматографии, то при описании колоночной хроматографии на силикагеле использовали систему для параллельной препаративной хроматографии YAMAZEN (колонка: колонка YAMAZEN Hi-FlashTM (силикагель), размер; S (16×60 мм), M (20×75 мм), L (26×100 мм), 2L (26×150 мм) или 3L (46×130 мм)), сферический силикагель для хроматографии PSQ 60BTM от FUJI SILYSIA CHEMICAL CO., LTD., силикагель для хроматографии BW-300TM от Fuji Silysia Chemical Co., Ltd., Wakogel ® C-200 (Wako Pure Chemical Industries, Ltd.) или силикагель 60 (70-230 меш) от Merck Ltd. Япония.
Также при описании колоночной хроматографии на NH-силикагеле использовали систему для параллельной препаративной хроматографии YAMAZEN (колонка: колонка YAMAZEN Hi-FlashTM (амино), размер S (16×60 мм), M (20×75 мм), L (26×100 мм), 2L (26×150 мм) или 3L (4×130 мм)) или NH-СИЛИКАГЕЛЬ (200-350 меш) от FUJI SILYSIA CHEMICAL CO., LTD.
В номенклатуре соединений в настоящем описании (±) и (RS) представляют рацемическую смесь, а (+)-, (-)-, (R) и (S) представляют (+), (-), (R) и (S) конфигурации энантиомеров соответственно. И "*" в стерической конфигурации показывает относительную конфигурацию, и если не указано конкретно, это означает определенный энантиомер.
Кроме того, обозначения "(1R*,2R*)-" будут представлять взаимоотношения между хиральными центрами в контексте относительной конфигурации, т.е. определенного энантиомера, характеризующегося конфигурацией (1R, 2R) или (1S, 2S).
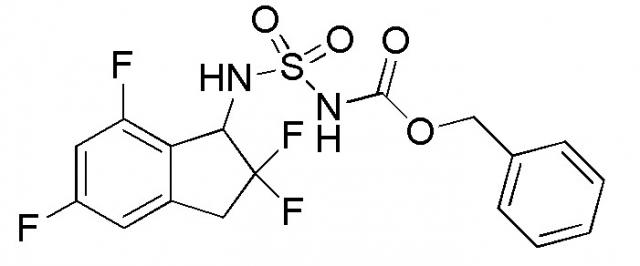
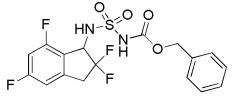
[0045] Пример 1
Синтез N-[(1S)-2,2,5,7-тетрафтор-2,3-дигидро-1H-инден-1-ил]сульфамида
Синтез 2,5,7-трифтор-2,3-дигидро-1H-инден-1-она
SelectfluorTM (1,16 г, 3,27 ммоля) добавляли к раствору 5,7-дифтор-1-инданона (номер по CAS 84315-25-3, 500 мг, 2,97 ммоля) в MeOH (20 мл) при комнатной температуре. Смесь нагревали с обратным холодильником в течение 2 часов и охлаждали до комнатной температуры. Затем растворитель отгоняли при пониженном давлении. Осадок обрабатывали DCM и нерастворимое вещество отфильтровывали. Затем растворитель отгоняли при пониженном давлении. Осадок растворяли в MeCN (10 мл) и 5N HCl (5 мл). Раствор перемешивали при комнатной температуре в течение 1 часа, а затем концентрировали in vacuo. Осадок разделяли между AcOEt и H2O. Органический слой промывали солевым раствором, высушивали над MgSO4, и концентрировали in vacuo с получением титульного соединения (547 мг, 2,94 ммоля).
1H-ЯМР (400 МГц, CDCl3)
δ м.д. 3,11-3,36 (м, 1H), 3,49-3,77 (м, 1H), 5,10-5,40 (м, 1H), 6,82 (тд, J=9,0, 1,9 Гц, 1H), 6,90-7,04 (м, 1H).
[0046] (2)
Синтез 2,2,5,7-тетрафтор-2,3-дигидро-1H-инден-1-она
т-Бутилдиметилсилилтрифторметансульфонат (1,00 мл, 4,35 ммоля) добавляли к раствору продукта, полученного в примере 1-(1) (540 мг, 2,90 ммоля), и TEA (1,21 мл, 8,70 ммоля) в DCM (20 мл) при 0°C. Смесь перемешивали при комнатной температуре в течение 5 часов. Затем к реакционной смеси добавляли диэтиловый эфир и насыщенный водный Na2CO3 и слои разделяли. Органический слой последовательно промывали 1N HCl, насыщенным водным Na2CO3 и солевым раствором, и высушивали над Na2SO4. Растворитель выпаривали in vacuo и осадок высушивали при пониженном давлении.
Осадок растворяли в MeCN (20 мл) и SelectfluorTM (1,13 г, 3,19 ммоля) добавляли при комнатной температуре. После перемешивания смеси при той же температуре в течение 11 часов растворитель отгоняли при пониженном давлении. Осадок растворяли в DCM и нерастворимое вещество отфильтровывали. Фильтрат концентрировали in vacuo. Осадок очищали посредством колоночной флеш-хроматографии (колонка Yamazen HI-FLASHTM с силикагелем размера L, 20 мл/мин, градиент 10%-50% AcOEt в н-гептане) с получением титульного соединения в виде белого твердого вещества (532 мг, 2,61 ммоля).
1H-ЯМР (400 МГц, CDCl3)
δ м.д. 3,57 (т, J=12,4 Гц, 2H), 6,74-6,94 (м, 1H), 6,95-7,08 (м, 1H).
[0047] (3)
Синтез 2,2,5,7-тетрафтор-2,3-дигидро-1H-инден-1-амина
Ацетат аммония (4,27 г, 55,4 ммоля) добавляли к раствору продукта, полученного в примере 1-(2) (377 мг, 1,85 ммоль), в изопропаноле (16 мл) при комнатной температуре и смесь нагревали с обратным холодильником в течение 30 мин. Цианоборгидрид натрия (348 мг, 5,54 ммоля) добавляли к реакционной смеси и перемешивали с обратным холодильником в течение 7 часов. После охлаждения до комнатной температуры к реакционной смеси добавляли AcOEt и 2N NaOH и слои разделяли. Органический слой концентрировали in vacuo. К осадку добавляли воду и разделяли между AcOEt и 1N HCl. Водный слой подщелачивали 2N NaOH и экстрагировали, используя AcOEt. Органический слой высушивали над Na2SO4, выпаривали и высушивали с получением титульного соединения в виде желтого масла (210 мг, 1,02 ммоль).
ESI-MS; m/z 206 [M+H]+.
1H-ЯМР (400 МГц, CDCl3)
δ (м.д.): 3,26-3,55 (м, 2H), 4,59 (дд, J=13,3, 5,3 Гц, 1H), 6,61-6,86 (м, 2H).
[0048] (4)
Синтез бензил N-(2,2,5,7-тетрафтор-2,3-дигидро-1H-инден-1-ил)сульфамоилкарбамата
К раствору в DCM (10 мл) продукта, полученного в примере 1-(3) (200 мг, 0,975 ммоль), при комнатной температуре добавляли [(бензилокси)карбонил]{[4-(диметилимино)пиридин-1(4H)-ил]сульфонил}амид (номер по CAS 1037211-09-8, 654 мг, 1,95 ммоля, полученный согласно способу, описанному в WO 2008083248) и TEA (0,545 мл, 3,90 ммоль). Полученный раствор перемешивали в течение 24 часов с обратным холодильником. После охлаждения до комнатной температуры к реакционной смеси добавляли AcOEt и 1N HCl. Слои разделяли и органический слой высушивали над MgSO4 и выпаривали in vacuo. Осадок очищали посредством колоночной хроматографии (силикагель, 30% AcOEt в н-гептане) с получением титульного соединения в виде белого твердого вещества (316 мг, 0,755 ммоля).
ESI-MS; m/z 441 [M+Na]+.
1H-ЯМР (400 МГц, CDCl3)
δ (м.д.): 3,25-3,54 (м, 2H), 5,14-5,38 (м, 3H), 5,72 (шир. с, 1H), 6,72 (т, J=9,4 Гц, 1H), 6,79 (д, J=7,8Гц, 1H), 7,30-7,46 (м, 5 H).
[0049] (5)
Синтез N-[(1S)-2,2,5,7-тетрафтор-2,3-дигидро-1H-инден-1-ил]сульфамида
Палладий на угле (10 масс./масс. %, 30 мг, 0,028 ммоль) добавляли к раствору продукта, полученного в примере 1-(4) (310 мг, 0,741 ммоль), в MeOH (5 мл) и AcOEt (5 мл) при 25°C. Полученный раствор перемешивали в течение 30 минут при комнатной температуре в атмосфере H2. AcOEt добавляли к реакционной смеси и фильтровали через Celite® для удаления палладия на угле. Фильтрат концентрировали in vacuo. Осадок очищали посредством колоночной флеш-хроматографии (колонка Yamazen HI-FLASHTM с силикагелем размера M, 10 мл/мин, градиент 30%-70% AcOEt в н-гептане) с получением титульного соединения в виде рацемата (181 мг, 0,637 ммоля).
Оптическое разделение полученного рацемата (180 мг, 0,633 ммоль) проводили посредством ВЭЖХ (CHIRALPAKTM IA, 20 мм I.D.×250 мм, 10 мл/мин, 15% EtOH в гексане) с получением S-формы титульного соединения в виде белого твердого вещества (76 мг, 0,267 ммоля, 98% э.и.), которая элюировалась второй из 2 изомеров со временем удержания 44 минуты.
ESI-MS; m/z 307 [M+Na]+.
1H-ЯМР(400 МГц, CDCl3)
δ (м.д.): 3,32-3,60 (м, 2H), 4,70 (шир. с, 2H), 4,93 (д, J=9,3 Гц, 1H), 5,30 (кв, J=9,3 Гц, 1H), 6,70-6,86 (м, 2H).
[0050] Пример 2
Синтез N-[(1S)-2,2,4,7-тетрафтор-2,3-дигидро-1H-инден-1-ил]сульфамида
Титульное соединение (2,13 г, 7,49 ммоля) получали в виде рацемата из 4,7-дифтор-1-инданона (номер по CAS 130408-16-1, 6,15 г, 36,6 ммоля) способом, аналогичным описанному в примере 1.
ESI-MS m/z: 307[M+Na]+
1H-ЯМР (400 МГц, CDCl3)
δ (м.д.): 3,33-3,63 (м, 2H), 4,73 (шир. с, 2H), 5,01 (д, J=8,4 Гц, 1H), 5,35 (кв, J=9,8 Гц, 1H), 6,92-7,16 (м, 2H).
Оптическое разделение полученного рацемата (180 мг, 0,633 ммоля) проводили посредством ВЭЖХ (CHIRALCELTM OD-H, 20 мм I.D.×250 мм, 15% EtOH в гексане, 10 мл/мин) с получением (1S)-формы титульного соединения в виде белого твердого вещества (45 мг, 0,158 ммоля, 99% э.и.), который элюировался вторым из 2 оптических изомеров. В результате анализа при помощи DAICEL CHIRALCELTM OD-H (4,6 мм I.D.×150 мм, 15% EtOH в гексане, 1 мл/мин) оптический изомер показал время удержания 12 минут.
[0051] Пример 3
Синтез (+)-N-(2,2,4,6,7-пентафтор-2,3-дигидро-1H-инден-1-ил)сульфамида
Титульное соединение (73 мг, 0,242 ммоль) получали в виде рацемата из 4,6,7-трифтор-1-инданона (номер по CAS 1260008-80-7, 250 мг, 1,34 ммоль) способом, аналогичным описанному в примере 1.
Оптическое разделение полученного рацемата (70 мг, 0,232 ммоль) проводили посредством ВЭЖХ (CHIRALPAKTM IC, 20 мм I.D.×250 мм, 10% EtOH в гексане, 10 мл/мин) с получением (+)-формы титульного соединения (31 мг, 0,103 ммоль, >99% э.и.), которая элюировалась первой из 2 оптических изомеров со временем удержания 40 минут.
ESI-MS; m/z: 325[M+Na]+
1H-ЯМР (400 МГц, CDCl3)
δ (м.д.): 3,34-3,61 (м, 2H), 4,78 (шир. с, 2H), 5,14 (шир. с, 1H), 5,29-5,48 (м, 1H), 6,89-7,04 (м, 1H).
[0052] Пример 4
Синтез N-[(1S*)-5-циано-2,2-дифтор-7-метил-2,3-дигидро-1H-инден-1-ил]сульфамида
(1) Синтез 2,2-дифтор-7-метил-1-оксо-2,3-дигидро-1H-инден-5-карбонитрила
Титульное соединение (600 мг, 2,90 ммоль) получали из 7-метил-1-оксоиндан-5-карбонитрила (номер по CAS 1337833-67-6, 1,00 г, 5,84 ммоль) способом, аналогичным описанному в примере 1-(1) и 1-(2).
ESI-MS; m/z: 208[M+H]+
1H-ЯМР (400 МГц, CDCl3)
δ (м.д.): 2,71 (с, 3H), 3,57 (т, J=12,8 Гц, 2H), 7,53 (с, 1H), 7,60 (с, 1H).
[0053] (2) Синтез N-[(1S*)-5-циано-2,2-дифтор-7-метил-2,3-дигидро-1H-инден-1-ил]сульфамида
Титульное соединение (59,0 мг, 0,205 ммоля) получали в виде рацемата из продукта из примера 4-(1) (157 мг, 0,759 ммоля) способом, аналогичным описанному в примере 1-(3)-1-(5).
Оптическое разделение полученного рацемата (59,0 мг, 0,205 ммоля) проводили посредством ВЭЖХ (CHIRALPAKTM IF, 20 мм I.D.×250 мм, 20% EtOH в гексане, 10 мл/мин) с получением титульного соединения (23,4 мг, 0,081 ммоля, >99% э.и.), которое элюировалось вторым из 2 оптических изомеров со временем удержания 41 минута.
ESI-MS; m/z: 310[M+Na]+
1H-ЯМР (400 МГц, DMSO-d6)
δ (м.д.): 2,42 (с, 3H), 3,29-3,45 (м, 1H), 3,47-3,63 (м, 1H), 4,86-4,97 (м, 1H), 6,85 (шир. с, 2H), 7,58-7,70 (м, 3H).
[0054] Пример 5
Синтез (-)-N-(2,2,6,7-тетрафтор-2,3-дигидро-1H-инден-1-ил)сульфамида
(1) Синтез 2,2,6,7-тетрафтор-2,3-дигидро-1H-инден-1-амина
4-Бром-2,6,7-трифтор-2,3-дигидро-1H-инден-1-он (2,30 г, 8,68 ммоля) получали из 4-бром-6,7-дифтор-1-инданона (номер по CAS 881189-76-0, 2,45 г, 9,92 ммоля) способом, аналогичным описанному в примере 1-(1). 4-Бром-2,2,6,7-тетрафтор-2,3-дигидро-1H-инден-1-он (1,80 г, 6,38 ммоля) получали из 4-бром-2,6,7-трифтор-2,3-дигидро-1H-инден-1-она (2,30 г, 8,68 ммоля) способом, аналогичным описанному в примере 1-(2).
Гидроксиламина гидрохлорид (0,90 г, 12,8 ммоль) добавляли к раствору 4-бром-2,2,6,7-трифтор-2,3-дигидро-1H-инден-1-она (1,80 г, 6,38 ммоля) в EtOH (10 мл) и реакционную смесь нагревали с обратным холодильником в течение 12 часов. После охлаждения до комнатной температуры реакционную смесь концентрировали in vacuo.
Осадок последовательно промывали DCM и водой и высушивали in vacuo. К раствору осадка в MeOH (20 мл) добавляли конц. H2SO4 (0,6 мл) и палладий на угле (90 мг).
Смесь перемешивали в течение 12 часов при комнатной температуре под атмосферой H2. Палладий на угле отфильтровывали и фильтрат концентрировали in vacuo. Осадок очищали посредством колоночной хроматографии на силикагеле с получением титульного соединения (700 мг, 3,41 ммоля).
ESI-MS; m/z: 206[M+H]+
[0055] (2) Синтез (-)-N-(2,2,6,7-тетрафтор-2,3-дигидро-1H-инден-1-ил)сульфамида
Титульное соединение (120 мг, 0,423 ммоля) получали в виде рацемата из продукта, полученного в примере 5-(1) (700 мг, 3,41 ммоль), способом, аналогичным описанному в примере 1-(3)-1-(5).
Оптическое разделение полученного рацемата (110 мг, 0,387 ммоль) проводили посредством ВЭЖХ (CHIRALPAKTM IC, 20 мм I.D.×250 мм, 20% EtOH в гексане, 10 мл/мин) с получением (-)-формы титульного соединения (38 мг, 0,134 ммоль, >99% э.и.), которая элюировалась первой из 2 оптических изомеров со временем удержания 20 минут.
ESI-MS; m/z: 307[M+Na]+
1H-ЯМР (400 МГц, CDCl3)
δ (м.д.): 3,29-3,58 (м, 2H), 4,75 (шир. с, 2H), 5,05 (д, J=9,7 Гц, 1H), 5,38 (кв, J=9,7 Гц, 1H), 6,94-7,02 (м, 1H), 7,14-7,23 (м, 1H).
[0056] Пример 6
Синтез (-)-N-(7-хлор-2,2,5-трифтор-2,3-дигидро-1H-инден-1-ил)сульфамида
(1)
Синтез 7-Хлор-2,5-дифтор-2,3-дигидро-1H-инден-1-она
SelectfluorTM (2,49 г, 7,02 ммоля) добавляли к раствору 7-хлор-5-фтор-1-инданона (номер по CAS 1260008-48-7, 1,08 г, 5,85 ммоль) в MeOH (30 мл) при комнатной температуре. Смесь нагревали с обратным холодильником в течение 2 часов. После охлаждения до комнатной температуры полученную смесь выпаривали для удаления растворителя при пониженном давлении. К осадку добавляли DCM и