Способ выявления экспансии тринуклеотидных cgg-повторов в 5'-нетранслируемой, промоторной области гена fmr1 при заболевании синдрома атаксии/тремора, ассоциированного с ломкой х-хромосомы (fxtas)
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Описан способ выявления экспансии тринуклеотидных CGG-повторов в 5'- нетранслируемой, промоторной области гена FMR1 при заболевании синдрома атаксии/тремора, ассоциированного с ломкой Х-хромосомой (FXTAS), который проводят путем исследования образца ДНК методом полимеразной цепной реакции (ПЦР). Анализ длин амплифицированных фрагментов проводят с помощью капиллярного гель-электрофореза с лазер-индуцированной флуоресцентной детекцией продуктов полимеразной цепной реакции с флуоресцентно-меченым праймером и последующим выявлением наличия экспансии CGG-повторов в исследуемом ДНК-образце, ассоциированных с FXTAS. При этом выявление наличия экспансии CGG-повторов в исследуемом ДНК-образце осуществляют путем проведения амплификации локуса тандемных CGG-повторов промоторной области гена FMR1 в ПЦР с использованием двух оригинальных специфических олигонуклеотидных праймеров: прямого FMR1 F: 5'-CGCTCAGCTCCGTTTCGG-3' и обратного, меченного флуоресцентной меткой - FAM, FMR1 R: 5'-(FAM)AAGTACCTTGTAGAAAGCGCCA-3', фланкирующих анализируемый регион ДНК. Причем реакцию ПЦР фрагментов ДНК, содержащих тандемные CGG-повторы, проводят в реакционной среде, содержащей: 50 мМ KCl, 50 мМ Трис-HCl с рН 8,8, 2,5 мМ MgCl2, 250 мкМ дезоксирибонуклеотидтрифосфата (dNTP), 1М бетаина, 100 мкМ 7-диазагуаназин-5'-трифосфата (7-deaza-GTP), 5% диметилсульфоксида (DMSO), 0,5 ед. термостабильной ДНК-полимеразы с ингибирующими активность фермента антителами и по 0,5 пмоль каждого праймера, прямого и обратного, при следующих условиях: начальное плавление ДНК проводят в течение 900 секунд при температуре 98°С. Далее проводят 35 циклов амплификации, включающие денатурацию при 97°С в течение 45 секунд, отжиг праймеров при температуре 62°С в течение 30 секунд и синтез участка ДНК при температуре 72°С в течение 240 секунд. А завершающую элонгацию осуществляют при температуре 72°С в течение 1500 секунд, а затем размер полученных флуоресцентно-меченых фрагментов - ампликонов ДНК оценивают методом фрагментного анализа на капиллярном генетическом секвенаторе. При этом для детектируемых пиков электрофореграммы количество CGG-повторов в промоторной области гена FMR1 (N) высчитывают по формуле: N=(1,04X-237)/3, где 1,04 - поправочный коэффициент; X - размер ампликона ДНК-образца соответствующего пика на электрофореграмме; 237 - размер области ампликона вне повторов (5'-конец и 3'-конец); 3 - число нуклеотидов в одном повторе. В случае детектирования у женщин одного пика на электрофореграмме, а у мужчин отсутствия детектируемого пика повторно проводят выявление наличия экспансии CGG-повторов в исследуемом ДНК-образце путем амплификации локуса тандемных CGG-повторов промоторной области гена FMR1 в ПЦР с использованием тех же олигонуклеотидных праймеров: прямого FMR1 F: 5'-CGCTCAGCTCCGTTTCGG-3' и обратного FMR1 R: 5'-AAGTACCTTGTAGAAAGCGCCA-3' без метки с последующим разделением полученных ампликонов электрофорезом. А количество CGG-повторов в промоторной области гена FMR1 (N) высчитывают по формуле: N=(X-237)/3, где X - размер ампликона ДНК-образца соответствующей полосы на электрофореграмме; 237 - размер области ампликона вне повторов (5'-конец и 3'-конец); 3 - число нуклеотидов в одном повторе. Способ обеспечивает повышение точности выявления экспансии тринуклеотидных CGG-повторов в 5'- нетранслируемой, промоторной области гена FMR1 в области премутации и «серой зоны» за счет высокой чувствительности способа. Изобретение может быть использовано для выявления микросателлитного генотипирования экспансии тандемных CGG-повторов в гене FMR1 (fragile X mental retardation 1) при заболевании FXTAS (Fragile X associated tremor/ataxia syndrome; синдром тремора/атаксии, ассоциированный с ломкой X-хромосомой). 1 з.п. ф-лы, 4 ил., 1 табл.
Реферат
Изобретение относится к области медицины, в частности к неврологии и молекулярной биологии, и может быть использовано для выявления микросателлитного генотипирования экспансии тандемных CGG-повторов в гене FMR1 (fragile X mental retardation 1) при заболевании FXTAS (Fragile X associated tremor/ataxia syndrome; синдром тремора/атаксии, ассоциированный с ломкой X-хромосомой).
Геном человека практически на половину состоит из повторов нуклеотидных последовательностей различного типа, наибольшая часть которых представлена короткими тандемными повторами (микросателлитами). Микросателлиты представляют собой повторы 1-6 нуклеотидных мотивов, встречаются на протяжении всего генома человека, составляя около 3%. Экспансия коротких тандемных повторов (три-, тетра-, пента- и гексануклеотидных) в отдельных генах является причиной многих наследственных заболеваний нервной системы человека (более 40). Наиболее репрезентативной группой среди таких заболеваний является группа неврологических заболеваний, связанная с экспансией тринуклеотидных повторов: болезнь Гентингтон, семейство спиноцеребеллярных атаксий, спинально-бульбарная амиотрофия Кеннеди, болезнь Фридрейха, синдром ломкой Х-хромосомы, синдром тремора/атаксии, ассоциированный с ломкой Х-хромосомой, миотонические дистрофии первого и второго типов, «гентингтоноподобные» нейродегенерации и другие.
Экспансия тринуклеотидных CGG-повторов в 5'- нетранслируемой, промоторной области гена FMR1 (локус Xq27.3) в зависимости от количества CGG копий обуславливает развитие различных клинических проявлений. Существует четыре основных состояния данного хромосомного участка, которые обуславливают четыре возможных фенотипа:
1) Нормальные состояние - аллели содержат менее 30 повторов.
2) Состояние полной мутации - более 200 CGG-повторов. Это приводит к развитию синдрома ломкой Х-хромосомы (FXS), который характеризуется, в первую очередь, появлением в раннем детском возрасте умственной отсталости, речевых нарушений, атаксии, формированием специфического внешнего вида.
3) Состояние премутации - аллели содержат от 55 до 200 CGG-повторов. Это приводит к развитию синдрома тремора/атаксии, ассоциированного с ломкой Х-хромосомой (FXTAS), который характеризуется мозжечковой атаксией, интенционным тремором, периферической полиневропатией и паркинсонизмом.
4) Промежуточное состояние, «серая зона» экспансии - аллели содержат от 30 до 55 CGG-повторов. Данное состояние считается нестабильным, чаще всего ассоциируется с риском развития паркинсонизма.
Полная мутация характеризуется инактивацией участка повышенной экспансии CGG-повторов за счет метилирования данной области гена, что ведет к дефициту продукта гена - белка FMRP. Серая зона и премутация же, наоборот, характеризуются повышенной секрецией белка. Оба состояния, недостаток и избыток протеина FMRP негативно влияют на жизнеспособность нейронов.
Определение степени экспансии тринуклеотидных CGG-повторов в гене FMR1 базируется на следующих методах ДНК-диагностики: метод Саузерн-блоттинга, метод анализа статуса метилирования, метод амплификации области CGG-повторов с помощью специфических фланкирующих праймеров с последующей оценкой длины полученных ампликонов различными методами (разделение с помощью полиакриламидного гель-электрофореза, разделение с помощью капиллярного гель-электрофореза с лазер-индуцированной флуоресцентной детекцией, анализ профилей плавления продуктов амплификации). Также в некоторых случаях применяется иммуноцитохимический тест. Каждый из этих методов имеет свои технические ограничения по применению при анализе четырех основных состояний области экспансии CGG-повторов в гене FMR1.
Саузерн-блот анализ. Саузерн-блоттинг является одним из методов выбора при диагностике синдрома ломкой Х-хромосомы (носительства полной мутации гена). Методика состоит из последовательных этапов рестрикции молекулы ДНК на короткие участки, разделения участков по длине методом электрофореза в агарозном геле, переноса фрагментов ДНК из геля на мембрану, закрепление фрагмента ДНК на мембране и его окрашивание (радиоактивным или хромогенным красителем), получение изображения. Саузерн-блот тест позволяет достоверно определить число CGG-копий в случае экспансии 160 повторов и выше (Das S, Kubota Т, Song М, Daniel R, Berry-Kravis EM, Prior TW, Popovich B, Rosser L, Arinami T, Ledbetter DH. Methylation analysis of the fragile X syndrome by PCR. Genet Test. 1997; 1: 151-5).Таким образом, метод позволяет выявить наличие полной мутации гена, но не дает возможности развести прочие состояния, такие как «серая зона» и премутация. Методика сложна технологически, что обуславливает высокий процент ложноотрицательных результатов, Метод дорогостоящий, трудоемкий, длительный.
Анализ ПЦР-продукта с разделением электрофорезом в полиакриламидном геле. Полимеразная цепная реакция - методика, позволяющая увеличить изначально малые концентрации фрагмента ДНК, что облегчает дальнейшую детекцию мутации. Разделение продукта ПЦР в полиакриламидном геле - один из наиболее простых и дешевых методов ДНК-диагностики. Суть методики заключается в введении образцов, полученных в ходе ПЦР, в специальную среду, в которой под воздействии электрического тока молекулы разной величины мигрируют с различной скоростью. В случае анализа гена FMR1 фрагменты ДНК с различным числом CGG-копий будут двигаться в геле с разной скоростью; полученные результаты сравниваются с референсными значениями (Jenni Murray, Howard Cuckle et al. Health Technology Assessment, 1997, 1 (4)). Метод не позволяет определить точное число тринуклеотидных повторов (погрешность до 5 копий).
Анализ ПЦР-продукта по оценке профилей плавления. Суть методики заключается в автоматическом плавлении продуктов ПЦР сразу по окончании реакции. Анализируя кривую плавления продуктов, можно сделать вывод о составе смеси. Эта методика позволяет выявить повышенную экспансию CGG-повторов, однако, не дает возможности четко рассчитать количество повторов, и разграничить состояния полной мутации и премутации (Clara R.L., Hai-Yang Law et al. Screening for CGG repeat expansion in the FMR1 gene by melting curve analysis og combined 5' and 3' direct triplet-primered PCRs. Clinical Chemistry, 2012, 58, 568-579).
Анализ статуса метилирования. Данный анализ позволяет выявить наличие или отсутствие метилирования конкретного участка гена. Существует несколько методик определения статуса метилирования гена FMR1. Основными являются метил-специфическая ПНР (ПЦР с добавлением специальных праймеров на метилированную и неметилированную последовательность ДНК) и масс-спектрометрия (определение массы интересующей пробы исходя из заряда, полученного при ее ионизации). Независимо от метода, оценивающего статус метилирования, анализ позволяет развести только два состояния - полная мутация либо остальные три варианта (норма, серая зона, премутация) (Marina Grasso,* Elles M.J. Boon et al. A Novel Methylation PCR that Offers Standardized Determination of FMR1 Methylation and CGG Repeat Length without Southern Blot Analysis. 2014, 16, 23-31; David E. Godler, 1* Howard R. Slater et al. Fragile X Mental Retardation 1 (FMR1) Intron 1 Methylation in Blood Predicts Verbal Cognitive Impairment in Female Carriers of Expanded FMR1 Alleles: Evidence from a Pilot Study, Clinical Chemisrty 58, 590-598.).
Иммуноцитохимический тест. Данная методика позволяет выявить наличие в тканях (кровь, волосы, ногти, фетальный материал) организма продукта гена FMR1 - белка FMRP. В основе методики лежит специфическая реакция взаимодействия антиген-антитело. Данный тест не используется рутинно, является достаточно дорогим и трудоемким. Применяется лишь в сложных дифференциально-диагностических ситуациях (например, в случае соответствующей кинической картины и ложно отрицательного результата ДНК-диагностики) (Willemsen R, Mohkamsing S et al. Rapid antibody test for fragile X syndrome. Lancet 1995; 345: 1147-1148).
В качестве ближайшего аналога рассмотрен способ выявления экспансии тринуклеотидных CGG-повторов в 5'- нетранслируемой, промоторной области гена FMR1 при заболевании синдрома атаксии/тремора, ассоциированного с ломкой Х-хромосомой (FXTAS) путем исследования образца ДНК методом полимеразной цепной реакции (ПЦР) с флуоресцентно-мечеными праймерами, анализом длин амплифицированных фрагментов с помощью капиллярного гель-электрофореза путем разделения фрагментов ДНК по величине и заряду в капиллярах, заполненных электролитом и последующей детекцией сигнала от флуоресцентной метки (Lyon Е, Laver Т et al. A simple, high-throughput assay for Fragile X expanded alleles using triple repeat primed PCR and capillary electrophoresis. J. Mol. Diagn. 12: 505-511). Метод быстрый и недорогой, однако ограничивается детекцией образцов с величиной экспансии не более 120 повторов, таким образом, не может быть использован для выявления носителей премутации с носительством повторов от 120 до 200
Технический результат заявленного изобретения заключается в повышении точности выявления экспансии тринуклеотидных CGG-повторов в 5'- нетранслируемой, промоторной области гена FMR1 в области премутации и «серой зоны» за счет высокой чувствительности способа.
Технический результат достигается тем, что выявление экспансии тринуклеотидных CGG-повторов в 5'- нетранслируемой, промоторной области гена FMR1 при заболевании синдрома атаксии/тремора, ассоциированного с ломкой Х-хромосомой (FXTAS), осуществляют путем исследования образца ДНК методом полимеразной цепной реакции (ПЦР), анализа длин амплифицированных фрагментов с помощью капиллярного гель-электрофореза с лазер-индуцированной флуоресцентной детекцией продуктов полимеразной цепной реакции с флуоресцентно-меченым праймером и последующим выявлением наличия экспансии CGG-повторов в исследуемом ДНК-образце, ассоциированных с FXTAS, при этом выявление наличия экспансии CGG-повторов в исследуемом ДНК-образце осуществляют путем проведения амплификации локуса тандемных CGG-повторов промоторной области гена FMR1 в ПЦР с использованием двух оригинальных специфических олигонуклеотидных праймеров: прямого FMR1 F: 5'-CGCTCAGCTCCGTTTCGG-3' и обратного, меченного флуоресцентной меткой - FAM, FMR1 R: 5'-(FAM)AAGTACCTTGTAGAAAGCGCCA-3', фланкирующих анализируемый регион ДНК, при этом реакцию ПЦР фрагментов ДНК, содержащих тандемные CGG-повторы, проводят в реакционной среде, содержащей: 50 мМ KCl, 50 мМ Трис-HCl с рН 8,8, 2,5 мМ MgCl2, 250 мкМ дезоксирибонуклеотидтрифосфата (dNTP), 1М бетаина, 100 мкМ 7-диазагуаназин-5'-трифосфата (7-deaza-GTP), 5% диметилсульфоксида (DMSO), 0,5 ед. термостабильной ДНК-полимеразы с ингибирующими активность фермента антителами и по 0,5 пкмоль каждого праймера: прямого и обратного, при следующих условиях: начальное плавление ДНК проводят в течение 900 секунд при температуре 98°С, далее проводят 35 циклов амплификации, включающие денатурацию при 97°С в течение 45 секунд, отжиг праймеров при температуре 62°С в течение 30 секунд и синтез участка ДНК при температуре 72°С в течение 240 секунд, а завершающую элонгацию осуществляют при температуре 72°С в течение 1500 секунд, а затем размер полученных флуоресцентно-меченых фрагментов - ампликонов ДНК-образца оценивают методом фрагментного анализа на капиллярном генетическом секвенаторе, при этом для детектируемых пиков электрофореграммы количество CGG-повторов в промоторной области гена FMR1 (N) высчитывают по формуле: N=(1,04X-237)/3, где 1,04 - поправочный коэффициент; X - размер ампликона ДНК-образца соответствующего пика на электрофореграмме; 237 - размер области ампликона вне повторов (5'-конец и 3'-конец); 3 - число нуклеотидов в одном повторе.
В предпочтительном варианте в случае детектирования у женщин одного пика на электрофореграмме, а у мужчин отсутствия детектируемого пика, что означает возможность содержания числа CGG-повторов более 80, повторно проводят выявление наличия экспансии CGG-повторов в исследуемом ДНК-образце путем амплификации локуса тандемных CGG-повторов промоторной области гена FMR1 в ПЦР с использованием тех же олигонуклеотидных праймеров: прямого FMR1 F: 5'-CGCTCAGCTCCGTTTCGG-3' и обратного FMR1 R: 5'-AAGTACCTTGTAGAAAGCGCCA-3' без метки с последующим разделением полученных ампликонов электрофорезом в 1,5% агарозном геле при напряжении электрического поля 70 B в течение 90 минут, распределение фрагментов ДНК детектируют и документируют в длинноволновом ультрафиолетовом освещении по свечению связавшегося интеркалирующего красителя и определяют размер ампликона ДНК-образца соответствующей полосы на электрофореграмме, ориентируясь на примененный молекулярный размерный стандарт, при этом количество CGG-повторов в промоторной области гена FMR1 (N) высчитывают по формуле: N=(X-237)/3, где X - размер ампликона ДНК-образца соответствующей полосы на электрофореграмме; 237 - размер области ампликона вне повторов (5'-конец и 3'-конец); 3 - число нуклеотидов в одном повторе.
Способ осуществляется следующим образом.
Генотипирование экспансии тринуклеотидных CGG-повторов в 5'-нетранслируемой, промоторной области гена FMR1, примененное нами для выявления заболевания - синдрома атаксии/тремора, ассоциированного с ломкой Х-хромосомой (FXTAS), основано на проведении исследования образца ДНК методом полимеразной цепной реакции (ПЦР) с последующим использованием метода анализа длин фрагментов с помощью капиллярного гель-электрофореза с лазер-индуцированной флуоресцентной детекцией продуктов полимеразной цепной реакции с флуоресцентно-меченным праймером, а при необходимости проведения второго этапа с анализом ПЦР-продуктов методом разделения электрофорезом в агарозном геле.
Таким образом, установление наличия экспансии CGG-повторов в исследуемом ДНК-образце осуществляется следующим образом.
Проводят амплификацию локуса тандемных CGG-повторов промоторной области гена FMR1 методом ПЦР с использованием двух оригинальных специфических олигонуклеотидных праймеров, фланкирующих анализируемый регион ДНК, один из которых химически связан с флуоресцентным красителем, детектируемым на канале FAM капиллярного генетического анализатора.
При подборе специфических олигонуклеотидных праймеров, для повышения специфичности ПЦР были соблюдены следующие критерии:
- размер праймера 16-25 нуклеотидов;
- температура отжига праймеров в диапозоне (58-65°С);
- разница в температуре плавления праймеров - не более 2 градусов;
- область отжига праймеров находиться вне зоны полиморфизма;
- суммарное количество GC-оснований в последовательности праймера 50-60%;
- отсутствие внутренней вторичной структуры (праймеры не должны быть само- и взаимно комплементарными);
- отсутствие комплементарности между 3'-концами (чтобы не образовывались праймер-димеры).
Используемые нами праймеры при проведении ПЦР:
прямой - FMR1 F: 5'-CGCTCAGCTCCGTTTCGG-3'
обратный - FMR1 R: 5'-(FAM)AAGTACCTTGTAGAAAGCGCCA-3', меченный флуоресцентной меткой FAM.
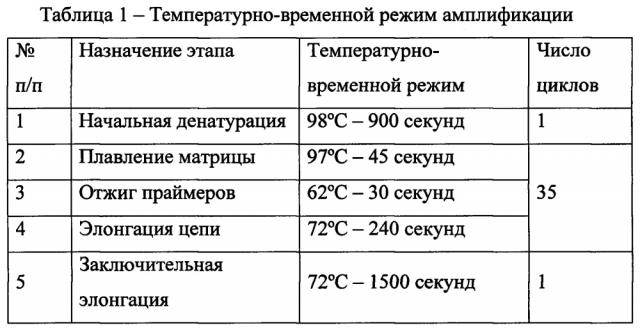
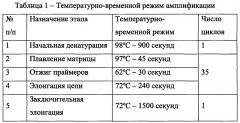
Реакцию ПЦР фрагментов ДНК, содержащих тандемные CGG-повторы, для последующего анализа проводят в 10 мкл реакционной среды, специально подобранной для амплификации сложных GC-богатых матриц, содержащей стандартные компоненты ПЦР среды: 50 мМ KCl, 50 мМ Трис-HCl (рН 8.8), 2.5 мМ MgCl2, 250 мкМ дезоксирибонуклеотид-трифосфат (dNTP), 0.5 ед. термостабильной ДНК-полимеразы с ингибирующими активность фермента антителами, по 0.5 пкмоль каждого праймера: прямого и обратного, меченного флуоресцентной меткой FAM, и специальные добавки, увеличивающие выход продукта и обеспечивающие точный синтез матрицы: 1М бетаина, 100 мкМ диазагуаназин-5'-трифосфат (7-deaza-GTP), 5% диметильсулфоксида (DMSO). Реакцию проводят на программируемом термоциклере, по протоколу реакции (см. таблицу 1) с увеличенными полками плавления и элонгации, необходимыми для синтеза длинных матриц, а также увеличенной температурой денатурации и плавления в связи с тугоплавкостью исследуемой матрицы.
После проведения ПЦР длину синтезированных флуоресцентно-меченых фрагментов ДНК далее оценивают методом фрагментного анализа на капиллярном генетическом секвенаторе, используя размерный стандарт Liz 500, с помощью программного обеспечения Data Collection software версии v3.0. Размерный стандарт Liz 500 содержит 16 стандартных ДНК-фрагментов (35, 50, 75, 100, 139, 150, 160, 200, 250, 300, 340, 350, 400, 450, 490 и 500 bp), меченных флуоресцентной меткой Liz. Капиллярный электрофорез проводят в 36-сантиметровых капиллярах при следующих, отличающихся от стандартных, условиях: время инжекции образца - 25 сек, при напряжении - 1,6 кВольт, время прогона - 900 сек при напряжении 15 кВольт.
Размер исследуемых фрагментов (ампликонов) рассчитывается с помощью калибровочной кривой, построенной на основе используемых стандартных ДНК-фрагментов (см. фиг. 1).
Прилежащая область исследуемого микросателлита (область CGG-повторов) содержит повышенное количество нуклеотидов G и С - 75%, а с учетом того что сам микросателлит представляет собой тандемные CGG-повторы, CG-содержание анализируемых матриц (ампликонов) может достигать 80% ÷ 90%, что в свою очередь влияет на их электрофоретическую подвижность. В силу своих физико-химических свойств такие GC-богатые матрицы при разделении электрофорезом (в данном случае капиллярным электрофорезом) проходят путь разделения несколько быстрее, чем ампликоны такого же размера, но стандартного, сбалансированного состава. Так как расчет размера анализируемого ампликона производится на основании калибровки по набору размерных стандартных матриц, необходимо делать поправку, что позволит избежать ошибки при точном подсчете количества тандемных микросателлитных повторов, что крайне важно при определении патогенности экспансии. Для расчета поправки и выведения формулы точного определения количества CGG-повторов в исследуемых апликонах было выбрано 10 образцов ДНК с различным числом повторов; наработаны ампликоны методом ПЦР в стандартных условиях с праймерами, не меченными флуоресцентной меткой, после чего они были проанализированы методом прямого капиллярного секвенирования по стандартному протоколу (фиг. 2). Посчитанное вручную, на электрофореграмме, количество повторов для каждого образца сравнивалось с количеством повторов полученным методом фрагментного анализа, в результате была высчитана поправка, которая в свою очередь была внесена в формулу для точного расчета числа повторов.
Конечная формула для точного расчета количества CGG-повторов в нашем дизайне постановки ДНК-анализа промоторной области гена FMR1 (N) имеет следующий вид: N=(1,04X-237)/3, где 1,04 - поправочный коэффициент; X - размер ампликона ДНК-образца соответствующего пика на электрофореграмме; 237 - размер области ампликона вне повторов (5'-конец и 3'-конец); 3 - число нуклеотидов в одном повторе.
С помощью выведенной формулы данный метод позволяет выявить точное количество CGG-повторов в исследуемых фрагментах, но только до 80 повторов, так как максимальный размер ампликона при таком исследовании может быть только 500 пар нуклеотидов исходя из используемого стандарта. Однако точность до одного повтора тринуклеотида важна именно в диапозоне 30÷80 повторов для разведения состояния «серой зоны» и «премутации».
Так как ген FMR1 находится на Х-хромосоме, то наличие у женщин одного детектируемого пика может означать, что она либо гомозиготная по этому аллелю или второй аллель содержит число повторов больше 80, а у мужчин отсутствие детектируемого пика означает что содержание числа CGG-повторов у него больше 80. В таких случаях возникает необходимость проводения следующего, уточняющего, этапа выявления наличия экспансии CGG-повторов в исследуемом ДНК-образце путем амплификации локуса тандемных CGG-повторов промоторной области гена FMR1 в ПЦР с использованием тех же олигонуклеотидных праймеров: прямого FMR1 F: 5'-CGCTCAGCTCCGTTTCGG-3' и обратного FMR1 R: 5'-AAGTACCTTGTAGAAAGCGCCA-3' без метки с последующим детектированием и разделением ДНК-образцов электрофорезом в агарозном геле. Электрофорез проводят в 2.0% агарозном геле, при комнатной температуре в буфере ТАЕ (40 мМ Трис-ацетат рН 8,1, 2 мМ ЭДТА), содержащем 0,4 мкг/мл бромистого этидия (интеркалирующего красителя), при напряжении электрического поля 70 Вольт в течение 90 мин. Распределение фрагментов ДНК детектируют и документируют в длинноволновом ультрафиолетовом освещении по свечению связавшегося интеркалирующего красителя с использованием гель-документирующей системы (см. фиг. 3). Рассчитывают размер фрагмента ДНК, содержащего CGG-повторов в количестве более 80 повторов, в случае его визуализации, ориентируясь на примененный молекулярный размерный стандарт. Количество CGG-повторов в промоторной области гена FMR1 (N) высчитывают по формуле: N=(X-237)/3, где X - размер ампликона ДНК-образца соответствующей полосы на электрофореграмме; 237 - размер области ампликона вне повторов (5'-конец и 3'-конец); 3 - число нуклеотидов в одном повторе.
Примеры осуществления способа
На фиг. 4 А, Б, В, Г представлены результаты автоматизированного гель-электрофоретического разделения с лазер-индуцируемой детекцией флуоресцентно-меченых продуктов амплификации (высокие пики - продукты амплификации, низкие пики - размерный стандарт LIZ 500).
А - электрофореграмма продукта амплификации ДНК-образца женщины (образец FX-2), для которого выявился только один пик размером 297bp (пар нуклеотидов). Если применить стандартную формулу расчета количества повторов без поправки, а именно из детектируемого размера вычесть 237bp - размер области ампликона вне повторов (5'-конец и 3'-конец) и разделить на 3 - число нуклеотидов в одном повторе, то получится только 20 повторов, тогда как, используя выведенную нами формулу с поправкой получается 24 повтора. Содержание в этом образце только одного пика свидетельствует о гомозиготном состоянии или, возможно, существует второй аллель, содержащий экспансию CGG-повторов больше 80, не детектируемый на этом этапе, и, таким образом, для данного образца требуется уточнение путем проведения дополнительного этапа. На электрофореграмме, полученной после дополнительного этапа (см. фиг. 3Б), видно, что данный образец действительно гомозиготен, так как присутствует только одна полоса.
Б - электрофореграмма продукта амплификации ДНК-образца женщины, для которого выявлены два пика размерами 286bp и 349bp, что соответствует, согласно нашей формуле, содержанию 20 CGG-повторов в одном аллеле и 42 во втором. В данном случае применение дополнительного этапа не требуется.
В - электрофореграмма продукта амплификации ДНК-образца мужчины, для которого выявлен пик размером - 346bp, что соответствует, согласно нашей формуле, содержанию 41 CGG-повтора. Так как анализируемая область находится на Х-хромосоме, то у мужчины может быть только один аллель и, следовательно, для этого образца ДНК применение дополнительного этапа не требуется.
Г - электрофореграмма продукта амплификации ДНК-образца мужчины (образец FX-8), для которого на первом этапе, как следует из результата, не выявлен пик, что свидетельствует о наличии экспансии CGG-повторов больше 80. На электрофореграмме, полученной после дополнительного этапа (см. фиг. 3А), видно, что данный образец действительно содержит полосу, соответствующую, ориентируясь на размерный стандарт, размеру ампликона ~ 650bp. Вычитая 237bp - размер области ампликона вне повторов (5'-конец и 3'-конец) и разделив на 3 - число нуклеотидов в одном повторе, получаем ~ 140 повторов. В данном случае при такой большой величине допускается ошибка в ~ 5 повторов, так как наличие мутантного аллеля однозначно и размер его соответствует состоянию «премутация», что в свою очередь приводит к заболеванию FXTAS.
1. Способ выявления экспансии тринуклеотидных CGG-повторов в 5'-нетранслируемой, промоторной области гена FMR1 при заболевании синдрома атаксии/тремора, ассоциированного с ломкой Х-хромосомой (FXTAS), включающий проведение исследования образца ДНК методом полимеразной цепной реакции (ПЦР), анализа длин амплифицированных фрагментов с помощью капиллярного гель-электрофореза с лазер-индуцированной флуоресцентной детекцией продуктов полимеразной цепной реакции с флуоресцентно-меченым праймером и последующим выявлением наличия экспансии CGG-повторов в исследуемом ДНК-образце, ассоциированных с FXTAS, отличающийся тем, что выявление наличия экспансии CGG-повторов в исследуемом ДНК-образце осуществляют путем проведения амплификации локуса тандемных CGG-повторов промоторной области гена FMR1 в ПЦР с использованием двух оригинальных специфических олигонуклеотидных праймеров: прямого FMR1 F: 5'-CGCTCAGCTCCGTTTCGG-3' и обратного, меченного флуоресцентной меткой - FAM, FMR1 R: 5'-(FAM)AAGTACCTTGTAGAAAGCGCCA-3', фланкирующих анализируемый регион ДНК, при этом реакцию ПЦР фрагментов ДНК, содержащих тандемные CGG-повторы, проводят в реакционной среде, содержащей: 50 мМ KCl, 50 мМ Трис-HCl с рН 8,8, 2,5 мМ MgCl2, 250 мкМ дезоксирибонуклеотидтрифосфата (dNTP), 1М бетаина, 100 мкМ 7-диазагуаназин-5'-трифосфата (7-deaza-GTP), 5% диметилсульфоксида (DMSO), 0,5 ед. термостабильной ДНК-полимеразы с ингибирующими активность фермента антителами и по 0,5 пмоль каждого праймера: прямого и обратного, при следующих условиях: начальное плавление ДНК проводят в течение 900 секунд при температуре 98°C, далее проводят 35 циклов амплификации, включающие денатурацию при 97°C в течение 45 секунд, отжиг праймеров при температуре 62°C в течение 30 секунд и синтез участка ДНК при температуре 72°C в течение 240 секунд, а завершающую элонгацию осуществляют при температуре 72°C в течение 1500 секунд, а затем размер полученных флуоресцентно-меченых фрагментов - ампликонов ДНК оценивают методом фрагментного анализа на капиллярном генетическом секвенаторе, при этом для детектируемых пиков электрофореграммы количество CGG-повторов в промоторной области гена FMR1 (N) высчитывают по формуле: N=(1,04X-237)/3, где 1,04 - поправочный коэффициент; X - размер ампликона ДНК-образца соответствующего пика на электрофореграмме; 237 - размер области ампликона вне повторов (5'-конец и 3'-конец); 3 - число нуклеотидов в одном повторе.
2. Способ по п. 1, отличающийся тем, что в случае детектирования у женщин одного пика на электрофореграмме, а у мужчин отсутствия детектируемого пика, что означает возможность содержания числа CGG-повторов более 80, повторно проводят выявление наличия экспансии CGG-повторов в исследуемом ДНК-образце путем амплификации локуса тандемных CGG-повторов промоторной области гена FMR1 в ПЦР с использованием тех же олигонуклеотидных праймеров: прямого FMR1 F: 5'-CGCTCAGCTCCGTTTCGG-3' и обратного FMR1 R: 5'-AAGTACCTTGTAGAAAGCGCCA-3' без метки с последующим разделением полученных ампликонов электрофорезом в 1,5% агарозном геле при напряжении электрического поля 70 В в течение 90 минут, распределение фрагментов ДНК детектируют и документируют в длинноволновом ультрафиолетовом освещении по свечению связавшегося интеркалирующего красителя и определяют размер ампликона ДНК-образца соответствующей полосы на электрофореграмме, содержащего CGG-повторов в количестве более 80 повторов, в случае его визуализации, ориентируясь на примененный молекулярный размерный стандарт, при этом количество CGG-повторов в промоторной области гена FMR1 (N) высчитывают по формуле: N=(X-237)/3, где X - размер ампликона ДНК-образца соответствующей полосы на электрофореграмме; 237 - размер области ампликона вне повторов (5'-конец и 3'-конец); 3 - число нуклеотидов в одном повторе.