Гетероциклические производные в качестве рецепторов, ассоциированных со следовыми аминами (taars)
Иллюстрации
Показать всеНастоящее изобретение относится к соединениям формулы
,
а также к фармацевтическим композициям на их основе. Технический результат: получены новые соединения, обладающие аффинностью к рецепторам к TAAR1, которые могут применяться для лечения депрессии, тревожных расстройств, биполярного расстройства, синдрома дефицита внимания и гиперактивности (СДВГ), расстройств, вызванных стрессом, психотических расстройств, шизофрении, неврологических заболеваний, болезни Паркинсона, нейродегенеративных расстройств, болезни Альцгеймера, эпилепсии, мигрени, гипертензии, злоупотребления веществами, вызывающими зависимость, метаболических расстройств, нарушения питания, диабета, диабетических осложнений, ожирения, дислипидемии, расстройств потребления и ассимиляции энергии, расстройств и нарушений температурного гомеостаза, нарушений сна и циркадного ритма и сердечно-сосудистых расстройств. 4 н. и 19 з.п. ф-лы, 16 схем, 1 табл., 55 пр.
Реферат
Настоящее изобретение относится к соединениям формулы
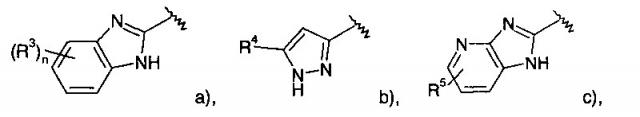
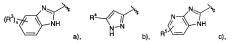
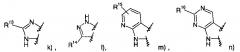
где R1 представляет собой одно- или двухчленную гетероарильную группу, выбранную из группы, состоящей из
R2 предста56вляет собой водород или галоген; или
R1 и R2 могут образовывать вместе с атомами углерода, к которым они присоединены, следующие кольца
или
R3 представляет собой водород, галоген или низший алкил; n представляет собой 1 или 2;
R4 представляет собой фенил, замещенный одним или двумя заместителями, выбранными из галогена или циано, или представляет собой пиридинил, возможно замещенный галогеном, или представляет собой тетрагидропиран, или представляет собой -NH-С(O)-фенил, возможно замещенный галогеном;
R5 представляет собой водород или галоген;
R6-R13 представляют собой фенил, возможно замещенный галогеном:
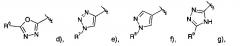
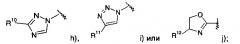
R14 представляет собой -NH-С(O)-фенил, замещенный галогеном;
R15 представляет собой водород, низший алкил, замещенный галогеном или представляет собой галоген;
R16 представляет собой водород или низший алкокси;
R17 представляет собой пиридинил, возможно замещенный низшим алкокси или низший алкил, замещенный галогеном;
к их фармацевтически приемлемым кислотно-аддитивным солям, ко всем рацемическим смесям, ко всем их соответствующим энантиомерам и/или оптическим изомерам и ко всем таутомерным формам соединений формулы I.
Было обнаружено, что соединения формулы I обладают хорошей аффинностью к рецепторам следовых аминов, особенно к TAAR1.
Соединения могут быть полезны для лечения депрессии, тревожных расстройств, биполярного расстройства, синдрома дефицита внимания и гиперактивности (СДВГ), расстройств, вызванных стрессом, психотических расстройств, таких как шизофрения, неврологических заболеваний, таких как болезнь Паркинсона, нейродегенеративных расстройств, таких как болезнь Альцгеймера, эпилепсии, мигрени, гипертензии, злоупотребления веществами, вызывающими зависимость, и метаболических расстройств, таких как расстройства приема пищи, диабет, диабетические осложнения, ожирение, дислипидемия, расстройства потребления и ассимиляции энергии, расстройств и нарушений температурного гомеостаза, нарушений сна и циркадного ритма и сердечно-сосудистых расстройств.
Некоторые из физиологических эффектов (т.е. эффекты на сердечно-сосудистую систему, гипотония, индукция седативного эффекта), которые были обнаружены для соединений, которые могут связываться с адренорецепторами (WO 02/076950, WO 97/12874 или ЕР 0717037) можно рассматривать как нежелательные побочные эффекты в случае лекарственных средств, направленных на лечении заболеваний центральной нервной системы, как описано выше. Поэтому является желательным получить лекарственные средства, обладающие селективностью в отношении рецептора TAAR1 по сравнению с адренергическими рецепторами. Объекты настоящего изобретения проявляют селективность в отношении рецептора TAAR1 по отношению к адренергическим рецепторам, в частности хорошей селективностью по сравнению с альфа1 и альфа2 адренергическими рецепторами человека и крысы.
Классические биогенные амины (серотонин, норэпинефрин, эпинефрин, допамин, гистамин) как нейромедиаторы играют важную роль в центральной и периферической нервной системе [1]. Их синтез и хранение, а также их деградация и обратный захват после высвобождения строго регулируются. Известно, что дисбаланс уровней биогенных аминов является ответственным за изменение функции мозга при многих патологических состояниях [2-5]. Соединения, образующие второй класс эндогенных аминов, так называемые следовые амины (trace amines, ТА), очень схожи с классическими биогенными аминами по своей структуре, метаболизму и субклеточной локализации. ТА включают п-тирамин, β-фенилэтиламин, триптамин и октопамин, и их уровень в нервной системе млекопитающих существенно ниже уровня классических биогенных аминов [6].
Нарушение их регуляции связано с различными психическими заболеваниями, такими как шизофрения и депрессия [7], и другими состояниями, такими как синдром дефицита внимания и гиперактивности, головная боль типа мигрени, болезнь Паркинсона, злоупотребление веществами, вызывающими зависимость, и расстройства приема пищи [8, 9].
В течение долгого времени существование ТА-специфических рецепторов являлось всего лишь гипотезой, основанной на присутствии в ЦНС (центральной нервной системе) человека и других млекопитающих анатомически дискретных сайтов связывания, обладающих высокой аффинностью к ТА [10, 11]. Соответственно считалось, что фармакологическое действие ТА опосредовано тем же известным механизмом, что и действие классических биогенных аминов, то есть либо сигналом, вызывающим их высвобождение, либо ингибированием их обратного захвата, либо “перекрестным связыванием” с их рецепторной системой [9, 12, 13]. В последнее время данная точка зрения претерпела значительные изменения в связи с идентификацией нескольких членов нового семейства GPCR (G-белок-связанных рецепторов), рецепторов следовых аминов (TAAR) [7, 14]. Обнаружено 9 TAAR-генов в геноме человека (включая 3 псевдогена) и 16 генов в геноме мыши (включая 1 псевдоген). TAAR-гены не содержат интронов (за одним исключением, TAAR2 содержит 1 интрон) и расположены рядом на одном хромосомном сегменте. Филогенетическое родство генов этих рецепторов, согласующееся с высокой степенью схожести, получаемой при сравнении с GPCR-фармакофором, и фармакологические данные дают возможность предположить, что эти рецепторы образуют три различных подсемейства [7, 14]. TAAR1 относится к первому подклассу, состоящему из четырех генов (TAAR1-4), которые представлены в геномах человека и грызунов высококонсервативными последовательностями. ТА активируют TAAR1 через Gα. Показано, что нарушение регуляции ТА связано с этиологией различных заболеваний, таких как депрессия, психоз, синдром дефицита внимания и гиперактивности, злоупотребление веществами, вызывающими зависимость, болезнь Паркинсона, головная боль типа мигрени, расстройства приема пищи, метаболические расстройства, и поэтому использование TAAR-лигандов в лечении данных заболеваний может являться весьма перспективным.
Поэтому получение новых знаний о рецепторах следовых аминов весьма актуально.
Использованные ссылки:
1. Deutch, A.Y. and Roth, R.H. (1999) Neurotransmitters. In Fundamental Neuroscience (2nd edn) (Zigmond, M.J., Bloom, F.E., Landis, S.C., Roberts, J.L, and Squire, L.R., eds.), pp. 193-234, Academic Press.
2. Wong, M.L. and Licinio, J. (2001) Research and treatment approaches to depression. Nat. Rev. Neurosci. 2, 343-351.
3. Carlsson, A. et al. (2001) Interactions between monoamines, glutamate, and GABA in schizophrenia: new evidence. Annu. Rev. Pharmacol. Toxicol. 41, 237-260.
4. Tuite, P. and Riss, J. (2003) Recent developments in the pharmacological treatment of Parkinsonʹs disease. Expert Opin. Investig. Drugs 12, 1335-1352.
5. Castellanos, F.X. and Tannock, R. (2002) Neuroscience of attention-deficit/hyperactivity disorder: the search for endophenotypes. Nat. Rev. Neurosci. 3, 617-628.
6. Usdin, Earl; Sandler, Merton; Editors. Psychopharmacology Series, Vol. 1: Trace Amines and the Brain. [Proceedings of a Study Group at the 14th Annual Meeting of the American College of Neuropsychoparmacology, San Juan, Puerto Rico] (1976).
7. Lindemann, L. and Hoener, M. (2005) A renaissance in trace amines inspired by a novel GPCR family. Trends in Pharmacol. Sci. 26, 274-281.
8. Branchek, T.A. and Blackburn, T.P. (2003) Trace amine receptors as targets for novel therapeutics: legend, myth and fact. Curr. Opin. Pharmacol. 3, 90-97.
9. Premont, R.T. et al. (2001) Following the trace of elusive amines. Proc. Natl. Acad. Sci. USA 98, 9474-9475.
10. Mousseau, D.D. and Butterworth, R.F. (1995) A high-affinity [3H] tryptamine binding site in human brain. Prog. Brain Res. 106, 285-291.
11. McCormack, J.K. et al. (1986) Autoradiographic localization of tryptamine binding sites in the rat and dog central nervous system. J. Neurosci. 6, 94-101.
12. Dyck, L.E. (1989) Release of some endogenous trace amines from rat striatal slices в присутствии and absence of a monoamine oxidase inhibitor. Life Sci. 44, 1149-1156.
13. Parker, E.M. and Cubeddu, L.X. (1988) Comparative effects of amphetamine, phenylethylamine and related drugs on dopamine efflux, dopamine uptake and mazindol binding. J. Pharmacol. Exp. Ther. 245, 199-210.
14. Lindemann, L. et al. (2005) Trace amine associated receptors form structurally and functionally distinct subfamilies of novel G protein-coupled receptors. Genomics 85, 372-385.
Предметом настоящего изобретения являются новые соединения формулы I и их фармацевтически приемлемые соли их применение для изготовления лекарственных средств для лечения заболеваний, связанных с биологической функцией рецепторов следовых аминов, их получение и лекарственные средства на основе соединений по изобретению при лечении или профилактике таких заболеваний, как депрессия, тревожные расстройства, биполярное расстройство, синдром дефицита внимания и гиперактивности, расстройства, вызванные стрессом, психотические расстройства, такие как шизофрения, неврологические заболевания, такие как болезнь Паркинсона, нейродегенеративные расстройства, такие как болезнь Альцгеймера, эпилепсия, мигрень, гипертензия, злоупотребление веществами, вызывающими зависимость, и метаболические расстройства, такие как расстройства приема пищи, диабет, диабетические осложнения, ожирение, дислипидемия, расстройства потребления и ассимиляции энергии, расстройства и нарушения температурного гомеостаза, нарушения сна и циркадного ритма и сердечно-сосудистые расстройства.
Предпочтительными показаниями к применению соединений по настоящему изобретению являются депрессия, психоз, болезнь Паркинсона, тревога и синдром дефицита внимания и гиперактивности (СДВГ) и сахарный диабет.
Как использовано в данном описании, термин “низший алкил” означает группу с насыщенной прямой или разветвленной цепью, содержащую от 1 до 7 атомов углерода, например метил, этил, пропил, изопропил, н-бутил, изобутил, 2-бутил, трет-бутил и т.д. Предпочтительными алкильными группами являются группы, содержащие 1-4 атома углерода.
Как использовано в данном описании, термин “низший алкокси” означает группу, где алкильный остаток, как определено выше, присоединен через атом кислорода.
Термин “галоген” означает хлор, иод, фтор и бром.
Как использовано в данном описании, термин “низший алкил, замещенный галогеном” означает группу с насыщенной прямой или разветвленной цепью, содержащую от 1 до 7 атомов углерода, как определено выше для термина «низший алкил», где по меньшей мере один атом водорода заменен на галоген. Предпочтительным атомом галогена является фтор. Примерами таких групп являются CF3, CHF2, CH2F, CH2CF3 или CH2CHF2.
Термин “фармацевтически приемлемые кислотно-аддитивные соли” включает в себя соли с неорганическими и органическими кислотами, такими как соляная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метан-сульфоновая кислота, п-толуолсульфоновая кислота и т.д.
Рацемическая смесь или рацемат являются такие, которые имеет равные количества левых и правых энантиомеров хиральной молекулы.
Энантиомером является один из двух стереоизомеров, которые являются зеркальным отображением друг друга.
Таутомерами являются изомеры органических соединений, которые легко переходят друг в друга в результате химической реакции. Эту реакция обычно приводит к формальной миграции атома водорода или протона, в сопровождении с переключением одинарной связи и смежной двойной связи. Вследствие быстрого взаимопревращения, таутомеры, как правило, считаются одним и тем же химическим соединением.
Воплощениями настоящего изобретения являются следующие структуры:
где R2 представляет собой водород или галоген; или
R3 представляет собой водород, галоген или низший алкил; n представляет собой 1 или 2;
R4 представляет собой фенил, замещенный одним или двумя заместителями, выбранными из галогена или циано, или представляет собой пиридинил, возможно замещенный галогеном, или представляет собой тетрагидропиран, или представляет собой -NH-С(O)-фенил, возможно замещенный галогеном;
R5 представляет собой водород или галоген;
R6-R13 представляют собой фенил, возможно замещенный галогеном;
R14 представляет собой -NH-С(O)-фенил, замещенный галогеном;
R15 представляет собой водород, низший алкил, замещенный галогеном или галоген; и
R16 представляет собой водород или низший алкокси;
R17 представляет собой пиридинил, возможно замещенный низшим алкокси или низший алкил, замещенный галогеном;
или их фармацевтически приемлемые кислотно-аддитивные соли все рацемические смеси, все их соответствующие энантиомеры и/или оптические изомеры и все таутомерные формы соединений формулы I.
Соединениями формулы Ia являются:
2-(4-(1Н-бензо[d]имидазол-2-ил)фенил)морфолин
2-(4-(6-хлор-1Н-диметил[d]имидазол-2-ил)фенил)морфолин
(S)-2-(4-(6-фтор-1Н-диметил[d]имидазол-2-ил)фенил)морфолин
(S)-2-(4-(4,6-дифтор-1Н-диметил[d]имидазол-2-ил)фенил)морфолин
(R)-2-(4-(фтор-1Н-диметил[d]имидазол-2-ил)фенил)морфолин или
(S)-2-(4-(5,6-диметил-1Н-диметил[d]имидазол-2-ил)фенил)морфолин.
Соединениями формулы Ib являются:
2-(4-(5-(4-хлорфенил)-1Н-пиразол-3-ил)фенил)морфолин
2-(4-(5-(4-фторфенил)-1Н-пиразол-3-ил)фенил)морфолин
(4-(5-(6-хлорпиридин-3-ил)-1Н-пиразол-3-ил)фенил)морфолин
4-(3-(4-(морфолин-2-ил)фенил)-1Н-пиразол-5-ил)бензонитрил
(R)-2-(4-(5-(3-хлорфенил)-1Н-пиразол-3-ил)фенил)морфолин
(S)-2-(4-(5-(3-хлорфенил)-1Н-пиразол-3-ил)фенил)морфолин
3-[5-(4-морфолин-2-ил-фенил)-2Н-пиразол-3-ил]-бензонитрил
(S)-2-(4-(5-(2,4-дифторфенил)-1Н-пиразол-3-ил)фенил)морфолин
(R)-2-(4-(5-(2,4-дифторфенил)-1Н-пиразол-3-ил)фенил)морфолин
(S)-2-(4-(5-(тетрагидро-2Н-пиран-4-ил)-1Н-пиразол-3-ил)фенил)морфолин
(S)-4-(3-(4-(морфолин-2-ил)фенил)-1Н-пиразол-5-ил)бензонитрил
(S)-2-(4-(5-(4-фторфенил)-1Н-пиразол-3-ил)фенил)морфолин
(S)-4-фтор-N-(3-(4-(морфолин-2-ил)фенил)-1Н-пиразол-5-ил)бензамид
(R)-2-(4-(5-(4-фторфенил)-1Н-пиразол-3-ил)фенил)морфолин
(R)-4-(3-(4-(морфолин-2-ил)фенил)-1Н-пиразол-5-ил)бензонитрил
(S)-3-фтор-4-(3-(4-(морфолин-2-ил)фенил)-1Н-пиразол-5-ил)бензонитрил
(S)-2-{4-[5-(6-хлор-пиридин-3-ил)-1Н-пиразол-3-ил]-фенил}-морфолин
(R)-2-{4-[5-(6-хлор-пиридин-3-ил)-1Н-пиразол-3-ил]-фенил}-морфолин
(S)-2-(3-фтор-4-(5-(4-фторфенил)-1Н-пиразол-3-ил)фенил)морфолин
(R)-2-(3-фтор-4-(5-(4-фторфенил)-1Н-пиразол-3-ил)фенил)морфолин или
(S)-2-(4-(5-(2-хлорпиридин-4-ил)-1Н-пиразол-3-ил)фенил)морфолин.
Соединение формулы Ic представляет собой:
(S)-2-(4-(6-бромо-1Н-имидазо[4,5-b]пиридин-2-ил)фенил)морфолин.
Соединениями формулы Id являются:
(S)-2-(4-(5-(4-фторфенил)-1,3,4-оксадиазол-2-ил)фенил)морфолин или
(R)-2-(4-(5-(4-фторфенил)-1,3,4-оксадиазол-2-ил)фенил)морфолин.
Соединениями формулы Ie являются:
(S)-2-(4-(1-(4-фторфенил)-1Н-1,2,3-триазол-4-ил)фенил)морфолин или
(R)-2-(4-(1-(4-фторфенил)-1Н-1,2,3-триазол-4-ил)фенил)морфолин.
Соединениями формулы If являются:
(S)-2-(4-(1-(4-фторфенил)-1Н-пиразол-4-ил)фенил)морфолин или
(R)-2-(4-(1-(4-фторфенил)-1Н-пиразол-4-ил)фенил)морфолин.
Соединениями формулы Ig являются:
(S)-2-(4-(5-(4-фторфенил)-1Н-1,2,4-триазол-3-ил)фенил)морфолин или
(R)-2-(4-(5-(4-фторфенил)-1Н-1,2,4-триазол-3-ил)фенил)морфолин.
Соединениями формулы Ih являются:
(S)-2-(4-(3-(4-фторфенил)-1Н-1,2,4-триазол-1-ил)фенил)морфолин или
(R)-2-(4-(3-(4-фторфенил)-1Н-1,2,4-триазол-1-ил)фенил)морфолин.
Соединениями формулы Ii являются:
(S)-2-(4-(4-(4-фторфенил)-1Н-1,2,3-триазол-1-ил)фенил)морфолин или
(R)-2-(4-(4-(4-фторфенил)-1Н-1,2,3-триазол-1-ил)фенил)морфолин.
Соединение формулы Ij представляет собой:
(S)-2-{4-[(R)-4-(4-фтор-фенил)-4,5-дигидро-оксазол-2-ил]-фенил}-морфолин.
Соединениями формулы Ik являются:
(S)-2-(2-(4-фторфенил)-1Н-диметил[d]имидазол-5-ил)морфолин или
(R)-2-(2-(4-фторфенил)-1Н-диметил[d]имидазол-5-ил)морфолин.
Соединение формулы II представляет собой:
4-фтор-N-(6-(морфолин-2-ил)-1Н-индазол-3-ил)бензамид.
Соединениями формулы Im являются:
(S)-2-(9Н-пиридо[2,3-b]индол-6-ил)морфолин
(S)-2-(3-(трифторметил)-9Н-пиридо[2,3-b]индол-6-ил)морфолин
(S)-2-(3-хлор-9Н-пиридо[2,3-b]индол-6-ил)морфолин
(R)-2-(3-(трифторметил)-9Н-пиридо[2,3-b]индол-6-ил)морфолин
(S)-2-(2-(трифторметил)-9Н-пиридо[2,3-b]индол-6-ил)морфолин или
(R)-2-(3-(трифторметил)-9Н-пиридо[2,3-b]индол-6-ил)морфолин.
Соединение формулы In представляет собой:
(S)-2-(2-изопропокси-9Н-пиримидо[4,5-b]индол-6-ил)морфолин.
Соединениями формулы Io являются:
(R)-2-(6-этоксипиридин-3-ил)-6-(морфолин-2-ил)диметил[d]оксазол
(R)-6-(морфолин-2-ил)-2-(6-(трифторметил)пиридин-3-ил)диметил[d]оксазол
(R)-6-(морфолин-2-ил)-2-(2-(трифторметил)пиридин-4-ил)диметил[d]оксазол или
(S)-6-(морфолин-2-ил)-2-(2-(трифторметил)пиридин-4-ил)диметил[d]оксазол.
Соединения формулы I по изобретению и их фармацевтически приемлемые соли могут быть получены способами, известными в данной области техники, например, с помощью способов, описанных ниже, которые включают депротекцию соединения формулы
с помощью HCl в диоксане в течение 2 часов при 60°C, или с помощью CF3COOH в дихлорметане при комнатной температуре до соединения формулы
где PG представляет собой кислотно-лабильную аминозащитную группу, такую как трет-бутоксикарбонильная группа, a R1 и R2 являются такими, как описано выше и, если необходимо, конвертирование полученного соединения в фармацевтически приемлемые кислотно-аддитивные соли.
Получение соединений формулы I по настоящему изобретению может быть проведена в последовательными или конвергентными путями синтеза. Синтезы соединений по изобретению показаны на следующих схемах 1-16 и в описании 55 конкретных примеров. Навыки, необходимые для проведения реакции и очистки полученных продуктов известны специалистам в данной области техники. Заместители и индексы, используемые в следующем описании процессов имеют значения, указанные здесь ранее, если не указано иное.
Более подробно, соединения формулы I могут быть получены с помощью способов, приведенных ниже, с помощью способов, приведенных в примерах, или аналогичными способами. Подходящие условия реакции для отдельных реакционных стадий известны специалисту в данной области техники. Последовательность реакций не ограничивается показанной на схемах 1-16, однако, в зависимости от исходных материалов и их соответствующей реакционной способности, последовательность стадий реакции может быть свободно изменена. Исходные материалы являются либо коммерчески доступными, либо могут быть получены способами, аналогичными способам, приведенным ниже, способами, описанными в ссылках, приведенных в описании или в примерах, или способами, известными в данной области техники.
Стадия А: N-защищенной производное морфолина 3 может быть формилировано посредством использования оргнометаллического реагента, такого как н-бутиллитий или втор-бутиллитий или трет-бутиллитий, в комбинации с диметилформамидом в подходящем растворителе, таком как ТГФ при температурах от -78°C до -10°C в течение 1-18 часов.
Предпочтительными условиями являются использование н-бутиллития и диметилформамида в ТГФ при -78°C в течение 2 часов. Предпочтительной защитной группой PG является трет-бутоксикарбонильная группа.
Стадия В: Циклизация альдегида 4а с 1,2-диаминоариловыми соединениями 5 может быть выполнена посредством взаимодействия этих соединений в присутствии окислительного реагента, такого как метабисульфит натрия в подходящем растворителе, таком как диметилацетамид при температурах от 0°C до 100°C в течение 1-24 часов.
Предпочтительными условиями являются применение метабисульфита натрия в диметилацетамиде при 90°C в течение 18 часов.
Стадия С: Отщепление аминозащитной группы может быть достигнуто различными способами, известными в уровне техники. Трет-бутоксикарбонильная группа может быть отщеплена с использованием минеральной кислоты, такой как HCl, H2SO4 или H3PO4 или органической кислоты, такой как CF3COOH, CHCl2COOH, НОАс или п-толуолсульфоновой кислоты в растворителе, таком как CH2Cl2, CHCl3, ТГФ, МеОН, EtOH или H2O при от 0 до 60°C.
Предпочтительными условиями являются применение HCl в диоксане в течение 2 часов при 60°C или применение CF3COOH в дихлорметане при комнатной температуре в течение ночи.
Стадия А: N-защищенное производное морфолина 3 может быть ацетилировано посредством использования оргнометаллического реагента, такого как н-бутиллитий или втор-бутиллитий или трет-бутиллитий в комбинации с N-метокси-N-метилацетамидом или диметилацетамидом в подходящем растворителе, таком как ТГФ при температурах от -78°C до 0°C в течение 1-18 часов.
Предпочтительными условиями являются использование н-бутиллития и N-метокси-N-метилацетамида в ТГФ при -78°C в течение 1 ч. Предпочтительной защитной группой PG является трет-бутоксикарбонильная группа.
Стадия В: Ацетильное соединение 4а может быть депротонировано с использованием основания, такого как литий-бис-(триметилсилил)амид или диизопропиламид лития в подходящем растворителе, таком как ТГФ и затем дополнительно взаимодействовать с хлорангидридом или эфиром VIII при температурах от -78°C до 0°C в течение 1-18 часов.
Предпочтительными условиями являются использование бис-(триметилсилил)амида лития и хлорангидрида в ТГФ при -78°C в течение 1 часов.
Стадия С: Дикарбонильное соединение 6 может взаимодействовать с гидразином или его гидратом в подходящем растворителе, таком как этанол, метанол, н-пропанол или изопропанол при от 0 до 80°С в течение 1-18 часов.
Предпочтительными условиями являются взаимодействие с гидратгидразином в этаноле при кипении с обратным холодильником в течение 3-4 часов.
Стадия D: Отщепление аминозащитной группы может быть достигнуто различными способами, известными в уровне техники. Трет-бутоксикарбонильная группа может быть отщеплена с использованием минеральной кислоты, такой как HCl, H2SO4 или H3PO4 или органической кислоты, такой как CF3COOH, CHCl2COOH, HOAc или п-толуолсульфоновой кислоты в растворителе, таком как CH2Cl2, CHCl3, ТГФ, МеOH, EtOH или H2O при от 0 до 60°C.
Предпочтительными условиями являются применение HCl в диоксане в течение 2 часов при 60°C или применение CF3COOH в дихлорметане при комнатной температуре в течение ночи.
Стадия А: Защищенные морфолина 2 могут быть разделены на из энантиомерные формы посредством хирального разделения. Предпочтительной защитной группой является трет-бутоксикарбонильная группа, предпочтительным хиральным разделением является хиральная хроматография с использованием хиральной неподвижной фазы, такой как Chiralpak AD, и подходящего растворителя, такого как смесь изопропанола и гептана.
Стадия В: Отщепление аминозащитной группы может быть достигнуто различными способами, известными в уровне техники. Трет-бутоксикарбонильная группа может быть отщеплена с использованием минеральной кислоты, такой как HCl, H2SO4 или H3PO4 или органической кислоты, такой как CF3COOH, CHCl2COOH, HOАс или п-толуолсульфоновой кислоты в растворителе, таком как CH2Cl2, CHCl3, ТГФ, МеOH, EtOH или H2O при от 0 до 60°C.
Предпочтительными условиями являются применение HCl в диоксане в течение 2 часов при 60°C или применение CF3COOH в дихлорметане при комнатной температуре в течение ночи.
Стадия А: Взаимодействие альдегида 4 с гидразидом 7 может быть выполнена посредством перемешивания обоих компонентов в подходящем растворителе, таком как этанол, метанол, ТГФ или дихлорметан с или без осушителя, такого как молекулярные сита или сульфат магния при температурах от 0°C до 60°C.
Предпочтительными условиями являются перемешивание в этаноле при комнатной температуре без осушителя в течение 2 часов.
Стадия В: Окислительная циклизация может быть достигнута посредством обработки 8 окисляющим реагентом, таким как [бис(трифторацетокси)йод]бензол в подходящем растворителе, таком как хлороформ, дихлорметан, 1,2-диметоксиэтан, ТГФ или диэтиловый эфир при температурах от -78°C до кипения с обратным холодильником в течение 1-24 часов.
Предпочтительными условиями являются обработка [бис(трифторацетокси)йод]бензолом в течение 20 минут при комнатной температуре.
Стадия С: Отщепление аминозащитной группы может быть достигнуто различными способами, известными в уровне техники. Трет-бутоксикарбонильная группа может быть отщеплена с использованием минеральной кислоты, такой как HCl, H2SO4 или H3PO4 или органической кислоты, такой как CF3COOH, CHCl2COOH, HOАс или п-толуолсульфоновой кислоты в растворителе, таком как CH2Cl2, CHCl3, ТГФ, МеOH, EtOH или H2O при от 0°C до 60°C.
Предпочтительными условиями являются применение HCl в диоксане в течение 2 часов при 60°C или применение CF3COOH в дихлорметане при комнатной температуре в течение ночи.
Стадия А: Образование алкилена может быть выполнено посредством взаимодействия альдегида 4а с подходящим реагентом, таким как диметил 1-диазо-2-оксопропилфосфонат и основанием, таким как карбонат калия или карбонат натрия в растворителе, таком как метанол, этанол или изопропанол при температурах -20°C - 60°C в течение 15 мин - 18 часов. Альтернативно, может быть использовано взаимодействие альдегида 4а с тетрабромметаном и трифенилфосфином, с последующей обработкой сильным основанием, таким как бутиллитий.
Предпочтительными условиями являются применение диметил 1-диазо-2-оксопропилфосфоната и карбоната калия в метаноле при комнатной температуре в течение 2 часов.
Стадия В: Образование триазола может быть достигнуто посредством взаимодействия алкина 9 с азидом 10 в подходящем растворителе, таком как бензол, толуол, дихлорметан, тетрагидрофуран, пиридин, N,N-диизопропиламин или триэтиламин с или без катализатора, такого как соли меди при от -20°C до 60°C в течение от 15 минут до 18 часов.
Предпочтительными условиями являются применение йодида меди (I) в N,N-диизопропиламине в качестве растворителя при комнатной температуре в течение 3 часов.
Стадия С: Отщепление аминозащитной группы может быть достигнуто различными способами, известными в уровне техники. Трет-бутоксикарбонильная группа может быть отщеплена с использованием минеральной кислоты, такой как HCl, H2SO4 или Н3РО4 или органической кислоты, такой как CF3COOH, CHCl2COOH, HOАс или п-толуолсульфоновой кислоты в растворителе, таком как CH2Cl2, CHCl3, ТГФ, МеOH, EtOH или H2O при от 0 до 60°C.
Предпочтительными условиями являются применение HCl в диоксане в течение 2 часов при 60°C или применение CF3COOH в дихлорметане при комнатной температуре в течение ночи.
Стадия А: Связывание бромпроизводного 3 с подходящей бороновой кислотой или эфиром бороновой кислоты 11 может быть выполнено посредством использования палладиевого катализатора, такого как ацетат палладия (II) или хлорид палладия (II) или тетракис(трифенилфосфин)палладий(0) в комбинации с лигандом, таким как трифенилфосфин, трициклогексилфосфин или аналогичным, и основанием, таким как фосфат калия, карбонат калия, карбонат цезия, триэтиламин или диизопропилэтиламин, в подходящем растворителе, таком как диоксан, диметилацетамид, диметилформамид, тетрагидрофуран, диметоксиэтан, диглим, этанол, метанол или вода при от 20°C до 180°C в течение от 5 минут до 18 часов в присутствии или без микроволнового излучения.
Предпочтительными условиями являются применение тетракис(трифенилфосфин)палладия (0) фосфата калия в диметилацетамиде при 150°C под микроволновым излучением в течение 10 минут.
Стадия В: Отщепление аминозащитной группы может быть достигнуто различными способами, известными в уровне техники. Трет-бутоксикарбонильная группа может быть отщеплена с использованием минеральной кислоты, такой как HCl, H2SO4 или H3PO4 или органической кислоты, такой как CF3COOH, CHCl2COOH, HOАс или п-толуолсульфоновой кислоты в растворителе, таком как CH2Cl2, CHCl3, ТГФ, МеOH, EtOH или H2O при от 0 до 60°C.
Предпочтительными условиями являются применение HCl в диоксане в течение 2 часов при 60°C или применение CF3COOH в дихлорметане при комнатной температуре в течение ночи.
Стадия А: Образование нитрила может быть выполнено посредством взаимодействия бромида 3 с подходящим реагентом, таким как цианид цинка и катализатора, такого как тетракис(трифенилфосфин)палладий(0), в растворителе, таком как диметилформамид, при температурах от 20°C - 120°C в течение 1 ч - 24 часов.
Предпочтительными условиями являются применение цианида цинка и тетракис(трифенилфосфин)палладия (0) в диметилформамиде при 85°С в течение ночи.
Стадия В: Образование триазола может быть достигнуто посредством взаимодействия нитрила 12 с гидразидом 13 в подходящем растворителе, таком как этанол, метанол, пропанол или бутан-1-ол, с подходящим основанием, таким как карбонат калия, карбонат натрия при от 20°C до 160°C в течение от 1 ч до 24 часов.
Предпочтительными условиями являются применение карбоната калия в бутан-1-оле в качестве растворителя при 150°C в течение 3 часов.
Стадия С: Отщепление аминозащитной группы может быть достигнуто различными способами, известными в уровне техники. Трет-бутоксикарбонильная группа может быть отщеплена с использованием минеральной кислоты, такой как HCl, H2SO4 или H3PO4 или органической кислоты, такой как CF3COOH, CHCl2COOH, HOАс или п-толуолсульфоновой кислоты в растворителе, таком как CH2Cl2, CHCl3, ТГФ, МеОН, EtOH или H2O при от 0 до 60°C.
Предпочтительными условиями являются применение HCl в диоксане в течение 2 часов при 60°C или применение CF3COOH в дихлорметане при 5 комнатной температуре в течение ночи.
Стадия А: Образование нитрила может быть выполнено посредством взаимодействия дигалогенового соединения 14 с подходящим реагентом, таким как цианид цинка, и катализатором, таким как тетракис(трифенилфосфин)палладий(0), в растворителе, таком как диметилформамид, при температурах от 20°C - 120°C в течение 1 ч - 24 часов.
Предпочтительными условиями являются применение цианид цинка и тетракис(трифенилфосфин)палладия (0) в диметилформамиде при 85°C в течение ночи.
Стадия В: Образование аминоиндазола 16 может быть достигнуто посредством взаимодействия нитрила 15 с гидразином, гидратгидразинием или солью гидразиния, такой как хлорид гидразиния или сульфат гидразиния, в подходящем растворителе, таком как этанол, метанол, пропанол или бутан-1-ол, с или без подходящего основания, такого как карбонат калия, карбонат натрия, при от 20°С до 140°С в течение от 1 ч до 24 часов.
Предпочтительными условиями являются применение гидратгидразиния в этаноле в качестве растворителя при кипении с обратным холодильником в течение 18 часов.
Стадия С: Амидное связывание может быть достигнуто посредством взаимодействия аминоиндазола 16 с подходящим ацилирующим реагентом 17, таким как хлорангидрид, и основанием, таким как диизопропилэтиламин, триэтиламин или пиридин, в растворителе, таком как дихлорметан, дихлорэтан, тетрагидрофуран, бензол, толуол, пиридин, при температурах от -20°C до 100°C в течение от 1 ч до 24 часов.
Альтернативно, в качестве ацилирующего реагента 17 может быть использована кислота (Х=ОН) в присутствии амидсвязывающего реагента, такого как 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC), дициклогексилкарбодиимид (DCC), O-(Бензотриазол-1-ил)-N,N,Nʹ,Nʹ-тетраметилурониягексафторфосфат (HBTU), O-(Бензотриазол-1-ил)- N,N,Nʹ,Nʹ-тетраметилурониятетрафторборат (TBTU) или аналогичный, и основания, такого как триэтиламин, диизопропилэтиламин или пиридин, в растворителе, таком как метиленхлорид, 1,2-дихлорэтан, тетрагидрофуран или этилацетат.
Предпочтительными условиями являются применение хлорангидрида в пиридине при комнатной температуре в течение 18 часов.
Стадия D: Отщепление аминозащитной группы может быть достигнуто различными способами, известными в уровне техники. Трет-бутоксикарбонильная группа может быть отщеплена с использованием минеральной кислоты, такой как HCl, H2SO4 или H3PO4 или органической кислоты, такой как CF3COOH, CHCl2COOH, HOАс или п-толуолсульфоновой кислоты в растворителе, таком как CH2Cl2, CHCl3, ТГФ, МеОН, EtOH или H2O при от 0 до 60°C.
Предпочтительными условиями являются применение HCl в диоксане в течение 2 часов при 60°C или применение CF3COOH в дихлорметане при комнатной температуре в течение ночи.
Стадия А: Амидное связывание может быть достигнуто посредством взаимодействия кислоты 18 с аминоспиртом 19 в присутствии в присутствии подходящего амидсвязывающего реагента, такого как 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC), дициклогексилкарбодиимид (DCC), О-(Бензотриазол-1-ил)-N,N,Nʹ,Nʹ-тетраметилурониягексафторфосфат (HBTU), О-(Бензотриазол-1-ил)-N,N,Nʹ,Nʹ-тетраметилурониятетрафторборат (TBTU) или аналогичного, и основанием, таким как триэтиламин, диизопропилэтиламин, пиридин или диметиламинопиридин в растворителе, таком как дихлорметан, 1,2-дихлорэтан, тетрагидрофуран или этилацетат при от -20°C до 80°C в течение от 1 ч до 24 часов.
Предпочтительными условиями являются применение 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC) в дихлорметане при комнатной температуре в течение 18 часов.
Стадия В: Отщепление аминозащитной группы может быть достигнуто различными способами, известными в уровне техники. Трет-бутоксикарбонильная группа может быть отщеплена с использованием минеральной кислоты, такой как HCl, H2SO4 или H3PO4 или органической кислоты, такой как CF3COOH, CHCl2COOH, HOАс или п-толуолсульфоновой кислоты в растворителе, таком как CH2Cl2, CHCl3, ТГФ, МеОН, EtOH или H2O при от 0 до 60°C.
Предпочтительными условиями являются применение HCl в диоксане в течение 2 часов при 60°C или применение CF3COOH в дихлорметане при комнатной температуре в течение ночи.
Стадия С: Циклизация может быть достигнута посредством обработки промежуточного соединения 21 активирующим реагентом, таким как трифторид диэтиламиносеры (DAST) в дихлорметане при от -20°C до 40°C в течение от 1 ч до 24 часов.
Предпочтительными условиями являются применение трифторида диэтиламиносеры (DAST) в дихлорметане в течение 5 часов при комнатной температуре.
Стадия А: Связывание бромопроизводного 3 с подходящим гетероциклом 22 может быть выполнено посредством использования медного катализатора, такого как йодид меди (I) или бромид меди (I), в комбинации с лигандом, таким как 8-гидроксихинолин или аналогичным, и основанием, таким как карбонат натрия, карбонат калия, карбонат цезия, в подходящем растворителе, таком как диоксан, диметилформамид, диметилацетамид, тетрагидрофуран, диметоксиэтан, диглим, этанол, метанол или вода или их смеси при от 20°C до 180°C в течение 15 мин до 48 часов в присутствии или без микроволнового излучения.
Предпочтительными условиями являются применение йодида меди (I), 8-гидроксихинолина и карбоната цезия в смеси диметилформамида и воды при 150°С в течение 48 часов.
Стадия В: Отщепление аминозащитной группы может быть достигнуто различными способами, известными в уровне техники. Трет-бутоксикарбонильная группа может быть отщеплена с использованием минеральной кислоты, такой как HCl, H2SO4 или H3PO4 или органической кислоты, такой как CF3COOH, CHCl2COOH, HОАс или п-толуолсульфоновой кислоты в раствор