Гетеробициклические производные в качестве ингибиторов hcv
Иллюстрации
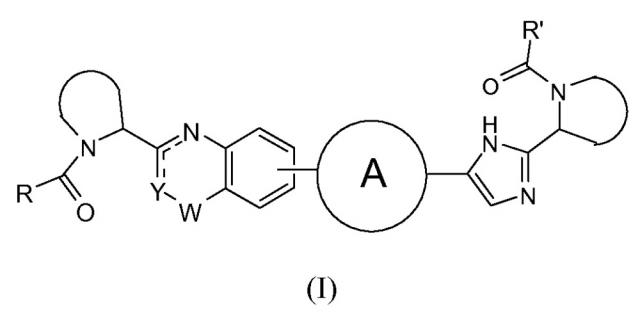
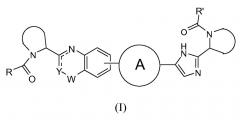
Показать всеНастоящее изобретение относится к области органической химии, а именно к гетероциклическому соединению формулы (I) или к его фармацевтически приемлемой соли, где Y представляет собой СН, N или CR4; W представляет собой карбонил, сульфонил или CR5R6; представляет собой
или независимо выбран из группы, содержащей R и R' независимо выбраны из -CR1R2R3, где R1 выбран из С1-4алкила; R2 представляет собой С1-4алкилоксикарбониламино; R3 представляет собой водород; R4 представляет собой водород или фтор; CR5R6 вместе образуют оксетан. Также изобретение относится к фармацевтической композиции на основе соединения формулы (I), его применению и продукту на его основе. Технический результат: получены новые гетероциклические соединения, полезные при лечении инфекции HCV. 7 н. и 7 з.п. ф-лы, 2 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к гетеробициклическим производным, в частности, но без ограничения, к хинолиноновым и хиназолиноновым производным, которые являются ингибиторами вируса гепатита C (HCV), к их синтезу и их применению, отдельно или в комбинации с другими ингибиторами HCV, при лечении или профилактике HCV.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
HCV является однониточным вирусом с положительно-полярной РНК, принадлежащий семейству вирусов Flaviviridae роду гепатовирусов. Вирусный геном транслируется в отдельную открытую рамку считывания, которая кодирует множество структурных и неструктурных белков.
После начальной острой инфекции у большинства инфицированных индивидуумов развивается хронический гепатит, поскольку HCV реплицируется преимущественно в гепатоцитах, но не являющийся непосредственно цитопатическим. В частности, отсутствие сильного T-лимфоцитного ответа и высокая склонность вируса к мутации, по-видимому, способствует высокой скорости развития хронической инфекции. Хронический гепатит может развиваться до фиброза печени, приводящего к циррозу, конечной стадии болезни печени, и HCC (гепатоцеллюлярному раку), что делает его основной причиной трансплантации печени.
Существует 6 основных генотипов и свыше 50 подтипов HCV, которые распространены в разных географических зонах. 1 генотип HCV является доминирующим генотипом в Европе и США. Обширная генетическая гетерогенность HCV имеет важные диагностические и клинические последствия, возможно объясняющие трудности в разработке вакцины и отсутствие ответной реакции на существующую терапию.
Перенос HCV может осуществляться через контакт с зараженной кровью или продуктами, полученными из зараженной крови, например, в результате переливания крови или внутривенного применения лекарственных средств. Внедрение диагностических тестов, используемых при отборе крови, привело к тенденции снижения посттрансфузионной заболеваемости HCV. Однако вследствие медленного развития заболевания печени до конечной стадии развития болезни, инфекции, уже имеющие место в настоящее время, будут продолжать представлять серьезную медицинскую и экономическую проблему на протяжении десятилетий.
Применяющиеся в настоящее время терапевтические методы лечения HCV основываются на (пэгилированном) интерфероне-альфа (IFN-α) в комбинации с рибофлавином. Такая комбинированная терапия приводит к стабильному вирусологическому ответу у более чем 40% пациентов, инфицированных HCV генотипа 1, и примерно у 80% пациентов, инфицированных генотипами 2 и 3. Помимо ограниченной эффективности в отношении HCV генотипа 1 такая комбинированная терапия сопровождается значительными побочными эффектами, в том числе подобными гриппу симптомами, гематологическими патологиями и нейропсихическими симптомами. Следовательно, существует потребность в более эффективных, удобных и легче переносимых способах лечения.
Практический опыт применения лекарственных средств против HIV, в частности ингибиторов протеазы HIV, показывает, что субоптимальная фармакокинетика и сложные схемы дозировки быстро приводят к случайным нарушениям режима и схемы приема лекарственных средств. Это, в свою очередь, означает, что 24-часовая остаточная концентрация (минимальная концентрация в плазме) для соответствующих лекарственных средств в режиме лечения HIV зачастую на длительные периоды времени в течение суток падает ниже IC90 или ED90. Считается, что при 24-часовом остаточном уровне, по меньшей мере, IC50, точнее IC90 или ED90, существенно замедляется развитие мутантов, «отключающих действие лекарственных средств». Достижение нужной фармакокинетики и скорости метаболизма лекарственного средства для получения таких остаточных уровней обуславливает жесткое требование к разработке лекарственного средства.
Белок NS5A HCV располагается в прямом направлении относительно белка NS4B и в обратном направлении относительно белка NS5B. При посттрансляционном расщеплении вирусной сериновой протеазой NS3/4A NS5A созревает до содержащего цинк трехдоменного фосфопротеина, который существует либо в виде гипофосфорилированных (56-кДа, p56), либо гиперфосфорилированных частиц (58-кДа, p58). NS5A HCV включается во многие аспекты жизненного цикла вируса, в том числе в вирусную репликацию и сборку инфекционных частиц, а также в модуляцию окружающей среды его клетки-хозяина. Хотя ни одна из ферментативных функций не была приписана белку, сообщается о взаимодействии с многочисленными вирусными и клеточными факторами.
В ряде патентов и патентных заявок раскрываются соединения с ингибиторной активностью против HCV, в частности, нацеливание на NS5A. В WO2006/133326 раскрываются стильбеновые производные, а в WO 2008/021927 и WO 2008/021928 раскрываются бифенильные производные, обладающие ингибиторной активностью по отношению к NS5A HCV. В WO 2008/048589 раскрываются 4-(фенилэтинил)-1H-пирозоловые производные и их антивирусное применение. В WO 2008/070447 раскрывается широкий диапазон ингибирующих HCV соединений, включающих бензимидазольный фрагмент. В обеих из WO-2010/017401 и WO-2010/065681 раскрываются бис-имидазольных ингибиторов HCV NS5A.
Существует потребность в ингибиторах HCV, которые смогут преодолеть недостатки существующей в настоящее время терапии HCV, такие как побочные эффекты, ограниченная эффективность, возникновение устойчивости и неудачи в соблюдении режима лечения, а также улучшить устойчивый ответ на вирусную нагрузку.
Настоящее изобретение относится к группе ингибирующих HCV гетеробициклических производных и, в частности, но без ограничения, хинолиноновых и хиназолиноновых производных с полезными свойствами, касающимися одного или нескольких из следующих параметров: противовирусная эффективность, подходящий профиль развития устойчивости, пониженная токсичность и генотоксичность или отсутствие таковых, подходящая фармакокинетика и фармакодинамика, удобство составления и введения, а также ограниченные межлекарственные взаимодействия с другими веществами-лекарственными средствами, в частности, с другими средствами против-HCV, или отсутствие таковых.
Соединения в соответствии с настоящим изобретением также могут быть привлекательными благодаря тому факта, что у них отсутствует активность против других вирусов, в частности против HIV. Инфицированные HIV пациенты часто страдают от сопутствующих инфекций, таких как HCV. Лечение таких пациентов ингибитором HCV, который также ингибирует HIV, может привести к возникновению устойчивых штаммов HIV.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном аспекте настоящее изобретение относится к новым соединениям формулы I:
или его стереоизомер, где
Y представляет собой CH или N, CR4;
W представляет собой карбонил, сульфонил или CR5R6;
представляет собой
независимо выбран из группы, содержащей
R и R' независимо выбраны из -CR1R2R3, арила, необязательно замещенного 1 или 2 заместителями, выбранными из галогена и метила или гетероциклоалкила, где
R1 выбран из C1-4алкила, C2-4алкила, замещенного метокси или гидроксилом, и фенила, необязательно замещенного 1 или 2 заместителями, независимо выбранными из галогена и метила;
R2 представляет собой гидроксил, амино, моно- или ди-C1-4алкиламино, C1-4алкил-карбониламино, C1-4алкилоксикарбониламино;
R3 представляет собой водород или C1-4алкил;
R4 представляет собой водород, C1-4алкил или фтор;
каждый из R5 и R6 независимо представляет собой C1-4алкил; или
CR5R6 вместе образуют C3-7циклоалкил, оксетан, тетрагидрофуран;
или его фармацевтически приемлемые соли или сольваты.
Кроме того, настоящее изобретение относится к продукту, содержащему (a) соединение согласно настоящему изобретению и (b) другой ингибитор HCV, в качестве комбинированного препарата для одновременного, раздельного или последовательного применения в лечение инфекций HCV.
В следующем аспекте настоящее изобретение относится к применению соединений формулы Ia-c или их подгрупп, определенных в настоящем документе, для ингибирования HCV. В качестве альтернативы, предусматривается применение указанных соединений для производства лекарственного препарата для ингибирования HCV.
В первом варианте осуществления настоящее изобретение относится к подгруппе соединений формулы I, которые могут быть представлены формулой (Ia);
Особый интерес представляют соединения формулы I или их подгруппы, определенные в настоящем документе, которые соответствуют формуле Ib и Ic.
В предпочтительном варианте осуществления независимо выбран из группы, включающей
Предпочтительно, по меньшей мере один представляет собой .
Более предпочтительно соединениями в соответствии с настоящим изобретением являются соединения, которые могут быть представлены формулой Id
В следующем варианте настоящего изобретения R2 выбран из группы, включающей C1-4алкилкарбониламино или C1-4алкилоксикарбониламино.
В еще одном варианте осуществления настоящего изобретения R1 выбран из разветвленного C3-4алкила; C2-3алкила, замещенного метокси; и фенила, необязательно замещенного 1 заместителем, выбранным из галогена и метила.
В другом варианте осуществления настоящего изобретения R3 представляет собой водород.
В следующем варианте осуществления R и R’ являются идентичными.
В еще одном варианте осуществления R2 представляет собой C1-4алкилкарбониламино или C1-4алкилоксикарбониламино, и R3 представляет собой водород.
В следующем аспекте настоящее изобретение относится к соединению формулы I или его фармацевтически приемлемой соли, гидрату или сольвату для применения при лечении или профилактике (или производстве лекарственного препарата для лечения или профилактики) инфекции HCV. Типичные генотипы HCV применительно к лечению или профилактике в соответствии с настоящим изобретением включают без ограничения генотип 1b (преобладающий в Европе) и 1a (преобладающий в Северной Америке). Настоящее изобретение также относится к способу лечения или профилактики инфекции HCV, в частности, генотипа 1a или 1b, предусматривающему введение субъекту при необходимости терапевтически эффективное количество соединения, определенного выше.
Чистые стереоизомерные формы соединений и промежуточных соединений, как упомянуто в настоящем документе, определяются как изомеры, по сути не содержащие другие энантиомерные или диастереомерные формы одной и той же основной молекулярной структуры указанных соединений или промежуточных соединений. В частности, термин “стереоизомерно чистый” относится к соединениям или промежуточным соединениям, характеризующимся стереоизомерным избытком по меньшей мере 80% (т.е. минимум 90% одного изомера и максимум 10% других возможных изомеров) и до стереоизомерного избытка 100% (т.е. 100% одного изомера и отсутствие другого), более конкретно, к соединениям или промежуточным соединениям, характеризующимся стереоизомерным избытком от 90% до 100%, еще более конкретно, характеризующимся стереоизомерным избытком от 94% до 100%, и наиболее конкретно, характеризующимся стереоизомерным избытком от 97% до 100%. Термины “энантиомерно чистый” и “диастереомерно чистый” следует понимать подобным образом, но в отношении энантиомерного избытка и диастереомерного избытка, соответственно, представляющей интерес смеси.
Чистые стереоизомерные формы или стереоизомеры соединений и промежуточных соединений в соответствии с настоящим изобретением можно получать посредством применения процедур, известных из уровня техники. Например, энантиомеры можно отделять друг от друга при помощи селективной кристаллизации их диастереомерных солей с оптически активными кислотами или основаниями. Их примерами являются винная кислота, дибензоилвинная кислота, дитолуоилвинная кислота и камфорсульфоновая кислота. В альтернативном случае, энантиомеры можно разделять при помощи хроматографических методик с использованием хиральных неподвижных фаз. Указанные чистые стереохимические изомерные формы также можно получать из соответствующих чистых стереоизомерных форм подходящих исходных материалов, при условии, что реакция протекает стереоспецифично. Предпочтительно, если необходим конкретных стереоизомер, то указанное соединение можно синтезировать стереоспецифическими способами получения. В этих способах преимущественно используют энантиомерно чистые исходные материалы.
Диастереомерные рацематы соединений формулы I можно получать отдельно традиционными способами. Подходящими способами физического разделения, которые можно преимущественно использовать, являются, например, селективная кристаллизация и хроматография, например, колоночная хроматография или сверхкритическая флюидная хроматография.
Соединения формулы I и подгруппы соединений формулы I, определенные выше, имеют несколько центров хиральности. Интерес представляют стереогенные центры пирролидинового кольца на 2-ом атоме углерода. Конфигурация в этом положении может соответствовать L-пролину, т.е.
или соответствовать D-пролину, т.е.
Также представляет интерес конфигурация группы –CR1R2R3, где R3 представляет собой H, если R1 выбран из разветвленного C3-4алкила; C2-3алкила, замещенного метокси, то предпочтительной является S-конфигурация; если R1 выбран из фенила, необязательно замещенного 1 или 2 заместителями, независимо выбранными из галогена и метила, то предпочтительной является R-конфигурация.
Фармацевтически приемлемые аддитивные соли включают в себя терапевтически активные нетоксические кислотно- и основно-аддитивные формы солей соединений формулы (I) или их подгрупп. Представляют интерес свободные, т.е. несолевые, формы соединений формулы I или какой-либо подгруппы соединений формулы I, определенных в настоящем документе.
Фармацевтически приемлемые кислотно-аддитивные соли традиционно можно получать путем обработки основной формы такой соответствующей кислотой. Соответствующие кислоты включают в себя, например, неорганические кислоты, такие как галогенводородные кислоты, например соляная или бромоводородная кислота, серная, азотная, фосфорная и подобные кислоты; или органические кислоты, такие, как, например, уксусная, пропионoвая, гликолевая, молочная, пировиноградная, щавелевая (т.е. этандиовая), малоновая, янтарная (т.е. бутандиовая), малеиновая, фумаровая, яблочная (т.е. гидроксилбутандиовая кислота), винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, салициловая, п-аминосалициловая, памовая и подобные кислоты. И наоборот, указанные солевые формы можно превратить путем обработки соответствующим основанием в свободную основную форму.
Соединения формулы (I), содержащие кислотный протон, также можно превратить в их основно-аддитивные соли, в частности, в металло- или амино-аддитивные солевые формы, путем обработки соответствующими органическими и неорганическими основаниями. Приемлемые основные солевые формы включают в себя, например, аммониевые соли, соли щелочных и щелочно-земельных металлов, например, соли лития, натрия, калия, магния, кальция и т.п., соли органических оснований, например, бензатиновая, N-метил-D-глюкаминовая, гидрабаминовая соли, и соли с аминокислотами, такими как, например, аргинин, лизин и т.п.
Термин "сольваты" охватывает любые фармацевтически приемлемые сольваты, которые могут быть образованы соединениями формулы I, а также их солями. Такими сольватами являются, например, гидраты, алкоголяты, например, этаноляты, пропаноляты и т.п.
Некоторые из соединений формулы I могут также существовать в таутомерной форме. Например, таутомерными формами амидных (-C(=O)-NH-) групп являются иминоспирты (-C(OH)=N-). Таутомерные формы, хотя они явно и не указаны в представленных в настоящем документе формулах, предназначены быть включенными в объем настоящего изобретения.
Как используется в настоящем документе, "C1-4алкил" как группа или часть группы, обозначает насыщенные с прямой или разветвленной цепью углеводородные группы с 1-4 атомами углерода, такие как, например, метил, этил, 1-пропил, 2-пропил, 1-бутил, 2-бутил, 2-метил-1-пропил, 2-метил-2-пропил. Для цели настоящего изобретения из C1-4алкила интерес представляет C3-4алкил, т.е. с прямой или разветвленной цепью углеводородные группы с 3 или 4 атомами углерода, такие как 1-пропил, 2-пропил, 1-бутил, 2-бутил, 2-метил-1-пропил, 2-метил-2-пропил. Особый интерес может представлять разветвленный C3-4алкил, такой как 2-пропил, 2-бутил, 2-метил-1-пропил, 2-метил-2-пропил.
Термин “C3-6циклоалкил”, как группа или ее часть, означает насыщенные циклические углеводородные группы с 3-6 атомами углерода, которые вместе образуют циклическую структуру. Примеры C3-6циклоалкила включают в себя циклопропил, циклобутил, циклопентил и циклогексил.
“C1-4алкокси”, как группа или часть группы, означает группу формулы -O-C1-4алкил, где C1-4алкил определен выше. Примерами C1-4алкокси являются метокси, этокси, н-пропокси, изопропокси.
Термин "галоген" является общим для атомов фтора, хлора, брома и йода.
Используемый в настоящем документе термин “(=O)” или “оксо” образует карбонильный фрагмент при присоединении к атому углерода. Следует отметить, что атом может быть только замещен оксогруппой, если позволяет валентность этого атома.
Используемый в настоящем документе с целью определения “арил”, как группа или ее часть, означает ароматическую кольцевую структуру, необязательно включающую один или два гетероатома, выбранные из N, O и S, в частности, из N и O. Указанная ароматическая кольцевая структура может содержать 5 или 6 кольцевых атомов.
Используемая в настоящем документе приставка “гетеро-” в определении группы означает, что группа содержит по меньшей мере 1 гетероатом, выбранный из N, O и S, в частности, N и O. Например, термин “гетероарил” означает ароматическую кольцевую структуру, определенную для термина “арил”, содержащую по меньшей мере 1 гетероатом, выбранный из N, O и S, в частности, из N и O, например, фуранил, оксазолил, пиридинил. В качестве альтернативы, термин “гетероC3-6циклоалкил” означает насыщенную циклическую углеводородную группу, определенную для “C3-6циклоалкила”, дополнительно содержащую по меньшей мере 1 гетероатом, выбранный из N, O и S, в частности, из N и O, например, тетрагидрофуранил, тетрагидропиранил, пиперидинил.
Если положение группы в молекулярном фрагменте не определено (например, заместитель в фениле) или представлено плавающей связью, такая группа может быть расположена на любом атоме такого фрагмента, при условии, что полученная структура химически стабильна. Если какая-либо переменная представлена более чем один раз в молекуле, каждое определение является.
Во всех случаях использования в настоящем документе термин “соединения формулы I” или “соединения в соответствии с настоящим изобретением” или подобные термины означают соединения формулы I, в том числе возможные стереоизомерные формы, и их фармацевтически приемлемые соли и сольваты.
Общие способы синтеза
Схема 1a
Структурные блоки, используемые в синтезе соединений формулы I, описываются в схеме 1. α-аминокетон IIa (схема 1, A=NH2), с X, являющимся галогеном, в частности, бромом или йодом, соединяют с приемлемым образом защищенным производным III, где PG’ представляет собой защитную группу на азоте, предпочтительно трет-бутоксикарбонил, в присутствие реагента присоединения для ацилирования аминогруппы, предпочтительно HATU, в присутствие основания, такого как DIPEA. Образованное таким образом промежуточное соединение циклизируют с имидазольным соединением общей формулы IV путем обработки ацетатом аммония, предпочтительно при температуре, варьирующей от 0°C до 150°C.
В качестве альтернативы, промежуточное соединение имидазол IV можно получать путем соединения α-галогенкетона IIb, где каждый Х и A независимо представляет атом галогена, Х предпочтительно выбран из йода или брома, а A предпочтительно выбран из хлора, брома или йода, с приемлемым образом защищенным соединением III, где PG' является защитной группой на азоте, предпочтительно трет-бутоксикарбонил, в присутствие приемлемого основания, например, DIPEA, с последующей циклизацией до имидазольного промежуточного соединения IV, как описано выше. Это промежуточное соединение IV может быть трансформировано до боронового сложного эфира формулы V при условиях Pd катализа, например, в присутствие Pd(dppf)Cl2, бис(пинаколато)диборона и основания, например, ацетата калия.
Подобным образом, соединения формулы IVa могут быть превращены в соединения формулы Va, как показано на схеме 1b. IVa можно получать путем удаления защитной группы PG' (например, при использовании HCl в диоксане или TMSOTf/лютидине в CH2Cl2 в случае, если PG’ равняется равняется трет-бутилоксикарбонилу) с последующим соединением полученного в результате амина с кислотой формулы R'(CO)OH при типичных условиях образования амидной связи (например, путем обработки с помощью HATU или HBTU и основания. такого как DIPEA, или при использовании EDCI/HOBt/DIPEA).
Схема 1b
Другие структурные блоки описаны на схемах 2a, 2b, 2c и 3a, 3b, 3c, 3d, 3e.
Схема 2a
На схеме 2a кислотное производное VI превращают в сложный β-кетоэфир VII с помощью способов, известных в литературе, например, путем активации карбоновой кислоты с DCC или CDI, за которой следует, например, реакция с кислотой Мельдрума и последующее декарбоксилирование в присутствии спирта, или, в качестве альтернативы, путем конденсации с магниевой солью моноалкилмалоната с последующим декарбоксилированием. Сложный β-кетоэфир VII (Ralk относится к C1-4алкилу) затем конденсируют с VIII или Х с последующей циклизацией в IXa и IXb соответственно (X’ представляет собой галоген, выбранный из йода или брома, предпочтительно брома). Конденсацию можно осуществлять в толуоле в присутствии уксусной кислоты. Циклизация в соединения формулы IXa и IXb можно осуществлять термически путем нагревания с обратным холодильником в Dowtherm™ A (смесь дифенилоксида и бифенила). Предпочтительным примером защитной группы PG является бензилоксикарбонил (CBz).
Схема 2b
В качестве альтернативы, соединения общей формулы IXc можно получать путем последовательности катализируемых Pd реакций карбонилирования по Соногашире/циклизации, как описано на схеме 2b. Исходя из йоданилинового соединения A.I при процедурах, подобных описанным в Applied Catalysis, A: General 2009, 369, 1-2, 125-132, и ссылок, упомянутых там.
Схема 2c
Соединения общей формулы IXd, в которых R4 равняется H или C1-4алкилу, можно получать, как показано на схеме 2c. Соединение VIII (X’ представляет собой галоген, выбранный из йода или брома, предпочтительно брома) можно превратить в соединение A.IV, например, путем обработки VIII BCl3 в растворителе, таком как бензол, при температуре ниже комнатной температуры, например, при охлаждении на льду, с последующей обработкой AlCl3 и нитрилом A.III (R4 равняется H или C1-4алкилу), например, при нагревании с обратным холодильником в бензоле. После гидролиза можно получить соединение A.IV. Образование амидной связи, исходя из A.IV и VI, приводит в результате к образованию соединения A.V. Эта реакция может быть осуществлена путем превращения соединения VI в галогенангидрид кислоты, например, фторангидрид кислоты или хлорангидрид кислоты, с последующей реакцией с A.IV в присутствии основания. Другим примером является образование A.V из VI и A.IV путем применения реагента присоединения 4-(4, 6-диметокси[1.3.5]триазин-2-ил)-4-метилморфолиния хлорида или соли BF4 (DMTMM). Циклизация A.V при основных условиях, например, KOH в EtOH, или NaOH в диоксане, дает в результате соединение IXd.
Схема 3a
На схеме 3a описан синтез соединений формулы XIII. Образование амидной связи, исходя из XI (X' представляет собой галоген, выбранный из йода или брома, предпочтительно брома) и VI, приводит к образованию соединения XII. Эта реакция может быть осуществлена путем превращения соединения VI в галогенангидрид кислоты, например, фторангидрид кислоты или хлорангидрид кислоты, с последующей реакцией с XI в присутствии основания. Другим примером является образование XII из VI и XI путем применения реагента присоединения 4-(4, 6-диметокси[1.3.5]триазин-2-ил)-4-метилморфолиния хлорида (DMTMM). Затем соединения XII превращают в соединения общей формулы XIII при основных условиях, например, KOH или Na2CO3 в этаноле.
Схема 3b
Соединение общей формулы A.XI (X' представляет собой галоген, выбранный из йода или брома, предпочтительно брома) можно получать, как показано на схеме 3b. С использованием способов, описанных в литературе (WO 2007039578; Tet. Lett. 2001, 42, 33, 5601-5603), фторид A.VI можно превратить в A.IX. Последнее соединение соединяют с галогенангидридом кислоты A.X (где X'' равняется хлор или фтор) в присутствии основания, например триэтиламина, с последующей циклизацией в соединение A.XI при основных условиях, таких как, например, 2N водный K2CO3 при нагревании с обратным холодильником.
Схема 3c
Соединение общей формулы A.XVI можно получать, как показано на схеме 3c. Диалкилирование сложного эфира A.XII соответствующим алкилгалогенидом, например, MeI в случае, если R5=R6=метил, в присутствии основания, например NaH, дает в результате соединение A.XIII. Этот сложный эфир можно превратить в соединение A.XIV путем последующего гидролиза, образования ацилазида (например, при обработке соответствующей кислоты A.XIII дифенилфосфорилазидом) и реакции Курциуса. После восстановления соединения A.XIV до A.XV, последнее соединение превращают в соединение A.XVI путем соединения с кислотой VI, например, при обработке HATU и основанием, таким как триэтиламин, и последующей циклизации в соединение A.XVI при кислотных условиях, например, в уксусной кислоте при 50°C.
Схема 3d
Альтернативная процедура синтеза соединения A.XIV (например, в случае, если R5 и R6 вместе с атомом углерода, который соединяет их, образуют оксетан) изображен на схеме 3d. Анион, образованный в реакции переметаллирования, например бутиллитий, и соединение A.XVII при низкой температуре, например -78°C, можно подвергнуть реагированию с сульфинамидом A.XVIII. После снятия защиты с образованного сульфинамида при кислотных условиях получают соединение A.XIV, которое далее можно превратить в A.XVI, как описано на схеме 3c.
Схема 4
Структурные блоки A.XIX, полученные с помощью способов, подобных описанным на схеме 2
(a, b, c) и схеме 3 (a, b, c и d), и V (схема 1) можно превратить в структуру XIV с использованием условий Сузуки-Мияуры (схема 4). Подобную реакцию Сузуки-Мияуры можно осуществлять, если V заменен на Va и/или A.XIX - на A.XIXa, что дает в результат соединения с общей формулой XXI, XXIII или I. A.XIXa можно получать из A.XIX путем избирательного удаления защитной группы PG (например, при использовании HCl в диоксане, TMSOTf/лютидина в CH2Cl2 или TFA в CH2Cl2 в случае, если PG равняется трет-бутилоксикарбонилу, или HBr в HOAc/H2O в случае, если PG равняется бензилоксикарбонилу) с последующим соединением полученного в результате амина с кислотой формулы R(CO)OH при типичных условиях образования амидной связи (например, путем обработки с помощью HATU или HBTU и основания. такого как DIPEA, или при использовании EDCI/HOBt/DIPEA) (схема 3e).
Схема 3e
Схема 5
Если PG' и PG на схемах 1-4 представляет R'(C=O)- и R(C=O)-, соответственно, соединения общей структуры XIV попадают под определение соединений формулы I. В таком случае на схеме 4 описан синтез соединений формулы I. В качестве альтернативы, с XIV может быть снята защита, как описано на схеме 5. Например, путем обработки кислотой (например, HCl в iPrOH), если PG или PG’ представляют трет-бутилоксикарбонил (Boc). Соединение XX может быть превращено в соединение формулы Ie, где R и R' являются идентичными, путем классического образования амида между кислотой R-(C=O)OH и бисамином XX, как описано на схеме 6. Предпочтительными способами являются применение HATU в присутствие основания, такого как DIPEA, или HOBt в присутствии EDCI и NEt3.
Схема 6
Если PG' отличается от PG, возможно селективное снятие защитной группы, описанное на схеме 5, что дает соединения XVIII или XIX, исходя из XIV. Например, в случае, если PG’ равняется трет-бутилоксикарбонилу (Boc), а PG равняется бензилоксикарбонилу (Cbz), селективное снятие защитной группы может быть осуществлено путем удаления Boc-защитной группы в кислотных условиях, таких как HCl в iPrOH при комнатной температуре, или путем удаления CBz-защитной группы в восстановительных условиях, например, водород в присутствие катализатора, например, Pd(OH)2.
Если PG' представляет R'(C=O)-, или PG представляет R(C=O)-, синтез соединений XIV, описанных на схемах 1-4, дает соединения формулы XXI (схема 7) или XXIII (схема 8), соответственно. Соединения XXI и XXIII можно получать из соединения XIX и R’(C=O)OH или XVIII и R(C=O)OH, соответственно, при типичных условиях образования амида. Затем эти соединения могут быть превращены в соединения формулы I. Селективное снятие защитной группы XXI с получением XXII с последующим образованием амидной связи между XXII и R(C=O)-OH дает соединения формулы I. Затем аналогичная последовательность реакций может быть применена для превращения XXIII в XXIV, а затем соединения формулы I.
Схема 7
Схема 8
В следующем аспекте настоящее изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I, определенного в настоящем документе, и фармацевтически приемлемый носитель. Терапевтически эффективным количеством в этом контексте является количество, достаточное для стабилизации или снижения инфекции HCV у инфицированных субъектов, или количество, достаточное для предупреждения инфекции HCV у субъектов с риском инфицирования. В следующем аспекте настоящее изобретение относится к способу получения фармацевтической композиции, определенной в настоящем документе, которая предусматривает тщательное смешивание фармацевтически приемлемого носителя с терапевтически эффективным количеством соединения формулы I, определенного в настоящем документе.
Таким образом, соединения в соответствии с настоящим изобретением или любая их подгруппа могут быть составлены в различные фармацевтические формы для целей введения. В качестве подходящих композиций могут приводиться все композиции, обычно используемые для систематического введения лекарственных средств. Для получения фармацевтических композиций в соответствии с настоящим изобретением эффективное количество конкретного соединения, необязательно в форме аддитивной соли или комплекса с металлом, в качестве активного ингредиента объединяют в однородную смесь с фармацевтически приемлемым носителем, при этом носитель может принимать широкое разнообразие форм в зависимости от формы препарата, необходимой для введения. Данные фармацевтические композиции являются желательными в единичной лекарственной форме, приемлемой, в частности, для введения перорально, ректально, чрескожно или путем парентеральной инъекции. Например, при получении композиций в виде пероральной лекарственной формы можно использовать любую общепринятую фармацевтическую среду, такую как, например, вода, гликоли, масла, спирты и т.п., в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры и растворы; или твердые носители, такие как крахмалы, сахара, каолин, смазывающие вещества, связующие вещества, средства для улучшения распадаемости и т.п., в случае порошков, пилюль, капсул и таблеток. Благодаря своей простоте введения таблетки и капсулы представляют собой наиболее предпочтительные пероральные формы единицы дозирования, в случае которых очевидно используются твердые фармацевтические носители. Для парентеральных композиций носитель будет, как правило, по меньшей мере в значительной степени включать стерильную воду, хотя может включать и другие ингредиенты, например, для улучшения растворимости. Например, могут быть получены растворы для инъекций, в которых носитель включает физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Также могут быть получены суспензии для инъекций, в случае которых могут использоваться подходящие жидкие носители, суспендирующие средства и т.п. Также включены препараты в твердой форме, которые предназначены для преобразования, непосредственно перед применением, в препараты в жидкой форме. В композициях, подходящих для чрескожного введения, носитель необязательно включает средство усиления проникновения и/или подходящее смачивающее средство, необязательно комбинированное с подходящими добавками любой природы в минимальных пропорциях, при этом добавки не оказывают никакого значительного вредного воздействия на кожу. Соединения в соответствии с настоящим изобретением также могут быть введены путем пероральной ингаляции или инсуффляции в форме раствора, суспензии или сухого порошка с использованием любой известной в уровне техники системы доставки.
Особенно предпочтительно составление вышеуказанных фармацевтических композиций в единичной лекарственной форме для простоты введения и равномерности дозирования. Единичная лекарственная форма, применяемая по данному документу, относится к физически отдельным единицам, подходящим в качестве единичных дозировок, при этом каждая единица содержит предварительно установленное количество активного ингредиента, рассчитанное для получения желаемого терапевтического эффекта в сочетании с необходимым фармацевтическим носителем. Примерами таких единичных лекарственных форм являются таблетки (включая делимые таблетки или покрытые таблетки), капсулы, пилюли, суппозитории, пакетики с порошком, пластинки, растворы для инъекций или суспензии и т.п., а также их отдельные множества.
Соединения формулы I показывают активность против HCV и могут быть использованы в лечение и профилактике инфекции HCV или заболеваний, ассоциированных с HCV. Последние включают в себя прогрессирующий фиброз печени, воспаление и некроз, ведущие к циррозу, конечной стадии болезни печени, и печеночноклеточной карциноме. Ряд соединений в соответствии с настоящим изобретением, более того, известен как активный против мутантных штаммов HCV. Кроме того, соединения