Способ и средство для лечения реактивного артрита хламидийной этиологии
Иллюстрации
Показать всеГруппа изобретений относится к области медицины и фармацевтики и может быть использована для лечения реактивного артрита хламидийной этиологии. Способ по изобретению включает внутрисуставное введение средства, содержащего фармацевтически приемлемую соль нафамостата, (2-гидроксипропил)-β-циклодекстрин и хондроитин сульфат. Средство по изобретению содержит нафамостата димезилат, циклодекстрин, повышающий растворимость нафамостата, а также хондропротекторный компонент - хондроитин сульфат. Использование изобретения позволяет достигнуть полной элиминации патогена из зараженного сустава при снижении суммарной дозы нафамостата и кратности инъекций. 2н. и 9 з.п. ф-лы, 6 табл., 3 ил. 8 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к области медицины и фармацевтики и конкретно касается способа и средства для лечения реактивного артрита хламидийной этиологии.
Уровень техники
Chlamydia trachomatis является наиболее распространенной бактерией-возбудителем заболеваний, передающихся половым путем. По данным ВОЗ, C. trachomatis в 2008 году было заражено более 105,7 млн. человек. В России, по данным Центрального НИИ организации и информатизации здравоохранения, заболеваемость урогенитальной хламидийной инфекцией за 2010 год составила 100770 человек. Реактивный артрит развивается после перенесенной урогенитальной, кишечной или респираторной инфекции и характеризуется воспалительным поражением суставов на фоне аутоиммунных нарушений. Хотя реактивный артрит может быть вызван различными возбудителями, до 80% реактивных артритов имеют хламидийную природу. Реактивный артрит влечет за собой временную потерю трудоспособности и, кроме того, у 20-50% больных перетекает в хронический артрит, в 15% случаев приводящий к тяжелому нарушению функций суставов. Основной ущерб государственным интересам наносится в результате длительных сроков временной нетрудоспособности при реактивном артрите - в среднем, 3-5 мес. При оценке количества пациентов, страдающих реактивным артритом и нуждающихся в лечении, в 60000 человек, потери государства в связи с их временной нетрудоспособностью составляют около 1,8 млрд. руб. в год.
Принципиальным отличием хламидийных артритов от артритов иной бактериальной этиологии является наличие в пораженных тканях сустава живого возбудителя, поддерживающего хроническое воспаление. В связи с этим, схемы лечения, используемые в России и за рубежом, предусматривают 1-3-х месячные курсы антибиотикотерапии, а при отсутствии положительного эффекта предполагается продолжение лечения с помощью других антибиотиков. Недостатками схем лечения, основанных на антибиотикотерапии, является относительная токсичность антибиотиков, что в сочетании с длительностью приема может приводить к возникновению побочных эффектов и несовместимо со здоровым образом жизни. В частности, неспецифичность антибиотиков приводит к подавлению нормальной микрофлоры с возможностью развития дисбактериозов. Кроме того, антибиотикотерапия может приводить к хронизации хламидийной инфекции, которая при этом становится устойчивой к действию любых антибиотиков за счет перехода возбудителя в так называемую персистирующую форму.
Поскольку при хламидийном артрите патоген локализуется в тканях пораженного сустава, наиболее эффективным способом доставки представляется ее введение непосредственно в полость сустава. В настоящий момент внутрисуставный способ введения лекарственных препаратов широко применяется при заболеваниях суставов. Таким способом вводятся кортикостероидные противовоспалительные гормоны, а также препараты хондропротекторного соединения - гиалуроновой кислоты. Однако, в уровне техники не известны антихламидийные препараты, для которых бы использовался внутрисуставный способ введения.
Таким образом, по-прежнему существует необходимость в создании средств для лечения реактивных артритов, хламидийной этиологии, которые были бы лишены указанных недостатков.
По нашему мнению таким средством являются препараты на основе фармацевтически приемлемой соли нафамостата, например, такой как нафамостата димезилат.
Нафамостат существует в виде двух фармацевтически приемлемых солей дигидрохлорида и димезилата.
Наиболее часто используемый нафамостата димезилат (6-[амино(имино)метил]-2-нафтил-4-{[амино(имино)метил]-амино}бензоата димезилат) является ингибитором сериновых протеаз широкого спектра действия (Aoyama Т. et al. Japan. J. Pharmacol., 1984, 35, 203-227). В настоящее время нафамостата димезилат применяется как альтернативный антикоагулянт при гемодиализе пациентов с плохой свертываемостью крови, при рассеянной внутрисосудистой коагулопатии, а также как противовоспалительный агент при остром панкреатите в некоторых странах Восточной Азии. На текущий момент показана его способность подавлять все основные каскадные системы крови (системы комплемента, коагуляции и фибринолиза, а также кинин-брадикининовую систему), синтез некоторых цитокинов (Aoyama Т. et al. Japan. J. Pharmacol., 1984, 35, 203-227; Iwaki M. et al. Nihon Yakurigaku Zasshi, 1984, 84(4), 373-384; Fujiwara Y. J. Hepatobiliary Pancreat. Sci., 2011, 18, 731-739), а также активность триптазы - главной сериновой протеазы тучных клеток (Sendo Т. et al. Br. J. Pharmacol., 2003, 138, 959-967). Антибактериальная активность нафамостата описана в нескольких патентных документах и научных публикациях. Объектом заявки WO 2008142397 является применение нафамостата димезилата в качестве средства для лечения бактериальных инфекций, главным образом кожных. В описании изобретения упоминается способность нафамостата димезилата подавлять рост Staphylococcus aureus, Propionibacterium acnes и Escherichia coli, а также его противовоспалительное действие: ингибирование синтеза IL-8 кератиноцитами, активированными S. aureus, и активности калликреинов кожи 5, 7, 8 и 14. Патентный документ JP 2009078996 касается применения нафамостата димезилата в качестве средства для лечения инфекций, вызванных бактериями рода Pseudomonas со множественной лекарственной устойчивостью. В Российской Федерации патентов на применение нафамостата в качестве антибактериального средства не существует.
Наиболее близким, по нашему мнению, аналогом является способ и средство для лечения хламидийной инфекции на основе нафамостата мезилата (Inman R.D. and Chiu В., Arthritis Research & Therapy 2012, 14:R150). В экспериментах in vitro авторами работы была показана способность нафамостата димезилата подавлять развитие C. trachomatis внутри эукариотических клеток в концентрации 25 мкг/мл. Для того, чтобы показать эффективность нафамостата димезилата in vivo, авторы использовали модель хламидийного артрита у крыс. Артрит индуцировался с помощью инъекции в коленный сустав крыс синовиальных фибробластов, предварительно инфицированных хламидиями. Лечение начиналось за день до заражения и заключалось в ежедневном внутрибрюшинном введении нафамостата димезилата (10 мг/кг) в течение всего эксперимента (до 4-го дня после заражения включительно). У крыс, получавших нафамостат, воспалительная реакция в инфицированных суставах была менее выражена, что проявлялось в уменьшении отека, снижении количества лейкоцитов в суставе и степени повреждения тканей сустава. Хотя авторы не проводили всестороннего исследования инфекционного процесса, наличия жизнеспособных хламидий или хламидийной ДНК, иммуноферментный анализ показал уменьшение количества хламидийных антигенов в суставах леченых крыс по сравнению с суставами контрольных животных на 4-й день после заражения. Полной элиминации патогена, однако, добиться не удалось. По-видимому, полная элиминация патогена не может быть достигнута при внутрибрюшинном или ином системном способе введения, поскольку нафамостат быстро расщепляется в крови на 6-амидино-2-нафтол и 4-гуанидино-бензойную кислоту (t1/2 гидролиза после внутривенного введения крысам составляет около двух минут).
Таким образом, для успешного применения нафамостата при хламидийном артрите необходима разработка других форм, а также схем и доз введения, способствующих полной элиминации патогена в тканях сустава, в том числе за счет его внутрисуставного введения.
Раскрытие изобретения
Нами предлагается способ лечения реактивного артрита хламидийной этиологии, включающий внутрисуставное введении средства, содержащего фармацевтически приемлемую соль нафамостата, (2-гидроксипропил)-β-циклодекстрин и хондроитин сульфат в терапевтически эффективном количестве.
Также предлагается средство для лечения реактивного артрита хламидийной этиологии, содержащее фармацевтически приемлемую соль нафамостата, (2-гидроксипропил)-β-циклодекстрин и хондроитин сульфат в эффективном количестве.
Средство может быть выполнено в виде раствора для внутрисуставного введения.
В качестве фармацевтически приемлемого растворителя может быть использован физиологический раствор.
В качестве фармацевтически приемлемой соли нафамостата используют, например, нафамостата димезилат.
Раскрываемое в заявке средство, например, состоит из: нафамостата димезилата, (2-гидроксипропил)-β-циклодекстрина и хондроитин сульфата в физиологическом растворе.
Предпочтительные соотношения в масс. ч. нафамостата димезилата, (2-гидроксипропил)-β-циклодекстрина и хондроитин сульфата в средстве составляют: (0,5-1)-(4-6)-(0,5-1).
Наиболее предпочтительное соотношение в масс. ч. (1-5-1), т.е. нафамостата димезилат берется в концентрации 50 мг/мл, (2-гидроксипропил)-β-циклодекстрин в концентрации 250 мг/мл, хондроитин сульфат в концентрации 50 мг/мл.
В частном случае применения изобретения средство вводится в дозе и кратности введения, достаточных для полной элиминации хламидий из тканей сустава, включая и персистирующие, неактивные формы хламидий. Предпочтительным является внутрисуставное введение 2-3 мл заявляемого средства дважды с интервалом в три дня, что должно обеспечивать полную элиминацию хламидий из коленных суставов при следующем содержании компонентов: нафамостата димезилат берется в концентрации 50 мг/мл физиологического раствора, (2-гидроксипропил)-β-циклодекстрин в концентрации 250 мг/мл физиологического раствора, хондроитин сульфат в концентрации 50 мг/мл физиологического раствора.
Технический результат изобретения выражается в достижении полной элиминации патогена из зараженного сустава, таким образом, делая невозможным рецидив заболевания, а также снижении суммарной дозы нафамостата димезилата и кратности инъекций.
Дополнительно хотелось бы отметить, что выбор трех активных компонентов является результатом экспериментальной работы и опирается на следующие теоретические предпосылки.
В качестве хондропротекторного соединения был выбран один из полимеров, входящих в состав синовиальной жидкости, а именно хондроитин сульфат. Хондроитин сульфат является сополимером N-ацетилгалактозамина и D-глюкуроновой кислоты, сульфатированных по разным позициям. Хондроитин сульфат является компонентом многих средств для терапии заболеваний суставов, применяемых перорально (Arthrosin, Cartigen, Cartilex, Jointec, Rejoin и др.), также существуют исследования, описывающие положительный эффект и безопасность внутрисуставного введения хондроитин сульфата (Frisbie D.D. et al., Vet. J. 2013, 197, 824-829; Henrotin Y. et al. BMC Res. Notes 2012, 5, 407; Hui J.H. et al. J. Mol. Histol. 2007, 38, 483-489).
(2-гидроксипропил)-β-циклодекстрин - циклический олигосахарид, часто используемый для повышения растворимости низкомолекулярных химических соединений, в том числе применяемых в качестве лекарственных средств. Циклодекстрины образуют трехмерные структуры, напоминающие по форме полый внутри усеченный конус, причем внешняя поверхность конуса оказывается гидрофильной, а внутренняя - гидрофобной. Низкомолекулярные соединения, обладающие плохой растворимостью в воде, образуют комплексы с циклодекстринами, заполняя их гидрофобные полости, за счет чего и повышается растворимость этих соединений (Katageri A. and Sheikh М. International Research Journal of Pharmacy, 2012, 3(1), 52-56). Различные циклодекстрины входят в состав таких лекарственных средств, как Cicladol и Brexin (противовоспалительные), Nitropen (сосудорасширяющее), PansporinT (антибиотик), Sporanox (противогрибковый препарат), Zeldox (антипсихотик), Omebeta (ингибитор протоновой помпы) и др.
Осуществление изобретения
Изобретение иллюстрируется следующими частными примерами.
Пример 1. Получение нафамостата димезилата (6-[амино(имино)метил]-2-нафтил 4-{[амино(имино)метил]-амино}бензоата димезилата) (Схема синтеза отражена на фиг. 1)
Синтез 6-циано-2-нафтола (соединение 2 в соответствии с фиг. 1). Смесь 22,3 г (10 ммоль) 6-бром-2-нафтола (соединение 1 в соответствии с фиг. 1) и 10,8 г (12 ммоль) цианистой меди в 25 мл диметилформамида нагревали в течение 3 часов при температуре 160-170°С в инертной атмосфере. После охлаждения реакционной смеси ее обрабатывали 10% раствором гидроксида натрия и отфильтровывали выпавший осадок. Фильтрат подкисляли 10% соляной кислотой и фильтровали выпавший осадок. После перекристаллизации из смеси этанол-вода получали светло-коричневый порошок с Тпл.=164-166°С.
Синтез 6-амидино-2-нафтол мезилата (соединение 4 на фиг. 1). 6-циано-2-нафтол (соединение 2 в соответствии с рисунком 37) 8,5 г, (50 ммоль) добавляли к 50 мл охлажденного насыщенного метанольного раствора хлороводорода. Затем смесь перемешивали в течение ночи, после чего концентрировали. Остаток растворяли в 50 мл метанола. Газообразный аммиак барботировали через раствор при 50°С в течение 3 часов. Смесь концентрировали в вакууме, после чего при перемешивании добавляли концентрированный раствор гидрокарбоната натрия. Осадок фильтровали и промывали водой и ацетоном. К суспензии в 10 мл метанола добавляли 5,8 г метансульфокислоты. К раствору добавляли диэтиловый эфир. Выпавший осадок 9,2 г 6-амидино-2-нафтол мезилата (соединение 4 в соответствии с фиг. 1) отфильтровывали. Выход составил 65%. Перекристаллизация из этанола приводила к получению светло-желтых кристаллов 6-амидино-2-нафтол мезилата (соединение 4 в соответствии с фиг. 1) с Тпл.=227-228°С. 1Н ЯМР (DMSO-d6) δ: 2,51 (3Н, с, CH3SO3), 7,05-8,58 (6Н, м, Ar), 8,87-9,56 (4Н, уш. NH), 10,39 (1Н, с, ОН).
Синтез гидрохлорида 4-гуанидино-бензойной кислоты (соединение 6 в соответствии с фиг. 1). К раствору 54 г (0,49 моль) 4-аминобензойной кислоты в 500 мл воды и 70 мл концентрированной соляной кислоты добавляли 38,4 г (0,91 моль) цианамида. Смесь перемешивали при температуре 90-95°С в течение 1 часа и затем выдерживали при комнатной температуре в течение ночи. Осадок промывали этилацетатом. В результате получали 38 г гидрохлорида 4-гуанидино-бензойной кислоты (соединение 6 на фиг. 1) с Тпл.=270°С (с разд.).
Синтез 6-[амино(имино)метил]-2-нафтил 4-{[амино(имино)метил]-амино}бензоата димезилата (нафамостата димезилат, соединение 7 в соответствии с фиг. 1). Смесь 2,2 г (10 ммоль) гидрохлорида 4-гуанидино бензойной кислоты, 2,8 г (10 ммоль) 6-амидино-2-нафтол мезилата (4), 2,3 г (12 ммоль) дициклогексилкарбодиимида в 40 мл сухого пиридина перемешивали в течение ночи при комнатной температуре. Осадок отфильтровывали и смешивали с 40 мл воды. Полученную суспензию отфильтровывали и к фильтрату добавляли раствор 3,8 г гидрокарбоната натрия в 40 мл воды. Осадок отфильтровывали, промывали ацетоном и к нему добавляли раствор хлористого водорода в диметилформамиде (0,8 г в 20 мл). Смесь перемешивали в течение ночи, и выпавший осадок отфильтровывали. Перекристаллизация из смеси ацетон-вода приводила к получению 6-[амино(имино)метил]-2-нафтил 4-{[амино(имино)метил]-амино}бензоата дигидрохлорида в виде бесцветного порошка с Тпл.=275°С (с разл.). Полученные кристаллы смешивали с метансульфокислотой при pH=4,4 и смесь перемешивали в течение ночи. Выпавший осадок отфильтровывали и перекристаллизовывали из смеси ацетон-вода. В результате получали 6-[амино(имино)метил]-2-нафтил 4-{[амино(имино)метил]-амино}бензоата димезилата (нафамостата димезилат, соединение 7 на фиг. 1) в виде белых кристаллов с Тпл.=260°С (с разд.). 1Н ЯМР (DMSO-d6) δ: 2,42 (6Н, с, CH3SO3), 7,66-8,23 (14 Н, м, Ar и NH2), 9,19-9,48 (4Н, уш. NH), 10,24 (1Н, с, NH).
Пример 2. Токсичность нафамостата димезилата в отношении культур эукариотических клеток
Поскольку хламидии являются облигатными внутриклеточными паразитами, оценку эффективности антихламидийных препаратов проводят на культурах эукариотических клеток, зараженных хламидиями. Однако исследуемое соединение может влиять не только на хламидийную инфекцию, но и непосредственно на эукариотические клетки. В случае, если исследуемое соединение токсично для культуры клеток эукариот, гибель эукариотических клеток вызовет также и гибель существующих внутри них хламидий, что может быть принято за антихламидийную активность исследуемого вещества.
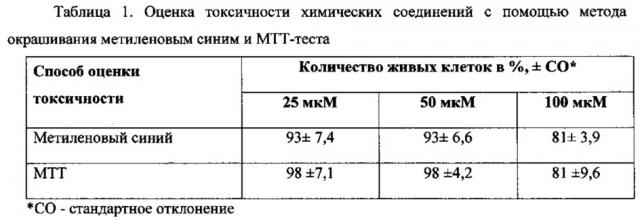
Токсичность нафамостата димезилата в отношении эукариотических клеток определялась с помощью метода окрашивания метиленовым синим и с помощью МТТ-теста.
Метод оценки токсичности с помощью метиленового синего основан на определении количества клеток в монослое посредством измерения количества связавшегося красителя. При этом следует принимать во внимание тот факт, что показатели цитотоксичности, полученные методом окрашивания метиленовым синим, зависят также от темпов пролиферации культивируемых клеток, и полученные результаты необходимо рассматривать с точки зрения влияния исследуемых соединений именно на пролиферативную активность эукариотических клеток.
Оценка токсичности методом окрашивания метиленовым синим проводилась следующим образом. В суточном монослое клеток линии McCoy (гибридная линия синовиальных клеток человека и мышиных фибробластов) в 96-луночном культуральном планшете заменяли среду культивирования (среда DMEM с 10% фетальной бычьей сыворотки, 5 мкг/мл амфотерицина, 4 мкг/мл гентамицина) на свежую среду и вносили разные дозы исследуемого химического соединения (нафамостата димезилата). Клетки инкубировали в течение 24 часов в CO2 инкубаторе при 37°С. Затем из лунок отбирали среду и отмывали клетки 0,1 мМ фосфатно-солевым буферным раствором (ФСБР). Клетки фиксировали охлажденным метанолом (20 мкл) в течение 15 мин при 4°С. К фиксированным клеткам добавляли 40 мкл 0,5% метиленового синего и инкубировали в течение 20 мин при комнатной температуре. После инкубации метиленовый синий отбирали из лунок и отмывали клетки 4 раза ФСБР. В лунки добавляли 100 мкл 0.5% додецилсульфата натрия (SDS) в ФСБР и инкубировали в течение 1 часа при комнатной температуре до полного лизиса клеток. С помощью спектрофотометра определяли оптическую плотность при длине волны 620 нм.
МТТ-тест направлен на определение количества живых клеток за счет детектирования их метаболической активности и основан на восстановлении бесцветной соли тетразолия (3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолия бромид, (МТТ)) митохондриальными и цитоплазматическими дегидрогеназами живых метаболически активных клеток с образованием формазана, количество которого измеряется спектрометрически.
В суточном монослое клеток McCoy в 96-луночном культуральном планшете заменяли среду культивирования на свежую среду и вносили разные дозы исследуемого химического соединения (нафамостата димезилата). Клетки инкубировали в течение 20 часов в CO2 инкубаторе при 37°С, вносили 1:10 от объема культуральной среды 10-кратного раствора МТТ (5 мг/мл), после чего инкубировали в течение еще 4 часов при 37°С в атмосфере 5% CO2. После этого культуральную среду отбирали, клетки отмывали однократно ФСБР, в каждую лунку добавляли по 100 мкл изопропанола и инкубировали при комнатной температуре в течение 30 минут. Количество превращенного субстрата оценивали с помощью измерения оптической плотности при длине волны 540 нм.
Метод окрашивания метиленовым синим показал низкую токсичность нафамостата димезилата в отношении клеток линии McCoy. Нафамостата димезилат в концентрации 25 и 50 мкМ снижает количество клеток на 7% по сравнению с контролем, в концентрации 100 мкМ - на 19%.
МТТ-тест показал результаты, в целом аналогичные методу окрашивания метиленовым синим. Нафамостата димезилат в концентрации 50 мкМ и ниже практически не вызывает гибели эукариотических клеток, при этом концентрация 100 мкМ приводит к гибели 19% клеток. Результаты обоих тестов суммированы в таблице 1. Таким образом, концентрации нафамостата димезилата 50 мкМ и ниже безопасны для клеток эукариот.
Пример 3. Подавление хламидийной инфекции нафамостата димезилатом in vitro
Оценка способности нафамостата димезилата подавлять жизнеспособность хламидий in vitro проводилась следующим образом. Работу проводили на клеточных линиях McCoy, инфицированных штаммом C. trachomatis Bu-434 серовар L2 (АТСС VR 902В) в формате 24-луночных планшетов с круглыми покровными стеклами диаметром 12 мм. Суточный монослой заражали хламидиями с МОИ 1 и одновременно добавляли разные дозы нафамостата димезилата. Планшет центрифугировали при 3000 об/мин 60 мин при 25°С и инкубировали клетки в течение 48 ч в СО2-инкубаторе при 37°С. Через 48 ч из лунок отбирали надосадочную жидкость и извлекали стекла с выросшим и инфицированным монослоем. Затем стекла промывали 0,1 мМ ФСБР и высушивали. После этого клетки фиксировали холодным (+4°С) ацетоном в течение 15 мин при комнатной температуре. На фиксированные клетки наносили 50 мкл моноклональных антител к видоспецифическому белковому антигену C. trachomatis, меченных флуоресцеин изотиоцианатом (ФИТЦ), «Pathfinder C. trachomatis Direct Specimen System» («Bio-Rad», США) и инкубировали в течение 30 мин во влажной камере при 37°С. После инкубации клетки промывали 2 раза ФСБР и препарат полностью высушивали. Готовые препараты исследовали в люминесцентном микроскопе, подсчитывая процент инфицированных клеток в 30 независимых полях зрения. Оценку влияния нафамостата димезилата на развитие внутриклеточного жизненного цикла хламидий проводили в сравнении с контролем по количеству и морфологии хламидийных включений.
Нафамостата димезилат в концентрации 25 мкМ подавляет развитие хламидийной инфекции на 79,0±2,4% (по количеству хламидийных включений), при этом большая часть хламидийных включений была представлена мелкими или разрушенными. В концентрации 50 мкМ нафамостата димезилат подавляет инфекцию на 88,0±1,0%, при этом включения мелкие и атипичные по морфологии (с нарушенной мембраной, плохо окрашивающиеся из-за малого количества бактерий внутри включений); в концентрации 100 мкМ наблюдается подавление на 93±1,7%, выявляются единичные мелкие и разрушенные включения (фиг. 2).
Пример 4. Выявление хламидий в суставе инфицированных животных
Выявление C. trachomatis в соскобном материале из полости суставов инфицированных животных осуществляли с помощью диагностической тест-системы «Pathfinder C. trachomatis Direct Specimen System» («Bio-Rad», США). После забора исследуемый материал наносили вращательными движениями на поверхность 8 мм лунки чистого обезжиренного предметного стекла так, чтобы все стороны «щеточки» соприкасались с поверхностью стекла. Соскоб высушивали на воздухе 20-30 мин, после чего фиксировали в течение 15 мин холодным (+4°С) ацетоном. Для окраски препарата наносили 40 мкл раствора моноклональных антител к видоспецифическому белковому антигену C. trachomatis, меченных флуоресцеин изотиоцианатом (ФИТЦ), полностью покрывая 8-миллиметровую лунку предметного стекла. Соскоб помещали во влажную камеру (+37°С) на 30 мин, не допуская подсыхания нанесенного раствора антител. Затем соскоб промывали 2 раза по 5 мин ФСБР при постоянном перемешивании со сменой буфера. После отмывки препарат полностью высушивали на воздухе при комнатной температуре. На высушенный препарат наносили каплю монтирующей жидкости (9 частей глицерина и одна часть ФСБР), после чего лунку покрывали обезжиренным покровным стеклом. Препараты исследовали в люминесцентном микроскопе сразу после окраски. Хламидии выявляются либо в виде характерных цитоплазматических включений (редко), окрашенных в изумрудно-зеленый цвет, либо внеклеточно - в виде отдельных ярко-зеленых элементарных и ретикулярных телец. Элементарное тельце под люминесцентным микроскопом выглядит как булавочный прокол ярко-зеленого цвета, ретикулярное тельце - ярко-зеленое пятно в 2-4 раза крупнее (фиг. 3).
Пример 5. Количественное определение жизнеспособных хламидий в зараженном суставе
Количественное определение жизнеспособных хламидий заключается в подсчете количества ВОЕ (включение-образующих единиц) в зараженном суставе. Для культурального выделения возбудителя из синовиальной полости одноразовыми щетками отбирали соскоб, щетки помещали во флаконы с 1 мл транспортной среды (среда ДМЕМ с добавлением 5% фетальной сыворотки крупного рогатого скота, 25 мМ глюкозы, 5 мкг/мл амфотерицина, 4 мкг/мл гентамицина) и хранили при -70°С. Материал, исследуемый на наличие хламидий, перед заражением культуры клеток оттаивали и тщательно пипетировали. Заражение проводили в 24-луночных планшетах на круглых стеклах диаметром 12 мм с 24-часовым монослоем клеток McCoy. В каждую лунку вносили по 0,5 мл исследуемого материала, планшеты центрифугировали (3000 об./мин, 60 мин, 25°С), инкубировали в течение 2 ч в термостате с 5% СО2, удаляли инокулят, дважды промывали средой ДМЕМ, после чего в лунки добавляли транспортную среду с циклогексимидом (1 мкг/мл) и инкубировали при 37°С в течение 48 ч. Далее из лунок отбирали надосадок и извлекали стекла с монослоем, промывали 0,1 мМ ФСБР, высушивали и фиксировали холодным (+4°С) ацетоном в течение 15 мин при комнатной температуре. На фиксированные клетки наносили 50 мкл моноклональных антител к видоспецифическому белковому антигену C. trachomatis, меченных ФИТЦ («Pathfinder C. trachomatis Direct Specimen System», «Bio-Rad», США), и инкубировали в течение 30 мин во влажной камере при 37°С. После инкубации клетки промывали 2 раза ФСБР и полностью высушивали. Готовые препараты исследовали в люминесцентном микроскопе, подсчитывая процент инфицированных клеток в 30 независимых полях зрения и определяя среднее значение. Такой метод является общепринятым и позволяет полуколичественно определять число инфекционных частиц в исследуемом образце.
Пример 6. Определение наличия ДНК хламидий в зараженных суставах
Для количественного определения ДНК хламидий в инфицированном суставе из 100 мкл собранной синовиальной жидкости выделяли ДНК и проводили ПЦР в реальном времени (ПЦР-РВ) с использованием набора реагентов для обнаружения ДНК C. trachomatis (ЗАО «Синтол»).
Пример 7. Приготовление заявляемого средства
Для приготовления средства в физиологический раствор добавляют последовательно нафамостата димезилат, (2-гидроксипропил)-β-циклодекстрин и хондроитин сульфат и растворяют при постоянном перемешивании. Количество компонентов взято в таком весовом соотношении, чтобы конечная концентрация нафамостата димезилата составляла 50 мг/мл, (2-гидроксипропил)-β-циклодекстрина - 250 мг/мл, хондроитин сульфат - 50 мг/мл физиологического раствора соответственно. После чего полученный раствор подвергают стерилизующей фильтрации, с последующим розливом в подготовленную для терапевтического применения тару.
Изделие медицинского назначения может представлять собой, например, запаянную ампулу, содержащую стерильный раствор заявляемого средства.
Пример 8. Элиминация хламидий из зараженного сустава при хламидийном артрите после применения заявляемого средства
В данном примере исследовалась динамика клинических проявлений и динамика освобождения организма от инфекции при применении средства на основе нафамостата димезилата на модели хламидийного артрита у крыс. В состав композиции входят нафамостата димезилат (50 мг/мл), хондроитин сульфат (Mw 20-30 кДа, 50 мг/мл) и (2-гидроксипропил)-β-циклодекстрин (250 мг/мл) в физиологическом растворе. Испытания проводили на крысах линии Wistar. Для заражения использовали взвесь очищенных элементарных телец (ЭТ) C. trachomatis Bu-434 серовар L2 (АТСС VR 902В), полученных по методике Miyashita N. и Matsumoto A. (Miyashita N. and Matsumoto A. J. Clin. Microbiol., 1992, 30, 2911-2916). Очищенные ЭТ суспензировали в сахарозо-фосфатно-солевом буфере (75,0 г сахарозы, 0,52 г KH2PO4, 3,07 г Na2HPO4⋅12H2O, 0,72 г глутаминовой кислоты, разведенной в 1000 мл дистиллированной воды) и хранили при -70°С. Титр ВОЕ/мл определяли методом высева на монослой эукариотических клеток.
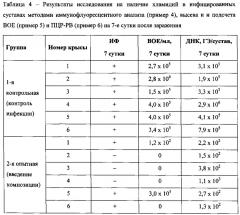
Для внутрисуставного заражения использовали дозу 1,0×108 ВОЕ/сустав. Взвесь очищенных элементарных телец C. trachomatis в физиологическом растворе вводили асептически в коленный сустав правой конечности в объеме 100 мкл с помощью иглы размера (0,45 мм × 12 мм). Опытной группе крыс на 3-и и 6-е сутки после инфекции была введена композиция (50 мкл, соответствует дозе 2,5 мг/сустав нафамостата димезилата), в то время как контрольная группа ее не получала. Препарат вводили асептически в коленный сустав в максимально согнутом положении через связку надколенника с помощью иглы. После инъекции для более равномерного распределения препарата по суставной полости делали серию полноамплитудных сгибательно-разгибательных движений сустава. По 6 крыс из каждой группы подвергались эвтаназии на 7-е, 15-е и 21-е сутки после заражения. В ходе эксперимента оценивалось общее состояние и поведение животных и состояние места инъекции (таблица 2). Наличие болевого синдрома в инфицированном суставе определялось по положению ноги и по пользованию этой ногой животного, т.е. наступает ли на ногу или держит на весу при различных двигательных актах. После эвтаназии оценивалось состояние подкожно-жировой клетчатки (таблица 3) и наличие жизнеспособных хламидий в суставе как описано в примерах 4-6 (таблицы 4-6).
Перед началом эксперимента в контрольной и опытной группах поведение животных не различалось. После инфицирования в обеих группах изменялось поведение животных, снижался аппетит и потребление воды, появлялась вялость, уменьшалась двигательная активность, болезненность опытного сустава вызывала хромоту. На протяжении первых 7 дней эксперимента нарастал отек опытного сустава, усиливалась хромота как у животных контрольной группы, так и у крыс опытной группы, получавших композицию, хотя животные из опытной группы пытались опираться на больную ногу. Дальнейшие наблюдения за животными показали улучшение состояния к 15-му дню наблюдений у животных из опытной группы, которые стали меньше хромать, старались опираться на больную ногу, начинали активнее двигаться, проявлять любопытство. У них усиливались аппетит и жажда. На 21-е сутки после заражения крысы из опытной группы находились в удовлетворительном состоянии, практически не хромали, признаков болевого синдрома при пальпации не проявляли. Крысы контрольной группы на 21-й день наблюдений незначительно припадали на больную лапу.
При посмертном вскрытии суставов на 7-е сутки после заражения у всех крыс контрольной группы наблюдался выраженный отек подкожно-жировой клетчатки, суставной хрящ был полупрозрачным без признаков кровоизлияния. У крыс опытной группы отек подкожно-жировой клетчатки зараженного сустава был менее выражен, чем в группе контрольных крыс, однако отмечались иктеричность и точечные кровоизлияния. Вскрытие суставов на 15-е и 21-е сутки показало постепенное улучшение состояния подкожно-жировой клетчатки в обоих группах.
На 7-й день исследований в суставной полости зараженного сустава контрольной группы животных развивалась хламидийная инфекция с высоким титром ВОЕ/мл (105), подтвержденная результатами иммунофлуоресцентного анализа и ПЦР. Во 2-й группе крыс, получавших композицию на основе нафамостата димезилата, было показано подавление хламидийной инфекции до титра 101 ВОЕ/мл. Концентрация ДНК в этой группе снизилась на 103 ГЭ/сустав. Различия между группами по критерию Манна-Уитни достоверны на уровне значимости 0,005. На 15-й день исследований в суставной полости зараженного сустава контрольной группы животных активная хламидийная инфекция была обнаружена только у двух крыс из шести в невысоком титре ВОЕ/мл (102), подтвержденная результатами иммунофлуоресцентного анализа (у одной крысы). Результаты ПЦР в контрольной группе животных показали снижение концентрации ДНК по сравнению с данными на 7-е сутки до 103 ГЭ/сустав. Во 2-й группе крыс, получавших композицию, было показано 100%-е подавление хламидийной инфекции. ДНК в концентрации 101 ГЭ/сустав обнаружена только у одного животного. Статистический анализ результатов высева и подсчета ВОЕ не выявил достоверных отличий между опытной и контрольной группами на 15-й день после заражения (критерий Манна-Уитни, p<0,05). Статистический анализ результатов ПЦР показал достоверное отличие между опытной и контрольной группами на 15-й день после заражения (критерий Манна-Уитни, p<0,005). На 21-й день после заражения в суставной полости инфицированного сустава животных как контрольной, так и опытной групп хламидийная инфекция не обнаруживалась методами иммунофлуоресцентного анализа и подсчета ВОЕ. В контрольной группе, однако, в материалах соскоба выявлялась ДНК C. trachomatis. При этом количество ДНК на сустав на этот срок не только не снизилось по сравнению с таковым на 15-е сутки, но и незначительно увеличилось. Метод ПЦР выявляет ДНК как живых бактерий, так и убитых и нежизнеспособных форм. Для того, чтобы оценить длительность сохранения ДНК нежизнеспособных хламидий в тканях сустава, отдельно был проведен эксперимент по введению в сустав крыс обработанной ультрафиолетовым облучением суспензии C. trachomatis и определению ДНК возбудителя. Было показано, что на 7-е сутки после введение хламидийная ДНК обнаруживалась, но в количестве меньшем, чем в случае заражения живым возбудителем. На 15-е и 21-е сутки ДНК хламидий в соскобах не выявлялась. Таким образом, выявление ДНК в контрольной группе на 15-е и 21-е сутки после заражения может говорить о наличии в суставе жизнеспособного возбудителя. Более того, отсутствие роста хламидий на 21-е сутки в сочетании с увеличением количества ДНК в контрольной группе может свидетельствовать о развитии персистентной или хронической инфекции, что является наиболее распространенным осложнением при хламидийном артрите. В группе крыс, получавших композицию на основе нафамостата димезилата, ДНК хламидий на 21-е сутки не выявлялась ни у одного из животных, т.е. введение композиции на основе нафамостата димезилата подавило как острый инфекционный процесс, так и возможность перехода в хроническую форму. Статистический анализ результатов ПЦР показал достоверное отличие между опытной и контрольной группами на 21-й день после заражения (критерий Манна-Уитни, p<0,005).
Таким образом, двукратное внутрисуставное введение композиции на основе нафамостата димезилата на 3 и 6-е сутки после заражения показало полное подавление хламидийной инфекции к 15-му дню наблюдений и полную элиминацию возбудителя к 21-му дню исследований.
1. Способ лечения реактивного артрита хламидийной этиологии, включающий внутрисуставное введение средства, содержащего фармацевтически приемлемую соль нафамостата, (2-гидроксипропил)-β-циклодекстрин и хондроитин сульфат в терапевтически эффективном количестве.
2. Способ по п. 1, отличающийся тем, что средство может быть выполнено в виде раствора для внутрисуставного введения.
3. Способ по п. 2, отличающийся тем, что в качестве фармацевтически приемлемого растворителя использован физиологический раствор.
4. Способ по п. 1, отличающийся тем, что в качестве фармацевтически приемлемой соли нафамостата используют нафамостата димезилат.
5. Способ по п. 4, отличающийся тем, что соотношения в мас.ч. нафамостата димезилата, (2-гидроксипропил)-β-циклодекстрина и хондроитин сульфата в средстве составляют: (0,5-1)-(4-6)-(0,5-1).
6. Средство для лечения реактивного артрита хламидийной этиологии, содержащее фармацевтически приемлемую соль нафамостата, (2-гидроксипропил)-β-циклодекстрин и хондроитин сульфат в эффективном количестве.
7. Средство по п. 6, отличающееся тем, что средство может быть выполнено в виде раствора для внутрисуставного введения.
8. Средство по п. 6, отличающееся тем, что в качестве фармацевтически приемлемого растворителя использован физиологический раствор.
9. Средство по п. 6, отличающееся тем, что в качестве фармацевтически приемлемой соли нафамостата используют нафамостата димезилат.
10. Средство по п. 9, отличающееся тем, что соотношения в мас.ч. нафамостата димезилата, (2-гидроксипропил)-β-циклодекстрина и хондроитин сульфата в средстве составляют: (0,5-1)-(4-6)-(0,5-1).
11. Средство по п. 10, отличающееся тем, что предпочтительное соотношение в мас.ч. нафамостата димезилата, (2-гидроксипропил)-β-циклодекстрина и хондроитин сульфата в средстве составляет (1-5-1).