Антибактериальная композиция в виде суппозитория и способ ее приготовления
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности и медицине и представляет собой антибактериальную композицию в виде суппозитория и способ ее получения, где композиция содержит жидкую субстанцию бактериофагов, включающую, по меньшей мере, три бактериофага с титром не менее 2×108 БОЕ на суппозиторий каждого штамма, суппозиторную основу, включающую витепсол или твердый жир типа А, а также твин-80, причем компоненты в композиции находятся, в определенном соотношении, в % на 1 суппозиторий. Изобретение обеспечивает системное антибактериальное действие и сохранение исходного высокого титра фаголизата. 2 н.п. ф-лы, 2 ил., 7 табл., 5 пр., 3 ил.
Реферат
Изобретение относится к медицине, а именно к фармацевтической промышленности и касается лекарственных форм в виде суппозиториев, содержащих бактериофаги, и способа их получения.
Впервые возможность использования бактериофагов в профилактике и лечении инфекционных заболеваний была продемонстрирована в 1917 г., когда среди ученых-микробиологов распространилась сенсационная новость, что Феликс д'Эрелль открыл вирусы, «пожирающие бактерии», и на их основе ему удалось разработать препараты для лечения солдат, заразившихся дизентерией.
Бактериофаги - это вирусы, характеризующиеся специфической способностью к избирательному инфицированию бактериальных клеток, с последующим лизисом клетки-хозяина (вирулентные фаги) или образованием лизогенов (умеренные фаги).
Развитие новых представлений в конце XX - начале XXI века как о молекулярной биологии, так и об экологических взаимоотношениях бактериофагов и их хозяев, а также все более широкое распространение в биосфере антибиотикорезистентных микроорганизмов, актуализировали своего рода второе рождение вирусов бактерий. Существенно возросшее количество персистирующих антибиотикорезистентных патогенных и условно-патогенных штаммов бактерий, утяжеляющих клиническое течение патологических состояний и существенно ухудшающих показатели инфекционной заболеваемости во многих странах мира, связано как с бесконтрольным использованием антибиотиков при самолечении и профилактики нозокомиальных инфекций, так и с массовым применением консервантов и бактерицидных препаратов в пищевой промышленности и сельском хозяйстве. Улучшение качества медицинской помощи инфекционным больным, а также переход на потребление экологически чистых не обработанных антибактериальными средствами продуктов питания подразумевает поиск новых и возрождение известных ранее форм и методов лечения инфекционных заболеваний, способов деконтаминации инструментария и помещений ЛПУ, а также консервации пищевой продукции.
Учитывая остроту проблемы распространения антибиотикоустойчивых возбудителей инфекций, решением Ученого Совета Роспотребнадзора от 21 июня 2011 года, а также в соответствии с протоколом совещания у руководителя Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека от 02 декабря 2015 года «О вопросах антимикробной резистентности» рекомендовано научно-исследовательским организациям совместно с фармпроизводителями направить усилия на разработку препаратов на основе бактериофагов, эффективных при осуществлении мероприятий по обеспечению санитарно-эпидемиологического благополучия населения Российской Федерации.
Многочисленные исследования, проведенные отечественными и зарубежными учеными, подтверждают возможность использования бактериофагов в качестве природных антимикробных агентов для борьбы с бактериальными инфекциями у людей, животных и сельскохозяйственных культур, в том числе вызванных антибиотикорезистентными штаммами.
Преимущества бактериофагов перед антибиотиками достаточно очевидны и заключаются в следующем:
- способны уничтожать бактерии, устойчивые к антибиотикам;
- в титре, не превышающем в готовой лекарственной форме 1010 БОЕ/мл, не вызывают побочных эффектов (реакция Яриша - Герксгеймера);
- благодаря узкой видовой специфичности, не подавляют рост нормофлоры;
- сочетаются с другими лекарственными препаратами;
- оказывают иммуностимулирующее действие.
Более восьмидесяти лет в бывшем Советском Союзе, а позднее и в Российской Федерации на филиалах НПО «Микроген» производятся свыше десятка наименований пероральных лекарственных средств как на основе отдельных видов бактериофагов, так и их комбинаций для лечения и профилактики острых кишечных инфекций и декомпенсированных форм дисбактериоза, а также гнойно-воспалительных заболеваний бактериального генеза.
Известен поливалентный дизентерийный бактериофаг в свечах, используемый для лечения дизентерии, вызванной Shigella flexneri разных серотипов или Shigella sonne (Чушков Ю.В. Издание: Фарматека Год издания: 2011 Объем: 8 с. - N 6. - С. 34-41).
Известны ректальные свечи, содержащие фильтрат фаголизатов наиболее распространенных сальмонелл групп А, В, С, Д, Е., а также свечи со стафилококковым бактериофагом в виде лиофилизированного концентрата (Чушков Ю.В. Издание: Фарматека Год издания: 2011 Объем: 8 с. - N 6. - С.34-41).
Недостатком данных препаратов является узкая сфера их применения и использование активного начала - бактериофага в виде лиофилизированного концентрата, который в процессе сублимационной сушки снижает литическую активность.
Известен препарат "Секстафаг" в виде ректальных суппозиториев, содержащий стафилококковый бактериофаг, стрептококковый бактериофаг, протейный бактериофаг, клебсиеллезный бактериофаг, синегнойный бактериофаг, коли бактериофаг со специфической активностью каждого концентрированного монофага не ниже 10-7 (патент РФ №2366708).
Под очищенным концентрированным фаголизатом бактерий в этом патенте подразумевают несколько высокоактивных фаговых рас или штаммов совместно и одновременно культивируемых на нескольких же штаммах бактерий одного вида. Реальная концентрация каждого штамма при таком культивировании как в фаголизате, так и в готовой лекарственной форме - суппозиториях, в том числе после хранения остается неизвестной. При использовании данного метода получения очищенного концентрированного фаголизата бактерий и отсутствии полногеномного секвенирования каждого нового штамма бактериофага, а также проверки на лизогенность исходных культур бактериальных штаммов-хозяев, повышается вероятность попадания в коктейль бактериофагов умеренных штаммов, что не только потенциально снижает терапевтические свойства препарата, но и является недопустимым с точки зрения безопасности использования бактериофагов в качестве лекарственных средств.
Защищен иммунобиологический бактерицидный препарат в виде суппозитория на основе бактериофага (патент №2366708), который содержит видоспецифические вирулентные бактериофаги и бактериофаги с индуцированной вирулентностью с литической активностью не ниже 10-4 по Аппельману в отношении тест-штаммов и выделенных из организма человека изолятов бактерий в фильтрате фаголизата (или в фильтрате концентрата фаголизата) нелизогенных бактерий, и фармацевтически приемлемые целевые добавки в количестве 50,0-95,0 мас. % от массы препарата.
Недостатком предлагаемых суппозиториев является сочетание вирулентных - разрешенных к применению в медицинских целях, бактериофагов и бактериофагов с индуцированной вирулентностью - исходно умеренных, которые не только не будут оказывать терапевтического эффекта, но и не допускаются к использованию в лекарственных средств, а также то, что специфическую активность препарата бактериофагов, обозначаемую отрицательной степенью, определяли титрованием в жидкой питательной среде по методу Аппельмана. Данный параметр сложно интерпретировать в случае, когда в препарате используется несколько штаммов против одного вида бактерий, т.е невозможно стандартизировать препарат по содержанию фаговых частиц каждого штамма отдельно в 1 мл. Фармакокинетические исследования и возможный уровень патогенетического терапевтического эффекта - местный или системный данных свечей отсутствует, также не описана технология получения суппозиторий.
Наиболее близким аналогом изобретения (прототипом) является способ изготовления свечей с бактериофагом путем соединения очищенного концентрированного фаголизата бактерий с основой, отличающийся тем, что в основу непосредственно вводят жидкий фаголизат с титром не ниже 10-7 по Аппельману в количестве не более 20% от общей массы композиции (патент RU №2188629).
Для получения свечей прототипа используется жидкая питательная среда. Сырьем для производства свечей служат фильтраты фаголизатов микробных культур, концентрированные методом ультрафильтрации и подвергнутые стерилизующей фильтрации. Надо отметить, что ультрафильтрация усложняет технологический процесс не меньше, чем лиофилизация. В качестве активного начала суппозиториев используются бактериофаги клебсиелл и комплексный бактериофаг (пентафаг), при этом количество штаммов не определено, указаны только виды бактериофагов. Хотя в патенте это не указано, следует уточнить, что отрицательной степенью обозначают специфическую активность препарата бактриофагов, определяемую титрованием в жидкой питательной среде по методу Аппельмана (Appelmans R. Le dosage du bacteriophage. C.R. Soc Biol. 1921; 85:1098-99) на посевных бактериальных штаммах. Данный параметр сложно интерпретировать в случае, когда в препарате используется несколько штаммов против одного вида бактерий, т.е. невозможно стандартизировать препарат по содержанию фаговых частиц каждого штамма отдельно в 1 мл, которое определяется методом агаровых слоев по Грациа (Gratia, A. Des relations numeriques entre bacteries lysogene set particules de bacterophage /A.Gratia//Annales de l'Institut Pasteur. - 1936. - Vol. 57. - P. 652-676). Таким образом, под очищенным концентрированным фаголизатом бактерий в этом патенте подразумевают несколько высокоактивных фаговых рас или штаммов совместно и одновременно культивируемых на нескольких же штаммах бактерий одного вида. Реальная концентрация каждого штамма как в фаголизате, так и в суппозитории, в том числе, после хранения остается неизвестной.
Чрезмерным усложнением процесса изготовления суппозиториев в патенте RU №2188629 является также введение этапа стерилизации свечной основы перед внесением в нее АФС (активная фармацевтическая субстанция). Данная лекарственная форма не относится к стерильным и не требует стерилизации вспомогательных компонентов (проводится только стерилизующая фильтрация субстанции бактериофагов для избавления от патогенных культур бактериальных штаммов-хозяев).
Задачей настоящего изобретения является разработка суппозиторной лекарственной формы на основе комбинированной жидкой субстанции по меньшей мере трех бактериофагов с исходно высоким титром фаголизата от 2×108 БОЕ/суппозиторий каждого штамма, снижающимся на конец срока годности препарата до уровня не ниже 1×108 БОЕ/суппозиторий. Для достижения поставленной задачи по запатентованной технологии с выращиванием фаголизата на плотной питательной среде были получены высокоактивные стерильные фильтраты фаголизатов, подобраны вспомогательные компоненты и сконструирована готовая лекарственная форма - суппозитории, обладающие исходной высокой специфической антибактериальной активностью, сохраняющейся после всасывания фаговых частиц через слизистую кишечника, что было подтверждено в ходе фармакокинетических испытаний на кроликах.
При разработке суппозиториев на основе бактериофагов использовались микробиологические, молекулярно-генетические, биотехнологические методы и процедуры доклинических испытаний.
Техническим результатом заявленного изобретения является тот факт, что впервые в мире был разработан состав суппозиториев для ректального применения в отношении антибиотикоустойчивых микроорганизмов на основе коктейля из трех и более бактериофагов, обладающий необходимой специфической антибактериальной активностью (титром, измеряемым в БОЕ/мл по Грация и спектром литического действия - процент лизируемых штаммов внутри гомологичного вида бактерий) и системным механизмом действия при лечении инфекционных заболеваний за счет всасывания через слизистую кишечника в системный кровоток. Это в дальнейшем послужит основой для создания нового метода индивидуализированной антибактериальной терапии для лечения инфекций, вызванных лекарственно-устойчивыми штаммами возбудителей.
Таким образом, технический результат, достигаемый при осуществлении предлагаемой группы изобретений заключается в обеспечении системного антибактериального действия композиции путем всасывая активного начала через слизистую кишечника в кровь, а также в сохранении исходного высокого титра фаголизата (не менее 2×108 БОЕ/суппозиторий каждого штамма), снижающегося на конец срока годности препарата до уровня не ниже 1×108 БОЕ/суппозиторий.
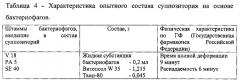
Сущность заявляемой группы изобретений заключается в следующем. Предлагается антибактериальная композиция в виде суппозитория, которая содержит жидкую субстанцию бактериофагов, включающую, по меньшей мере, три бактериофага с титром не менее 2×108 БОЕ/суппозиторий, суппозиторную основу, включающую витепсол или твердый жир типа А, а также твин (полисорбат)-80 при следующем соотношении компонентов на 1 суппозиторий, масс. %:
| жидкая субстанция бактериофагов | 13,3% |
| витепсол или твердый жир типа А | 82-84% |
| твин (полисорбат)-80 | 2,7-4,7% |
Предлагается также способ приготовления приведенной выше антибактериальной композиции, в котором сначала в расплавленный при температуре 43-50°С витепсол или твердый жир типа А вводят твин (полисорбат)-80. Затем полученную основу охлаждают до температуры 40-42°С и при перемешивании вводят в нее жидкую субстанцию бактериофагов. В связи с поставленной задачей был разработан алгоритм по созданию нового препарата на основе бактериофагов, включающий следующие этапы:
Согласно разработанного алгоритма, на первом этапе наших исследований были выделены и идентифицированы штаммы бактерий-мишеней. Для этого был использован комплекс инновационных лабораторных методов исследования, включающий классические микробиологические методы с посевом патологического материала на несколько видов питательных сред и использованием отечественных и импортных коммерческих биохимических тест-систем. Видовую идентификацию труднокультивируемых микроорганизмов проводили масс-спектрометрическим методом с использованием времяпролетного масс-спектрометра MALDI-TOF MS. Чувствительность микроорганизмов исходно определяли диско-диффузным методом. Микроорганизмы с МЛУ (множественная лекарственная устойчивость) тестировали иммуноферментным методом для идентификации фактора, обеспечивающего резистентность. Известные локусы антибиотикорезистентности регистрировали с помощью амплификации со специфическими праймерами в ПЦР-реакции. Далее проводили выделение из объектов окружающей среды и селекцию вирулентных штаммов бактериофагов по спектру их специфической литической активности против идентифицированных бактерий-мишеней. Выделение бактериофагов и изучение их биологических свойств проводили методами, предложенными М. Адамсом (1959) и Д.М. Гольдфарбом (1961). Для определения титра фаговых частиц и морфологии негативных колоний использовали метод Грациа (1936). Обязательным этапом при выборе индикаторной бактериальной культуры, на которой в дальнейшем будет культивироваться бактериофаг, являлась ее проверка на лизогенность в тесте по индукции профага в клетке с помощью митомицина С или УФО (ультрафиолетовое облучение). Морфологическую структуру бактериофагов исследовали с помощью электронной микроскопии нативных фаговых частиц. Уникальность и вирулентную природу бактериофагов подтверждали в процессе биоинформационного анализа, представляющего из себя следующую процедуру: на основе данных высокопроизводительного секвенирования второго поколения Ion Torrent Sequencing проводилась сборка генома бактериофага в режиме de-novo с использованием пакета программного обеспечения NEWBLER. Собранный геном имел точность прочтения каждого нуклеотида не ниже 99,9%. Далее проводился поиск открытых рамок считывания с целью аннотирования генома - определения возможных генов. Потенциальные продукты этих генов анализировались при помощи программного обеспечения PHACTS. Данное программное обеспечение позволяло предсказать тип жизненного цикла бактериофага (умеренный или вирулентный). Подтверждение вирулентности бактериофага проводилось также в ходе выявления генов, кодирующих известные интегразы, репрессоры транскрипции или их гомологи. Такой поиск проводился с использованием собранной нами из различных открытых ресурсов базы данных аминокислотных последовательностей умеренных бактериофагов и алгоритма blastp. Высокоактивные стерильные фаголизаты получали способом, защищенным патентом RU №2525141 «Способ получения бактериофага». Оценку безопасности производственно-перспективных штаммов фагов, включающую микробиологические, биохимические и молекулярно-генетические тесты, а также испытания на лабораторных животных проводили в соответствии с собственными разработанными процедурами (Киселева И.А. Специализированный продукт диетического профилактического питания на основе коктейля бактериофагов: конструирование, технология производства, оценка безопасности и эффективности применения: автореферат диссертации кандидата биологических наук: 03.01.06, 03.02.03 - Москва, 2015. - 26 с).
В качестве АФС для разработки суппозиториев использовали высокоактивные стерильные фаголизаты в жидкой форме. Свечную основу подбирали исходя из максимального сохранения специфической активности АФС (титра бактериофагов) в готовой лекарственной форме, которую проверяли по методу Грациа, используя разработанную, в рамках данных исследований, процедуру пробоподготовки. Для подтверждения универсальности подобранной суппозиторной основы в качестве комбинированной намеренно АФС использовали бактериофаги разных видов, отобранные не по принципу нозологической общности, а на основании существенных различий их биологических и генетических характеристик.
Пробоподготовка суппозиториев для определения подлиности и количественного содержания бактериофагов
Помещали три суппозитория в стерильный контейнер, добавляли необходимое количество изотонического раствора хлорида натрия, контейнер закрывали крышкой и помещали для растворения на водяную баню, предварительно нагретую до 45°С, на 10 минут, периодически встряхивая емкость с суппозиторием до полного растворения и перехода в эмульсионное состояние. Далее отобрали 0,5 мл в пробирку с мясопептонным бульоном (МПБ) для определения титра бактериофагов по методу Грациа. В ходе фармакокинетических исследований, для подтверждения наличия в клиническом материале фаговых частиц, кровь, мочу и кал кроликов до и после однократного назначения бактериофагов последовательно исследовали микробиологическими: спот-тестом, методом Грация, и молекулярно-генетическими: двойной вложенной ПЦР (полимеразной цепной реакция), методами. Морфологическую полноценность фаговых частиц в крови кроликов подтверждали путем определения специфических антител к одному из бактериофагов, входящих в суппозитории. Для этого в рамках данного исследования была специально сконструирована иммуноферментная тест-система.
I. Микробиологические методы выделения бактериофагов из клинического материала
Прямой метод выделения бактериофагов
Исследуемые жидкости (кровь, мочу) фильтровали через бактериальный фильтр (0,22 мкм, «Millipore»). Твердый исследуемый материал (оформленные испражнения - кал) предварительно измельчали, эмульгировали, фильтровали через бумажный фильтр, а затем через бактериальный. Наличие фага в полученном фильтрате определяли по методу спот-теста и Грациа.
Выделение бактериофагов методом обогащения с «подсевом»
Жидкий исследуемый материал (кровь) засевали в МПБ. Одновременно с исследуемым материалом в питательную среду вносили 0,2 мл суточной культуры бактерий, чувствительных к выделяемому бактериофагу. Инкубировали в термостате при 37°С 18-20 часов. После инкубации содержимое фильтровали через бактериальный фильтр. Полученный фильтрат исследовали на наличие бактериофага к бактериальным культурам, взятым для обогащения.
II. Обнаружение бактериофага в исследуемых образцах
- методом нанесения фага (spot-тест) на газон бактериальной культуры. В чашки Петри разливали 1,5% мясопептонный агар (ΜΠΑ). После застывания и подсушивания агара на чашки Петри наносили по 0,1 мл 16-18 часовой бульонной культуры микроорганизмов, чувствительных к бактериофагам, находящимся в исследуемом фильтрате, растирали шпателем по всей поверхности чашки, чтобы получить равномерный сплошной рост культуры. После того, как культура впиталась и чашки подсохли, на них каплями (spot-тест) наносили исследуемый фильтрат. После подсушивания, чашки перевертывали вверх дном и ставили в термостат при 37°С на 18-24 часа. На следующие сутки производили учет результатов - наличие или отсутствие «пятна лизиса».
- с учетом эффективности фаговой инфекции: по 10 мкл из последовательных десятикратных разведений исследуемого фильтрата наносили на газон бактериальной культуры, чувствительной к искомым бактериофагам, в полужидком (0,7%) агаре. Учет производили после инкубации чашек при 37°С в течение 18-20 часов - наличие или отсутствие «пятна лизиса» или подсчет количества негативных колоний в «пятне лизиса».
III. Метод определения литической активности (титра) бактериофагов
Метод Грациа (метод агаровых слоев)
Этот метод основан на внесении различных разведений титруемого бактериофага в соответствующую культуру бактерий и посеве на плотную питательную среду с целью получения негативных колоний бактериофага. Накануне опыта готовили стерильные питательные среды: 1,5% ΜΠΑ на чашках Петри по 25 мл; пробирки MПБ по 4,5 мл в каждой; 0,7% ΜΠΑ в пробирках по 2,5 мл. В день постановки опыта из пробы, содержащей титруемый бактериофаг, готовили в пробирках ряд десятикратных последовательных разведений. Затем в пробирку с 0,7% ΜΠΑ, расплавленным и охлажденным до 50-52°С, вносили 1 мл образца соответствующего разведения исследуемого бактериофага, перемешивали, добавляли 0,1-0,2 мл 109 микробных клеток в 1 мл по ОСО (отраслевому стандартном образцу мутности бактериальной взвеси) 42-28-85-2015 (10 ME), чувствительных к бактериофагу, опять слегка перемешивали и содержимое пробирки выливали в чашку с ΜΠΑ (вторым слоем). После остывания среды чашки инкубировали в термостате при 37°С в течение 18-20 ч. Титр фага определяли путем подсчета количества негативных колоний на параллельных чашках и умножением среднего арифметического на показатель разведения.
IV. Метод двойной вложенной ПЦР (double-nested PCR)
Выделение ДНК бактериофагов из крови проводили с помощью набора для выделения К-сорб (ООО «НПФ Синтол», Москва). В реакцию брали 1 мкл выделенной ДНК. Высокочувствительное выявление фрагментов ДНК фагов осуществляли с помощью двойной вложенной ПЦР (double-nested PCR). Реакционные смеси готовили с использованием реагентов, входящих в комплект рекомбинантной Taq ДНК-полимеразы (Fermentas, Литва). Для проведения реакций использовали олигонуклеотидные последовательности, приведенные в таблице 1. Детекцию результата амплификации проводили путем постановки горизонтального электрофореза в 1% агарозном геле.
V. Методика определения антител к бактериофагу РА-5 с помощью иммуноферментного анализа
А. Получение кроличьей антисыворотки к бактериофагу РА-5
Для получения антисыворотки проводили внутримышечную иммунизацию кролика.
Схема иммунизации:
1. 0,5 мл полного адьюванта Фрейнда + 0,5 мл раствора фага (концентрация 1010БОЕ/мл).
2. через 10 дней 0,25 мл неполного адьюванта + 0,25 мл раствора фага.
3. через 20 дней 0,1 мл неполного адьюванта + 0,1 мл раствора фага.
4. через 30 дней 0,5 мл неполного адьюванта + 0,5 мл раствора фага.
Б. Конструирование иммуноферментной тест-системы
1. Сорбируем антиген на пластиковый планшет. В лунки планшета вносим по 100 мкл бактериофага РА-5 в концентрации 1010 БОЕ/мл, закрываем пленкой и оставляем на ночь в холодильнике. В последние лунки рядов антиген не вносим - данные лунки являются отрицательным контролем в отсутствии антигена.
2. Через 18-20 часов инкубации удаляем содержимое лунок (резко вытряхиваем). Промываем 5-6 раз в моющем растворе (BSM Diagnostics, США). После промывки тщательно удаляем промывочный раствор, постукивая планшетом по фильтровальной бумаге, сложенной в несколько раз, для полного удаления жидкости из лунок.
3. Разводим исследуемую сыворотку в физиологическом растворе.
4. Вносим исследуемые образцы по 100 мкл в лунки планшета.
5. В качестве положительного контроля вносим сыворотку иммунизированного одноименным бактериофагом кролика в дубле или триплете.
6. В качестве дополнительного отрицательного контроля вносим в дубле физ. раствор.
7. Инкубируем 60 мин при 37°С.
8. После инкубации промываем планшет, как описано выше.
9. Для выявления связавшегося с сорбированным антигеном иммуноглобулина G, используем конъюгат Protein A-Peroxidase, Staphylococcus aureus/horseradish (Lot 084K132, Sigma, США). Данный конъюгат был выбран на том основании, что содержащийся в нем реагент Protein А стафилококка имеет сродство к иммуноглобулинам G разных видов млекопитающих, в том числе человека и кролика.
10. Для разведения конъюгата используем PBS-T (забуференный фосфатами физиологический раствор, содержащий твин-20 в концентрации 0,1%).
11. Рабочее разведение конъюгата - 1:64000 (подобрано в результате предварительных экспериментов).
12. Во все лунки планшета вносим по 100 мкл конъюгата в рабочем разведении.
13. Инкубируем 60 мин при 37°С.
14. Промываем планшет как описано ранее.
15. Во все лунки планшета вносим по 100 мкл субстратного раствора, содержащего ТМБ (ВСМ Diagnostics).
16. Инкубируем 15 мин в темноте при комнатной температуре.
17. Для прекращения реакции в каждую лунку вносим по 100 мкл стоп-реагента (ВСМ Diagnostics).
18. Проводим измерение оптической плотности при 450 нм на планшетном фотометре Infinite (Tecan, Австрия).
VI. Метод определения антифагового иммунного ответа in vitro в реакции нейтрализации
Вирусная природа бактериофага подразумевает, при системном действии последнего, инициацию иммунного ответа млекопитающих. Оценить иммунный ответ in vitro можно в реакция нейтрализации, заключающейся в падении силы литической активности (титра) бактериофага при его добавлении в сыворотку крови животного. Ниже представлена отработанная методика:
Сыворотку крови кролика разводили в 1500 раз в стандартном фосфатном буфере (PBS), затем к 450 мкл разведенной сыворотки добавляли 50 мкл фаголизата исследуемого бактериофага в титре 106 БОЕ/мл. Полученную смесь инкубировали в термостате в течение 30 минут при температуре 37°С. После инкубации смесь разводили в 100 раз МПБ и титровали по методу Грациа (подраздел III). Падение титра бактериофага в сыворотке крови интактного кролика свидетельствовало о наличие неспецифического иммунного ответа, достоверное отличие в величине титра бактериофага у иммунизированного и интактного животного свидетельствовало о выработке специфических антифаговых антител.
Получение жидкой субстанции бактериофагов в титре, достаточном для определения терапевтической дозы в готовой лекарственной форме
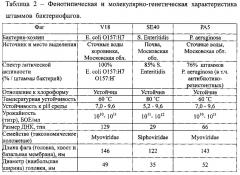
С целью подготовки АФС для суппозиториев на основе коктейля бактериофагов были отобраны следующие штаммы P. aeruginosa РА5, Е. coli V18, S. Enteritidis SE40.
Сравнительная фенотипическая и молекулярно-генетическая характеристика отобранных для суппозиториев штаммов бактериофагов представлены в таблице 2.
Штаммы бактериофагов P. aeruginosa РА5, Е. coli V18, S. Enteritidis SE40 различаются как по длине ДНК, так и по размеру фаговых частиц, что в дальнейшем позволит сформировать полное представление о фармакокинетике бактериофагов разных видов, введенных с помощью суппозиториев per rectum лабораторным животным.
Получение жидкой субстанции бактериофагов
Культивирование бактериофагов на плотных питательных средах с высоким титром вирусных частиц и предельно низкими значениями эндотоксина согласно патенту RU на изобретение №2525141 включает следующие этапы:
1 этап - получение 18-ти часовой культуры штамма-хозяина на плотной питательной среде. Бактериальные культуры микробиологической петлей засевают в МПБ, разлитый по 4,5 мл из расчета одна пробирка на одну матрасную колбу. Посеянные таким образом индикаторные штаммы культивируют в термостате 18 часов при 37°С, через 18 часов экспозиции достигая 108-109 КОЕ/мл.
2 этап - нанесение штамма-хозяина на поверхность плотной питательной среды.
Раскатывают культуру по всей поверхности питательной среды, создавая монослой. Культивируют в течение 3,5 часов при оптимальной температуре для роста культуры штамма-хозяина.
3 этап - нанесение маточного штамма бактериофага.
В образовавшийся таким образом газон культуры вносят шприцем или стерильной микробиологической пипеткой 2 мл одноименного (маточного) бактериофага в титре 105-106 БОЕ/мл. Покачивающим движением распределяют бактериофаг так, чтобы он тонким слоем покрыл всю поверхность газона бактериальной культуры. Инкубируют в термостате 13-15 часов при оптимальной температуре для роста культуры штамма-хозяина и одноименного бактериофага.
4 этап - сбор бактериофага.
В матрас в асептических условиях вносят физиологический раствор с рН 7,0-7,2 в количестве 0,04-0,045 мл на 1 см2 (9 мл на один матрас). Плавным покачивающим движением производят смыв фага с поверхности питательного агара. Стерильной микробиологической пипеткой собирают жидкую фракцию и переносят в стерильные центрифужные пробирки. Для освобождения фаголизата от нелизированных бактерий в пробирки добавляют хлороформ из расчета 1/10. Экспонируют полученную суспензию 30 минут при непрерывном шуттелировании, центрифугируют 30 мин при 5000-6000 об/мин. Собирают полученный супернатант в стерильную емкость.
5 этап - очистка и контроль фаголизата.
Полученные раздельно фаголизаты сводят в коктейль бактериофагов, включая в него виды фагов, отобранные для изготовления суппозиториев, стерилизуют фильтрацией через фильтр с диаметром пор 0,22 мкм и затем очищают от эндотоксинов на хроматографической колонке типа Endo Trap Blue или Endo Trap HD (Hyglos GmbH, Германия) согласно инструкции производителя с использованием буфера поставляемого в комплекте с колонкой.
Технология изготовления суппозиториев заключается в следующем: в расплавленный при температуре 43-47 градусов витепсол, вводят твин (полисорбат)-80, перемешивают, основу охлаждают до температуры 40 градусов и постепенно при перемешивании вводят жидкую субстанцию бактериофагов, затем суппозиторную массу выливают в ячейки для суппозиториев, охлаждают, запаивают, нарезают и готовые суппозитории упаковывают. Возможно применение заявленной технологии с использованием специализированных технологических линий.
Технология изготовления суппозиториев при использовании твердого жира типа А заключается в следующем: в расплавленный при температуре 45-50 градусов твердый жир типа А, вводят твин (полисорбат)-80, перемешивают, основу охлаждают до температуры 40-42 градусов и постепенно при перемешивании вводят жидкую субстанцию бактериофагов, затем суппозиторную массу выливают в ячейки для суппозиториев, охлаждают, запаивают, нарезают и готовые суппозитории упаковывают. Возможно применение заявленной технологии с использованием специализированных технологических линий.
Определение титра бактериофагов в готовой лекарственной форме
Пробы образцов суппозиториев опытных серий на основе жидкой субстанции бактериофагов по схеме пробоподготовки, приведенной в разделе «Пробоподготовка суппозиториев для определения подлинности и количественного содержания бактериофагов», были исследованы по методу Грациа с целью определения титра фаговых частиц в готовой лекарственной форме, а также сравнение данного показателя с исходными значениями определенными для субстанций. В таблице 5 приведены средние значения титров бактериофагов, определенные в суппозиториях заявленного.
Фармакокинетические испытания суппозиторной лекарственной формы на основе коктейля бактериофагов на лабораторных животных (кроликах), подтверждающие достижение терапевтического уровня бактериофагов в крови, моче и фекалиях животных
В эксперимент были включены 6 кроликов обоего пола с весом от 2,5 до 3 кг. Кроликам вводили ректально суппозитории на основе заявляемой жидкой субстанции бактериофагов. У кроликов исследовали образцы крови (с ЭДТА), мочи, кала с помощью качественного - спот-теста и количественного метода Грациа до и после введения суппозиториев.
На фигуре 1 представлена динамика средних значений титров бактериофагов в моче (а) и кале (б) кроликов, получавших суппозитории заявляемого состава. Максимальные значения титров бактериофагов в исследованных образцах достигаются через 4,5-6 часов после однократного введения суппозиториев и через 24 часа их концентрации снижаются до минимума. В процессе исследования выявлены определенные закономерности в изменении уровня бактериофагов в моче, крови и кале, которые могут быть связаны с размером вирусных частиц, влияющим на их способность преодолевать слизистую оболочку кишечника и проникать в кровь. В таблице 2 приведены приблизительные размеры фагов и их ДНК, позволяющие выстроить их в порядке убывания этих размеров следующим образом: V18>PA5>SE40. Логично, что фаги, обладающие меньшим размером, (SE40 и РА5) должны быстрее, чем бактериофаги большего размера (V18), проникать из просвета прямой кишки кроликов в кровь и далее в мочу. На фигуре 1а первый пик концентраций фагов меньшего размера приходится на 3 часа после введения суппозиториев в прямую кишку. Более высокие, относительно первых, вторые (6-тичасовые) пики концентраций бактериофагов SE40 и РА5 при определении их в кале (фиг. 1б) свидетельствуют о выведении фаговых частиц, поступивших в кровь, с желчью обратно в кишечник животных. Фаги, обладающие большим размером (V18), медленнее (или с большим трудом) преодолевают слизистый барьер кишечника - пиковые значения их титров, фиксируемые в моче, соответствуют 4,5 часам после введения суппозиториев в прямую кишку кроликов (фиг. 1а). Отсутствие второго пика у фага V18 на фигуре 16 свидетельствуют о нейтрализации фаговых частиц, вторично всосавшихся в кровь, иммунной системой кролика (иллюстрация данного процесса представлена в таблице 6). Вторично выводящиеся через кишечник фаговые частицы (V18) не обладают исходной литической активностью в отношении бактерий-хозяев, что и не позволяет определить их исходно высокие титры в кале спустя 4,5 часа после введения суппозиториев в прямую кишку животных.
Высокочувствительное выявление фрагментов ДНК фагов в крови животных осуществляли с помощью метода двойной вложенной ПЦР. На фигуре 2 представлен горизонтальный электрофорез продуктов (ампликонов) 2 и 3 раундов ПЦР, подтверждающий наличие в крови кроликов ДНК бактериофагов от 100-200 копий (3 раунд ПЦР) до 1000-10000 копий (2 раунд ПЦР). Вероятность выявления фаговых ДНК (максимальные количества копий различных штаммов фагов) увеличивается к 6 часам после введения суппозиториев кроликам.
На фигуре 2 представлена динамика наличия ДНК сальмонеллезного (а), синегнойного (б) и эширихиозного (в) бактериофагов в крови кроликов. Номерами 6-11 обозначены кролики, 100 п. н. - маркер длин ДНК, К- - отрицательный контроль (реакционная смесь), К+ - положительный контроль (ДНК определяемых бактериофагов)
Косвенным подтверждением наличия небольшого количества полноценных фаговых частиц (а не только ДНК бактериофагов), всосавшихся в кровь подопытных кроликов, может служить наличие IgG-антител к бактериофагу РА-5, определенных методом иммуноферментного анализа (ИФА); причем схема иммунизация животного соответствовала методу, используемому для белковой структуры антигена (в нашем случае - белковый капсид фаговой частицы).
Определение IgG-антител к бактериофагу РА-5 методом иммуноферментного анализа (ИФА).
1. В сыворотке крови иммунизированного кролика методом ИФА обнаружены IgG-антитела к бактериофагу РА-5, причем в высоком титре, что показано при дв