Композиция системы доставки на основе конъюгата для доставки полинуклеотида рнк-интерференции в клетку печени и способ ее получения
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к композиции для направленной доставки представляющего интерес полинуклеотида РНК-интерференции в гепатоциты in vivo, и может быть использовано в медицине. Полинуклеотид РНК-интерференции вводят совместно с нацеливающим пептидом мелитина, модифицированным рецепторами асиалогликопротеина (ASGPr), для доставки в клетку печени млекопитающего. Указанные пептиды доставки обеспечивают функциональное проникновение через мембраны клеток печени для возможности перемещения полинуклеотида РНК-интерференции внутрь клеток. 3 н. и 17 з.п. ф-лы, 5 ил., 11 табл., 18 пр.
Реферат
УРОВЕНЬ ТЕХНИКИ
Доставка полинуклеотидов и других по существу не проникающих через клеточные мембраны соединений в живую клетку в значительной степени ограничена сложной системой клеточных мембран. Лекарственные средства, используемые в антисмысловой, РНКи и генной терапии, представляют собой относительно большие гидрофильные полимеры и часто несут сильный отрицательный заряд. Обе указанные физические характеристики сильно ограничивают их непосредственную диффузию через клеточную мембрану. По этой причине основным ограничением для доставки полинуклеотида является доставка указанного полинуклеотида через клеточную мембрану в цитоплазму или ядро клетки.
Один способ, который используется для in vivo доставки малой нуклеиновой кислоты, заключатся в присоединении нуклеиновой кислоты либо к малой нацеливающей молекуле, либо к липиду или стеролу. Несмотря на то, что при использовании указанных конъюгатов наблюдается некоторая доставка и активность, необходимая для этих методов очень высокая доза нуклеиновой кислоты делает их непрактичными.
Также было разработано множество реагентов трансфекции, которые обеспечивали достаточно эффективную доставку полинуклеотидов в клетки in vitro. Однако доставка полинуклеотидов in vivo с использованием указанных реагентов трансфекции является сложной и признана неэффективной из-за токсичности in vivo, нежелательных взаимодействий с компонентами сыворотки или слабым направленным действием. Реагенты трансфекции, которые хорошо работают in vitro, катионные полимеры и липиды, как правило, образуют большие катионные электростатические частицы и дестабилизируют клеточные мембраны. Положительный заряд реагентов трансфекции in vitro облегчает связывание с нуклеиновой кислотой через заряд-зарядовые (электростатические) взаимодействия, таким образом, приводя к образованию комплекса нуклеиновая кислота/реагент трансфекции. Положительный заряд также является полезным для неспецифического связывания носителя с клеткой и для слияния с мембраной, ее дестабилизации или разрушения. Дестабилизация мембран облегчает доставку по существу не проникающего через клеточные мембраны полинуклеотида через клеточную мембрану. Хотя указанные свойства облегчают перенос нуклеиновой кислоты in vitro, они обуславливают токсичность и обеспечивают неэффективное направленное действие in vivo. Катионный заряд приводит к взаимодействию с компонентами сыворотки, которое вызывает дестабилизацию взаимодействия полинуклеотид-реагент трансфекции, плохую биодоступность и слабое нацеливание. Мембранная активность реагентов трансфекции, которая может являться эффективной in vitro, часто вызывает токсичность in vivo.
Для доставки in vivo носитель (нуклеиновая кислота и связанный агент доставки) должен быть маленьким, менее 100 нм в диаметре, предпочтительно, менее 50 нм. Еще более маленькие комплексы, менее 20 нм или менее 10 нм, были бы более применимыми. Носители для доставки размером больше 100 нм имеют очень слабый доступ к клеткам in vivo, отличным от клеток кровеносных сосудов. Комплексы, образованные за счет электростатических взаимодействий, склонны агрегировать или распадаться под воздействием физиологических концентраций солей или компонентов сыворотки. Кроме того, катионный заряд на носителях для доставки in vivo приводит к нежелательным взаимодействиям с компонентами сыворотки и, таким образом, слабой биодоступности. Интересно, что сильный отрицательный заряд также может ингибировать направленную доставку in vivo, препятствуя взаимодействию, необходимому для нацеливания, т.е. связыванию направленных лигандов с клеточными рецепторами. Таким образом, для распределения и направленного действия in vivo являются желаемыми почти нейтральные носители. В отсутствие тонкой регуляции разрушающая или дестабилизирующая мембраны активность вызывает токсичность при использовании in vivo. Баланс между токсичностью носителя и доставкой нуклеиновой кислоты легче достигается in vitro, чем in vivo.
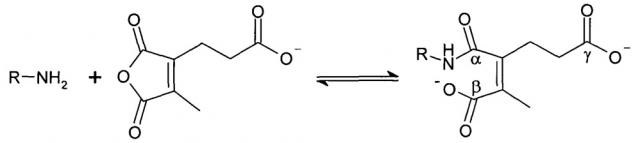
В публикации патента США 20040162260 Розема и др. (Rozema et al.) описали способ обратимой регуляции разрушающей мембрану активности мембраноактивного полиамина. Мембраноактивный полиамин обеспечивал средства разрушения клеточных мембран. рН-зависимая обратимая регуляция обеспечивала средство ограничения активности эндосом клеток-мишеней, ограничивая таким образом токсичность. Указанный способ основан на модификации 2-пропионов-3-метилмалеиновым ангидридом аминов в полиамине.
Указанная модификация приводила к превращению поликатиона в полианион путем превращения первичных аминов в пары карбоксильных групп (β-карбоксил и γ-карбоксил) и обратимому ингибированию мембранной активности полиамина. Розема и др. (Rozema et al., Bioconjugate Chem. 2003, 14, 51-57) показали, что β-карбоксил не обладал полностью явным отрицательным зарядом и сам по себе не был способен ингибировать мембранную активность. Было показано, что добавление γ-карбоксильной группы являлось необходимым для эффективного подавления мембранной активности. Для обеспечения совместной доставки нуклеиновой кислоты и носителя для доставки указанную нуклеиновую кислоту ковалентно связывали с полимером для доставки. Авторы продемонстрировали доставку полинуклеотидов в клетки in vitro с использованием описанной системы доставки на основе биологически лабильного конъюгата. Однако из-за того, что носитель обладал высоким отрицательным зарядом, поскольку и нуклеиновая кислота, и модифицированный полимер имели высокую плотность отрицательного заряда, указанная система не была эффективной для доставки in vivo. Отрицательный заряд, вероятно, подавлял клеточно-специфичное нацеливание и усиливал неспецифический захват ретикулоэндотелиальной системой (RES).
В публикации патента США 20080152661, Розема и др. (Rozema et al.) улучшили способ, описанный в опубликованной патенте США 20040162260, путем устранения высокой плотности отрицательного заряда модифицированного мембраноактивного полимера. Путем использования нейтральной гидрофильной нацеливающей группы (галактозной) и стерической стабилизирующей группы (PEG, ПЭГ) вместо γ-карбоксила 2-пропионо-3-метилмалеинового ангидрида Розема и др. (Rozema et al.) обеспечили сохранение общей растворимости в воде и обратимое подавление мембранной активности с достижением эффективного нацеливания на гепатоциты in vivo. Как и в предыдущих случаях, полинуклеотид был ковалентно связан с полимером трансфекции. Ковалентное присоединение полинуклеотида к полимеру трансфекции поддерживали для обеспечения гарантированной совместной доставки полинуклеотида с полимером трансфекции в клетки-мишени во время введения in vivo путем предотвращения отсоединения полинуклеотида от полимера трансфекции. Совместная доставка полинуклеотида и полимера трансфекции была необходима, поскольку указанный полимер трансфекции обеспечивал транспорт полинуклеотида через клеточную мембрану, либо снаружи клетки внутрь, либо из эндоцитозного компартмента в цитоплазму клетки. В публикации патента США 20080152661 была описана высокоэффективная доставка полинуклеотидов, в частности, олигонуклеотидов РНКи, в клетки печени in vivo с использованием указанного нового усовершенствованного физиологически чувствительного поликонъюгата.
Однако ковалентное присоединение нуклеиновой кислоты к полиамину имело неотъемлемые ограничения. Модификация полимеров для трансфекции для присоединения как нуклеиновой кислоты, так и маскирующих агентов, осложнялась зарядовыми взаимодействиями. Присоединение отрицательно заряженной нуклеиновой кислоты к положительно заряженному полимеру неизбежно приводит к агрегации, ограничивая, таким образом, концентрацию смеси. Агрегацию можно было бы преодолеть с использованием избытка поликатиона или полианиона. Однако указанный раствор ограничивает отношения, на основе которых могут быть приготовлены нуклеиновая кислота и полимер. Кроме того, присоединение отрицательно заряженной нуклеиновой кислоты к не модифицированному катионному полимеру вызывало конденсацию и агрегацию комплекса и подавляло модификацию полимера. Модификация полимера с образованием отрицательного полимера нарушала присоединение нуклеиновой кислоты.
Согласно предварительной заявке на патент США 61/307,490, Розема и др. (Rozema et al.) также усовершенствовали технологию, описанную в публикации патента США 20080152661. В предварительной заявке на патент США 61/307,490 (Rozema et al.) показано, что при тщательном выборе нацеливающих молекул и независимом присоединении подходящих нацеливающих молекул независимо к миРНК и к полимеру доставки, можно не соединять миРНК и полимер доставки, сохраняя при этом эффективное нацеливание обоих элементов на клетки in vivo и обеспечивая эффективную функциональную направленную доставку миРНК. Полимеры доставки, используемые в публикации патента США 20080152661 и предварительной заявке на патент США 61/307,490, представляли собой относительно большие синтетические полимеры, поли(винилэфиры) и поли(акрилаты). Более крупные полимеры обеспечивали возможность модификации нацеливающими лигандами для специфического связывания с клетками и молекулами PEG для повышенного экранирования. Более крупные полимеры были необходимы для эффективной доставки, возможно, благодаря повышенной мембранной активности и повышенной защите нуклеиновой кислоты в клеточных эндосомах. Более крупные поликатионы сильнее взаимодействуют как с мембранами, так и с анионными РНК.
Авторы настоящего изобретения разработали улучшенную систему доставки миРНК с использованием намного более маленького пептида доставки. Улучшенная система обеспечивает эффективную доставку миРНК с пониженной токсичностью и, соответственно более широким терапевтическим диапазоном.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Согласно предпочтительному варианту реализации, изобретение относится к композиции для доставки полинуклеотида интерферирующей РНК в клетку печени in vivo, содержащей: а) направленный на рецептор асиалогликопротеина (ASGPr) обратимо маскированный пептид мелитина (пептид доставки) и b) полинуклеотид интерферирующей РНК, конъюгированный с гидрофобной группой, содержащей по меньшей мере 20 атомов углерода (конъюгат РНК). Пептид доставки и конъюгат миРНК синтезируются раздельно и могут поставляться в отдельных контейнерах или в одном контейнере. Полинуклеотид интерферирующей РНК не конъюгирован с пептидом доставки.
Согласно другому предпочтительному варианту реализации, изобретение относится к композиции для доставки полинуклеотида интерферирующей РНК в клетку печени in vivo, содержащей: а) нацеленный на ASGPr обратимо маскированный пептид мелитина (пептид доставки) и b) полинуклеотид интерферирующей РНК, конъюгированный с галактозным кластером (конъюгат РНК). Пептид доставки и конъюгат миРНК синтезируются раздельно и могут поставляться в отдельных контейнерах или в одном контейнере. Полинуклеотид интерферирующей РНК не конъюгирован с полимером.
Согласно предпочтительному варианту реализации изобретения нацеленный на ASGPr обратимо маскированный пептид мелитина представляет собой пептид мелитина, обратимо модифицированный путем осуществления реакции первичных аминов указанного пептида с маскирующими агентами, содержащими лиганд ASGPr. Амин является обратимо модифицированным, если отщепление модифицирующей группы приводит к восстановлению указанного амина. Обратимая модификация пептида мелитина маскирующими агентами, описанными в настоящей заявке, приводит к обратимому ингибированию мембранной активности указанного пептида мелитина. В маскированном состоянии обратимо маскированный пептид мелитина не проявляет разрушающей мембрану активности. Для ингибирования мембранной активности и обеспечения нацеливания на клетку, т.е. образования обратимо маскированного пептида мелитина, требуется обратимая модификация более 80% или более 90% аминов на пептиде мелитина.
Предпочтительный маскирующий агент, содержащий лиганд ASGPr, имеет нейтральный заряд и содержит галактозамин или производное галактозамина, содержащее амино-реактивную группу дизамещенного малеинового ангидрида. Другой предпочтительный маскирующий агент, содержащий лиганд ASGPr, содержит галактозамин или производное галактозамина, содержащее поддающееся расщеплению пептидазой дипептид-n-амидобензильное амино-реактивное карбонатное производное. Реакция амино-реактивного карбоната с амином приводит к обратимой модификации амина с образованием амидобензилкарбаматной связи.
Согласно предпочтительному варианту реализации изобретения пептид мелитина включает мелитин пчелы Apis florea (маленькой или карликовой медоносной пчелы). Apis mellifera (западной или европейской или большой медоносной пчелы). Apis dorsata (гигантской медоносной пчелы), Apis cerana (азиатской медоносной пчелы) или его производные. Предпочтительный пептид мелитина содержит последовательность: Xaa1-Xaa2-Xaa3-Ala-Xaa5-Leu-Xaa7-Val-Leu-Xaa10-Xaa11-Xaa12-Leu-Pro-Xaa15-Leu-Xaa17-Xaa18-Trp-Xaa20-Xaa21-Хаа22-Хаа23-Хаа24-Хаа25-Хаа26, где:
Xaa1 представляет собой лейцин, D-лейцин, изолейцин, норлейцин, тирозин, триптофан, валин, аланин, диметилглицин, глицин, гистидин, фенилаланин или цистеин,
Хаа2 представляет собой изолейцин, лейцин, норлейцин или валин,
Хаа3 представляет собой глицин, лейцин или валин,
Хаа5 представляет собой изолейцин, лейцин, норлейцин или валин,
Хаа7 представляет собой лизин, серин, аспарагин, аланин, аргинин или гистидин,
Xaa10 представляет собой аланин, треонин или лейцин,
Xaa11 представляет собой треонин или цистеин,
Xaa12 представляет собой глицин, лейцин или триптофан,
Xaa15 представляет собой треонин или аланин,
Xaa17 представляет собой изолейцин, лейцин, норлейцин или валин,
Xaa18 представляет собой серин или цистеин,
Хаа20 представляет собой изолейцин, лейцин, норлейцин или валин,
Xaa21 представляет собой лизин или аланин,
Хаа22 представляет собой аспарагин или аргинин,
Хаа23 представляет собой лизин или аланин,
Хаа24 представляет собой аргинин или лизин,
Хаа25 представляет собой лизин, аланин или глутамин,
Хаа26 является необязательньш и, в случае его наличия, представляет собой глутамин, цистеин, глутамин-NH2 или цистеин-NH2;
и по меньшей мере два из Xaa21, Хаа23 и Хаа25 представляют собой лизин.
Более предпочтительно, мелитин содержит последовательность: Хаа1-Хаа2-Хаа3-Ala-Хаа5-Leu-Xaa7-Val-Leu-Xaa10-Xaa11-Xaa12-Leu-Pro-Xaa15-Leu-Xaa17-Ser-Trp-Xaa20-Lys-Xaa22-Lys-Arg-Lys-Xaa26, где:
Xaa1 представляет собой лейцин, D-лейцин, норлейцин или тирозин,
Хаа2 представляет собой изолейцин, лейцин, норлейцин или валин,
Хаа3 представляет собой глицин, лейцин или валин,
Хаа5 представляет собой изолейцин, валин, лейцин или норлейцин,
Хаа7 представляет собой лизин, серии, аспарагин, аланин, аргинин или гистидин,
Xaa10 представляет собой аланин, треонин или лейцин,
Хаа11 представляет собой треонин или цистеин,
Xaa12 представляет собой глицин, лейцин или триптофан,
Xaa15 представляет собой треонин или аланин,
Xaa17 представляет собой изолейцин, лейцин или норлейцин,
Хаа20 представляет собой изолейцин, лейцин или норлейцин,
Хаа22 представляет собой аспарагин или аргинин, и
Хаа26 представляет собой глутамин или цистеин.
Наиболее предпочтительно, мелитин содержит последовательность: Xaa1-Xaa2-Gly-Ala-Xaa5-Leu-Lys-Val-Leu-Ala-Xaa11-Gly-Leu-Pro-Thr-Leu-Xaa17-Ser-Trp-Xaa20-Lys-Xaa22-Lys-Arg-Lys-Xaa26, где:
Xaa1, Хаа2, Хаа5, Xaa17 и Хаа20 независимо представляют собой изолейцин, лейцин или норлейцин,
Xaa11 представляет собой треонин или цистеин,
Хаа22 представляет собой аспарагин или аргинин, и
Хаа26 представляет собой глутамин или цистеин.
Предпочтительно маскирующий агент содержит нейтральный гидрофильный дизамещенный алкилмалеиновый ангидрид:
,
где R1 содержит нацеливающую на клетку группу. Предпочтительно алкильная группа представляет собой метальную или этильную группу. Предпочтительно нацеливающая группа содержит лиганд рецептора асиалогликопротеина. Пример замещенного алкилмалеинового ангидрида представляет собой производное 2-пропионо-3-алкилмалеинового ангидрида. Нейтральное гидрофильное производное 2-пропионо-3-алкилмалеинового ангидрида образовано в результате присоединения нейтральной гидрофильной группы к 2-пропионо-3-алкилмалеиновому ангидриду через γ-карбоксильную группу 2-пропионо-3-алкилмалеинового ангидрида:
где R1 содержит нейтральный лиганд ASGPr, и n=0 или 1. Согласно одному варианту реализации изобретения лиганд ASGPr связан с ангидридом через короткий PEG-линкер.
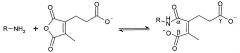
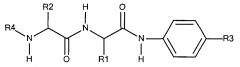
Предпочтительно маскирующий агент содержит гидрофильное подверженное расщеплению пептидазой (протеазой) дипептид-n-амидобензильное амино-реактивное карбонатное производное. В ферментативно расщепляемых линкерах согласно изобретению используется дипептид, связанный с активированной амидобензилом карбонатной группой. Лиганд ASGPr присоединен к амино-концу дипептида. Активированная амидобензилом карбонатная группа находится на карбокси-конце дипептида. Расщепляемые пептидазой линкеры, подходящие для применения согласно изобретению, имеют следующую структуру:
где R4 содержит лиганд ASGPr, и R3 содержит амино-реактивную карбонатную группу, и R1 и R2 представляют собой R-группы аминокислот. Предпочтительный активированный карбонат представляет собой пара-нитрофенол. Однако другие амино-реактивные карбонаты, известные в данной области техники, легко можно использовать вместо пара-нитрофенола. В результате реакции активированного карбоната с амином мелитина происходит связывание нацеливающего соединения, лиганда рецептора асиалогликопротеина, с пептидом мелитина поддающейся расщеплению пептидазой дипептид-амидобензилкарбаматной связью. Ферментативное расщепление дипептида приводит к отделению нацеливающего лиганда от пептида и инициирует реакцию элиминации, приводящую к регенерации амина пептида.
Дипептиды Glu-Gly, Ala-Cit, Phe-Cit («Cit» представляет собой аминокислоту цитруллин) показаны в Примере 3. Несмотря на то, что также допускается присутствие заряженных аминокислот, предпочтительными являются нейтральные аминокислоты.
Предпочтительный маскирующий агент обеспечивает функцию нацеливания за счет аффинности к рецепторам клеточной поверхности, т.е. маскирующий агент содержит лиганд рецептора клеточной поверхности. Предпочтительные маскирующие агенты содержат сахариды, обладающие аффинностью к ASGPr, включая, но не ограничиваясь ими: галактозу, N-ацетилгалактозамин и производные галактозы. Производные галактозы, обладающие аффинностью к ASGPr, хорошо известны в данной области техники. Важным признаком обратимо модифицированного мелитина является то, что более 80% аминов мелитина (в популяции пептидов) модифицированы путем присоединения лигандов ASGPr физиологически лабильными обратимыми ковалентными связями.
Согласно другому варианту реализации изобретения пептиды мелитина согласно изобретению также модифицированы на амино- или карбокси-конце путем ковалентного присоединения пространственного стабилизатора или конъюгата лиганд ASGPr-пространственный стабилизатор. Модификации амино или карбокси-конца пептида могут осуществляться во время синтеза с использованием стандартных методов, известных в данной области техники. Альтернативно, модификация амино- или карбокси-конца может осуществляться путем модификации цистеиновых остатков пептида мелитина, содержащего амино- или карбокси-концевые цистеиновые остатки. Предпочтительно пространственный стабилизатор представляет собой полиэтиленгликоль. Предпочтительно полиэтиленгликоли содержат 1-120 этиленовых звеньев. Согласно другому варианту реализации изобретения размер полиэтиленгликолей предпочтительно составляет менее 5 кДа. Для конъюгатов лиганд ASGPr-пространственный стабилизатор предпочтительный пространственный стабилизатор представляет собой полиэтиленгликоль, содержащий 1-24 этиленовых звеньев.
Конъюгат полинуклеотида РНКи и пептид доставки вводят млекопитающему в фармацевтически приемлемых носителях или разбавителях. Согласно одному варианту реализации изобретения пептид доставки и конъюгат полинуклеотида РНКи можно объединять в растворе до введения млекопитающему. Согласно другому варианту реализации изобретения пептид доставки и конъюгат полинуклеотида РНКи можно совместно вводить млекопитающему в виде отдельных растворов. Согласно другому варианту реализации изобретения пептид доставки и конъюгат полинуклеотида РНКи можно вводить млекопитающему последовательно. В случает последовательного введения пептид доставки можно вводить до введения конъюгата полинуклеотида РНКи. Альтернативно, в случае последовательного введения конъюгат полинуклеотида РНКи можно вводить до введения пептида доставки.
Другие объекты, признаки и преимущества согласно изобретению будут очевидны из следующего подробного описания, сопровождающегося рисунками.
КРАТКОЕ ОПИСАНИЕ ФИГУР
ФИГ.1 Таблица, в которой перечислены пептиды мелитина, подходящие для применения согласно изобретению.
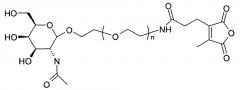
ФИГ.2. Рисунок, показывающий связь кластера GalNAc с РНК.
ФИГ.3. График, показывающий (А) уровень азота мочевины крови (BUN) и (В) уровень креатинина у приматов, которых лечили обратимо модифицированными пептидами мелитина для доставки миРНК и конъюгатами миРНК-холестерин.
ФИГ.4. График, показывающий (А) уровень аспартатаминотрансферазы (AST) и (В) уровень аланинтрансаминазы (ALT) у приматов, которых лечили обратимо модифицированными пептидами мелитина для доставки миРНК и конъюгатами миРНК-холестерин.
ФИГ.5. График, показывающий снижение эндогенного уровня Фактора VII у приматов, которых лечили обратимо модифицированными пептидами мелитина для доставки миРНК и конъюгатами миРНК-холестерин.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящей заявке описан усовершенствованный способ доставки полинуклеотидов интерферирующих РНК (РНКи) в клетки печени млекопитающего in vivo. Согласно изобретению, описана in vivo система доставки полинуклеотида РНКи, в которой используется маленький пептид доставки, мелитин, являющийся производным пептида пчелиного яда, и независимо нацеленный полинуклеотид РНКи. Применение нацеливающих на печень молекул конъюгатов полинуклеотидов РНКи и нацеливающих на рецептор асиалогликопротеина обратимо ингибированных пептидов мелитина обеспечивает эффективную доставку полинуклеотида РНКи в печень.
Поскольку мелитин и полинуклеотиды РНКи независимо нацелены на гепатоциты, концентрация мелитина и полинуклеотидов и отношение между ними ограничивается только растворимостью компонентов, а не растворимостью ассоциированного комплекса или способностью образовывать указанный комплекс. Также полинуклеотид и мелитин можно смешивать в любой момент времени до введения или даже вводить раздельно, что позволяет, соответственно, хранить компоненты отдельно друг от друга, в растворе или в сухом виде.
Изобретение включает системы доставки конъюгата, имеющие следующий состав:
Y-Мелитин-(L-М)x плюс N-T,
где N представляет собой полинуклеотид РНКи, Т представляет собой группу, нацеливающую полинуклеотид (гидрофобную группу, содержащую 20 или более атомов углерода, или галактозный кластер), Мелитин представляет собой пептид мелитина пчелиного яда или его производное, как описано в настоящей заявке, и маскирующий агент М содержит лиганд ASGPr, как описано в настоящей заявке, ковалентно связанный с Мелитином через физиологически лабильную обратимую связь L. Отщепление L приводит к регенерации немодифицированного амина Мелитина. Y является необязательным и, в случае его наличия, содержит полиэтиленгликоль (PEG) или конъюгат лиганд ASGPr-PEG, связанный с амино-концом, карбокси-концом или амино- или карбокси-концевым цистеином Мелитина. Присоединение Y к амино-концу или амино-концевому цистеину является предпочтительным. Х представляет собой целое число больше 1. В немодифицированном состоянии Мелитин является мембраноактивным. Однако пептид доставки Мелитин-(L-М)x не является мембраноактивным. Обратимая модификация первичных аминов Мелитина путем присоединения М приводит к обратимому ингибированию или инактивации мембранной активности Мелитина. Процент модифицированных первичных аминов Мелитина является достаточным для ингибирования мембранной активности полимера и обеспечения нацеливания на гепатоциты. Предпочтительно значение x - более 80% и, более предпочтительно, более 90% первичных аминов Мелитина, что определяется по числу аминов на Мелитине в отсутствие любых маскирующих агентов. Более конкретно, х имеет значение от более 80% и до 100% первичных аминов Мелитина. Отмечено, что мелитин, как правило, содержит 3-5 первичных аминов на амино-конце (если он не модифицирован) и, как правило, 2-4 лизиновых остатка. Таким образом, процентная модификация аминов отражает процентную модификацию аминов в популяции пептидов мелитина. При расщеплении обратимых связей L немодифицированные амины регенерируют, и, соответственно, Мелитин возвращается в его немодифицированное мембраноактивное состояние. Предпочтительная обратимая связь представляет собой рН-лабильную связь. Другая предпочтительная обратимая связь представляет собой расщепляемую протеазами связь. Мелитин-(L-М)x, ASGPr-нацеленный обратимо маскированный мембраноактивный полимер (пептид доставки) и T-N, конъюгат полинуклеотида, синтезируют или получают отдельно. Т и N не являются прямо или не прямо ковалентно связанными с Мелитином, L или М. Электростатическое или гидрофобное соединение полинуклеотида или конъюгата полинуклеотида с маскированным или немаскированным полимером не является необходимым для in vivo доставки полинуклеотида в печень. Маскированный полимер и конъюгат полинуклеотида могут поставляться в одном и том же контейнере или в отдельных контейнерах. Они могут быть объединены до введения, введены совместно или введены последовательно.
Гидрофильные группы указывают в качественном отношении, что указанная химическая группа предпочитает воду. Как правило, такие химические группы являются растворимыми в воде и являются донорами или акцепторами водородных связей с водой. Гидрофильная группа может быть заряженной или незаряженной. Заряженные группы могут быть положительно заряженными (анионными) или отрицательно заряженными (катионными) или заряженными как положительно, так и отрицательно (цвиттерионными). Примеры гидрофильных групп включают следующие химические группы: углеводы, полиоксиэтилен, некоторые пептиды, олигонуклеотиды, амины, амиды, алкоксиамиды, карбоновые кислоты, сульфаты и гидроксилы.
Гидрофобные группы указывают в качественном отношении, что химическая группа избегает воду. Как правило, такие химические группы не растворимы в воде и не склонны образовывать водородные связи. Липофильные группы растворяются в жирах, маслах, липидах и неполярных растворителях и имеют слабую способность или не имеют способности образовывать водородные связи. Углеводороды, содержащие два (2) или более атомов углерода, некоторые замещенные углеводороды, холестерин и производные холестерина являются примерами гидрофобных групп и соединений.
Гидрофобные группы предпочтительно представляют собой углеводороды, содержащие только атомы углерода и водорода. Однако допускается присутствие неполярных заместителей или неполярных гетероатомов, которые поддерживают гидрофобность и включают, например, атом фтора. Термин включает алифатические группы, ароматические группы, ацильные группы, алкильные группы, алкенильные группы, алкинильные группы, арильные группы, аралкильные группы, аралкенильные группы и аралкинильные группы, каждая из которых может быть прямой, разветвленной или циклической. Термин гидрофобная группа также включает: стерины, стероиды, холестерин и производные стероидов и холестерина.
В настоящем документе мембраноактивные пептиды являются поверхностно-активными, амфипатическими пептидами, которые способны оказывать один или более их следующих эффектов на биологическую мембрану: изменение или разрушение мембраны, которое позволяет не проникающим через мембрану молекулам входить в клетку или пересекать мембрану, формирование поры в мембране, фрагментацию мембран или разрушение или растворение мембран. В настоящей заявке мембрана или клеточная мембрана содержит липидный бислой. Изменение или разрушение мембраны можно функционально определить по активности пептида по меньшей мере в одном из следующих анализов: лизис эритроцитов (гемолиз), подтекание липосом, слияние липосом, клеточное слияние, лизис клеток и высвобождение из эндосом. Мембраноактивные пептиды, которые вызывают лизис клеточных мембран, также называются мембранолитическими пептидами. Пептиды, которые предпочтительно вызывают разрушение эндосом или лизосом по сравнению с плазматическими мембранами, считаются эндосомолитическими. Действие (эффект) мембраноактивных пептидов на клеточную мембрану может быть временным. Мембраноактивные пептиды обладают аффинностью в отношении мембраны и вызывают денатурацию или деформацию бислойных структур.
Доставка полинуклеотида в клетку опосредуется пептидом мелитина, разрушающим или дестабилизирующим плазматическую мембрану или внутреннюю мембрану везикулы (такую как мембрана эндосомы или лизосомы), включая образование поры в мембране или разрушение эндосомальных или лизосомальных везикул, что приводит к высвобождению содержимого везикулы в цитоплазму клетки.
Эндосомолитичесие пептиды представляют собой пептиды, которые в ответ на специфические для эндосом факторы окружения, такие как пониженный рН или присутствие литических ферментов (протеаз), способны приводить к разрушению или лизису эндосомы или обеспечивать высвобождение в норме не проникающего через клеточные мембраны соединения, такого как полинуклеотид или белок, из внутриклеточных заключенных в мембрану везикул, таких как эндосома или лизосома. В эндосоме происходит изменение физико-химических свойств эндосомолитических полимеров. Указанное изменение может представлять собой изменение растворимости полимера или способности взаимодействовать с другими соединениями или мембранами в результате изменения заряда, гидрофобности или гидрофильности. Примеры эндосомолитических пептидов включают рН-лабильные или чувствительные к ферментам группы или связи. Обратимо маскированный мембраноактивный пептид, в котором маскирующие агенты присоединены к полимеру через рН-лабильные связи, может, таким образом, считаться эндосомолитическим полимером.
Мелитин в настоящей заявке представляет собой малый амфипатический мембраноактивный пептид, содержащий от примерно 23 до примерно 32 аминокислот, являющийся производным встречающих в природе в пчелином яде пептидов мелитина. Природный мелитин содержит 26 аминокислот и является преимущественно гидрофобным на амино-конце и преимущественно гидрофильным (катионным) на карбокси-конце. Мелитин согласно изобретению может быть выделен из биологического источника или может являться синтетическим. Синтетический полимер создается или производится человеком с использованием химического процесса, а не получается в результате природного биологического процесса. В настоящей заявке мелитин включает природные пептиды пчелиного яда семейства мелитина, которые могут быть обнаружены, например, в яде следующих видов: Apis florea, Apis mellifera, Apis cerana, Apis dorsata, Vespula maculifrons, Vespa magnifica, Vespa velutina, Polistes sp. HQL-2001 и Polistes hebraeus. В настоящей заявке мелитин также включает синтетические пептиды, содержащие аминокислотную последовательность, идентичную или подобную природным пептидам мелитина. В частности, аминокислотная последовательность мелитина включает последовательности, показанные на Фиг.1. Помимо аминокислот, которые сохраняют свойственную мелитину высокую мембранную активность, могут быть добавлены 1-8 аминокислот к амино- или карбокси-концу пептида. В частности, могут быть добавлены цистеиновые остатки к амино- или карбокси-концу. Перечень на Фиг.1 не является полным, так как легко можно представить другие консервативные аминокислотные замены. Синтетические пептиды мелитина могут содержать природные аминокислоты в L-форме или энантиомерные аминокислоты в D-форме (инвертированные). Однако пептид мелитина должен содержать по существу все аминокислоты в L-форме, либо все аминокислоты в D-форме, но может содержать аминокислоты с противоположным стереоцентром, присоединенные к любому из амино- или карбокси-конца. Аминокислотная последовательность мелитина также может быть обращенной (ретро). Ретро-мелитин может содержать аминокислоты в L-форме или аминокислоты в D-форме (ретроинвертированный). Два пептида мелитина также могут быть ковалентно связаны с образованием димера мелитина. Мелитин может содержать модифицирующие группы, присоединенные либо к амино-концу, либо к карбокси-концу пептида, отличные от маскирующих агентов, которые усиливают тканевую направленность или облегчают in vivo циркуляцию. Однако в настоящей заявке мелитин не включает цепи или полимеры, содержащие более двух пептидов мелитина, ковалентно связанных друг с другом или с другим полимером или скаффолдом.
Маскирование
Пептиды мелитина согласно изобретению включают обратимо модифицированные пептиды мелитина, где обратимая модификация приводит к ингибированию мембранной активности, нейтрализации мелитина с уменьшением положительного заряда и образованию почти нейтрально заряженного полимера, и обеспечивает специфичное к клеточному типу нацеленное действие. Мелитин обратимо модифицирован путем обратимой модификации первичных аминов пептида.
Пептиды мелитина согласно изобретению способны разрушать плазматические мембраны или мембраны эндосом/лизосом. Однако мембранная активность приводит к токсичности при введении пептида in vivo. Таким образом, обратимое маскирование мембранной активности мелитина необходимо для его применения in vivo. Указанное маскирование осуществляют путем обратимого присоединения маскирующих агентов к мелитину с образованием обратимо маскированного мелитина, т.е. пептида доставки. Помимо ингибирования мембранной активности маскирующие агенты обеспечивают клеточно-специфические взаимодействия, т.е. нацеливание.
Важной чертой маскирующих агентов является то, что в агрегате они ингибируют мембранную активность полимера и обеспечивают in vivo нацеливание на гепатоциты. Мелитин является мембраноактивным в немодифицированном (немаскированным) состоянии и не мембраноактивным (инактивирваонным) в модифицированном (маскированном) состоянии. Количество маскирующих агентов, связанных с пептидом, является достаточным для достижения желаемого уровня инактивации. Желаемую степень модификации мелитина путем присоединения маскирующего агента (агентов) легко определить с использованием подходящих анализов активности пептида. Например, если мелитин обладает мембранной активностью в конкретном анализе, то маскирующий агент связан с указанным пептидом в количестве, достаточном для достижения желаемой степени подавления мембранной активности в указанном анализе. Предпочтительной является модификация ≥80% или ≥90% первичных аминогрупп на популяции пептидов мелитина по результатам определения количества первичных аминов на пептидах в отсутствие каких-либо маскирующих агентов. Также предпочтительной характеристикой маскирующих агентов является то, что их присоединение к пептиду снижает положительный заряд полимера, так