Способ оценки содержания циркулирующих десиалированных липопротеидов низкой плотности
Иллюстрации
Показать всеИзобретение относится к медицине и к клинической биохимии и может быть использовано для оценки содержания циркулирующих десиалированных липопротеидов низкой плотности (цмЛПНП). Сущность способа: используют твердофазный лектин-иммуноферментный метод, основанный на связывании цмЛПНП с 100 мкл раствора агглютинина RCA120 в изотоническом фосфатном буфере (ИБФ) в концентрации 30 мкг/мл, иммобилизованного в лунках планшета, промывке лунок буферным раствором с бычьим сывороточным альбумином (БСА), содержащим 2 г/л БСА, внесении по 100 мкл меченных пероксидазой поликлональных антител 1 мкг/мл к белку аполипопротеину В, инкубировании 1 ч при комнатной температуре, внесении 100 мкл исследуемого образца крови в ИФБ, инкубировании в течение 2 ч при 20°С, промывке, проявлении цитратным буфером рН 4,5, содержащим ортофенилендиамин и перекись водорода, инкубировании 30 мин при 37°С, остановке реакции добавлением серной кислоты и количественной оценке цмЛПНП за счет измерения оптической плотности при длине волны 492 нм, что позволяет определять содержание цмЛПНП без их предварительного выделения. Изобретение обладает более высокой чувствительностью и воспроизводимостью и позволяет избирательно анализировать цмЛПНП, таким образом дает возможность точно и надежно измерять концентрацию цмЛПНП без предварительного выделения фракции ЛПНП. Способ является простым, доступным и быстрым в осуществлении, позволяет проводить скрининговые обследования с целью выявления наличия атеросклеротического процесса на доклинической стадии и при диспансеризации населения. 3 ил., 4 пр.
Реферат
Изобретение относится к медицине и клинической биохимии и может быть использовано в лабораторной диагностике для определения циркулирующих десиалированных липопротеидов низкой плотности (цмЛПНП) с диагностическими и терапевтическими целями.
Одним из наиболее ранних проявлений атеросклеротического поражения является аккумуляция липидов клетками интимы артерий человека. Показано, что основным источником липидов являются липопротеиды низкой плотности (ЛПНП) [1-4]. Обнаруженные в крови человека модифицированные ЛПНП (мЛПНП), обладающие пониженным, по сравнению с нативными липопротеидами, содержанием сиаловой кислоты, были названы "десиалированными" ЛПНП. Именно десиалированные липопротеиды, в отличие от нативных, вызывают аккумуляцию липидов (в частности, эфиров холестерина) в клетках интимы артерий человека и макрофагах, т.е. являются атерогенными [5-6]. К настоящему времени убедительно экспериментально доказано существование в крови человека цмЛПНП, обладающих атерогенными свойствами [7-11]. Множественная модификация нативных ЛПНП может происходить в плазме крови и представляет собой каскад последовательных событий: десиалирование ЛПНП, появление способности вызывать накопление внутриклеточных липидов, потерю нейтральных липидов и фосфолипидов, уменьшение размера частиц, увеличение электроотрицательного заряда частиц, протекание процессов перекисного окисления липидов. Десиалирование ЛПНП осуществляется присутствующей в крови человека транс-сиалидазой, переносящей сиаловую кислоту между гликоконъюгатами липопротендов, гликопротеидов и ганглиозидов плазмы и клеток крови. Была также обнаружена повышенная предрасположенность десиалированных ЛПНП к окислению, которая является, скорее всего, следствием потери жирорастворимых витаминов, являющихся естественными антиоксидантами [8].
Таким образом, учитывая важную патогенетическую роль цмЛПНП в атеросклерозе, остается актуальной разработка наиболее информативных и в то же время относительно простых, доступных для клинических лабораторных исследований способов определения цмЛПНП. В настоящее время в лабораторной практике отсутствуют доступные для рутинных исследований реагенты и методы определения содержания атерогенных цмЛПНП в сыворотке крови человека. Более того, все ранее предложенные способы не учитывают как сложность фракционного состава ЛПНП, так и многофакторный, многостадийный характер их модификации, начальным звеном которой является именно процесс десиалирования.
Известен способ определения мЛПНП [12], отличающийся тем, что, с целью упрощения определения за счет сокращения числа стадий, супернатант после первого центрифугирования крови инкубируют с красителем. После этого проводят электрофоретическое разделение липидов из фракций крови. Способ включает следующие процедуры: к 1 мл сыворотки крови добавляют 40 мл 8% ПЭГ-6000, инкубируют 1 ч при комнатной температуре и центрифугируют 40 мин при 2800 g. Часть полученного супернатанта повторно центрифугируют 40 мин при 25000 g. Осадок промывают 0,25 мл раствора преципитата после первого и второго центрифугирования и используют для электрофоретического исследования. Разделение проводят в геле агарозы на пластинах, при этом в пробах супернатанта после первого центрифугирования определяют модифицированные липопротеиды высокой плотности, а после второго центрифугирования модифицированные липопротеиды низкой и очень низкой плотности. Недостатком этого способа являются низкая избирательность метода по отношению как к ЛПНП в целом, так и к мЛПНП, а также трудоемкость и длительность проведения исследования.
Наиболее интенсивно разрабатываемыми методами определения мЛПНП являются иммуноферментные тесты с использованием моноклональных антител к мЛПНП [13].
Многостадийность, трудоемкость и длительность иммуноферментного теста, выявление только эпитопов, характерных для искусственно модифицированных ЛПНП (неспецифичность), а также высокая себестоимость реагентов затрудняют использование их в рутинных исследованиях.
Известен способ экспресс-определения атерогенности крови [14], который состоит в определении множественно модифицированных липопротеидов низкой плотности (ммЛПНП) в плазме крови человека путем обработки ее буфером, содержащим поливинилпирролидон 12600±2700, и последующей визуальной регистрации помутнения по сравнению с контрольной пробой. Наличие помутнения, обусловленного агрегацией ммЛПНП, свидетельствует об атерогенности крови.
Недостатком этого способа является то, что он выявляет только ммЛПНП, которые быстро элиминируются из кровотока при взаимодействии со скавенджер-рецепторами. К тому же ммЛПНП связываются с аутоантителами к ним с образованием иммунных комплексов, которые при ряде условий не агрегируются, и поэтому у некоторых больных с тяжелым атеросклерозом данный тест дает отрицательный результат.
Известен способ определения минимально модифицированных липопротеидов низкой плотности (Мм-ЛПНП) в сыворотке или плазме крови человека [15], который наиболее близок к заявляемому способу по существенным признакам и был выбран в качестве прототипа.
При его применении Мм-ЛПНП агрегируют из сыворотки или плазмы крови путем обработки буфером, содержащим поливинилпирролидон (ПВП) с мол. массой 12600±2700, при конечной концентрации ПВП от 11,3% до 14,2% в пробе. После инкубации в течение 10 мин измеряют светопоглощение в опытной и контрольной пробах, вычисляют разность и при величине разности более 10 ЕД констатируют атерогенность крови у обследуемого человека за счет повышенного уровня Мм-ЛПНП.
Этот способ также не лишен недостатков, указанных выше, акцентирован на анализе окисленных ЛПНП и не позволяет определить содержание в крови цмЛПНП.
Таким образом, существует потребность в способе определения, который лишен вышеуказанных недостатков и обеспечивает условия для выделения и количественного определения цмЛПНП.
Задача решается новым способом, который включает определение уровня цмЛПНП в плазме крови твердофазным лектин-иммуноферментным методом, основанным на связывании цмЛПНП с агглютинином RCA120, иммобилизованным в лунках планшета, с последующей их количественной оценкой с помощью пероксидаза-меченых анти-апоВ поликлональных антител.
Описание способа определения уровня цмЛПНП в плазме крови.
Аполипопротеин В (ароА В) ЛПНП имеет два типа полисахаридных цепей, связанных N-гликозидной связью: олигоманнозидные и сиалированные биантенные. При этом сиаловая кислота содержится в цепях второго типа, где она является терминальным сахаром. Входящие в состав ЛПНП гликосфинголипиды также содержат терминальную сиаловую кислоту. Так как следующим за сиаловой кислотой остатком сахара в сиалированных биантенных цепях является галактоза, то десиалирование ЛПНП должно экспрессировать галактозу. Таким образом, десиалированные ЛПНП могут взаимодействовать с галактозоспецифичными лектинами. В способе используется агглютинин Ricinus communis (RCA 120), имеющий высокое сродство к терминальной бета-галактозе и низкое сродство к другим сахарным остаткам, входящим в состав полисахаридных цепей ЛПНП. Для определения уровня цмЛПНП в плазме крови используется твердофазный лектин-иммуноферментный метод, основанный на связывании модифицированных липопротеидов с RCA120, иммобилизованного в лунках планшета, с последующим их выявлением и количественной оценкой с помощью пероксидаза-меченых анти-апоВ поликлональных антител. В лунки вносят по 100 мкл раствора RCA120 в изотоническом фосфатном буфере в концентрации 30 мкг/мл и инкубируют в течение 2 ч при 37°С. Затем лунки промывают четыре раза в ИФБ, содержащем 2 г/л бычьего сывороточного альбумина (ИФБ/БСА), вносят по 100 мкл меченных пероксидазой поликлональных антител (1 мкг/мл) и инкубируют 1 ч при комнатной температуре. Затем лунки снова промывают раствором ИФБ/БСА и вносят 100 мкл исследуемого образца (плазмы крови) в ИФБ и инкубируют в течение 2 ч при 20°С. Последующее проявление проводят добавлением цитратного буфера, рН 4,5, содержащего ортофенилендиамин и перекись водорода, инкубируют 30 мин при 37°С. Реакцию останавливают добавлением серной кислоты. Оптическую плотность измеряют при длине волны 492 нм на многоканальном спектрофотометре. цмЛПНП могут быть измерены в интервале концентраций 20-800 нг/мл. При этом выделенные с помощью лектин-хроматографии нативные ЛПНП практически не связываются с RCA120 вплоть до концентраций 1 мг/мл.
Изобретение иллюстрируется следующими примерами его осуществления.
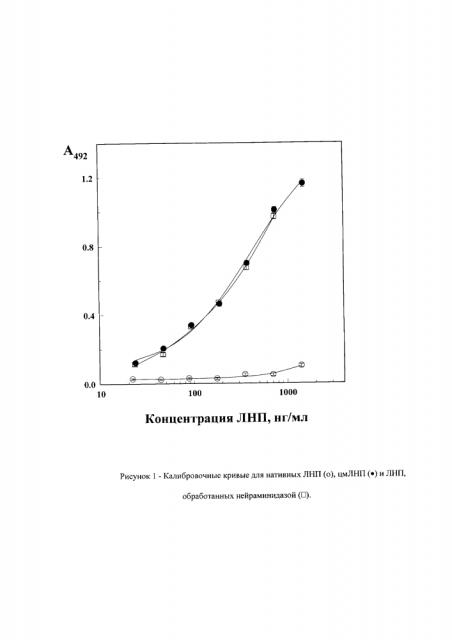
Пример 1. Калибровочные кривые обработанных нейроминидазой ЛПНП, выделенных из крови больных цмЛПНП и нативных ЛПНП, представлены на рис. 1. Видно, что кривые обработанных нейраминидазой ЛПНП и цмЛПНП практически совпадают. Также видно, что данный метод может использоваться при определении концентрации цмЛПНП в сыворотке крови в диапазоне 20-800 г/л. При этом сиалированные (нативные) ЛПНП, выделенные с помощью лектиновой хроматографии, не связываются с RCA120 вплоть до концентрации 1 мг/мл.
Пример 2. На рис. 2 представлено сравнение данных определения цмЛПНП как в сыворотке, так и в цельной крови как больных сердечно-сосудистыми заболеваниями, так и здоровых лиц. Видно, что кривые практически совпадают при определении содержания цмЛПНП как в сыворотке, так и в крови. Можно сделать вывод, что компоненты крови практически не влияют на точность определения содержания цмЛПНП в ней в диапазоне концентраций 20-200 μг/л.
Пример 3. На рис. 3 представлены данные определения уровня цмЛПНП в сыворотке методами ИФА и лектиновой хроматографии. Видно, что данные, полученные этими методами, практически совпадают (коэффициент корреляции 0,96, р<0,005). Чувствительность метода ИФА составляет 5 нг цмЛПНП на 1 мл пробы.
Пример 4. Результаты определения уровня цмЛПНП в крови больных с документированным атеросклерозом. Измерение уровня цмЛПНП в крови 30-ти здоровых доноров показало, что их содержание варьирует от 12 до 105 мкг/мл (1,4-19,7% от общего уровня апоВ в сыворотке). Средняя концентрация составила 49+10 мкг/мл (7,1+1,7% от уровня апоВ). Уровень цмЛПНП в крови 30-ти пациентов с каротидным атеросклерозом составлял от 173 мкг/мл (14,0% от уровня апоВ в сыворотке) до 774 мкг/мл (56,5%) (в среднем 402+54 мкг/мл или 35,9+4,3%). Различие средних уровней содержания десиалированных ЛПНП в крови здоровых лиц и пациентов было статистически значимым (р<0,05).
По сравнению с прототипом разработанный твердофазный лектин-иммуноферментный метод выделения и определения цмЛПНП обладает более высокой чувствительностью и воспроизводимостью и позволяет избирательно анализировать цмЛПНП. Таким образом, описываемый метод дает возможность точно и надежно измерять концентрацию цмЛПНП без предварительного выделения фракции ЛПНП. Использование простого, доступного и быстрого в осуществлении способа определения цмЛПНП в крови человека позволяет проводить скрининговые обследования с целью выявления наличия атеросклеротического процесса на доклинической стадии и при диспансеризации населения. Эта методика может быть использована в дальнейшем для рутинного определения содержания цмЛНП в крови для экспрессной диагностики атерогенеза при сердечно-сосудистых патологиях.
Литература
1. Ohlsson, L. Dairy products and plasma cholesterol levels. // Food. Nutr. Res. - 2010. - 54.
2. Forrester, J.S. Redefining normal low-density lipoprotein cholesterol: a strategy to unseat coronary disease as the nation's leading killer. // J. Am. Coll. Cardiol. - 2010. - Vol.56. - P. 630-636.
3. Feeman, W.E. Cholesterol guidelines. // Ann. Intern. Med. - 1989. - Vol.111. - P. 1047-1048.
4. Packard, C.J., Shepherd, J. Low density lipoprotein metabolism. // Prog. Clin. Biol. Res. - 1988. - Vol.255.- P. 117-123.
5. Tertov V.V., Bittolo-Bon G., Sobenin LA. et al. Naturally occurring modified low density lipoproteins are similar if not identical: more electronegative and desialylated lipoprotein subfractions. Exp Mol Pathol. 1995; 62(3): 166-172.
6. Tertov V.V., Orekhov A.N., Sobenin LA. и др. Carbohydrate composition of protein and lipid components in sialic acid-rich and -poor low density lipoproteins from subjects with and without coronary artery disease. J Lipid Res. 1993; 34(3): 365-375.
7. Orekhov A.N., Tertov V.V., Mukhin D.N. Desialylated low density lipoprotein - naturally occurring lipoprotein with atherogenic potency. Atherosclerosis. 1991; 86: 153-161.
8. Tertov V.V., Orekhov A.N., Sobenin LA. и др. Three types of naturally occurring modified lipoproteins induce intracellularlipid accumulation due to lipoprotein aggregation. Circ Res. 1992; 71: 218-228.
9. Harada L.M. Carvalho M.D., Passarelli M., Quintâo E.C. Lipoprotein desialylation simultaneously enhances the cell cholesterol uptake and impairs the reverse cholesterol transport system: in vitro evidences utilizing neuraminidase-treated lipoproteins and mouse peritoneal macrophages. Atherosclerosis. 1998; 139(1): 65-75.
10. Harada L.M. Carvalho M.D., Passarelli M., Quintâo E.C. Lipoprotein desialylation simultaneously enhances the cell cholesterol uptake and impairs the reverse cholesterol transport system: in vitro evidences utilizing neuraminidase-treated lipoproteins and mouse peritoneal macrophages. Atherosclerosis. 1998; 139 (1): 65-75.
11. Lindbohm N., Gylling H., Miettinen Т.Е., Miettinen T.A. Statin treatment increases the sialic acid content of LDL in hypercholesterolemic. Atherosclerosis. 2000; 151(2): 545-550.
12. Карпов P.C., Канская H.B., 1992. Способ определения модифицированных липопротендов крови (RU 1720015): СОЮЗ СОВЕТСКИХ СОЦИАЛИСТИЧЕСКИХ РЕСПУБЛИК (я)5 G01N 33/92, ГОСУДАРСТВЕННЫЙ КОМИТЕТ ПО ИЗОБРЕТЕНИЯМ И ОТКРЫТИЯМ ПРИ ГКНТ СССР.
13. Virella G., Derrick MB., Pate V. et al. Development of capture assay for different modification of human low-density lipoprotein // Clinical and Diagnostic Lab. Immunol. - 2005. - V. 12, №1. - P. 68-75.
14. Шойбонов Б.Б., Баронец В.Ю., Панченко Л.Ф., Кубатиев А.А. Способ экспресс-определения атерогенности крови. Патент РФ №2437098 от 20.12.2011 г., Бюл. №35.
15. Шойбонов Б.Б. Способ определения минимально модифицированных липопротеинов низкой плотности в сыворотке или плазме крови человека. Патент РФ №2501013. Официальная публикация патента 10.12.2013.
Способ определения циркулирующих десиалированных липопротеидов низкой плотности (цмЛПНП) в плазме крови без выделения фракции ЛПНП, при котором используется твердофазный лектин-иммуноферментный метод, основанный на связывании цмЛПНП с 100 мкл раствора агглютинина RCA120 в изотоническом фосфатном буфере (ИБФ) в концентрации 30 мкг/мл, иммобилизованного в лунках планшета, промывке лунок буферным раствором с бычьим сывороточным альбумином (БСА), содержащим 2 г/л БСА, внесении по 100 мкл меченных пероксидазой поликлональных антител 1 мкг/мл к белку аполипопротеину В, инкубировании 1 ч при комнатной температуре, внесении 100 мкл исследуемого образца крови в ИФБ, инкубировании в течение 2 ч при 20°С, промывке, проявлении цитратным буфером рН 4,5, содержащим ортофенилендиамин и перекись водорода, инкубировании 30 мин при 37°С, остановке реакции добавлением серной кислоты и количественной оценке цмЛПНП за счет измерения оптической плотности при длине волны 492 нм, что позволяет определять содержание цмЛПНП без их предварительного выделения.