Получение гетеромультимерных белков
Иллюстрации
Показать всеПредставленные изобретения касаются способов получения гетеромультимерного белка, обладающего способностью специфически связываться более чем с одной мишенью (варианты), а также способов создания комбинаторных библиотек таких гетеромультимерных белков (варианты). Охарактеризованные способы включают культивирование первой клетки-хозяина, экспрессирующей первые тяжелую и легкую цепи и второй клетки-хозяина, экспрессирующей вторые тяжелые и легкие цепи, получение комбинированной культуры, содержащей первые и вторые клетки-хозяева с образованием гетеромультимерного белка. Представленные изобретения позволяют эффективно и с высоким уровнем экспрессировать гены и осуществлять простую сборку гетеромультимерных белков. 5 н. и 47 з.п. ф-лы, 49 ил., 4 табл., 7 пр.
Реферат
Перекрестная ссылка на родственные заявки
В настоящей заявке испрашивается приоритет предварительной заявки на патент США рег. № 61/327302 под названием «Получение гетеромультимерных белков», которая была подана 23 апреля 2010, и полное содержание которой вводится в настоящее описание посредством ссылки.
Область, к которой относится изобретение
Настоящее изобретение относится к способам получения гетеромультимерных белков.
Предшествующий уровень техники
Моноклональные антитела типа IgG содержат две идентичных антигенсвязывающих "руки" и константный домен (Fc). Антитела с различной специфичностью своих связывающих "рук" обычно не встречаются в природе, а поэтому они могут быть сконструированы с применением химической технологии (например, химическим методом перекрестного сшивания и т.п.), методов рекомбинантной ДНК и/или технологии слияния клеток.
Биспецифические антитела могут одновременно связываться с двумя различными антигенами. Это их свойство позволяет разработать терапевтические стратегии, которые было бы невозможно осуществить с использованием стандартных моноклональных антител. Широкая панель репрезентативных антител, которые были разработаны в формате биспецифических антител, указывает на огромный интерес специалистов к этим молекулам. См., Berg J., Lotscher E., Steimer K.S., et al., «Bispecific antibodies that mediate killing of cells infected with human immunodeficiency virus of any strain», Proc. Natl. Acad. Sci. USA (1991) 88(11):4723-4727, и Fischer N. and Leger O., "Biospecific Antibodies: Molecules That Enable Novel Therapeutic Strategies", Pathobiology (2007) 74:3-14.
Другим классом мультиспецифических молекул являются рекомбинантные слитые белки. Рекомбинантные слитые белки, состоящие из внеклеточного домена иммунорегуляторных белков и константного домена (Fc) иммуноглобулина (Ig), представляют все увеличивающийся класс терапевтических препаратов, применяемых в медицине. Иммуноадгезины объединяют в себе связывающуюся область последовательности белка с нужной специфичностью и эффекторный домен антитела. Иммуноадгезины обладают двумя ценными свойствами, которые играют важную роль в их активности как терапевтических средств, а именно, они обладают специфичностью к мишени и фармакокинетической стабильностью (время их полужизни in vivo сравнимо с временем полужизни антител). Иммуноадгезины могут быть использованы в качестве антагониста для ингибирования или блокирования нежелательных взаимодействий, или в качестве агониста для имитации или усиления физиологических ответов. См., Chamow S.M., Zhang D.Z., Tan X.Y., et al., «A humanized, bispecific immunoadhesin-antibody that retargets CD3+ effectors to kill HIV-1-infected cells» J. Hematother 1995; 4(5):439-446.
В литературе также обсуждались и другие мультиспецифические молекулы. Так, например, они обсуждаются в публикациях: Fisher et al., Pathobiology (2007) 74:3-14 (обзор различных биспецифических молекул); в патенте США № 6660843, выданном 9 декабря 2003, Feige et al. (пептидные антитела); в публикации патента США № 2002-004587, опубликованного 10 января 2002 (мультиспецифические антитела); в патенте США № 7612181, выданном 3 ноября 2009, Wu et al. (антитела с двумя вариабельными доменами); в патенте США № 6534628, Nord K. et al., Prot Eng (1995) 8:601-608, Nord K. et al., Nat Biotech (1997) 15:772-777, и Grönwall et al., Biotechnol Appl Biochem. (2008) Jun; 50(Pt 2):97-112 (аффинные антитела); Martens et al., Clin Cancer Res (2006), 12:6144-6152 и Jin et al., Cancer Res (2008) 68(11):4360-4368 (антитела с одной «рукой»); Bostrom et al., Science (2009) 323:1610-1614 (Fab с двойным действием, антитела со смешанной валентностью). Специалистам известны антитела и другого типа.
Изготовление клинически чистого материала для получения мультиспецифических молекул, описанных выше, связано с определенными проблемами. Как указывалось выше, существует множество методов получения молекул со смешанными связывающими "руками", то есть со связывающими "руками", которые не являются идентичными друг другу. Каждый из этих методов имеет свои недостатки.
Метод химического перекрестного сшивания является трудоемким, поскольку может возникнуть необходимость очистки релевантных молекул от гомодимеров и других нежелательных побочных продуктов. Кроме того, стадии химической модификации могут приводить к нарушению целостности белков и, тем самым, к снижению их стабильности. Таким образом, этот метод часто является неэффективным и может приводить к потере активности антитела.
Технология слияния клеток (например, гибридомная технология) заключается в экспрессии двух тяжелых и двух легких цепей, случайная сборка которых приводит к образованию 10 комбинаций антител. Нужные гетеромультимерные антитела представляют собой лишь небольшую фракцию продуцируемых таким образом антител. Очистка нужных гетеромультимерных белков приводит к резкому снижению выхода продукта и к повышению затрат на их производство.
Методы рекомбинантных ДНК были применены для получения различных гетеромультимерных белков, например, одноцепочечного Fv, диантител и т.п., которые не содержат Fc-домена. Главным недостатком молекулы антитела этого типа является отсутствие Fc-домена, а следовательно, и способности антитела к индуцированию эффекторной функции (например, активации комплемента, связывания с Fc-рецептором и т.п.). Таким образом, желательно получить такое биспецифическое антитело, которое содержало бы функциональный Fc-домен.
Методы рекомбинантных ДНК были также применены для получения биспецифических антител со структурой «узлы в дырках». См. заявку на патент США 20030078385 (Arathoon et al. - Genentech). Одним из недостатков такой стратегии является то, что легкие цепи двух родительских антител должны быть идентичными для предотвращения ошибочного спаривания и образования нежелательных и/или неактивных молекул в результате их экспрессии в одной и той же клетке.
Таким образом, необходимость в разработке альтернативных способов получения гетеромультимерных белков остается актуальной. И описанное здесь изобретение относится к таким способам. Эти и другие аспекты и преимущества настоящего изобретения будут очевидны из нижеследующего описания.
Краткое описание сущности изобретения
Получение гетеромультимерных белков, например, мультиспецифических антител, с применением современных технологий связано с определенными проблемами, включая получение смеси продуктов, низкий выход и снижение/элиминацию эффекторных функций и т.п. Таким образом, желательно получить эффективные гетеромультимерные белки с высоким выходом.
Различные методы продуцирования молекул антител, по существу, хорошо известны специалистам. В патенте США № 6331415 (Cabilly et al.), например, описан метод рекомбинантного продуцирования иммуноглобулина, в котором тяжелая и легкая цепи экспрессируются одновременно из одного вектора или из двух отдельных векторов, находящихся в одной клетке. В публикации Wibbenmeyer et al. (1999, Biochim Biophys Acta 1430(2):191-202) и Lee & Kwak (2003, J. Biotechnology 101:189-198) описано продуцирование моноклональных антител из отдельно полученных тяжелых и легких цепей с использованием плазмид, экспрессируемых в отдельных культурах E. coli. Различные другие подходящие методы получения антител описаны, например, Harlow, et al., ANTIBODIES: A LABORATORY MANUAL, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., (1988), и в заявке WO2006028936. Кроме того, в каждой из этих работ указаны недостатки, такие как низкий выход, применение химических соединений.
Настоящее изобретение относится к способам экспрессии каждого компонента, например, одной "руки" антитела, гетеромультимерного белка, содержащего шарнирную область, в отдельной клетке-хозяине, и сборки гетеромультимерного белка, содержащего шарнирную область, например, мультиспецифического антитела, без добавления восстановителя.
Настоящее изобретение относится к простому и эффективному способу/экономически выгодному способу получения гетеромультимерных белков, например, мультиспецифических антител.
Настоящее изобретение относится к эффективным и новым способам получения мультиспецифических иммуноглобулиновых комплексов (например, мультиспецифических антител) и других мультимерных белков (в целом называемых здесь «гетеромультимерными белками»), где указанные способы не имеют ограничений, присущих традиционным методам. Гетеромультимерные белки, такие как биспецифические антитела, могут быть получены в виде высокогомогенного гетеромультимерного полипептида способами согласно изобретению. Кроме того, описанные здесь способы не требуют добавления восстановителя для образования по меньшей мере одной, по меньшей мере двух, по меньшей мере трех и по меньшей мере четырех межцепьевых дисульфидных связей в гетеромультимерном белке.
В первом аспекте изобретения описанный здесь способ позволяет получить гетеромультимерный белок, включающий первый полипептид, содержащий шарнирную область и имеющий первый домен гетеродимеризации, и второй полипептид, содержащий шарнирную область и имеющий второй домен гетеродимеризации, где указанный второй домен гетеродимеризации взаимодействует с указанным первым доменом гетеродимеризации, и где первый и второй полипептиды, содержащие шарнирную область, связаны друг с другом по меньшей мере одной межцепьевой дисульфидной связью; причем указанный способ включает стадии:
(a) культивирования первой клетки-хозяина, содержащей первую нуклеиновую кислоту, кодирующую первый полипептид, содержащий шаринирную область, в условиях, при которых экспрессируется полипептид, содержащий шарнирную область;
(b) культивирования второй клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую второй полипептид, содержащий шаринирную область, в условиях, при которых экспрессируется полипептид, содержащий шарнирную область;
(c) разрушения клеточных мембран в целях высвобождения первого и второго полипептидов, содержащих шарнирную область, во внеклеточную среду, где первая и вторая клетки-хозяева были объединены в одну суспензию; и
(d) выделения гетеромультимерного белка,
где указанный способ не требует добавления восстановителя.
Во втором аспекте настоящее изобретение относится к способу получения гетеромультимерного белка, включающего первый полипептид, содержащий шарнирную область и имеющий первый домен гетеродимеризации, и второй полипептид, содержащий шарнирную область и имеющий второй домен гетеродимеризации, где указанный второй домен гетеродимеризации взаимодействует с указанным первым доменом гетеродимеризации, и где первый и второй полипептиды, содержащие шарнирную область, связаны друг с другом по меньшей мере одной межцепьевой дисульфидной связью; причем указанный способ включает стадии:
(a) получения очищенного первого полипептида, содержащего шарнирную область и имеющего первый домен гетеродимеризации;
(b) получения очищенного второго полипептида, содержащего шарнирную область и имеющего второй домен гетеродимеризации;
(c) объединения первого и второго полипептидов, содержащих шарнирную область;
(d) рефолдинга первого полипептида, содержащего шарнирную область, со вторым полипептидом, содержащим шарнирную область; и
(e) выделения комплекса гетеромультимерного белка.
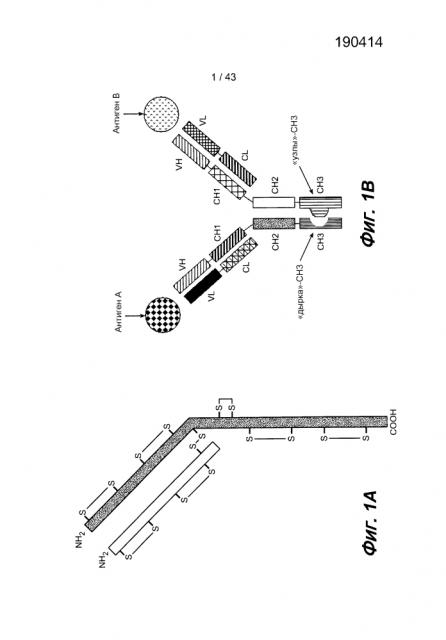
В третьем аспекте настоящее изобретение относится к способу получения гетеромультимерного белка, где указанный способ включает инкубирование первой пары полипептидов тяжелой и легкой цепи иммуноглобулина и второй пары полипептидов тяжелой и легкой цепи иммуноглобулина в условиях, позволяющих осуществлять мультимеризацию первой и второй пары полипептидов с образованием по существу гомогенной популяции антител, где указанные условия не требуют добавления восстановителя; где первая пара полипептидов обладает способностью связываться с первой мишенью; вторая пара полипептидов обладает способностью связываться со второй молекулой-мишенью; и где Fc-полипептид первого полипептида тяжелой цепи и Fc-полипептид второго полипептида тяжелой цепи встречаются на интерфейсе, и интерфейс второго Fc-полипептида содержит выступ, который может входить в полость интерфейса первого Fc-полипептида.
В четвертом аспекте настоящее изобретение относится к способу создания комбинаторной библиотеки гетеромультимерных белков, включающей первый полипептид, содержащий шарнирную область и имеющий первый домен гетеродимеризации, и второй полипептид, содержащий шарнирную область и имеющий второй домен гетеродимеризации, где указанный второй домен гетеродимеризации взаимодействует с указанным первым доменом гетеродимеризации, и где первый и второй полипептиды, содержащие шарнирную область, связаны друг с другом по меньшей мере одной межцепьевой дисульфидной связью; причем указанный способ включает стадии:
(a) культивирования первой клетки-хозяина и по меньшей мере двух дополнительных клеток-хозяев, где:
a. указанная первая клетка-хозяин включает первую нуклеиновую кислоту, кодирующую полипептид, содержащий первый домен гетеродимеризации, и
b. указанные дополнительные клетки-хозяева включают нуклеиновую кислоту, кодирующую полипептид, содержащий второй домен гетеродимеризации,
(b) объединения первой и по меньшей мере двух дополнительных клеток-хозяев;
(c) обработки указанных клеток так, чтобы первый и второй полипептиды, содержащие домен гетеродимеризации, высвобождались во внеклеточную среду; и
(d) выделения гетеромультимерных белков,
где указанный способ не требует добавления восстановителя.
В пятом аспекте настоящее изобретение относится к гетеромультимерным белкам, полученным описанными здесь способами.
Следует отметить, что способы согласно изобретению могут включать и другие стадии, которые представляют собой рутинные стадии, обычно осуществляемые для инициации и/или завершения процессов, проводимых описанными здесь способами согласно изобретению. Так, например, в одном из вариантов изобретения, стадию (a) в способе согласно изобретению проводят после стадии, в которой нуклеиновую кислоту, кодирующую первый полипептид, содержащий шарнирную область, вводят в первую клетку-хозяина, а нуклеиновую кислоту, кодирующую второй полипептид, содержащий шарнирную область, вводят во вторую клетку-хозяина. В одном из вариантов изобретения способы согласно изобретению также включают стадию очистки гетеромультимерных белков, обладающих специфичностью связывания по меньшей мере с двумя различными мишенями. В одном из вариантов изобретения до проведения стадии очистки гетеромультимерных белков, не более чем примерно 10%, 15% или 20% выделенных полипептидов присутствует в виде мономеров или димеров «тяжелая цепь-легкая цепь».
В одном из вариантов изобретения первый и/или второй полипептид, содержащий шарнирную область, представляет собой тяжелую цепь антитела. В другом варианте изобретения тяжелую цепь антитела спаривают с легкой цепью антитела, в результате чего получают пару «тяжелая цепь-легкая цепь». В некоторых вариантах изобретения пара «тяжелая цепь-легкая цепь» связана ковалентной связью. В другом варианте изобретения пара «тяжелая цепь-легкая цепь» определяет мишень-связывающую «руку». В некоторых вариантах изобретения мишень-связывающие "руки" являются идентичными. В некоторых вариантах изобретения каждая мишень-связывающая «рука» распознает две различные мишени.
В некоторых вариантах изобретения первый и/или второй полипептид, содержащий шарнирную область, включает Fc-область. В другом варианте изобретения первый и/или второй полипептид, содержащий шарнирную область, включает по меньшей мере один константный домен тяжелой цепи. В другом варианте изобретения первый и/или второй полипептид, содержащий шарнирную область, включает вариабельный домен тяжелой цепи. В другом варианте изобретения первый и/или второй полипептид, содержащий шаринирную область, включает рецептор-связывающий домен. В некоторых вариантах изобретения первый и/или второй полипептид, содержащий шарнирную область, являются по существу идентичными (то есть, домен гетеродимеризации не может быть идентичен областям, находящимся за пределами домена гетеродимеризации). В некоторых вариантах изобретения первый и/или второй полипептид, содержащие шарнирную область, не являются идентичными.
В некоторых вариантах изобретения гетеромультимерный белок выбран из группы, состоящей из антитела, биспецифического антитела, мультиспецифического антитела, антитела с одной «рукой», моноспецифического одновалентного антитела, мультиспецифического одновалентного антитела, биспецифического максиантитела, моноантитела, иммуноадгезина, пептидного антитела, биспецифического пептидного антитела, одновалентного пептидного антитела, аффинного антитела и гибрида «рецептор-белок».
В некоторых вариантах изобретения указанные гетеромультимерные белки содержат шарнирную область, которая имеет по меньшей мере один, по меньшей мере два, по меньшей мере три, по меньшей мере четыре или любое целое число цистеиновых остатков, которые обычно образуют дисульфидную связь между тяжелыми цепями. В некоторых вариантах изобретения дополнительные цистеины были введены в шарнирную область.
Гетеромультимерный белок согласно изобретению может также представлять собой фрагмент антитела, такой как, например, Fc или Fc-слитый полипептид, при условии, что он будет содержать шарнирную область иммуноглобулина. Fc-слитый полипептид обычно содержит Fc-полипептид (или его фрагмент), слитый с гетерологичной полипептидной последовательностью (такой как антигенсвязывающий домен), такой как внеклеточный домен рецептора (ECD), слитый с Fc-полипептидом иммуноглобулина (например, ECD Flt-рецептора, слитый с Fc IgG2). Так, например, в одном из вариантов изобретения, Fc-слитый полипептид содержит VEGF-связывающий домен, который может представлять собой рецептор VEGF, включающий flt, flk и т.п. Гетеромультимерный белок согласно изобретению обычно содержит константный домен тяжелой цепи и константный домен легкой цепи. В одном из вариантов изобретения гетеромультимерный белок согласно изобретению включает модификацию (например, такую как, но не ограничивающуюся ими, инсерция одной или нескольких аминокислот, например, с образованием последовательности димеризации, такой как «лейциновая застежка»), введенную для обеспечения димеризации или мультимеризации тяжелых цепей. В некоторых вариантах изобретения часть Fc-полипептида (но не весь полипептид) может отсутствовать в гетеромультимере согласно изобретению, при условии, что он будет сохранять шарнирную область иммуноглобулина. В некоторых из этих вариантов отсутствующей последовательностью Fc-полипептида является часть CH2- и/или CH3-доменов или полноразмерные CH2- и/или CH3-домены. В некоторых из этих вариантов, гетеромультимерный белок содержит домен димеризации (такой как последовательность «лейциновая застежка»), например, присоединенный к C-концу фрагмента тяжелой цепи. В некоторых из этих вариантов гетеромультимерный белок содержит домен димеризации, в который были введены мутации с образованием домена димеризации «узлы в дырках» (более подробное определение см. ниже).
В некоторых вариантах способов и гетеромультимерных белков согласно изобретению, полипептиды, содержащие шарнирную область, обладают по меньшей мере одним свойством, которое способствует гетеромеризации и при этом минимизирует гомодимеризацию первого и второго полипептидов, содержащих шарнирную область (например, между Fc-полипептидами тяжелых цепей). Такое(ие) свойство(а) способствует(ют) повышению выхода и/или чистоты и/или гомогенности группы гетеромультимерных белков, полученных описанными здесь способами согласно изобретению. В одном из вариантов изобретения Fc-полипептиды первого и второго полипептидов, содержащих шарнирную область, встречаются/взаимодействуют на интерфейсе. В некоторых вариантах изобретения, где Fc-полипептиды первого и второго полипептидов, содержащих шарнирную область, встречаются на интерфейсе, указанный интерфейс второго Fc-полипептида включает выступ, который может быть помещен в полость в интерфейсе первого Fc-полипептида. В одном из вариантов изобретения первый Fc-полипептид был модифицирован путем изменения матричного/исходного полипептида так, чтобы он содержал полость, либо второй Fc-полипептид был модифицирован путем изменения матричного/исходного полипептида так, чтобы он содержал выступ, либо то и другое. В одном из вариантов изобретения первый Fc-полипептид был модифицирован путем изменения матричного/исходного полипептида так, чтобы он содержал полость, а второй Fc-полипептид был модифицирован путем изменения матричного/исходного полипептида так, чтобы он содержал выступ, или то и другое. В одном из вариантов изобретения интерфейс второго Fc-полипептида содержит выступ, который может быть помещен в полость в интерфейсе первого Fc-полипептида, где указанные полость или выступ или то, и другое были введены в интерфейс первого и второго Fc-полипептидов, соответственно. В некоторых вариантах изобретения, где первый и второй Fc-полипептиды встречаются на интерфейсе, указанный интерфейс первого Fc-полипептида содержит выступ, который может быть помещен в полость в интерфейсе второго Fc-полипептида. В одном из вариантов изобретения второй Fc-полипептид был модифицирован путем изменения матричного/исходного полипептида так, чтобы он содержал полость, либо первый Fc-полипептид был модифицирован путем изменения матричного/исходного полипептида так, чтобы он содержал выступ или то, и другое. В одном из вариантов изобретения второй Fc-полипептид был модифицирован путем изменения матричного/исходного полипептида так, чтобы он содержал полость, а первый Fc-полипептид был модифицирован путем изменения матричного/исходного полипептида так, чтобы он содержал выступ, или то и другое. В одном из вариантов изобретения интерфейс первого Fc-полипептида содержит выступ, который может быть помещен в полость в интерфейсе второго Fc-полипептида, где указанные выступ или полость или то, и другое были введены в интерфейс первого и второго Fc-полипептидов, соответственно.
В одном из вариантов изобретения каждый выступ и каждая полость содержит природный аминокислотный остаток. В одном из вариантов изобретения Fc-полипептид, содержащий выступ, получают путем замены исходного остатка из интерфейса матричного/исходного полипептида «импортным» остатком, имеющим более крупную боковую цепь, чем исходный остаток. В одном из вариантов изобретения Fc-полипептид, содержащий выступ, получают способом, включающим стадию, в которой нуклеиновую кислоту, кодирующую исходный остаток из интерфейса указанного полипептида, заменяют нуклеиновой кислотой, кодирующей «импортный» остаток, имеющий более крупную боковую цепь, чем исходный остаток. В одном из вариантов изобретения исходным остатком является треонин. В одном из вариантов изобретения «импортным» остатком является аргинин (R). В одном из вариантов изобретения «импортным» остатком является фенилаланин (F). В одном из вариантов изобретения «импортным» остатком является тирозин (Y). В одном из вариантов изобретения «импортным» остатком является триптофан (W). В одном из вариантов изобретения «импортным» остатком являются R, F, Y или W. В одном из вариантов изобретения выступ получают путем замены двух или более остатков в матричном/исходном полипептиде. В одном из вариантов изобретения в Fc-полипептиде, содержащем выступ, треонин в положении 366 был заменен триптофаном, где аминокислоты пронумерованы в соответствии с Европейской системой нумерации (EU), Kabat et al. (pp. 688-696 in Sequences of proteins of immunological interest, 5th ed., Vol. 1 (1991; NIH, Bethesda, MD)).
В некоторых вариантах изобретения Fc-полипептид, содержащий полость, получают путем замены исходного остатка в интерфейсе матричного/исходного полипептида «импортным» остатком, имеющим менее крупную боковую цепь, чем исходный остаток. Так, например, Fc-полипептид, содержащий полость, может быть получен способом, включающим стадию, в которой нуклеиновую кислоту, кодирующую исходный остаток из интерфейса указанного полипептида, заменяют нуклеиновой кислотой, кодирующей «импортный» остаток, имеющий менее крупную боковую цепь, чем исходный остаток. В одном из вариантов изобретения исходным остатком является треонин. В одном из вариантов изобретения исходным остатком является лейцин. В одном из вариантов изобретения исходным остатком является тирозин. В одном из вариантов изобретения «импортный» остаток не является цистеином (C). В одном из вариантов изобретения «импортным» остатком является аланин (A). В одном из вариантов изобретения «импортным» остатком является серин (S). В одном из вариантов изобретения,«импортным» остатком является треонин (T). В одном из вариантов изобретения «импортным» остатком является валин (V). Полость может быть получена путем замены одного или нескольких исходных остатков матричного/исходного полипептида. Так, например, в одном из вариантов изобретения, Fc-полипептид, содержащий полость, имеет замену двух или более исходных аминокислот, выбранных из группы, состоящей из треонина, лейцина и тирозина. В одном из вариантов изобретения Fc-полипептид, включающий полость, содержит два или более «импортных остатков», выбранных из группы, состоящей из аланина, серина, треонина и валина. В некоторых вариантах изобретения Fc-полипептид, содержащий полость, имеет замену двух или более исходных аминокислот, выбранных из группы, состоящей из треонина, лейцина и тирозина, и где указанные исходные аминокислоты были заменены «импортными» остатками, выбранными из группы, состоящей из аланина, серина, треонина и валина. В одном из вариантов изобретения в Fc-полипептиде, содержащем полость, треонин в положении 366 был заменен серином, где аминокислоты пронумерованы в соответствии с Европейской системой нумерации (EU), Kabat et al., см. выше. В одном из вариантов изобретения, в Fc-полипептиде, содержащем полость, лейцин в положении 368 был заменен аланином, где аминокислоты пронумерованы в соответствии с Европейской системой нумерации (EU), Kabat et al., см. выше. В одном из вариантов изобретения в Fc-полипептиде, содержащем полость, тирозин в положении 407 был заменен валином, где аминокислоты пронумерованы в соответствии с Европейской системой нумерации (EU), Kabat et al., см. выше. В одном из вариантов изобретения Fc-полипептид, содержащий полость, имеет две или более аминокислотных замен, выбранных из группы, состоящей из T366S, L368A и Y407V, где аминокислоты пронумерованы в соответствии с Европейской системой нумерации (EU), Kabat et al., см. выше. В некоторых вариантах этих фрагментов антител, в Fc-полипептиде, содержащем выступ, треонин в положении 366 был заменен триптофаном, где аминокислоты пронумерованы в соответствии с Европейской системой нумерации (EU), Kabat et al., см. выше.
В различных вариантах изобретения Fc-полипептид первого и второго полипептидов тяжелой цепи могут быть, а могут и не быть идентичными, при условии, что они будут обладать способностью к димеризации с образованием Fc-области (определенной в настоящем описании). Первый Fc-полипептид обычно тесно связан с одним или несколькими доменами тяжелой цепи иммуноглобулина в одном полипептиде, например, с последовательностями шарнирной области, константного и/или вариабельного доменов. В одном из вариантов изобретения первый Fc-полипептид содержит по меньшей мере часть последовательности шарнирной области (включая всю эту последовательность), по меньшей мере часть CH2-домена (включая весь этот домен) и/или по меньшей мере часть CH3-домена (включая весь этот домен). В одном из вариантов изобретения первый Fc-полипептид содержит последовательность шарнирной области и CH2- и CH3-домены иммуноглобулина. В одном из вариантов изобретения второй Fc-полипептид содержит по меньшей мере часть последовательности шарнирной области (включая всю эту последовательность), по меньшей мере часть CH2-домена (включая весь этот домен) и/или по меньшей мере часть CH3-домена (включая весь этот домен). В одном из вариантов изобретения второй Fc-полипептид содержит последовательность шарнирной области и CH2- и CH3-домены иммуноглобулина. В одном из вариантов изобретения антитело согласно изобретению содержит первый и второй Fc-полипептиды, каждый из которых включает по меньшей мере часть по меньшей мере одного константного домена антитела. В одном из вариантов изобретения константный домен антитела представляет собой CH2- и/или CH3-домен. В любом из вариантов антитела согласно изобретению, которое содержит константный домен, указанный константный домен антитела может происходить от иммуноглобулина любого класса, например, IgG. Источником иммуноглобулина может быть иммуноглобулин любого подходящего вида (например, IgG может быть человеческим IgG1) или синтетический иммуноглобулин.
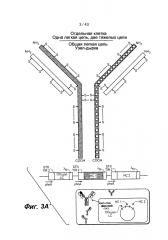
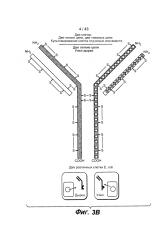
В одном из вариантов изобретения первый полипептид легкой цепи и второй полипептид легкой цепи в первой и второй связывающейся с молекулой-мишенью "руки" антитела согласно изобретению, соответственно, включают детерминанты, связывающиеся с другим/отличающимся антигеном (например, другие/отличающиеся последовательности вариабельного домена). В одном из вариантов изобретения первый полипептид легкой цепи и второй полипептид легкой цепи в первой и второй связывающейся с молекулой-мишенью "руке" антитела согласно изобретению, соответственно, включают одну и ту же (то есть, общую) антигенсвязывающую детерминанту, например, одну и ту же последовательность вариабельного домена.
Способы согласно изобретению позволяют получить гетеромультимерные молекулы с высокой гомогенностью. Настоящее изобретение относится к способам, в которых по меньшей мере примерно 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% полипептидов присутствует в комплексе, содержащем первую пару полипептидов тяжелой и легкой цепей и вторую пару полипептидов тяжелой и легкой цепей. В одном из вариантов настоящее изобретение относится к способам, в которых примерно 60-99%, 70-98%, 75-97%, 80-96%, 85-96% или 90-95% полипептидов присутствует в комплексе, содержащем первую пару полипептидов тяжелой и легкой цепей и вторую пару полипептидов тяжелой и легкой цепей.
В одном из вариантов изобретения антитело согласно изобретению выбрано из группы, состоящей из IgG, IgE, IgA, IgM и IgD. В некоторых вариантах изобретения шарнирная область антитела согласно изобретению предпочтительно представляет собой шарнирную область иммуноглобулина, выбранного из группы, состоящей из IgG, IgA и IgD. Так, например, в некоторых вариантах изобретения, антитело или шарнирная область антитела представляют собой антитело или шарнирную область IgG, которым, в некоторых вариантах изобретения, является IgG1 или IgG2 (например, IgG2a или IgG2b). В некоторых вариантах изобретения антитело согласно изобретению выбрано из группы, состоящей из IgG, IgA и IgD. В одном из вариантов изобретения указанное антитело является человеческим, гуманизованным, химерным или нечеловеческим (например, мышиным).
Гетеромультимерные белки согласно изобретению по существу обладают способностью связываться, предпочтительно, специфически, с антигенами. Такими антигенами являются, например, опухолевые антигены, факторы регуляции выживания клеток, факторы регуляции пролиферации клеток, молекулы, ассоциированные с развитием или дифференцировкой ткани (например, молекулы, которые, как известно или как предполагается, играют определенную роль в таких функциях), молекулы клеточной поверхности, лимфокины, цитокины, молекулы, участвующие в регуляции клеточного цикла, молекулы, участвующие в васкулогенезе, и молекулы, ассоциированные с ангиогенезом (например, молекулы, которые, как известно или как предполагается, играют определенную роль в ангиогенезе). Антигеном, с которым может связываться гетеромультимерный белок согласно изобретению, может быть член субсерии антигенов одной из вышеупомянутых категорий, где другая(ие) субсерия(и) указанной категории содержит(ат) другие молекулы/антигены, обладающие отличающимися свойствами (по отношению к представляющему интерес антигену). Предполагается, что представляющий интерес антиген может также принадлежать к двум или более категориям. В одном из вариантов настоящее изобретение относится к гетеромультимерному белку, который связывается, предпочтительно специфически, с опухолевым антигеном, который не является молекулой клеточной поверхности. В одном из вариантов изобретения опухолевым антигеном является молекула клеточной поверхности, такая как полипептид рецептора. Другим примером, в некоторых вариантах изобретения, может служить гетеромультимерный белок согласно изобретению, который связывается, предпочтительно специфически, с опухолевым антигеном, который не является фактором дифференцировки кластеров. Другим примером может служить гетеромультимерный белок согласно изобретению, который обладает способностью связываться, предпочтительно специфически, с фактором дифференцировки кластеров, который, в некоторых вариантах изобретения, не является, например, CD3 или CD4. В некоторых вариантах изобретения, гетеромультимерным белком согласно изобретению является анти-VEGF антитело. В некоторых вариантах изобретения гетеромультимерным белком согласно изобретению является биспецифическое антитело, выбранное из группы, состоящей из IL-1альфа/IL-1бета, IL-12/IL-18; IL-13/IL-9; IL- 13/IL-4; IL-13/IL-5; IL-5/IL-4; IL-13/IL-lбета; IL-13/IL-25; IL-13/TARC; IL-13/MDC; IL-13/MEF; IL-13/TGF-β; агониста IL-13/LHR; IL-12/TWEAK, IL-13/CL25; IL-13/SPRR2a; IL-13/SPRR2b; IL-13/ADAM8, IL-13/PED2, IL17A/IL17F, CD3/CD19, CD138/CD20; CD138/CD40; CD19/CD20; CD20/CD3; CD38/CD138; CD38/CD20; CD38/CD40; CD40/CD20; CD-8/IL-6; CD20/BR3, TNFальфа/TGFбета, TNFальфа/IL-1бета; TNFальфа/IL-2, TNFальфа/IL-3, TNFальфа/IL-4, TNFальфа/IL-5, TNFальфа/IL6, TNFальфа/IL8, TNFальфа/IL-9, TNFальфа/IL-10, TNFальфа/IL-11, TNFальфа/IL-12, TNFальфа/IL-13, TNFальфа/IL-14, TNFальфа/IL-15, TNFальфа/IL-16, TNFальфа/IL-17, TNFальфа/IL-18, TNFальфа/IL-19, TNFальфа/IL-20, TNFальфа/IL-23, TNFальфа/IFNальфа, TNFальфа/CD4, TNFальфа/VEGF, TNFальфа/MIF, TNFальфа/ICAM-1, TNFальфа/PGE4, TNFальфа/PEG2, лиганда TNFальфа/RANK, TNFальфа/Te38; TNFальфа/BAFF; TNFальфа/CD22; TNFальфа/CTLA-4; TNFальфа/GP130; TNFα/IL-12p40; VEGF/HER2, VEGF-A/HER2, VEGF-A/PDGF, HER1/HER2, VEGF-A/VEGF-C, VEGF-C/VEGF-D, HER2/DR5, VEGF/IL-8, VEGF/MET, рецептора VEGFR/MET, VEGFR/EGFR, HER2/CD64, HER2/CD3, HER2/CD16, HER2/HER3; EGFR/HER2, EGFR/HER3, EGFR/HER4, IL-13/CD40L, IL4/CD40L, TNFR1/IL-1R, TNFR1/IL-6R, TNFR1/IL-18R, EpCAM/CD3, MAPG/CD28, EGFR/CD64, CSPGs/RGM A; CTLA-4/BTNO2; IGF1/IGF2; IGF1/2/Erb2B; MAG/RGM A; NgR/RGM A; NogoA/RGM A; OMGp/RGM A; PDL-I/CTLA-4; и RGM A/RGM B, IL1β/IL18, NRP1A/VEGFA, VEGFA/NRP2, cMET/EGFR, ALK1/BMP9, VEGFA/α5β1, HER1/HER3-BU и CMV. В некоторых вариантах изобретения гетеромультимерный белок согласно изобретению связывается по меньшей мере с двумя молекулами-мишенями, выбранными из группы, состоящей из α5β1, ALK1, BMP9, IL-1альфа, IL-1бета, TARC, MDC, MEF, TGF-β, агониста LHR, TWEAK, CL25, SPRR2a, SPRR2b, ADAM8, PED2, CD3, CD4, CD16, CD19, CD20, CD22, CD28, CD40, CD38, CD64, CD138, CD-8, BR3, TNFальфа, TGF-бета, IL-2, IL-3, IL-4, IL-5, IL-6, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-14, IL-15, IL-16, IL-17, IL-17A, IL-17F, IL-18, IL-19, IL-20, IL-23, IL-25, IFNальфа, MIF, ICAM-1, PGE4, PEG2, лиганда RANK, Te38, BAFF, CTLA-4, GP130, IL-12p40, VEGF, VEGF-A, PDGF, HER1, HER2, HER3, HER3-BU, HER4, VEGF-C, VEGF-D, DR5, cMET, MET, рецептора MET, VEGFR, EGFR, CD40L, TNFR1, IL-1R, IL-6R, IL-18R, EpCAM, MAPG, CSPGs, BTNO2, IGF1, IGF2, IGF1/2, Erb2B, MAG, NgR, NogoA, NRP1, NRP2, OMGp, PDL-I, RGM A и RGM B. В некоторых вариантах изобретения гетеромультимерный белок согласно изобретению связывается с CD3 и по меньшей мере с одной дополнительной молекулой-мишенью, выбранной из BLR1, BR3, CD19, CD20, CD22, CD72, CD79A, CD79B, CD180 (RP105), CR2, FcRH1, FcRH2, FcRH5, FCER2, FCRL4, HLA-DOB и NAG14.
В способах согласно изобретению первая и вторая клетки-хозяева могут быть культивированы в любых условиях, позволяющих экспрессировать и выделять представляющие интерес полипептиды. Так, например, в одном из вариантов изобретения, первую клетку-хозяина и вторую клетку-хозяина в способе согласно изобретению культивируют в виде отдельных клеточных культур. В другом варианте изобретения первую клетку-хозяина и вторую клетку-хозяина в способе согласно изобретению культивируют в виде смешанной культуры, содержащей обе клетки-хозяина.
В некоторых вариантах изобретения, клетки-хозяева, экспрессирующие по меньшей мере один, по меньшей мере два, по меньшей мере три или более дополнительных полипептидов, содержащих шарнирную область, могут быть культивированы в одной и той же культуре или в отдельных культурах в виде первой и/или второй клетки-хозяина, содержащей шарнирную область. В некоторых вариантах изобретения дополнительный(ые) полипептид(ы), содержащий(е) шарнирную область, включает(ют) один и тот же домен гетеродимеризации в виде первого полипептида, содержащего шарнирную область. В некоторых вариантах изобретения дополнительный(ые) полипептид(ы), содержащий(е) шарнирную область, включает(ют) один и тот же домен гетеродимеризации в виде второго полипептида, содержащего шарнирную область.
Гетеромультимерные белки м