Аффинная хроматография с применением fc-рецепторов
Иллюстрации
Показать всеИзобретение относится к области биохимии. Описано изобретение, включающее применение иммобилизованного нековалентного комплекса неонатального Fc-рецептора и бета-2-микроглобулина (b2m), связанного с хроматографическим материалом, в качестве лиганда для аффинной хромотографии при аффинной хромотографии с восходящим линейным градиентом рН, где нековалентный комплекс неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина (b2m) биотинилирован, а хроматографический материал модифицирован стрептавидином. В одном варианте аффинную хроматографию с восходящим линейным градиентом рН применяют для разделения антител или химерных полипептидов, содержащих, по меньшей мере, Fc-участок. Изобретение расширяет арсенал средств, применяемых в качестве лигандов в аффинной хромотографии с восходящим линейным градиентом рН. 13 з.п. ф-лы, 12 ил., 12 табл., 9 пр.
Реферат
В данном документе описано применение колонки для аффинной хроматографии с иммобилизованным человеческим неонатальным Fc-рецептором в качестве лиганда для аффинной хроматографии.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Иммуноглобулин обычно содержит два так называемых полипептида легкой цепи (две легкие цепи) и два так называемых полипептида тяжелой цепи (две тяжелые цепи). В состав каждого из полипептидов тяжелой и легкой цепи входит вариабельный домен (вариабельный участок) (как правило, N-концевая область полипептидной цепи), содержащий связывающие участки, способные взаимодействовать с антигеном. Каждый из полипептидов легкой и тяжелой цепи содержит константный участок (как правило, в С-концевой области). Константный участок тяжелой цепи опосредует связывание антитела i) с клетками, несущими рецептор для Fc-фрагмента IgG (Fc-гамма рецептор, или FcγR), например, фагоцитами, или ii) с клетками, несущими неонатальный Fc-рецептор (FcRn), также известный как рецептор Брамбелла. Он также опосредует связывание с некоторыми факторами, в т.ч. с факторами классического пути активации комплемента, например, с компонентом C1q.
Неонатальный Fc-рецептор (FcRn) также известен как рецептор, подобный молекулам главного комплекса гистосовместимости (ГКГС) класса I (см. обзор Ward, E.S. and Ober, R.J., Advances in Immunology 103 (2009) 77-115). Исследования показали, что этот рецептор служит для регуляции уровней IgG и его распределения в организме на протяжении взрослой жизни (Ghetie, V., et al., Nat. Biotechnol. 15 (1997) 637-640; Israel, E.J., Immunology 89 (1996) 573-578; Junghans, R.P. and Anderson, C.L., Proc. Natl. Acad. Sci. USA 93 (1996) 5512-5516), а также выполняет множество других функций в различных типах клеток и тканей (см., например, Akilesh, S., et al., Proc. Natl. Acad. Sci. USA 105 (2008) 967-972; Dickinson, B.L., et al., J. Clin. Invest. 104 (1999) 903-911; Kim, H., et al., Invest. Ophthalmol. Vis. Sci. 49 (2008) 2025-2029; Spiekermann, G.M., et al., J. Exp. Med. 196 (2002) 303-310; Zhu, X., et al., J. Immunol. 166 (2001) 3266-3276). Ортологи FcRn выделены у многих биологических видов, включая мышь, крысу, человека, овцу, корову, поссума, свинью и верблюда (Adamski, F.M., et al., Mol. Immunol. 37 (2000) 435-444; Ahouse, J.J., et al., J. Immunol. 151 (1993) 6076-6088; Kacskovics, I., et al., J. Immunol. 164 (2000) 1889-1897; Kacskovics, I., et al., Dev. Comp. Immunol. 30 (2006) 1203-1215; Kandil, E., et al., J. Immunol. 154 (1995) 5907-5918; Mayer, В., et al., Immunology 107 (2002) 288-296; Schnulle, P.M. and Hurley, W.L., Vet. Immunol. Immunopathol. 91 (2003) 227-231; Simister, N.E. and Mostov, K.E., Nature 337 (1989) 184-187; Story, С.М., et al., J. Exp. Med. 180 (1994) 2377-2381), что свидетельствует о том, что данный рецептор присутствует практически у всех видов млекопитающих. Многочисленные функции FcRn обусловлены его способностью «сортировать» IgG, предотвращая его деградацию в лизосомах клеток, и высвобождать связанный IgG после переноса через плазматическую мембрану в процессе экзоцитоза (Ober, R.J., et al., Proc. Natl. Acad. Sci. USA 101 (2004) 11076-11081; Ober, R.J., et al., J. Immunol. 172 (2004) 2021-2029; Prabhat, P., et al., Proc. Natl. Acad. Sci. USA 104 (2007) 5889-5894). Кроме того, благодаря возможности регулировать оборот и поведение IgG in vivo вначале появились сообщения о конструировании антител с увеличенным временем полужизни в организме мышей (Ghetie et al., см. выше), которые придали импульс для развития целой области биофармацевтической индустрии, представляющей особый интерес (DallʹAcqua, W.F., et al., J. Biol. Chem. 281 (2006) 23514-23524; Hinton, P.R., et al., J. Biol. Chem. 279 (2004) 6213-6216; Hinton, P.R., et al., J. Immunol. 176 (2006) 346-356; Shields, R.L., et al., J. Biol. Chem. 276 (2001) 6591-6604).
В WO 2005/047327 описаны варианты полипептидов, связывающихся с неонатальным Fc-рецептором (FcRn), димерные белки, связывающие Fc и способы, относящиеся к ним. Варианты полипептидов с измененной эффекторной функцией описаны в WO 2006/031370. В WO 2009/041643 описан способ изменения изоэлектрической точки антитела вследствие аминокислотной замены в CDR. В WO 2010/048313 описан рекомбинантный FcRn и его варианты для очистки гибридных белков, содержащих Fc. Magistrelli, G., et al. описали надежный способ получения рекомбинантного FcRn в клетках млекопитающих, обеспечивающий его упорядоченную иммобилизацию для исследований связывания IgG (J. Immunol. Meth. in press, available online 12.09.2011).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Один из аспектов данного описания представляет собой применение иммобилизованного нековалентного комплекса неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина (b2m) в качестве лиганда для аффинной хроматографии.
Обнаружили, что способы/применения, описанные в данном документе, позволяют разделить, выделить близкородственные виды антител, т.е. различающиеся по одному или по небольшому количеству аминокислотных остатков, и охарактеризовать их свойства in vivo.
Таким образом, различные виды антител, т.е. различающиеся на один аминокислотный остаток, выделенные с помощью описанного здесь способа, можно применять для определения/идентификации аминокислотных остатков, задействованных в связывании FcRn, которые влияют на время полужизни.
Таким образом, способ, описанный в данном документе, позволяет разделять различные варианты одного родительского антитела и определять точное соотношение между такими вариантами, в отличие от известных в настоящее время способов, которые лишь дают информацию о сумме модификаций, а не о каждом виде в отдельности (т.е. для смеси родительского антитела, варианта 1, варианта 2 и варианта 1/2 масс-спектрометрия позволяет определить общее количество молекул, содержащих вариант 1, т.е. вариантов, содержащих единственную модификацию (1), а также вариантов, содержащих обе модификации (1/2)).
Этого можно достичь благодаря i) иммобилизации на хроматографическом носителе полученного рекомбинантным способом FcRn человека вместе с полученным рекомбинантным способом бета-2-микроглобулином человека в сочетании с ii) линейным градиентом pH.
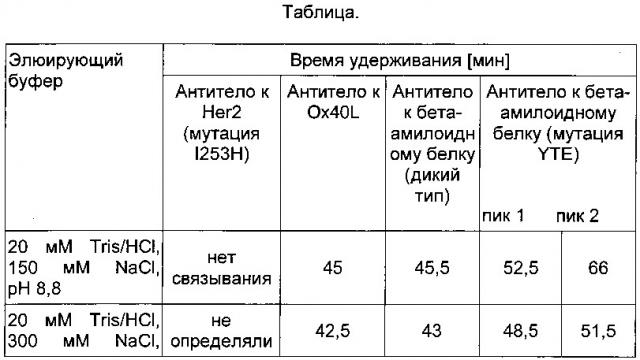
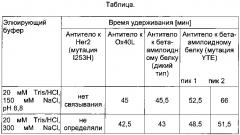
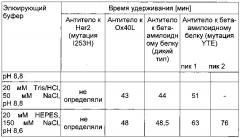
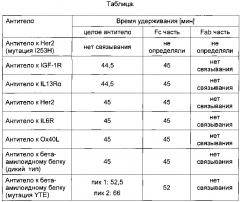
Было обнаружено, что в заданных условиях время удерживания антитела IgG1 дикого типа составляет приблизительно от 42 до 49 минут. В одном воплощении время удерживания антитела или гибридизованного с Fc белка, содержащего Fc-участок подкласса IgG1 дикого типа, составляет приблизительно 45 минут.
Антитело, имеющее модифицированный Fc-участок, слабее связывающийся с FcRn, характеризуется меньшим временем удерживания, тогда как антитело, имеющее модифицированный Fc-участок, прочнее связывающийся с FcRn, характеризуется большим временем удерживания. В одном воплощении нековалентный комплекс неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина (b2m) связан с твердой фазой. В одном воплощении твердая фаза представляет собой хроматографический материал. В одном воплощении нековалентный комплекс неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина (b2m) биотинилирован, а твердая фаза покрыта стрептавидином.
В одном воплощении применяют аффинную хроматографию с градиентом pH. В одном воплощении градиент pH представляет собой изменение pH от первого значения до второго значения, где первое значение pH составляет приблизительно от pH 3,5 приблизительно до pH 7,5, а второе значение pH составляет приблизительно от pH 6,0 приблизительно до pH 9,5. В одном воплощении градиент pH представляет собой градиент с увеличением значения pH или градиент с уменьшением значения pH. В одном воплощении первое значение pH составляет приблизительно pH 5,5, а второе значение pH составляет приблизительно pH 8,8, или первое значение pH составляет приблизительно pH 7,4, а второе значение pH составляет приблизительно pH 6,0.
В одном воплощении бета-2-микроглобулин происходит из того же биологического вида, что и FcRn.
В одном воплощении применение представляет собой определение времени полужизни анитела in vivo путем определения соотношения времени удерживания антитела и референтного антитела.
В одном воплощении применение представляет собой разделение антител или химерных полипептидов, по меньшей мере содержащих Fc-участок.
В одном воплощении применение представляет собой определение окисленного метионина в составе антитела.
В одном воплощении применение представляет собой определение степени олигомеризации антитела.
В одном воплощении применение представляет собой скрининг библиотеки модифицированных антител или модифицированных химерных полипептидов родительского антитела или родительского химерного полипептида, содержащего по меньшей мере связывающую FcRn часть Fc-участка, на модифицированные антитела или модифицированные химерные полипептиды, у которых аффинность связывания с FcRn изменена по сравнению с родительским антителом или родительским химерным полипептидом.
В одном воплощении применение представляет собой выявление антител или химерных полипептидов, содержащих по меньшей мере связывающую FcRn часть Fc-участка, демонстрирующих измененное связывание неонатального Fc-рецептора.
В одном воплощении антитело представляет собой моноспецифическое антитело или фрагмент антитела или химерный полипептид, или биспецифическое антитело или антительный фрагмент химерного полипептида, или триспецифическое антитело или антительный фрагмент химерного полипептида, или тетраспецифическое антитело или антительный фрагмент химерного полипептида.
В одном воплощении применение представляет собой удаление половинных молекул антител из препарата IgG.
В одном воплощении применение представляет собой удаление агрегатов антител и олигомеров антител из препаратов IgG.
Один аспект данного описания представляет собой вариант с модификацией Fc-участка иммуноглобулина человека изотипа IgG1, в котором в позиции 252 произведена замена аминокислоты метионина на гистидин, а в позиции 428 произведена заменена аминокислоты метионина на глутаминовую кислоту.
Один аспект данного описания представляет собой способ отбора антитела с заданным временем полужизни in vivo, в котором проводят хроматографирование и отбирают антитело, у которого время удерживания находится в заданном диапазоне относительно IgG1 дикого типа.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1 Линейная зависимость площади под кривой от внесенного количества антитела при хроматографии с использованием колонки с иммобилизованным FcRn согласно данному описанию.
Фиг. 2 Хроматография анти-IGF-1R антитела дикого типа и с мутацией YTE на колонке с иммобилизованным FcRn согласно данному описанию.
Фиг. 3 Хроматография с применением FcRn (А/В/С верхний ряд) различных препаратов антител с различным содержанием половинных молекул антител, о котором свидетельствуют результаты капиллярного электрофореза в присутствии додецил-сульфата натрия (CE-SDS) (А/В/С нижний ряд).
Фиг. 4 Хроматография с применением FcRn различных препаратов антител с различным содержанием мономеров и агрегатов антител.
Фиг. 5 Зависимость времени удерживания при хроматографии с применением FcRn от количества Fc-участков в молекуле, которая подвергается хроматографическому анализу.
Фиг. 6 Влияние окисления антитела на время удерживания при хроматографии с применением FcRn.
Фиг. 7 Хроматография антитела дикого типа и антитела с мутацией НЕ, распознающих бета-амилоидный белок, на колонке с иммобилизованным FcRn согласно данному описанию.
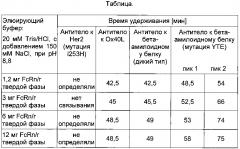
Фиг. 8 Влияние окисления Met252 и Met428 на взаимодействие с FcRn. При загрузке образца антитела IgG1, хранившегося в течение 2 мес при 40°C (кривая 2), в колонку с иммобилизованным FcRn элюирование происходит быстрее и наблюдается два пика, что указывает на присутствие окисленных форм антитела IgG1, тогда как при загрузке образцов антитела IgG1, хранившихся в течение 2 мес при 25°C (кривая 1) и при -80°C (кривая 3), в колонку с иммобилизованным FcRn элюирование происходит медленнее, при этом пики по существу перекрываются. Условия хроматографии: буфер А (20 мМ MES, 150 мМ NaCl, pH 5,5), буфер В (20 мМ HEPES, 150 мМ NaCl, pH 8,2), скорость 0,5 мл/мин, градиент буфер А→буфер В: 60 мин (стандартные условия).
Фиг. 9 Исследование IgG1 антитела, подвергшегося неблагоприятному воздействию, методом поверхностного плазмонного резонанса (SPR, от англ. Surface plasmon resonance). При внесении образца антитела IgG1, хранившегося в течение 2 мес при 40°C, в биосенсор BIAcore для анализа методом SPR получали различные сенсограммы для антител IgG1 дикого типа и с окисленными Met252 и Met428.
Фиг. 10 Влияние агрегатов антител на взаимодействие с FcRn. Анализ исходного образца антитела к IL13Rα, его выделенных мономеров и выделенных агрегатов с помощью хроматографии с применением FcRn. Условия хроматографии: буфер А (20 мМ MES, 150 мМ NaCl, pH 5,5), буфер В (20 мМ Tris/HCl, 150 мМ NaCl, pH 8,8), скорость потока 0,5 мл/мин, градиент буфер А→буфер В: 50 мин (стандартные условия).
Фиг. 11 Исследование агрегатов антитела к IL13Rα методом SPR. Сенсограммы референтного стандарта антитела к IL13Rα, (кривая 1), исходного образца (3), выделенных мономеров антитела к IL13Rα (кривая 2) и выделенных агрегатов антитела к IL13Rα (кривая 4).
Фиг. 12 Влияние мутаций Fc на фармакокинетику у мышей, трансгенных по FcRn. Группы, в каждую из которых входило по 8 животных, получали антитело дикого типа или его вариант с тройной мутацией YTE однократно в виде внутривенной болюсной инъекции в дозе 10 мг/кг. Результаты представлены как среднее ± стандартное отклонение (SD), значимость различий с антителом дикого типа исследовали методом дисперсионного анализа (+++, р<0,001). А: площадь под кривой зависимости сывороточной концентрации от времени в интервале от 0 до 672 ч (AUC(0-672)). В: время полужизни.
СВЕДЕНИЯ, ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Неонатальный Fc-рецептор (FcRn) играет важную роль в метаболизме антител IgG in vivo.
Аффинная хроматография с применением FcRn позволяет разделить образцы IgG по площади их пиков и профилю времени удерживания. С ее помощью можно исследовать взаимодействие между FcRn и IgG in vitro и получить представление о структурных и функциональных особенностях IgG, используемых в терапевтических целях, влияющих на их фармакокинетику in vivo.
Таким образом, аффинную хроматографию с применением FcRn можно использовать как полуколичественный анализ, позволяющий прогнозировать фармакокинетику IgG дикого типа и его мутантных форм in vivo. Кроме того, аффинную хроматографию с применением FcRn можно использовать для изучения взаимодействия между FcRn и IgG, например, для изучения характеристик партий IgG или для проведения сравнительных исследований.
Найдены условия стандартизованного метода жидкостной аффинной хроматографии с применением FcRn и градиента pH, позволяющие воспроизвести механизм взаимодействия между IgG и FcRn in vivo. Человеческий FcRn иммобилизуют на колонке в качестве аффинного лиганда и создают линейный градиент pH, например от pH 5,5 до 8,8.
Например, аналитическая аффинная хроматография с применением FcRn позволяет выявить и охарактеризовать образцы IgG и варианты по паттернам пиков и профилю времени удерживания. Способ позволяет различить 1) одинаковые IgG с различными Fab фрагментами, 2) окисленные и неокисленные формы IgG, 3) агрегаты и мономеры, а также 4) антитела с различиями в области Fc-участка.
Было обнаружено, что при аффинной хроматографии с применением FcRn изменение профиля элюирования вариантов IgG (вариантов с модификациями Fc-участка) относительно профиля IgG дикого типа позволяет спрогнозировать фармакокинетический профиль in vivo. Эти результаты указывают, что аффинная хроматография с применением FcRn является новым способом, который может найти применение в исследовании взаимодействия FcRn-IgG, целостности IgG и главным образом IgG как таковых.
I. Определения
Термин "приблизительно" обозначает диапазон +/-20% от указанного далее численного значения. В одном воплощении термин "приблизительно" обозначает диапазон +/-10% от указанного далее численного значения. В одном воплощении термин "приблизительно" обозначает диапазон +/-5% от указанного далее численного значения.
Термин "модификация" обозначает замену, добавление или делецию одного или нескольких аминокислотных остатков родительского антитела или химерного полипептида, содержащего по меньшей мере связывающую FcRn часть Fc-участка с получением модифицированного антитела или химерного полипептида.
Термин "аминокислотная замена" обозначает замещение по меньшей мере одного существующего аминокислотного остатка другим отличающимся аминокислотным остатком (замещающим аминокислотным остатком). Замещающий аминокислотный остаток может представлять собой "протеиногенный аминокислотный остаток" и быть выбранным из группы, состоящей из аланина (трехбуквенный код: ala, однобуквенный код: А), аргинина (arg, R), аспарагина (asn, N), аспарагиновой кислоты (asp, D), цистеина (cys, С), глутамина (gin, Q), глутаминовой кислоты (glu, Е), глицина (gly, G), гистидина (his, Н), изолейцина (ile, I), лейцина (leu, L), лизина (lys, К), метионина (met, М), фенилаланина (phe, F), пролина (pro, Р), серина (ser, S), треонина (thr, Т), триптофана (trp, W), тирозина (tyr, Y) и валина (val, V).
Термин "вставка аминокислоты" обозначает включение по меньшей мере одного аминокислотного остатка в заданной позиции аминокислотной последовательности. В одном воплощении вставка представляет собой вставку одного или двух аминокислотных остатков. Вставленный(е) аминокислотный(е) остаток (остатки) может (могут) быть протеиногенным(и) и непротеиногенным(и).
Термин "делеция аминокислоты" обозначает удаление по меньшей мере одного аминокислотного остатка в заданной позиции аминокислотной последовательности.
Термин "антитело" в данном описании используется в широком смысле и включает антитела с различной структурой, включая моноклональные антитела, поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела) и фрагменты антител, при условии, что они проявляют способность связывать FcRn.
Термин "буферное вещество" обозначает вещество, которое, будучи в растворе, способно препятствовать изменениям значения pH раствора, например, при добавлении или высвобождении веществ с кислотными или основными свойствами.
Термин "CH2 домен" обозначает часть полипептида тяжелой цепи антитела, которая находится приблизительно между позициями 231 и 340 (нумерация по системе EU согласно Kabat). В одном воплощении CH2 домен имеет аминокислотную последовательность SEQ ID NO: 1: APELLGG PSVFLFPPKP KDTLMISRTP EVTCVWDVS HEDPEVKFNW YVDGVEVHNA KTKPREEQE STYRWSVLT VLHQDWLNGK EYKCKVSNKA LPAPIEKTIS KAK.
Термин "CH3 домен" обозначает часть полипептида тяжелой цепи антитела, которая находится приблизительно между позициями 341 и 446 (нумерация по системе EU). В одном воплощении CH3 домен имеет аминокислотную последовательность SEQ ID NO: 2: GQPREPQ VYTLPPSRDE LTKNQVSLTC LVKGFYPSDI AVEWESNGQP ENNYKTTPPV LDSDGSFFLY SKLTVDKSRW QQGNVFSCSV MHEALHNHYT QKSLSLSPG.
Термин "класс" антитела обозначает тип константного домена или константного участка его тяжелой цепи. Существует пять основных классов антител: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть подразделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, соответствующие различным классам иммуноглобулинов, обозначаются α, δ, ε, γ и μ, соответственно.
Термин "Fc-участок человеческого происхождения" обозначает С-концевую область тяжелой цепи иммуноглобулина человека, имеющую в своем составе по меньшей мере часть шарнирного участка, СН2 домен и СНЗ домен. В одном воплощении Fc-участок тяжелой цепи IgG человека располагается между Cys226 или Pro230 и карбокси-концом тяжелой цепи. В одном воплощении Fc-участок имеет аминокислотную последовательность SEQ ID NO: 10. При этом С-концевой лизин (Lys447) Fc-участка может присутствовать или отсутствовать. Если не указано иначе, нумерация аминокислотных остатков Fc-участка или константного участка приведена в соответствии с системой нумерации EU, также обозначаемой EU индекс, согласно описанию Kabat, Е.А., et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991), NIH Publication 91-3242.
Термин "FcRn" обозначает неонатальный Fc-рецептор человеческого происхождения. Функция FcRn заключается в защите IgG от деградации в лизосомах, в результате приводящей к уменьшению его клиренса и увеличению времени полужизни. FcRn представляет собой гетеродимерный белок, состоящий из двух полипептидов: белка с молекулярной массой 50 кДа, подобного молекулам главного комплекса гистосовместимости класса I (α-FcRn), и β2-микроглобулина (β2m) с молекулярной массой 15 кДа. FcRn связывается с высокой аффинностью с CH2-CH3 частью Fc домена IgG. Взаимодействие между IgG и FcRn строго зависит от pH и характеризуется стехиометрическим соотношением 1:2, при этом одна молекула IgG при помощи двух тяжелых цепей связывается с двумя молекулами FcRn (Huber, А.Н., et al., J. Mol. Biol. 230 (1993) 1077-1083). Связывание FcRn происходит в эндосомах при кислых значениях pH (pH<6,5), а высвобождение IgG происходит на поверхности клеток, обладающих нейтральным значением pH (приблизительно 7,4). pH-зависимая природа взаимодействия способствует защите IgG, проникающих в клетку путем пиноцитоза, от внутриклеточной деградации при связывании с рецептором FcRn в кислой среде эндосом. Затем FcRn способствует возврату IgG на клеточную поверхность и последующему высвобождению в кровоток при экспозиции комплекса FcRn-IgG в окружающую клетку среду с нейтральными значениями pH.
Термин "связывающая FcRn часть Fc-участка" обозначает часть полипептида тяжелой цепи антитела, которая находится приблизительно между позициями EU 243 и EU 261, приблизительно между позициями EU 275 и EU 293, приблизительно между позициями EU 302 и EU 319, приблизительно между позициями EU 336 и EU 348, приблизительно между позициями EU 367 и EU 393, приблизительно в позиции EU 408 и приблизительно между позициями EU 424 и EU 440. В одном воплощении модифицированы один или несколько следующих аминокислотных остатков согласно нумерации EU по Kabat: F243, Р244, Р245 Р, К246, Р247, К248, D249, Т250, L251, М252, I253, S254, R255, Т256, Р257, Е258, V259, Т260, С261, F275, N276, W277, Y278, V279, D280, V282, Е283, V284, Н285, N286, А287, К288, Т289, К290, Р291, R292, Е293, V302, V303, S304, V305, L306, Т307, V308, L309, Н310, Q311, D312, W313, L314, N315, G316, К317, Е318, Y319, I336, S337, К338, А339, К340, G341, Q342, Р343, R344, Е345, Р346, Q347, V348, С367, V369, F372, Y373, Р374, S375, D376, I377, А378, V379, Е380, W381, Е382, S383, N384, G385, Q386, Р387, Е388, N389, Y391, Т393, S408, S424, С425, S426, V427, М428, Н429, Е430, А431, L432, Н433, N434, Н435, Y436, Т437, Q438, К439 и S440 (нумерация EU).
Термин "полноразмерное антитело" обозначает антитело, структура которого по существу схожа со структурой нативного антитела или у которого тяжелые цепи содержат Fc-участок, как описано в данном документе.
Термин "шарнирный участок" обозначает часть полипептида тяжелой цепи антитела, которая связывает CH1 домен и CH2 домен, например, приблизительно от позиции 216 до позиции 230, согласно системе нумерации EU по Kabat. Шарнирный участок обычно представляет собой димер, состоящий из двух полипептидов с идентичной аминокислотной последовательностью. Шарнирный участок обычно содержит приблизительно 25 аминокислотных остатков и обладает подвижностью, что позволяет антигенсвязывающим участкам двигаться независимо. В шарнирном участке можно выделить три домена: верхний, средний и нижний шарнирный домены (Roux, et al., J. Immunol. 161 (1998) 4083).
Термины "клетка-хозяин", "линия клеток-хозяев" и "культура клеток-хозяев" используются взаимозаменяемо и обозначают клетки, в которые была внедрена экзогенная нуклеиновая кислота, включая потомство таких клеток. Клетки-хозяева включают "трансформанты" и "трансформированные клетки", включающие первично трансформированные клетки и их потомков, независимо от числа пассажей. Потомство может быть не полностью идентично родительской клетке по содержанию нуклеиновой кислоты, но может иметь мутации. Сюда также включаются мутантные потомки, обладающие такими же функциями или биологической активностью при скрининге или отборе, как и исходные трансформированные клетки.
"Гуманизированное" антитело обозначает химерное антитело, содержащее аминокислотные остатки гипервариабельных участков (HVR, от англ. hypervariable regions) и аминокислотные остатки каркасных участков (FR, от англ. framework regions). В некоторых воплощениях гуманизированное антитело содержит по существу все из по меньшей мере одного, а обычно двух вариабельных доменов, в которых все или по существу все гипервариабельные участки (например, CDR) соответствуют участкам антитела, не являющегося человеческим, и все или по существу все каркасные участки соответствуют участкам человеческого антитела. Гуманизированное антитело может содержать по меньшей мере часть константного участка антитела, полученного из антитела человека. "Гуманизированная форма" антитела, например, антитела не являющегося человеческим, обозначает антитело, прошедшее гуманизацию.
Термин "гипервариабельный участок" или "HVR", используемый в данном описании, обозначает каждый из участков вариабельного домена антитела, имеющих гипервариабельную последовательность и/или формирующих петли определенной структуры ("гипервариабельные петли"). Как правило, нативные антитела, состоящие из четырех цепей, имеют 6 HVR; три в VH (Н1, Н2, H3), и три в VL (L1, L2, L3). Как правило, HVR содержат аминокислотные остатки гипервариабельных петель и/или "участков определяющих комплементаность" (CDR), последние характеризуются наибольшей вариабельностью последовательности и/или задействованы в распознавании антигена. Приведенные в качестве примера гипервариабельные петли находятся между аминокислотными остатками 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (Н1), 53-55 (Н2) и 96-101 (H3). (Chothia, С. and Lesk, A.M., J. Mol. Biol. 196 (1987) 901-917). Приведенные в качестве примера CDR (CDR-L1, CDR-L2, CDR-L3, CDR-H1, CDR-H2 и CDR-H3) находятся между аминокислотными остатками 24-34 в L1, 50-56 в L2, 89-97 в L3, 31-35В в Н1, 50-65 в Н2 и 95-102 в Н3. (Kabat, Е.А., et al., Sequences of Proteins of Immunological Interest, 5th ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991), NIH Publication 91-3242). Как правило, CDR содержат аминокислотные остатки, образующие гипервариабельные петли, за исключением CDR1 в составе VH. CDR также включают "остатки, определяющие специфичность" или "SDR," которые представляют собой остатки, контактирующие с антигеном. SDR находятся в составе участков CDR, обозначаемых "укороченными CDR", или a-CDR (от англ. abbreviated-CDRs). Приведенные в качестве примера a-CDR (a-CDR-L1, a-CDR-L2, a-CDR-L3, a-CDR-H1, a-CDR-H2 и a-CDR-H3) образованы аминокислотными остатками в положениях 31-34 в L1, 50-55 в L2, 89-96 в L3, 31-35В в Н1, 50-58 в Н2 и 95-102 в Н3 (см. Almagro, J.С. and Fransson, J., Front. Biosci. 13 (2008) 1619-1633). Если не указано иначе, остатки HVR и иные остатки вариабельного домена (например, остатки каркасного участка) в данном документе пронумерованы в соответствии с Kabat et al., см. выше.
"Индивид" или "субъект" является млекопитающим. Млекопитающие включают одомашненных животных (например, коров, овец, кошек, собак и лошадей), приматов (например, людей и не относящихся к человеку приматов, таких как обезьяны), кроликов и грызунов (например, мышей и крыс), но не ограничиваются ими. В определенных воплощениях индивидом или субъектом является человек.
Термин "моноклональное антитело" обозначает антитело, полученное из популяции по существу гомогенных антител, т.е. отдельные антитела, составляющие популяцию, идентичны и/или связывают один эпитоп, за исключением возможных вариантов антител, например, содержащих мутации, которые возникают естественным путем или в ходе получения препарата моноклонального антитела, при этом подобные варианты, как правило, присутствуют в минорных количествах. В противоположность препаратам поликлональных антител, обычно содержащим различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело в препарате моноклональных антител направлено против единственной детерминанты или антигена. Таким образом, определение "моноклональное" указывает на характер антитела, полученного из по существу гомогенной популяции антител, и не должно рассматриваться как необходимость получения антитела определенным способом. Например, моноклональные антитела, предназначенные для применения в соответствии с настоящим изобретением, могут быть произведены с помощью различных технологий, включая гибридомную технологию, технологию рекомбинантной ДНК, технологию фагового дисплея и технологии с использованием трансгенных животных, имеющих все локусы человеческих иммуноглобулинов или их часть, но не ограничиваясь ими; данные способы и другие приведенные в качестве примера способы производства моноклональных антител описаны в данном документе.
"Нативные антитела" обозначают молекулы иммуноглобулинов естественного происхождения с различной структурой. Например, нативные антитела IgG представляют собой гетеротетрамерные гликопротеины с молекулярной массой приблизительно 150000 Дальтон, состоящие из двух идентичных легких цепей и двух идентичных тяжелых цепей, соединенных дисульфидными связями. В направлении от N- к С-концу в каждой тяжелой цепи расположен вариабельный участок (VH), также обозначаемый тяжелым вариабельным доменом или вариабельным доменом тяжелой цепи, за которым следуют три константных домена (СН1, СН2 и CH3). Аналогично, в направлении от N- к С-концу в каждой легкой цепи расположен вариабельный участок (VL), также обозначаемый легким вариабельным доменом или вариабельным доменом легкой цепи, за которым следует легкий константный домен (CL). Легкая цепь антитела может относиться к двум типам, обозначаемым каппа (κ) и лямбда (λ), в зависимости от аминокислотной последовательности ее константного домена.
Термин "непротеиногенный аминокислотный остаток" обозначает аминокислотный остаток, отличный от перечисленных выше протеиногенных аминокислотных остатков, который может быть ковалентно связан с граничащими аминокислотными остатками в полипептидной цепи. Примерами непротеиногенных аминокислотных остатков являются норлейцин, орнитин, норвалин, гомосерин. Другие примеры приведены в публикации Ellman, et al., Meth. Enzym. 202 (1991) 301-336. Примеры способов синтеза непротеиногенных аминокислотных остатков описаны, например, в публикации Noren, et al., Science 244 (1989) 182 и Ellman et al., см. выше.
"Показатель идентичности аминокислотной последовательности (выраженный в процентах)" относительно референтной полипептидной последовательности определяется как процент аминокислотных остатков в кандидатной последовательности, которые идентичны аминокислотным остаткам в референтной полипептидной последовательности после выравнивания последовательностей и расстановки пропусков (гэпов), если это необходимо для достижения наибольшего процента идентичности последовательностей, и без принятия каких-либо консервативных замен за часть идентичной последовательности. Выравнивание в целях определения процента идентичности аминокислотной последовательности может выполняться различными способами, известными в данной области техники, например, с помощью общедоступных компьютерных программ, таких как BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области могут определить надлежащие параметры для выравнивания последовательностей, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Для целей настоящего описания, значения % идентичности аминокислотной последовательности получены при помощи компьютерной программы для сравнения последовательностей ALIGN-2. Компьютерная программа для сравнения последовательностей ALIGN-2 была разработана в компании Genentech, Inc., исходный код был представлен вместе с пользовательской документацией в бюро по охране авторских прав США, Washington D.C., 20559, где было зарегистрировано авторское право под номером TXU510087. Доступ к программе ALIGN-2 можно получить в компании Genentech, Inc., South San Francisco, California, или код программы может быть скомпилирован на основе исходного кода. Программа ALIGN-2 должна быть скомпилирована для работы на платформе UNIX, включая платформу digital UNIX V4.0D. Все параметры для сравнения последовательностей заданы программой ALIGN-2 и остаются неизменными.
В случаях, когда для сравнения аминокислотных последовательностей используется ALIGN-2, процент идентичности заданной аминокислотной последовательности А к последовательности В, с последовательностью В, или по сравнению с заданной аминокислотной последовательностью В (что можно также сформулировать как заданная аминокислотная последовательность А, имеющая или содержащая определенный процент идентичной аминокислотной последовательности к последовательности В, с последовательностью В, или по сравнению с заданной аминокислотной последовательностью В) рассчитывается по формуле:
X/Y×100,
где X это число аминокислотных остатков, которые были расценены программой для выравнивания последовательностей ALIGN-2 как абсолютные совпадения при выравнивании А и В в рамках этой программы, и где Y это общее число аминокислотных остатков в В. Следует принимать во внимание, что когда длина аминокислотной последовательности А не равна длине аминокислотной последовательности В, процент идентичности аминокислотной последовательности А с последовательностью В не будет равен проценту идентичности аминокислотной последовательности В с последовательностью А. Если не указано иначе, все значения % идентичности аминокислотных последовательностей, приведенные в данном документе, получены согласно описанию в предыдущем параграфе о применении компьютерной программы ALIGN-2.
Термин "фармацевтический препарат" относится к препарату, который находится в такой форме, которая обеспечивает эффективное проявление биологической активности содержащегося в нем активного ингредиента, и не содержит дополнительных компонентов, которые являются неприемлемо токсичными для субъекта, которому будет вводиться препарат.
"Фармацевтически приемлемый носитель" относится к ингредиенту в фармацевтическом препарате, отличному от активного ингредиента, который является нетоксичным для субъекта. Фармацевтически приемлемый носитель включает, буфер, эксципиент, стабилизатор или консервант, но не ограничивается ими.
Термин "восходящий линейный градиент pH" обозначает градиент pH, начальная точка которого находится в области низких (т.е. более кислых) значений pH, а конечная точка которого находится в области более высоких (т.е. менее кислых, нейтральных или щелочных) значений pH. В одном воплощении начальная точка восходящего линейного градиента pH соответствует значению pH приблизительно 5,5, а конечная точка соответствует значению pH приблизительно 8,8.
Термин "нисходящий линейный градиент pH" обозначает градиент pH, начальная точка которого находится в области высоких (т.е. нейтральных или щелочных) значений pH, а конечная точка которого находится в области низких (т.е. нейтральных или кислых) значений pH. В одном воплощении начальная точка нисходящего линейного градиента pH соответствует значению pH приблизительно 7,4, а конечная точка соответствует значению pH приблизительно 6,0.
Используемый в данном документе термин "лечение" (и его грамматические производные, такие как "лечить" или "проводить лечение") обозначает клиническое вмешательство в попытке изменить естественный ход заболевания у индивида, получающего лечение, и могут осуществляться как для профилактики, так и при наличии патологического состояния. Желательные эффекты от лечения включают предупреждение возникновения или повторного проявления заболевания, смягчение симптомов, уменьшение любых прямых или непрямых патологических последствий заболевания, предупреждение метастазирования, снижение скорости прогрессирования заболевания, улучшение или временное облегчение состояния, а также ремиссию или улучшение прогноза, но не ограничиваются ими. В некоторых воплощениях антитела по изобретению применяют, чтобы отсрочить развитие заболевания или чтобы замедлить прогрессирование заболевания.
Термин "вариабельный участок" или "вариабельный домен" обозначает домен легкой или тяжелой цепи антитела, задействованный в связывании антитела с антигеном. Вариабельные домены тяжелой и легкой цепей нативного антитела (VH и VL, соответственно), как правило, имеют схожую структуру, каждый домен содержит четыре консервативных каркасных участка (FR) и три гипервариабельных участка (HVR). (См., например, Kindt, T.J., et al., Kuby Immunology, 6th ed., W.H. Freeman and Co., N.Y. (2007), page 91). Для обеспечения специфичности связывания антигена может быть достаточно одного VH или VL домена. Кроме того, антитела, связывающиеся с конкретным антигеном, можно выделить с использованием VH или VL домена антитела, связывающегося с антигеном, при скрининге библиотеки комплементарных доменов VL или VH, соответственно. См., например, Portolano, S., et al., J. Immunol. 150 (1993) 880-887; Clackson, Т., et al., Nature 352 (1991) 624-628).
Термины "вариант", "модифицированное антитело" и "модифицированный химерный полипептид" обозначают молекулы, у которых аминокислотная последовательность отличается от аминокислотной последовательности родительской молекулы. Как правило, такие молекулы имеют одну или несколько модификаций, вставок или делеций. В одном воплощении модифицированное антитело или модифицированный химерный полипептид содержит аминокислотную последовательность, содержащую по меньшей мере часть Fc-участка, не имеющую естественного происхождения. Идентичность последовательностей таких мо