2-карбоксамид циклоамино производные мочевины в комбинации с ингибиторами hsp90 для лечения пролиферативных заболеваний
Иллюстрации
Показать всеГруппа изобретений относится к фармации и онкотерапии. Предложено: фармацевтическая комбинация для лечения меланомы, содержащая: (a) 2-амид 1-({4-метил-5-[2-(2,2,2-трифтор-1,1-диметилэтил)пиридин-4-ил]тиазол-2-ил}амида) (S)-пирролидин-1,2-дикарбоновой кислоты (соединение А) или его фармацевтически приемлемую соль; и (b) по меньшей мере один ингибитор Hsp90, представляющий собой этиламид 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-морфолин-4-илметил-фенил)изоксазол-3-карбоновой кислоты (AUY922), или его фармацевтически приемлемую соль; применение указанной комбинации для получения лекарственного средства для лечения меланомы и соответствующий способ лечения меланомы. Технический результат: синергизм действия соединений комбинации в снижении объёма опухоли. 3 н. и 1 з.п. ф-лы, 9 ил., 2 табл., 6 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к фармацевтической комбинации, содержащей 2-карбоксамид циклоамино производное мочевины формулы (I) и ингибиторы белка теплового шока 90, а также к применению таких комбинаций при лечении пролиферативных заболеваний, более конкретно, PI3K-зависимых заболеваний, более конкретно, PI3K-альфа-зависимых заболеваний.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Метаболический путь PI3K/Akt/mTOR является важным, четко регулируемым путем выживания для нормальной клетки. Фосфатидилинозитол 3-киназы (PI3K) являются широко представленными липидными киназами, которые катализируют перенос фосфата в положение D-3' инозитольных липидов с образованием фосфоинозитол-3-фосфата (PIP), фосфоинозитол-3,4-дифосфата (PIP2) и фосфоинозитол-3,4,5-трифосфата (PIP3). Эти продукты PI3K-катализируемых реакций выступают в качестве вторичных мессенджеров и играют центральные роли в ключевых клеточных процессах, включая рост клеток, дифференциацию, подвижность, пролиферацию и выживание.
Из двух классов 1 PI3K, класс 1A PI3K представляет собой гетеродимеры, состоящие из каталитической p110 субъединицы (α, β, δ изоформы), конструктивно связанной с регуляторной субъединицей, которая может представлять собой p85α, p55α, p50α, p85β или р55γ. Подкласс класса 1B содержит один член семейства, гетеродимер, состоящий из каталитической p110γ субъединицы, связанной с одной из двух регуляторных субъединиц, P101 или P84 (Fruman et al., Annu Rev. Biochem. 67:481 (1998); Suire et al., Curr. Biol. 15:566 (2005)).
Во многих случаях PIP2 и PIP3 рекрутируют AKT к плазматической мембране, где она выступает в качестве узловой точки для многих внутриклеточных сигнальных путей, важных для роста и выживания (Fantl et al., Cell 69:413-423(1992); Bader et al., Nature Rev. Cancer 5:921 (2005); Vivanco и Sawyer, Nature Rev. Cancer 2:489 (2002)). Нарушенная регуляция PI3K, которая часто повышает выживаемость через активацию AKT, является одним из наиболее распространенных событий при злокачественных новообразованиях у человека и, как было показано, происходит на нескольких уровнях. Подавляющий опухоль ген PTEN, который дефосфорилирует фосфоинозитиды в положении 3' инозитольного кольца и тем самым противодействует активности PI3K, функционально исключен в различных видах опухолях. В других опухолях гены для изоформы p110α, PIK3CA и для AKT являются амплифицированными и повышающими экспрессию белка из их генных продуктов, что было продемонстрировано на нескольких злокачественных новообразованиях человека.
Кроме того, соматические миссенс-мутации в PIK3CA, которые активируют дополнительные сигнальные пути, описывались достаточно часто для широкого разнообразия злокачественных новообразований человека (Kang at el., Proc. Natl. Acad. Sci. USA 102:802 (2005); Samuels et al., Science 304:554 (2004); Samuels et al., Cancer Cell 7:561-573 (2005)). Таким образом, известно, что ингибиторы PI3K альфа имеют особое значение при лечении пролиферативного заболевания и других расстройств.
Кроме того, белок теплового шока 90 (Hsp90) признан в качестве мишени для противораковых средств. Hsp90 является весьма распространенным и важным белком, который действует как молекулярный шаперон для обеспечения устойчивости конформации, формы и функции белков-клиентов. Семейство Hsp90 шаперонов включает четыре члена: Hsp90α и Hsp90β, оба локализованы в цитозоле, GRP94 в эндоплазматическом ретикулуме и TRAP1 в митохондриях. Hsp90 является распространенным клеточным шапероном, составляющим примерно 1%-2% общего белка.
Среди белков стресса Hsp90 является уникальным, т.к. он не требуется для биосинтеза большинства полипептидов. Hsp90 образует комплексы с онкогенными белками, называемыми ʺбелки-клиентыʺ, которые являются конформационно лабильными передатчиками сигналов, играющими важную роль в контроле роста, в выживании клеток и в развитии тканей.
Такое связывание предотвращает деградацию этих белков-клиентов. Подсемейство белков-клиентов Hsp90, таких как Raf, AKT, phospho-AKT, CDK4 и семейство EGFR, включающее ErbB2, представляет собой группу онкогенных сигнальных молекул, играющих основную роль в росте, дифференциации и апоптозе клеток, всех процессов, которые играют важную роль для раковых клеток. Ингибирование присущей ему АТФазной активности белка Hsp90 нарушает взаимодействие с белками-клиентами Hsp90, что приводит к их деградации по убиквитин-протеосомному пути.
Шапероны Hsp90, которые характеризуются консервативным АТФ-связывающим сайтом в N-концевом домене, относятся к небольшому подсемейству АТФаз и известны как ДНК-гираза, Hsp90, гистидинкиназа и подсемейство MutL (GHKL). Шапероновая (образование вторичной структуры белков) активность Hsp90 зависит от его АТФазной активности, которая снижается в очищенном ферменте. Однако было установлено, что АТФазная активность Hsp90 повышается при его связывании с белками, так называемыми ко-шаперонами. Таким образом, белки Hsp90 функционируют in vivo в качестве субъединиц крупных, динамичных белковых комплексов. Hsp90 важен для выживания эукариотических клеток и сверхэкспрессирован во многих опухолях.
Несмотря на многочисленные варианты лечения пациентов с пролиферативными заболеваниями, остаются потребность в эффективных и безопасных терапевтических средствах и потребность в их преимущественном применении в комбинационной терапии. Неожиданно было обнаружено, что определенные соединения 2-карбоксамидциклоамино производные мочевины формулы (I), которые были описаны в WO 2010/029082, в комбинации с ингибиторами Hsp90 вызывают сильную анти-пролиферативную активность и in vivo противоопухолевый ответ.
Совместная обработка раковых клеток ингибитором Hsp90 и ингибитором PI3K, в частности, высоко специфическим ингибитором PI3K альфа соединения формулы (I), является особенно эффективной, так как она сочетает в себе ингибирование компонентов проксимальных путей, таких как рецепторные тирозинкиназы (в основном, мишеневые посредством ингибирования Hsp90), с другим ингибитором (PI3K ингибитором), который также действует близко к верхней части сигнального каскада. Дополнительное преимущество ингибирования Hsp90 может возникнуть в результате его действия на другие сигнальные компоненты в метаболическом пути PI3K/Akt/mTOR, как например, на AKT и pAKT, и его широкого действия на многие белки-клиенты.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
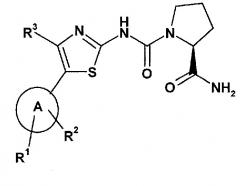
Настоящее изобретение относится к фармацевтической комбинации, содержащей (a) соединение формулы (I)
(I),
где
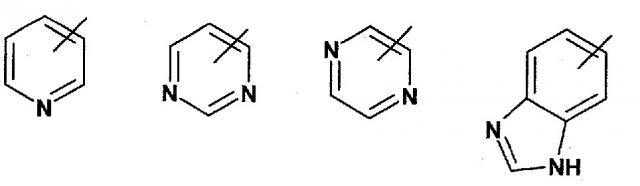
A представляет собой гетероарил, выбранный из группы, состоящей из:
R1 представляет собой один из следующих заместителей: (1) незамещенный или замещенный, предпочтительно, замещенный C1-C7-алкил, где указанные заместители независимо выбраны из одной или нескольких, предпочтительно, из от одной до девяти, следующих групп: дейтерий, фтор, или из от одной до двух следующих групп C3-C5-циклоалкил; (2) необязательно замещенный C3-C5-циклоалкил, где указанные заместители независимо выбраны из одной или нескольких, предпочтительно, из от одной до четырех следующих групп: дейтерий, C1-C4-алкил (предпочтительно, метил), фтор, циано, аминокарбонил; (3) необязательно замещенный фенил, где указанные заместители независимо выбраны из одной или нескольких, предпочтительно, из от одной до двух, следующих групп: дейтерий, галоген, циано, C1-C7-алкил, C1-C7-алкиламино, ди(C1-C7-алкил)амино, C1-C7-алкиламинокарбонил, ди(C1-C7-алкил)аминокарбонил, C1-C7-алкокси; (4) необязательно моно- или дизамещенный амин; где указанные заместители независимо выбраны из следующих групп: дейтерий, C1-C7-алкил (который является незамещенным или замещенным одним или несколькими заместителями, выбранными из группы, включающей дейтерий, фтор, хлор, гидрокси), фенилсульфонил (который является незамещенным или замещенным одним или несколькими, предпочтительно, одним, C1-C7-алкилом, C1-C7-алкокси, ди(C1-C7-алкил)амино-C1-C7-алкокси); (5) замещенный сульфонил; где указанный заместитель выбран из следующих групп: C1-C7-алкил (который является незамещенным или замещенным одним или несколькими заместителями, выбранными из группы из дейтерия, фтора), пирролидино (который является незамещенным или замещенным одним или несколькими заместителями, выбранными из группы из дейтерия, гидрокси, оксо; в частности один оксо); (6) фтор, хлор;
R2 представляет собой водород;
R3 представляет собой (1) водород, (2) фтор, хлор, (3) необязательно замещенный метил, где указанные заместители независимо выбраны из одной или нескольких, предпочтительно, из от одной до трех, следующих групп: дейтерий, фтор, хлор, диметиламино;
при исключении 2-амида 1-({5-[2-(трет-бутил)пиримидин-4-ил]-4-метилтиазол-2-ил}амида) (S)пирролидин-1,2-дикарбоновой кислоты,
или его фармацевтически приемлемую соль; и (b) по меньшей мере, один ингибитор Hsp90 или его фармацевтически приемлемую соль. Такая комбинация может быть предназначена для одновременного, раздельного или последовательного использования при лечении пролиферативного заболевания.
В предпочтительном варианте осуществления изобретения фармацевтическая комбинация по настоящему изобретению включает соединение формулы (I), выбранное из 2-амида 1-({4-метил-5-[2-(2,2,2-трифтор-1,1-диметилэтил)пиридин-4-ил]тиазол-2-ил}амида) (S)пирролидин-1,2-дикарбоновой кислоты (“соединение A”) или его фармацевтически приемлемой соли.
Фармацевтическая комбинация по настоящему изобретению включает, по меньшей мере, одно мишеневое соединение, снижающее или ингибирующее присущую Hsp90 АТФазную активность и/или деградадирующее, нацеливающее, снижающее или ингибирующее белки-клиенты Hsp90 посредством убиквитин протеосомного метаболизма. Такие соединения далее указываются как ʺингибиторы белка теплового шока 90ʺ или ʺингибиторы Hsp90ʺ. Примеры ингибиторов Hsp90, подходящих для использования в настоящем изобретении, включают, но этим не ограничиваются, производное гелданамицина, танеспимицин (17-аллиламино-17-деметоксигелданамицин) (известный также как KOS-953 и 17-AAG); радицикол; метансульфонат 6-хлор-9-(4-метокси-3,5-диметилпиридин-2-илметил)-9H-пурин-2-амина (известный также как CNF2024); IPI504; SNX5422; этиламид 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты (AUY922); и (R)-2-амино-7-[4-фтор-2-(6-метоксипиридин-2-ил)фенил]-4-метил-7,8-дигидро-6H-пиридо[4,3-d]пиримидин-5-он (HSP990).
Кроме того, настоящее изобретение относится к фармацевтической композиции, содержащей соединение формулы (I) или его фармацевтически приемлемую соль и, по меньшей мере, один ингибитор Hsp90 или его фармацевтически приемлемую соль. В одном варианте осуществления изобретения указанная фармацевтическая композиция по настоящему изобретению предназначена для использования при лечении пролиферативного заболевания.
Кроме того, настоящее изобретение относится к применению фармацевтической комбинации, содержащей соединение формулы (I) или его фармацевтически приемлемую соль и, по меньшей мере, один ингибитор Hsp90 или его фармацевтически приемлемую соль, при получении лекарственного средства для лечения пролиферативного заболевания.
Кроме того, настоящее изобретение относится к способу лечения пролиферативного заболевания у субъекта, при необходимости этого, включающему введение указанному субъекту терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, и, по меньшей мере, одного ингибитора Hsp90 или его фармацевтически приемлемой соли. В соответствии с настоящим изобретением соединение формулы (I) и ингибитор Hsp90 могут быть введены либо в виде одной фармацевтической композиции, в виде отдельных композиций, либо последовательно.
Кроме того, настоящее изобретение относится к набору, содержащему соединение формулы (I) по п. 1 или его фармацевтически приемлемую соль, и, по меньшей мере, один ингибитор Hsp90 или его фармацевтически приемлемую соль.
ОПИСАНИЕ ФИГУР
На фигуре 1 показана противоопухолевая активность соединения A против PIK3CA мутантной линии клеток рака желудка HGC-27.
На фигуре 2 показана масса тела у групп мышей, несущих HGC-27, обработанных растворителем и соединением A.
Для in vivo исследований, представленных на фигурах 1 и 2, бестимусных самок мышей, несущих подкожные ксенотрансплантаты HGC-27, обрабатывали соединением A (соед. A) или растворителем в указанных дозах и режимах. Обработку начинали через 12 дней после прививки опухолевых клеток и продолжали в течение 12 последующих дней. Статистику по изменению объемов опухолей проводили с использованием однофакторной ANOVA с апостериорным критерием Данетта (*p<0,05 против контролей растворителей).
На фигуре 3 показана противоопухолевая активность растворителя, 12,5 мг/кг перорально, один раз в день (qd) отдельного агента соединения A, 50 мг/кг, внутривенно, два раза в неделю (2qw) отдельного агента AUY922 и комбинации соединения A с AUY922 против PIK3CA мутантной линии клеток рака желудка HGC-27. Значения являются средним ± SEM; размером образца (n=10 мышей в группе). (*p<0,05, значительное ингибирование по сравнению с контрольными группами, обработанными растворителем и обработанными отдельным агентом (ранговый критерий Манна-Уитни с апостериорным критерием Стьюдента-Ньюмана-Келса).
На фигуре 4 показаны усредненные изменения массы тела (представленные как отношение массы тела в день измерения и начальной массы тела в день 12 [оба откорректированные путем вычитания первичной массы опухоли], выраженные в процентах для каждого отдельного животного) для групп мышей с PIK3CA мутантной линией клеток рака желудка HGC-27, обработанных растворителем, 12,5 мг/кг соединения A, 50 мг/кг AUY922 и комбинацией соединения A в дозе 25 мг/кг и AUY922 в дозе 50 мг/кг.
На фигуре 5 показана противоопухолевая активность растворителя, 25 мг/кг перорально qd отдельного агента соединения A, 50 мг/кг, внутривенно, 2qw отдельного агента AUY922 и комбинации соединения A с AUY922 против PIK3CA мутантной линии клеток рака желудка HGC-27. Значения являются средним ± SEM; размером образца (n=10 мышей в группе). (*p<0,05, значительное ингибирование по сравнению с контрольными группами, обработанными растворителем и обработанными отдельным агентом (ранговый критерий Манна-Уитни с апостериорным критерием Данна).
На фигуре 6 показаны усредненные изменения массы тела (представленные как отношение массы тела в день измерения и начальной массы тела в день 12 [оба откорректированные путем вычитания первичной массы опухоли], выраженные в процентах для каждого отдельного животного) для групп мышей с PIK3CA мутантной линией клеток рака желудка HGC-27, обработанных растворителем, 25 мг/кг соединения A, 50 мг/кг AUY922 и комбинацией соединения A в дозе 25 мг/кг и AUY922 в дозе 50 мг/кг.
На фигуре 7 показана противоопухолевая активность растворителя, 50 мг/кг перорально qd отдельного агента соединения A, 50 мг/кг, внутривенно, 2qw отдельного агента AUY922 и комбинации соединения A с AUY922 против PIK3CA мутантной линии клеток рака желудка HGC-27. Значения являются средним ± SEM; размером образца (n=10 мышей в группе). (*p<0,05, значительное ингибирование по сравнению с контрольными группами, обработанными растворителем и обработанными отдельным агентом (ранговый критерий Манна-Уитни с апостериорным критерием Стьюдента-Ньюмана-Келса).
На фигуре 8 показаны усредненные изменения массы тела (представленные как отношение массы тела в день измерения и начальной массы тела в день 12 [оба откорректированные путем вычитания первичной массы опухоли], выраженные в процентах для каждого отдельного животного) для групп мышей с мутантной PIK3CA линией клеток рака желудка HGC-27, обработанных растворителем, 50 мг/кг соединения A, 50 мг/кг AUY922 и комбинацией соединения A в дозе 50 мг/кг и AUY922 в дозе 50 мг/кг.
На фигуре 9 показаны (a) частичный рост опухоли и (b) средние изменения массы тела при обработке растворителем/плацебо (n=5), 40 мг/кг перорально qd отдельным агентом соединением A (n=7), 50 мг/кг, внутривенно, 2qw отдельным агентом AUY922 (n=8) и комбинацией 40 мг/кг перорально qd соединения A и 50 мг/кг AUY922 (n=5) против клеточной линии меланомы A375.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Следующие общие определения предоставлены для лучшего понимания изобретения:
“Галоген” (или “гало”) обозначает фтор, бром, хлор или йод, в частности, фтор, хлор. Галогензамещенные группы и фрагменты, такие как алкил, замещенный галогеном (галогеналкил), могут быть моно-, поли- или пергалогенированными.
“Гетероатомы” представляют собой атомы, иные, чем углерод и водород, предпочтительно, азот (N), кислород (O) или серу (S), в частности, азот.
“Углеродсодержащие группы”, фрагменты или молекулы содержат от 1 до 7, предпочтительно, от 1 до 6, более предпочтительно, от 1 до 4, наиболее предпочтительно, 1 или 2, атомов углерода. Любая нециклическая углеродсодержащая группа или фрагмент с более чем 1 атомом углерода является прямой или разветвленной.
Префикс “низший” или “C1-C7” обозначает радикал, содержащий вплоть до и включая максимум 7, особенно вплоть до и включая максимум 4, атома углерода, и эти радикалы являются либо линейными, либо разветвленными с одним или множеством разветвлений.
“Алкил” относится к алкильной группе с прямой цепью или разветвленной цепью, предпочтительно, представляет собой прямой или разветвленный C1-12-алкил, особенно предпочтительно, представляет собой прямой или разветвленный C1-7-алкил; например, метил, этил, н- или изопропил, н-, изо-, втор- или трет-бутил, н-пентил, н-гексил, н-гептил, н-октил, н-нонил, н-децил, н-ундецил, н-додецил, при особом предпочтении, отдаваемом метилу, этилу, н-пропилу, изо-пропилу и н-бутилу и изобутилу. Алкил может быть незамещенным или замещенным. Примеры заместителей включают, но этим не ограничиваются, дейтерий, гидрокси, алкокси, галоген и амино. Примером замещенного алкила является трифторметил. Циклоалкил также может быть заместителем для алкила. Примером такого случая является фрагмент (алкил)-циклопропил или алкандиил-циклопропил, например -CH2-циклопропил. C1-C7-алкил, предпочтительно, представляет собой алкил, содержащий от и включая 1 вплоть до и включая 7, предпочтительно, от и включая 1 до и включая 4, атомов углерода, и является линейным или разветвленным; предпочтительно, низший алкил представляет собой бутил, такой как н-бутил, втор-бутил, изобутил, трет-бутил, пропил, такой как н-пропил или изопропил, этил или, предпочтительно, метил.
Каждая алкильная часть других групп, таких как “алкокси”, “алкоксиалкил”, “алкоксикарбонил”, “алкоксикарбонилалкил”, “алкилсульфонил”, “алкилсульфоксил”, “алкиламино”, “галогеналкил”, будет иметь те же значения, что описаны выше для определения “алкил”.
“Алкандиил” относится алкандиильной группе с прямой цепью или разветвленной цепью, присоединенной двумя разными атомами углерода к фрагменту, он, предпочтительно, представляет собой прямой или разветвленный C1-12 алкандиил, особенно предпочтительно, представляет собой прямой или разветвленный C1-6 алкандиил; например, метандиил (-CH2-), 1,2-этандиил (-CH2-CH2-), 1,1-этандиил ((-CH(CH3)-), 1,1-, 1,2-, 1,3-пропандиил и 1,1-, 1,2-, 1,3-, 1,4-бутандиил, при особом предпочтении, отдаваемом метандиилу, 1,1-этандиилу, 1,2-этандиилу, 1,3-пропандиилу, 1,4-бутандиилу.
“Алкендиил” относится к алкендиильной группе с прямой цепью или разветвленной цепью, присоединенной двумя разными атомами углерода к молекуле, он, предпочтительно, представляет собой прямой или разветвленный C2-6-алкандиил; например, -CH=CH-, -CH=C(CH3)-, -CH=CH-CH2-, -C(CH3)=CH-CH2-, -CH=C(CH3)-CH2-, -CH=CH-C(CH3)H-, -CH=CH-CH=CH-, -C(CH3)=CH-CH=CH-, -CH=C(CH3)-CH=CH-, при особом предпочтении, отдаваемом -CH=CH-CH2-, -CH=CH-CH=CH-. Алкендиил может быть замещенным или незамещенным.
“Циклоалкил” относится к насыщенному или частично насыщенному моноциклическому конденсированному полициклическому или спиро-полициклическому карбоциклу, содержащему от 3 до 12 кольцевых атомов в карбоцикле. Иллюстративные примеры циклоалкильных групп включают следующие фрагменты: циклопропил, циклобутил, циклопентил и циклогексил. Циклоалкил может быть незамещенным или замещенным; примеры заместителей представлены при определении алкила и также включают сам алкил (например, метил). Фрагмент, подобный -(CH3)-циклопропилу, рассматривается как замещенный циклоалкил.
“Арил” относится к ароматической гомоциклической кольцевой системе (то есть, только углерод в качестве образующих кольцо атомов) с 6 или более атомами углерода; арил предпочтительно представляет собой ароматический фрагмент, содержащий от 6 до 14 кольцевых атомов углерода, более предпочтительно, от 6 до 10 кольцевых атомов углерода, такой как фенил или нафтил, предпочтительно, фенил. Арил может быть незамещенным или замещенным одним или несколькими, предпочтительно, вплоть до трех, более предпочтительно, вплоть до двух, заместителями, независимо выбранными из группы, включающей незамещенный или замещенный гетероциклил, как описано далее, особенно пирролидинил, такой как пирролидино, оксопирролидинил, такой как оксопирролидино, C1-C7-алкилпирролидинил, 2,5-ди-(C1-C7-алкил)пирролидинил, такой как 2,5-ди-(C1-C7-алкил)пирролидино, тетрагидрофуранил, тиофенил, C1-C7-алкилпиразолидинил, пиридинил, C1-C7-алкилпиперидинил, пиперидино, пиперидино, замещенный амино, или н-моно-, или N,N-ди-(низший алкил, фенил, C1-C7-алканоил и/или фенил-низший алкил)амино, незамещенный или замещенный н-низшим алкилом пиперидинил, присоединенный через кольцевой атом углерода, пиперазино, низший алкилпиперазино, морфолино, тиоморфолино, S-оксотиоморфолино или S,S-диоксотиоморфолино; C1-C7-алкил, амино-C1-C7-алкил, н-C1-C7-алканоиламино-C1-C7-алкил, н-C1-C7-алкансульфониламино-C1-C7-алкил, карбамоил-C1-C7-алкил, [N-моно- или N,N-ди-(C1-C7-алкил)карбамоил]-C1-C7-алкил, C1-C7-алкансульфинил-C1-C7-алкил, C1-C7-алкансульфонил-C1-C7-алкил, фенил, нафтил, от моно- до три-[C1-C7-алкил, галоген и/или циано]фенил или от моно- до три-[C1-C7-алкил, галоген и/или циано]нафтил; C3-C8-циклоалкил, от моно- до три-[C1-C7-алкил и/или гидрокси]-C3-C8-циклоалкил; галоген, гидрокси, низший алкокси, низший алкокси-низший алкокси, (низший алкокси)-низший алкокси-низший алкокси, галоген-C1-C7-алкокси, фенокси, нафтилокси, фенил- или нафтил-низший алкокси; амино-C1-C7-алкокси, низший-алканоилокси, бензоилокси, нафтоилокси, формил (CHO), амино, н-моно- или N,N-ди-(C1-C7-алкил)амино, C1-C7-алканоиламино, C1-C7-алкансульфониламино, карбокси, низший алкоксикарбонил, например; фенил- или нафтил-низший алкоксикарбонил, такой как бензилоксикарбонил; C1-C7-алканоил, такой как ацетил, бензоил, нафтоил, карбамоил, н-моно- или N,N-дизамещенный карбамоил, такой как н-моно- или N,N-ди-замещенный карбамоил, где заместители выбраны из низшего алкила, (низший алкокси)-низшего алкила и гидрокси-низшего алкила; амидино, гуанидино, уреидо, меркапто, низший алкилтио, фенил- или нафтилтио, фенил- или нафтил-низший алкилтио, низший алкилфенилтио, низший алкилнафтилтио, галоген-низший алкилмеркапто, сульфо (-SO3H), низший алкансульфонил, фенил- или нафтилсульфонил, фенил- или нафтил-низший алкилсульфонил, алкилфенилсульфонил, галоген-низший алкилсульфонил, такой как трифторметансульфонил; сульфонамидо, бензосульфонамидо, азидо, азидо-C1-C7-алкил, особенно азидометил, C1-C7-алкансульфонил, сульфамоил, н-моно- или N,N-ди-(C1-C7-алкил)сульфамоил, морфолиносульфонил, тиоморфолиносульфонил, циано и нитро; где каждый фенил или нафтил (также в фенокси или нафтокси), указанные выше в качестве заместителя или части заместителя замещенного алкила (или также замещенного арила, гетероциклила и так далее, указанных в данном документе), сами являются незамещенными или замещенными одним или несколькими, например, вплоть до трех, предпочтительно, 1 или 2, заместителями, независимо выбранными из галогена, галоген-низшего алкила, такого как трифторметил, гидрокси, низший алкокси, азидо, амино, н-моно- или N,N-ди-(низший алкил и/или C1-C7-алканоил)амино, нитро, карбокси, низший-алкоксикарбонил, карбамоил, циано и/или сульфамоил.
“Гетероциклил” относится к гетероциклическому радикалу, который является ненасыщенным (= несущим максимально возможное количество сопряженных двойных связей в кольце(ах)), насыщенным или частично насыщенным и, предпочтительно, представляет собой моноциклическое или, в более широком аспекте данного изобретения, бициклическое, трициклическое или спироциклическое кольцо; и содержит от 3 до 24, более предпочтительно, от 4 до 16, наиболее предпочтительно, от 5 до 10, и, наиболее предпочтительно, 5 или 6 кольцевых атомов; где один или несколько, предпочтительно, от одного до четырех, особенно, одно или два кольцевых атома являются гетероатомом (остальные кольцевые атомы, следовательно, являются углеродами). Связывающее кольцо (то есть кольцо, присоединенное к молекуле), предпочтительно, содержит от 4 до 12, особенно от 5 до 7 кольцевых атомов. Термин гетероциклил также включает гетероарил. Гетероциклический радикал (гетероциклил) может быть незамещенным или замещенным одним или несколькими, особенно от 1 до 3, заместителями, независимо выбранными из группы, включающей заместители, определенные выше для замещенного алкила, и/или из одного или нескольких следующих заместителей: оксо (=O), тиокарбонил (=S), имино(=NH), имино-низший алкил. Кроме того, гетероциклил, особенно, представляет собой гетероциклильный радикал, выбранный из группы, состоящей из оксиранила, азиринила, азиридинила, 1,2-оксатиоланила, тиенила (= тиофенил), фуранила, тетрагидрофурила, пиранила, тиопиранила, тиантренила, изобензофуранила, бензофуранила, хроменила, 2Н-пирролила, пирролила, пирролинила, пирролидинила, имидазолила, имидазолидинила, бензимидазолила, пиразолила, пиразинила, пиразолидинила, тиазолила, изотиазолила, дитиазолила, оксазолила, изоксазолила, пиридила, пиразинила, пиримидинила, пиперидинила, пиперазинила, пиридазинила, морфолинила, тиоморфолинила, (S-оксо или S,S-диоксо)тиоморфолинила, индолизинила, азепанила, диазепанила, особенно 1,4-диазепанила, изоиндолила, 3H-индолила, индолила, бензимидазолила, кумарила, индазолила, триазолила, тетразолила, пуринила, 4Н-хинолизинила, изохинолила, хинолила, тетрагидрохинолила, тетрагидроизохинолила, декагидрохинолила, октагидроизохинолила, бензофуранила, дибензофуранила, бензотиофенила, дибензотиофенила, фталазинила, нафтиридинила, хиноксалила, хиназолинила, хиназолинила, циннолинила, птеридинила, карбазолила, бета-карболинила, фенантридинила, акридинила, перимидинила, фенантролинила, фуразанила, феназинила, фенотиазинила, феноксазинила, хроменила, изохроманила, хроманила, бензо[1,3]диоксол-5-ила и 2,3-дигидробензо[1,4]диоксин-6-ила, где каждый из этих радикалов является незамещенным или замещенным одним или несколькими, предпочтительно, вплоть до трех, заместителями, выбранными из тех, которые указаны выше для замещенного арила, и/или из одного или нескольких следующих заместителей: оксо (=O), тиокарбонила (=S), имино(=NH), имино-низшего алкила.
“Арилалкил” относится к арильной группе, присоединенной к молекуле через алкильную группу, такую как метильная или этильная группа, предпочтительно, фенэтилу или бензилу, в частности, бензилу. Подобным же образом, циклоалкил-алкил и гетероциклил-алкил представляют собой циклоалкильную группу, присоединенную к молекуле через алкильную группу, или гетероциклильную группу, присоединенную к молекуле через алкильную группу. В каждом случае арил, гетероциклил, циклоалкил и алкил могут быть замещены, как определено выше.
“Соли” (которые подразумеваются в термине “или его соли” или “или его соль”), могут быть представлены самостоятельно или в смеси со свободным соединением, например, соединением формулы (I), и являются, предпочтительно, фармацевтически приемлемыми солями. Такие соли соединений формулы (I) получают, например, в виде кислотно-аддитивных солей, предпочтительно, с органическими и неорганическими кислотами, из соединений формулы (I), обладающих основным атомом азота. Подходящими неорганическими кислотами являются, например, галогенсодержащие кислоты, такие как хлористоводородная кислота, серная кислота или фосфорная кислота. Подходящими органическими кислотами являются, например, карбоновые кислоты или сульфоновые кислоты, такие как фумаровая кислота или метансульфоновая кислота. Для целей выделения или очистки возможно также использовать фармацевтически неприемлемые соли, например, пикраты или перхлораты. Для терапевтического применения используются только фармацевтически приемлемые соли или свободные соединения (где это применимо в форме фармацевтических препаратов), и они иногда являются предпочтительными. Ввиду тесной взаимосвязи между новыми соединениями в свободной форме и теми, которые находятся в форме своих солей, включая те соли, которые могут быть использованы в качестве промежуточных, например, при очистке или характеризации новых соединений, любую ссылку на свободные соединения выше и далее следует понимать как ссылку также на соответствующие соли, в зависимости от обстоятельств и целесообразности. Соли соединений формулы (I) являются, предпочтительно, фармацевтически приемлемыми солями; подходящие образующие противоионы фармацевтически приемлемые соли известны в данной области.
“Комбинация” относится либо к комбинации постоянного состава в виде одной стандартной лекарственной формы, либо к комбинации непостоянного состава (или набора компонентов) для объединенного введения, где соединение формулы (I) и компонент комбинации (например, другое лекарственное средство, как описано далее, указываемое также как “терапевтический агент” или “со-агент”) могут быть введены независимо в одно и то же время или раздельно в промежутках времени, особенно, когда эти промежутки времени позволяют компонентам комбинации проявлять совместное, например, синергетическое действие. Термин “объединенное введение” или тому подобное, как используется в данном документе, означает введение выбранного компонента комбинации одному субъекту, при необходимости этого (например, пациенту), и предназначен для охвата лечебных режимов, при которых агенты не обязательно вводятся одним и одним и тем же путем введения или в одно и то же время. Термин “комбинация определенного состава” означает, что активные ингредиенты, например, соединение формулы (I) и компонент комбинации, оба водятся пациенту одновременно в виде единого целого или единой дозировки. Термины “комбинация неопределенного состава” или “набор компонентов” означает, что активные ингредиенты, например, соединение формулы (I) и компонент комбинации, оба водятся пациенту в виде раздельных компонентов либо одновременно, параллельно, либо последовательно, без конкретных ограничений во времени, где такое введение обеспечивает терапевтически эффективный уровень двух соединений в организме пациента. Последнее также относится к смешанной терапии, например, введение трех или более активных ингредиентов.
“Лечение” включает профилактическое (превентивное) и терапевтическое лечение, а также задержку прогрессирования расстройства или заболевания. Термин “профилактическое” означает предупреждение появления или рецидива заболеваний, сопровождающих пролиферативные заболевания. Термин “задержка прогрессирования”, как используется в настоящем документе, означает введение комбинации пациентам, находящимся в предварительной стадии или на ранней стадии пролиферативного заболевания, подлежащего лечению, например, пациентам, у которых диагностирована предварительная стадии соответствующего заболевания, или пациентам, находящимся в состоянии, например, процесса медицинского лечения, или состоянии в результате несчастного случая, при которых имеется вероятность развития соответствующей болезни.
Термин “субъект” предназначен для включения животных. Примерами субъектов являются млекопитающие, например, люди, собаки, коровы, лошади, свиньи, овцы, козы, кошки, мыши, кролики, крысы и трансгенные животные. В некоторых вариантах осуществления изобретения субъектом является человек, например, человек, страдающий от, рискующий пострадать от или потенциально способный страдать от опухолевого заболевания мозга. Особенно предпочтительно, субъектом является человек.
“Фармацевтический препарат” или “фармацевтическая композиция” относятся к смеси или раствору, содержащим, по меньшей мере, одно терапевтическое соединение для введения млекопитающему, например, человеку, чтобы предотвратить, лечить или контролировать конкретное заболевание или состояние, влияющее на млекопитающее.
“Со-назначение”, “со-введение”, или “объединенное введение”, или тому подобное означают введение выбранных терапевтических средств одному пациенту, и предназначены для включения в лечебные режимы, согласно которым средства не обязательно вводятся одним и тем же путем введения или в одно и то же время.
“Фармацевтически приемлемый” относится к таким соединениям, веществам, композициям и/или дозированным формам, которые, в рамках обоснованного медицинского заключения, подходят для контакта с тканями млекопитающих, особенно людей, без чрезмерной токсичности, раздражения, аллергической реакции и других проблемных осложнений, соизмеримых с разумным отношением польза/риск.
“Терапевтически эффективный”, предпочтительно, относится к количеству, которое терапевтически или в более широком смысле также профилактически эффективны против прогрессирования пролиферативного заболевания.
“Стандартная фармацевтическая композиция” относится к стандартному носителю или основе, разработанных для обеспечения пациента эффективным количеством обоих терапевтических агентов. Стандартная основа предназначена для доставки эффективного количества каждого из агентов, а также любых фармацевтически приемлемых носителей или инертных наполнителей. В некоторых вариантах осуществления изобретения основой является таблетка, капсула, пилюля или пластырь. В других вариантах осуществления основой является раствор или суспензия.
“Интервал доз” относится к высшему или низшему пределу приемлемого варианта количества конкретного агента. Обычно пациенту, проходящему лечение, может вводиться доза агента в любом количестве в пределах указанного диапазона.
Термин “примерно” или “приблизительно” обычно обозначает в пределах 20%, более предпочтительно, в пределах 10%, и наиболее предпочтительно, даже в пределах 5% данного значения или интервала. Альтернативно, особенно в биологических системах, термин “примерно” означает в пределах примерно log (то есть, порядка величины) предпочтительно, в пределах в два раза от данного значения.
Настоящее изобретение относится к фармацевтической комбинации, содержащей (a) соединение формулы (I), как определено далее, или его фармацевтически приемлемую соль; и (b) по меньшей мере, один ингибитор Hsp90 или его фармацевтически приемлемую соль. Такая комбинация может быть для одновременного, раздельного или последовательного использования при лечении пролиферативного заболевания.
Конкретные 2-карбоксамидциклоамино производные мочевины, которые является подходящими по настоящему изобретению, их получение и подходящие, содержащие их фармацевтические препараты описаны в WO 2010/029082 и включают соединения формулы (I)
(I),
где
A представляет собой гетероарил, выбранный из группы, состоящей из:
R1 представляет собой один из следующих заместителей: (1) незамещенный или замещенный, предпочтительно, замещенный C1-C7-алкил, где указанные заместители независимо выбраны из одной или нескольких, предпочтительно, из от одной до девяти следующих групп: дейтерий, фтор, или из от одной до двух следующих групп C3-C5-циклоалкил; (2) необ