Конъюгаты антагонистов интегрина для нацеленной доставки к клеткам, экспрессирующим lfa-1
Иллюстрации
Показать всеИзобретение относится к соединениям формулы I, где R1 выбирают из соединений (1), (2), (3), которые применяют для изготовления и доставки конъюгированных группировок, таких как малые молекулы, пептиды, нуклеиновые кислоты, флуоресцентные группировки и полимеры, сшитых с антагонистами интегрина LFA-1, для нацеленной доставки к клеткам, экспрессирующим LFA-1. 5 н. и 16 з.п. ф-лы, 6 ил., 1 табл., 10 пр.
(1),
(2)
(3)
Реферат
Настоящее изобретение относится к синтезу и взаимодействию эффективных и селективных низкомолекулярных антагонистов интегрина, содержащих подходящие линкеры и функциональные группы для химического взаимодействия с другими молекулами, содержащими реактивными нуклеофилами, такими как тиолы, таким образом, что между группировкой, которую нужно конъюгировать, и молекулярной частицей для нацеленной доставки образуется ковалентная связь. Низкомолекулярные антагонисты для нацеленной доставки связываются с когнатными рецепторными системами, поскольку являются антагонистами функционально-ассоциированного антигена лимфоцитов 1 (LFA-1; от англ. lymphocyte function associated antigen 1) и/или двойными антагонистами LFA-1/МАС-1 (мембраноатакующего комплекса; от англ. "membrane attack complex") к рецептору молекулы внеклеточной адгезии 1 (ICAM-1; от англ. "intercellular adhesion molecule-1"). Ковалентно связанная группировка включает низкомолекулярные терапевтические средства, полимеры, пептиды и олигонуклеотиды. Она включает 5ʹ-тиосодержащие олигонуклеотиды для образования производных 5ʹ-тио-миРНК (малых интерферирующих РНК) в качестве средств, обеспечивающих нацеленную доставку данных миРНК. Такие дериватизированные миРНК в сочетании с подходящими агентами трансфекции помогают при селективной доставке миРНК к клеткам, экспрессирующим такие рецепторы интегрина, предотвращая посредством этого экспрессию целевых генов за счет РНК интерференции (РНКи).
Функционально-ассоциированный антиген лимфоцитов 1, также известный как LFA-1, представляет собой интегрин, обнаруживаемый на всех Т-клетках, а также на В-клетках, макрофагах и нейтрофилах, и вовлечен в рекрутмент к сайту инфекции. Этот антиген связывается с ICAM-1 на антигенпрезентирующих клетках и функционирует как молекула адгезии. ICAM-1 (молекула внеклеточной адгезии 1), также известная как кластер дифференциации 54 (CD54; от англ. "Cluster of Differentiation 54"), представляет собой гликопротеин клеточной поверхности. Считают, что аберрантные уровни взаимодействий LFA-1/ICAM-1 являются действующими механизмами при воспалительных заболеваниях и расстройствах и, следовательно, антагонизм таких систем считают средством терапии. Таким образом, нацеленная доставка высокоаффинных малых молекул к этим системам может обеспечить средства для селективной доставки терапевтических средств, таких как миРНК, к клеточным системам, экспрессирующим рецептор ICAM-1.
РНК интерференция является хорошо известным процессом, при котором трансляции матричной РНК (мРНК) в белок препятствует ассоциирование или связывание комплементарных или частично комплементарных олигонуклеотидов, таких как малая интерферирующая РНК (миРНК), короткая шпилечная РНК (кшРНК), микроРНК или антисенс-олигонуклеотиды. миРНК представляют собой двунитевые молекулы РНК, длина которых находится в диапазоне 19-25 нуклеотидов, ассоциированные с группой белков в цитоплазме, известной как индуцированный РНК комплекс сайленсинга (RISC; от англ. "RNA-induced silencing complex"). RISC в конечном счете разделяет двунитевую миРНК, давая возможность одной нити связываться или ассоциироваться с комплементарным или частично комплементарным участком молекулы мРНК, после чего мРНК разрушается RISC, либо ее трансляция предотвращается иначе, следовательно, подавляя экспрессию кодируемого белка или генного продукта.
Одна из проблем при применении нуклеиновых кислот, таких как миРНК, в терапевтических областях применения (в частности, для системного введения людям) состоит в доставке нуклеиновых кислот: (1) в конкретные ткани-мишени или конкретные типы клеток и (2) в цитоплазму этих клеток (то есть, где присутствует мРНК и транслируется в белок). Проблема доставки отчасти основана на том факте, что нуклеиновые кислоты отрицательно заряжены и легко разрушаются (в частности, если они не модифицированы), эффективно фильтруются почками и сами по себе не могут легко транспортироваться в цитоплазму клеток. Таким образом, значительное количество исследований сосредоточено на решении проблемы доставки различными носителями и препаратами, включающими липосомы, мицеллы, пептиды, полимеры, конъюгаты и аптамеры. См. Ling et al., Advances in Systemic siRNA Delivery, Drugs Future 34(9): 721 (September 2009). Некоторые более перспективные носители для доставки включают применение липидных систем, включающих липидные наночастицы. См. Wu et al., Lipidic Systems for In Vivo siRNA Delivery, AAPS J. 11(4): 639-652 (December 2009); публикация международной заявки на патент № WO 2010/042877 авторов Hope et al. ("Improved Amino Lipids And Methods For the Delivery of Nucleic Acids"). Тем не менее, остается необходимость в дальнейшем усовершенствовании нацеленной доставки миРНК, а также других веществ, таких как малые молекулы, пептиды, другие нуклеиновые кислоты, флуоресцентные группировки и полимеры, к конкретным клеткам-мишеням и в цитоплазму таких клеток.
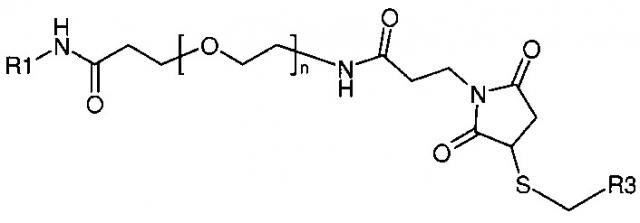
Изобретение относится к соединениям формулы I:
где R1, R2 и n являются такими, как определено в подробном описании и в формуле изобретения. В частности, настоящее изобретение относится к соединениям формулы I для улучшенной доставки конъюгированных группировок, таких как малые молекулы, пептиды, нуклеиновые кислоты, флуоресцентные группировки и полимеры, к клеткам-мишеням, экспрессирующим димер интегрина α4β1 (очень поздний антиген-4), димер αVβ3 или функционально-ассоциированный антиген лимфоцитов 1 (LFA-1), для различных терапевтических и других применений. Настоящее изобретение также относится к способам получения и применения таких соединений.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1а: В таблице 1 показана композиция одиночных и двойных нитей конкретной 5ʹ-дериватизированной миРНК.
Фиг. 1b: В таблице 2 показаны аналитические данные для конъюгатов миРНК с малой молекулой.
Фиг. 1с: В таблице 3 показаны последовательности миРНК, где 5ʹ-антисмысловая нить дериватизирована Nu547.
Фиг. 1d: В таблице 4 показаны эффективности конъюгатов малой молекулы с миРНК в анализах антагонистов интегрина и данные константы диссоциации (КД) миРНК.
Фиг. 1е: В таблице 5 показана идентичность, характеризация и эффективности связывания реагентов, меченных изомером ФИТЦ.
На фиг. 1f показана гистограмма ("В": Дуплекс-27 500 нМ и Пример 140 10 мкМ; "А": Дуплекс-27).
На фиг. 2 показано изображение захвата репрезентативной миРНК (Дуплекс-27 (500 нМ).
На фиг. 3 показаны изображения клеток Jurkat с ФИТЦ, конъюгированным с примером ФИТЦ-5 (ФИТЦ-меченым антагонистом LFA-1), при 10 мкМ.
На фиг. 4 показаны изображения клеток Jurkat с ФИТЦ, конъюгированным с примером ФИТЦ-14 (ФИТЦ-меченым антагонистом VLA-4) при 10 мкМ. На гистограмме показан сдвиг в присутствии дуплекса миРНК с элементом для нацеленной доставки к VLA-4. В присутствии антагониста VLA-4 примера 140 этот сдвиг сплюснут.
На фиг. 5 показано снижение экспрессии АНА1 в клетках H1299 при обработке дуплексами миРНК, дериватизированной на 5ʹ-смысловой нити малой молекулы для нацеленной доставки к интегрину. На оси у показан наблюдаемый уровень экспрессии АНА1. Более низкий столбик указывает на более высокую степень нокдауна (более высокую степень трансфекции миРНК); более высокий столбик на более низкую степень нокдауна (то есть на меньшую степень трансфекции миРНК). Дуплексы, изображенные синим цветом, имеют модификации для нацеленной доставки на 5ʹ-конце смысловой нити; дуплексы, изображенные розовым цветом, имеют модификации для нацеленной доставки на 5ʹ-конце смысловой нити, а также флуорофор Nu547, присоединенный к 5ʹ-концу антисмысловой нити.
На фиг. 6 показаны уровни экспрессии мРНК глицеральдегид-3-фосфатдегидрогеназы (GAPDH; от англ. "glyceraldehyde 3-phosphate dehydrogenase"), маркера здоровья клетки. Сходство уровней экспрессии для этих клеток, дериватизированных миРНК, с уровнями для обработанных плацебо и необработанных клеток является показателем отсутствия клеточной токсичности при данной концентрации и продолжительности обработки.
Если не указано иное, приведенные ниже специальные термины и выражения, используемые в описании и в формуле изобретения, определены, как описано ниже:
Термин "группировка" относится к атому или группе химически связанных атомов, присоединенной к другому атому или молекуле одной или более химических связей, образуя за счет этого часть молекулы. Например, переменные R1 и R2 формулы I относятся к группировкам, присоединенным к структуре, показанной в формуле I, ковалентной связью, где это указано.
Термин "конъюгированная группировка" относится к группировке, представляющей собой терапевтическое или полезное соединение, пептид, полимер, малую молекулу, флуоресцентную группировку, олигонуклеотид или нуклеиновую кислоту. Примеры включают лекарственные средства, терапевтические пептиды, антисенс-олигонуклеотиды, миРНК и флуоресцеинизотиоцианат (ФИТЦ).
Если не указано иное, термин "атом водорода" или "гидро" относится к группировке атома водорода (-Н), а не к Н2.
Термин "атом галогена" относится к группировке атома фтора, хлора, брома или йода.
Термин "алкил" относится к алифатической прямоцепочечной или разветвленной насыщенной углеводородной группировке, имеющей от 1 до 25 атомов углерода.
Термин "ТФУ" относится к трифторуксусной кислоте.
Если не указано иное, термин "соединение формулы" или "соединения формулы" означает любое соединение, выбранное из рода соединений, определенного формулой (включая любую фармацевтически приемлемую соль или сложный эфир любого такого соединения, если не отмечено иное).
Термин "фармацевтически приемлемые соли" относится к солям, сохраняющим биологическую эффективность и свойства свободных оснований или свободных кислот, которые не являются ни биологически, ни иначе нежелательными. Соли могут быть образованы с неорганическими кислотами, такими как соляная кислота, бромисто-водородная кислота, серная кислота, азотная кислота, фосфорная кислота и тому подобное, предпочтительно соляная кислота, и с органическими кислотами, такими как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, малеиновая кислота, малоновая кислота, салициловая кислота, янтарная кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, пара-толуолсульфоновая кислота, N-ацетилцистеин и тому подобное. Кроме того, соли могут быть получены путем присоединения неорганического основания или органического основания к свободной кислоте. Соли, образованные с неорганическим основанием, включают, но не ограничены ими, соли натрия, калия, лития, алюминия, кальция и магния и тому подобное. Соли, образованные от органических оснований, включают, но не ограничены ими, соли первичных, вторичных и третичных аминов, замещенных аминов, включающих природные замещенные амины, циклических аминов и основных ионообменных смол, таких как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, этаноламин, лизин, аргинин, N-этилпиперидин, пиперидин, полиаминные смолы и тому подобное. В зависимости от паттернов замещения соединения по настоящему изобретению могут также существовать в виде цвиттерионов.
Соединения по настоящему изобретению могут находиться в форме фармацевтически приемлемых солей. Соединения по настоящему изобретению могут также находиться в форме фармацевтически приемлемых сложных эфиров (то есть метиловых и этиловых эфиров кислот формулы I, применяемых в качестве пролекарств). Соединения по настоящему изобретению могут быть также сольватированными, то есть гидратированными. Сольватацию можно осуществить в ходе процесса получения, либо она может происходить, например, вследствие гигроскопических свойств исходно безводного соединения формулы I (гидратация).
Соединения, имеющие одну и ту же молекулярную формулу, но различающиеся по природе или последовательности связывания их атомов или по расположению их атомов в пространстве, называют "изомерами". Изомеры, различающиеся по расположению их атомов в пространстве, называют "стереоизомерами". Диастереомеры представляют собой стереоизомеры, имеющие противоположную конфигурацию при одном или более хиральных центров, не являющиеся энантиомерами. Стереоизомеры, несущие один или более асимметрических центров, представляющие собой неналагаемые зеркальные отображения друг друга, называют "энантиомерами". Когда соединение имеет асимметрический центр, например, если атом углерода связан с четырьмя различными группами, возможна пара энантиомеров. Энантиомер может быть охарактеризован абсолютной конфигурацией его асимметрического центра или центров и описан на основании правил R- и S-последовательности Кана, Ингольда и Прелога или на основании способа вращения плоскости поляризованного света, и обозначен как правовращающий или левовращающий (то есть в виде (+) или (-)-изомеров соответственно). Хиральное соединение может существовать либо в виде отдельного энантиомера, либо в виде их смеси. Смесь, содержащая равные доли энантиомеров, называют "рацемической смесью".
Термин "терапевтически эффективное количество" означает количество соединения, эффективное для предупреждения, облегчения или ослабления симптомов заболевания или продления жизни субъекта, подлежащего лечению. Определение терапевтически эффективного количества находится в пределах компетенции специалиста в данной области техники. Терапевтически эффективное количество или дозировка соединения согласно данному изобретению может варьировать в широких пределах и может быть определено способом, известным в данной области техники. Такую дозировку регулируют на основании индивидуальных потребностей в каждом конкретном случае, включающем конкретное вводимое соединение (соединения), путь введения, состояние, подлежащее лечению, а также пациента, подлежащего лечению. Суточную дозу можно вводить в виде однократной дозы или в разделенных дозах, либо для парентерального введения ее можно вводить в виде непрерывной инфузии.
Термин "фармацевтически приемлемый носитель" подразумевает включение любого вещества и всех веществ, совместимых с фармацевтическим введением, включая растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические агенты и агенты, замедляющие всасывание, и другие вещества и соединения, совместимые с фармацевтическим введением. Применение этих веществ в композициях рассматривают в любом случае за исключением случаев, когда какая-либо традиционная среда или агент несовместимы с активным соединением. В композиции можно также включать дополнительные активные соединения.
Подробно настоящее изобретение относится к соединениям формулы I:
или к их фармацевтически приемлемым солям или сложным эфирам; где n равно 1-24, и где:
R1 выбран из группы, состоящей из следующих соединений:
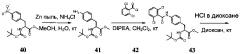
(1) соединения формулы:
;
(2) соединения формулы:
; и
(3) соединения формулы:
где Q представляет собой H или ОН;
R2 выбран из группы, состоящей из следующих соединений:
(1) соединения формулы:
;;
(2) соединения формулы:
;
(3) соединения формулы:
; и
(4) соединения формулы:
,
где R3 представляет собой конъюгированную группировку и X представляет собой либо атом серы, либо соединение формулы:
Как используют в приведенных выше структурах, символ используют, чтобы указывать, где эта структура или группировка присоединена к базовой молекуле ковалентной связью. Кроме того, выражение "к ПЭГ" или "к S" или подобные выражения, используемые в комбинации с указанным выше символом, указывает, где или как структура или группировка присоединена к базовой молекуле, если имеются множественные точки присоединения. Например, если R2 представляет собой соединение формулы:
где X представляет собой соединение формулы:
то структура на основе формулы I представляет собой:
где R1, R3 и n являются такими, как определено в формуле I.
Настоящее изобретение также относится к способам получения и применения соединений формулы I, а также фармацевтических композиций, содержащих такие соединения. Соединения формулы I полезны при улучшении доставки малых молекул, белков, нуклеиновых кислот, полимеров, флуоресцентных маркеров и других веществ к клеткам-мишеням, экспрессирующим рецепторы ICAM-1. В конкретных воплощениях настоящее изобретение относится к композициям и препаратам, содержащим соединения формулы I, полезным при доставке миРНК в цитоплазму клеток-мишеней, экспрессирующих рецепторы ICAM-1, для ингибирования экспрессии определенных белков-мишеней посредством РНК интерференции.
В более конкретных воплощениях изобретение относится к применению соединений формулы I для получения препарата, способствующего доставке нуклеиновых кислот, таких как миРНК, к опухолевым клеткам и другим типам клеток, экспрессирующих рецепторы ICAM-1. Кроме того, применение соединений формулы I для синтеза препаратов доставки для лечения воспалительных и пролиферативных расстройств, таких как раки, составляет часть изобретения.
R1 представляет собой низкомолекулярные антагонисты интегрина для нацеленной доставки соединений формулы I к интегрину LFA-1, способствуя посредством этого их доставке к клеткам, экспрессирующим такие рецепторы.
В конкретных воплощениях изобретения низкомолекулярный антагонист интегрина для нацеленной доставки группировок R1, присоединен в таком положении, что сродство связывания этой малой молекулы с интегрином по существу не снижено относительно свободного низкомолекулярного антагониста интегрина. Группировки R1 формулы I нацелены на рецептор ICAM-1 (посредством антагонистов LFA-1 или двойных антагонистов LFA-1/MAC-1 к рецептору ICAM-1).
В конкретных воплощениях изобретения группировки R1 представляет собой антагонисты LFA-1 и/или двойные антагонисты LFA-1/MAC-1 или группировку для нацеленной доставки к рецептору ICAM-1 формулы:
или их фармацевтически приемлемую соль или сложный эфир.
В других воплощениях изобретения R1 представляет собой антагонисты LFA-1 и/или двойные антагонисты LFA-1/MAC-1 или группировку для нацеленной доставки к рецептору ICAM-1 формулы:
или их фармацевтически приемлемую соль или сложный эфир.
В других воплощениях изобретения R1 представляет собой антагонисты LFA-1 и/или двойные антагонисты LFA-1/MAC-1 или группировку для нацеленной доставки к рецептору ICAM-1 формулы:
или их фармацевтически приемлемую соль или сложный эфир, где Q представляет собой H или ОН.
R2 может представлять собой реакционные группировки, которые могут образовывать ковалентные связи с терапевтическими или другими полезными соединениями или конъюгированными группировками, обладающими сильной нуклеофильностью, такими как тиолсодержащие молекулы. Примеры таких реакционных группировок включают группировки, выбранные из группы, состоящей из следующих группировок:
; и .
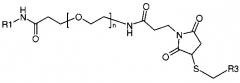
Альтернативно R2 может представлять собой группировку, которая уже присоединена к конъюгированной группировке, такой как терапевтическое или другое полезное соединение, белок или олигонуклеотид (R3). Более конкретно R2 может представлять собой группировку формулы:
где R3 представляет собой конъюгированную группировку и X представляет собой либо атом серы, либо соединение формулы:
В конкретных воплощениях изобретения R3 представляет собой олигонуклеотид. В более конкретных воплощениях изобретения R3 представляет собой 5ʹ-конец смысловой нити молекулы РНК, которая может существовать в виде одной нити или в дуплексе, таком как молекула миРНК. Такие молекулы миРНК, также известные как агенты РНКи, ингибируют экспрессию гена-мишени в клетке. В конкретных воплощениях изобретения R3 представляет собой молекулу миРНК, состоящую по существу из олигорибонуклеотидной нити длиной от 15 до 30 нуклеотидов, где 5ʹ конец смысловой олигорибонуклеотидной нити соединен с R2, как показано в приведенных выше структурах, и комплементарную по меньшей мере одному участку мРНК, соответствующей гену-мишени. В других воплощениях изобретения R3 представляет собой олигонуклеотид ДНК, присоединенный к его 5ʹ-концу. Такая дериватизированная ДНК может существовать в виде одной нити или в виде одной нити, гибридизованной с комплементарной нитью другого олигонуклеотида. Олигонуклеотидные нити могут быть либо немодифицированными, либо модифицированными для метаболической стабильности. Такие модификации включают, но не ограничены ими, замены в конкретных положениях на фосфате (например, фосфоротиоат) и 2ʹ-гидрокси (например, 2ʹ-O-метил и 2ʹ-фтор).
В конкретных воплощениях изобретения R2 формулы I представляет собой -X-S-CH2-R3, где R3 включает смысловую нить РНК, как показано ниже в формуле 5 (на основе формулы I):
где R1, n и X являются такими, как определено в формуле I.
В других конкретных воплощениях изобретения смысловая нить может быть связана с антисмысловой нитью.
В других конкретных воплощениях изобретения R2 представляет собой -X-S-CH2-R3, где R3 представляет собой малую молекулу или белок, образуя посредством этого ковалентно связанную специфичную молекулу формулы I для нацеленной доставки.
В более конкретных воплощениях изобретения R2 представляет собой -X-S-CH2-R3, где R3 представляет собой терапевтическую малую молекулу или белок.
В других конкретных воплощениях изобретения R2 представляет собой -X-S-CH2-R3, где R3 представляет собой флуоресцентную группировку, полезную для визуализации этих связываний рецептора интегрина, используя методы клеточной микроскопии.
В других конкретных воплощениях изобретения R2 представляет собой -X-S-CH2-R3, где R3 представляет собой полимер, имеющий первичные реакционные сульфиды. Более конкретно R3 может представлять собой катионный полимер, полезный для комплексообразования и доставки миРНК к клеточным поверхностям и цитоплазматическим доменам клеток.
В более конкретных воплощениях изобретения настоящее изобретение направлено на соединения формулы I, где R3 представляет собой один из структурных изомеров флуоресцеинизотиоцианата (ФИТЦ), представленных ниже:
.
В других более конкретных воплощениях настоящее изобретение направлено на соединения формулы I, где R3 представляет собой один из структурных изомеров ФИТЦ-14, представленных ниже:
В других воплощениях настоящее изобретение направлено на соединение формулы I, где n равно 9-13, предпочтительно 12.
В более конкретных воплощениях настоящее изобретение направлено на соединение формулы I, выбранное из группы, состоящей из одного из следующих соединений (или его фармацевтически приемлемую соль или сложный эфир):
Лигандный реагент 1 LFA-1
(S)-3-{3-{2-[2-(2-{2-[3-(2,5-Диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]-этокси]-этокси}-этокси)-этокси]-пропиониламино}-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}амино)пропионовая кислота;
Лигандный реагент 2 LFA-1
(S)-3-{3-(2-{2-[2-(2-{2-[2-(2-{2-[3-(2,5-Диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]-этокси)-этокси]-этокси}-этокси)-этокси]-этокси}-этокси)-этокси]-пропиониламино}-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}амино)пропионовая кислота;
Лигандный реагент 3 LFA-1
(S)-3-{3-[2-(2-{2-[2-(2-{2-[2-(2-{2-[2-(2-{2-[3-(2,5-Диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]-этокси}-этокси)-этокси]-этокси}-этокси)-этокси]-этокси}-этокси)-этокси]-этокси}-этокси)-этокси]-пропиониламино}-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}амино)пропионовая кислота;
Лигандный реагент 4 LFA-1
(S)-3-{4-[4-(3-(2-{2-[2-(2-{2-[2-(2-{2-этокси)-этокси]-этокси}-этокси)-этокси]-этокси}-этокси)-этокси]-амино-пропокси)-2,6-дихлор-бензоиламино]-фенил}-2-[2-хлор-4-(3-гидрокси-бензилкарбамоил)-бензоиламино]-пропионовая кислота-ПЭГ8;
Лигандный реагент 5 LFA-1
S)-2-[2-Хлор-4-(3-гидрокси-бензилкарбамоил)-бензоиламино]-3-(4-{2,6-дихлор-4-[3-(3-{2-[2-(2-{2-[3-(2,5-диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]-этокси}-этокси)-этокси]-этокси}-пропиониламино)-пропокси]-бензоиламино}-фенил)-пропионовая кислота;
Лигандный реагент 6 LFA-1
S)-2-[2-Хлор-4-(3-гидрокси-бензилкарбамоил)-бензоиламино]-3-(4-{2,6-дихлор-4-[3-(3-{2-[2-(2-{2-2-[2-(2-{2-2-[2-(2-{2-[3-(2,5-диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]-этокси}-этокси)-этокси]-этокси}-этокси}-этокси)-этокси]-этокси}-пропиониламино)-пропокси]-бензоиламино}-фенил)-пропионовая кислота;
Лигандный реагент 7 LFA-1
S)-2-[2-Хлор-4-(3-гидрокси-бензилкарбамоил)-бензоиламино]-3-(4-{2,6-дихлор-4-[3-(3-{2-[2-(2-{2-2-[2-(2-{2-[3-(2,5-диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]-этокси}-этокси)-этокси]-этокси]-этокси}-этокси)-этокси]-этокси}-пропиониламино)-пропокси]-бензоиламино}-фенил)-пропионовая кислота;
Лигандный реагент 8 LFA-1
(S)-3-{[(3-{3-[3-(2-{2-[2-(2-{2-[2-(2-{2-[3-(2,5-Диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]-этокси}-этокси)-этокси]-этокси}-этокси)-этокси]-этокси}-этокси)-пропиониламино]-пропил-окси}-фенил)-карбонил]-амино}-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}-амино)-пропионовая кислота;
Лигандный реагент 9 LFA-1
(S)-3-{[(3-{3-[3-(2-{2-[2-(2-{2-[2-(2-{2-[3-(2,5-Диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]-этокси}-этокси)-этокси]-этокси}-этокси)-этокси]-этокси}-этокси)-пропиониламино]-пропил-окси}-5-гидрокси-фенил)-карбонил]-амино}-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}-амино)-пропионовая кислота;
Лигандный реагент 10 LFA-1
(S)-3-[({3-[3-(3-{2-[2-(2-{2-[3-(2,5-Диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]-этокси}-этокси)-этокси]-этокси}-пропиониламино)-пропил-окси]-5-гидрокси-фенил}-карбонил)-амино]-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}-амино)-пропионовая кислота.
Кроме того, настоящее изобретение относится к новым композициям и препаратам, содержащим соединения формулы I, для получения наночастиц при объединении с миРНК, приводящем в результате к улучшенной доставке нуклеиновых кислот, таких как миРНК, в цитоплазму клеток-мишеней, экспрессирующих комплексы LFA-1/ICAM-1. В конкретных воплощениях настоящее изобретение направлено на препарат миРНК, содержащий следующие ингредиенты: (1) соединение формулы I, где R2 включает олигонуклеотид 5ʹ-миРНК; и (2) поликатионный агент трансфекции.
Настоящее изобретение также относится к способам получения и применения таких соединений и композиций. Соединения формулы I полезны в качестве ингредиентов композиций или препаратов, улучшающих доставку лекарственных средств, нуклеиновых кислот или других терапевтических соединений к тканям или клеткам, экспрессирующим комплексы LFA-1/ICAM-1. В конкретных воплощениях настоящее изобретение относится к препаратам, содержащим соединения формулы I, полезным при доставке миРНК в цитоплазму клеток-мишеней, экспрессирующих комплексы LFA-1/ICAM-1, чтобы ингибировать экспрессию определенных белков посредством РНК интерференции. В более конкретных воплощениях настоящее изобретение относится к соединениям формулы I и композициям, содержащим такие соединения, которые могут эффективно доставлять миРНК к опухолевым клеткам и другим типам клеток, экспрессирующих рецепторы ICAM-1, для лечения рака или воспалительных заболеваний. Такие соединения и композиции более эффективны и проявляют улучшенную способность к нокдауну по сравнению с аналогичными препаратами, не содержащими соединения формулы I.
В одном воплощении изобретения предложено соединение формулы I:
или его фармацевтически приемлемая соль или сложный эфир; где n равно 1-24, и где:
R1 выбран из группы, состоящей из следующих соединений:
(1) соединения формулы:
;
(2) соединения формулы:
; и
(3) соединения формулы:
,
где Q представляет собой H или ОН;
R2 выбран из группы, состоящей из следующих соединений:
(1) соединения формулы:
;
(2) соединения формулы:
;
(3) соединения формулы:
; и
(4) соединения формулы:
,
где R3 представляет собой конъюгированную группировку и X представляет собой либо атом серы, либо соединение формулы:
В одном воплощении изобретения предложено соединение формулы I, где R1 представляет собой соединение формулы:
.
В одном воплощении изобретения предложено соединение формулы I, где R1 представляет собой соединение формулы:
.
В одном воплощении изобретения предложено соединение формулы I, где R1 представляет собой соединение формулы:
,
где Q представляет собой H или ОН.
В одном воплощении изобретения предложено соединение формулы I, где R1 представляет собой соединение формулы:
,
где Q представляет собой Н.
В одном воплощении изобретения предложено соединение формулы I, где R1 представляет собой соединение формулы:
где Q представляет собой ОН.
В одном воплощении изобретения предложено соединение формулы I, где R2 представляет собой соединение формулы:
.
В одном воплощении изобретения предложено соединение формулы I, где R2 представляет собой соединение формулы:
.
В одном воплощении изобретения предложено соединение формулы I, где R2 представляет собой соединение формулы:
.
В одном воплощении изобретения предложено соединение формулы I, где R2 представляет собой соединение формулы:
,
где R3 представляет собой одно- или двунитевой олигонуклеотид, и X представляет собой либо атом серы, либо соединение формулы:
В одном воплощении изобретения предложено соединение формулы I, где R2 представляет собой соединение формулы:
,
где R3 представляет собой одно- или двунитевой олигонуклеотид и X представляет собой атом серы.
В одном воплощении изобретения предложено соединение формулы I, где R2 представляет собой соединение формулы:
,
где R3 представляет собой молекулу миРНК, и X представляет собой либо атом серы, либо соединение формулы:
В одном воплощении изобретения предложено соединение формулы I, где R1 представляет собой соединение формулы:
,
где R2 представляет собой соединение формулы:
где R3 представляет собой молекулу миРНК и X представляет собой либо атом серы, либо соединение формулы:
В одном воплощении изобретения предложено соединение формулы I, где R1 соединение формулы:
,
где R2 представляет собой соединение формулы:
где R3 представляет собой молекулу миРНК и X представляет собой либо атом серы, либо соединение формулы:
В одном воплощении изобретения предложено соединение формулы I, где R1 представляет собой соединение формулы:
где Q представляет собой H или ОН,
где R2 представляет собой соединение формулы:
где R3 представляет собой молекулу миРНК, и X представляет собой либо атом серы, либо соединение формулы:
В одном воплощении изобретения предложено соединение формулы I, выбранное из группы, состоящей из следующих соединений:
(S)-3-{3-{2-[2-(2-{2-[3-(2,5-Диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]-этокси]-этокси}-этокси)-этокси]-пропиониламино}-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}амино)пропионовой кислоты; и
(S)-3-{3-(2-{2-[2-(2-{2-[2-(2-{2-[3-(2,5-Диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]-этокси)-этокси]-этокси}-этокси)-этокси]-этокси}-этокси)-этокси]-пропиониламино}-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}амино)пропионовой кислоты.
В одном воплощении изобретения предложено соединение формулы I, выбранное из группы, состоящей из следующих соединений:
(S)-3-{3-[2-(2-{2-[2-(2-{2-[2-(2-{2-[2-(2-{2-[3-(2,5-Диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]-этокси}-этокси)-этокси]-этокси}-этокси)-этокси]-этокси}-этокси)-этокси]-этокси}-этокси)-этокси]-пропиониламино}-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}амино)пропионовой кислоты; и
(S)-3-{4-[4-(3-(2-{2-[2-(2-{2-[2-(2-{2-этокси)-этокси]-этокси}-этокси)-этокси]-этокси}-этокси)-этокси]-амино-пропокси)-2,6-дихлор-бензоиламино]-фенил}-2-[2-хлор-4-(3-гидрокси-бензилкарбамоил)-бензоиламино]-пропионовой кислоты-ПЭГ8.
В одном воплощении изобретения предложено соединение формулы I, выбранное из группы, состоящей из следующих соединений:
S)-2-[2-Хлор-4-(3-гидрокси-бензилкарбамоил)-бензоиламино]-3-(4-{2,6-дихлор-4-[3-(3-{2-[2-(2-{2-[3-(2,5-диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]-этокси}-этокси)-этокси]-этокси}-пропиониламино)-пропокси]-бензоиламино}-фенил)-пропионовой кислоты; и
S)-2-[2-Хлор-4-(3-гидрокси-бензилкарбамоил)-бензоиламино]-3-(4-{2,6-дихлор-4-[3-(3-{2-[2-(2-{2-2-[2-(2-{2-2-[2-(2-{2-[3-(2,5-диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]-этокси}-этокси)-этокси]-этокси}-этокси}-этокси)-этокси]-этокси}-пропиониламино)-пропокси]-бензоиламино}-фенил)-пропионовой кислоты.
В одном воплощении изобретения предложено соединение формулы I, выбранное из группы, состоящей из следующих соединений:
S)-2-[2-Хлор-4-(3-гидрокси-бензилкарбамоил)-бензоиламино]-3-(4-{2,6-дихлор-4-[3-(3-{2-[2-(2-{2-2-[2-(2-{2-[3-(2,5-диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]-этокси}-этокси)-этокси]-этокси]-этокси}-этокси)-этокси]-этокси}-пропиониламино)-пропокси]-бензоиламино}-фенил)-пропионовой кислоты; и
(S)-3-{[(3-{3-[3-(2-{2-[2-(2-{2-[2-(2-{2-[3-(2,5-Диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]-этокси}-этокси)-этокси]-этокси}-этокси)-этокси]-этокси}-этокси)-пропиониламино]-пропил-окси}-фенил)-карбонил]-амино}-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}-амино)-пропионо