Грануляты, содержащие эсликарбазепина ацетат
Иллюстрации
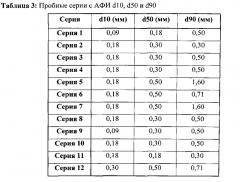
Показать всеГруппа изобретений относится к области фармацевтики. Описана твердая фармацевтическая композиция, содержащая эсликарбазепина ацетат и вспомогательные вещества, в виде гранул. При этом, по меньшей мере, 90% гранул композиции имеют размер частиц 1200 мкм или менее и, по меньшей мере, 90% гранул композиции имеют размер частиц 90 мкм или более и/или, по меньшей мере, 50% гранул композиции имеют размер частиц 250 мкм или более. Указанные гранулы имеют определенный размер частиц, определенный с помощью метода просеивания. Также описан способ получения гранулярной фармацевтической композиции эсликарбазепина ацетата. Изобретения обеспечивают единообразное распределение гранул с малым количеством небольших и крупных частиц. 3 н. и 65 з.п. ф-лы, 5 пр., 5 табл., 7 ил.
Реферат
Область изобретения
Настоящее изобретение относится к твердой фармацевтической композиции, содержащей эсликарбазепина ацетат (ESL), причем композиция находится в виде гранул, и, по меньшей мере, 90% гранул композиции имеют размер частиц около 90 мкм или более, и/или, по меньшей мере, 50% гранул композиции имеют размер частиц около 250 мкм или более. Настоящее изобретение также относится к способу получения гранулярной композиции, содержащей фармацевтически активное вещество, где, по меньшей мере, 90% полученных гранул имеют размер частиц около 90 мкм или более, и/или где, по меньшей мере, 50% полученных гранул с покрытием имеют размер частиц около 250 мкм или более.
Предпосылки к созданию изобретения
Документ WO 2009/054743 относится к композициям для перорального применения, содержащим эсликарбазепина ацетат, и к способам их приготовления. Тем не менее, этот документ не раскрывает гранулярные композиции, в которых, по меньшей мере, 90% гранул композиции имеют размер частиц около 90 мкм, и/или в которых, по меньшей мере, 50% гранул композиции имеют размер частиц около 250 мкм или более.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Согласно первому аспекту, настоящее изобретение предоставляет твердую фармацевтическую композицию для перорального применения, содержащую эсликарбазепина ацетат и одно или более фармацевтически приемлемых вспомогательных веществ, причем композиция находится в виде гранул, и где, по меньшей мере, 90% гранул композиции имеют размер частиц, по меньшей мере, около 90 мкм, и/или где, по меньшей мере, 50% гранул композиции имеют размер частиц, по меньшей мере, около 250 мкм.
Гранулы композиции имеют размер больший, чем известные частицы эсликарбазепина ацетата. Таким образом, достигается то преимущество, что гранулы растворяются медленнее. Это означает, что в этом случае менее вероятно, что пациент, принимающий эти гранулы почувствует неприятный вкус одного из ингредиентов композиции. Например, композицию можно добавлять в еду пациента. Более крупные гранулы будут растворяться в еде медленнее, так что при ее потреблении менее вероятно, что еда будет иметь неприятный вкус одного из ингредиентов композиции, например, эсликарбазепина ацетата.
Гранулы композиции относительно однородны по размеру, то есть разница между самым большим и самым маленьким размером частиц относительно небольшая. Это означает, что гранулы легче использовать, потому что, например, ими проще посыпать пищу или посыпать пищу более равномерно.
Также гранулы легче использовать в процессах производства. Например, их легче взвешивать. Их также легче упаковывать в пакеты типа саше. Кроме того, такие гранулы легче доставать из упаковки, например, из саше. Это означает, что гранулы легче принимать, также снижаются потери лекарственного препарата по сравнению с использованием порошков, которые легко прилипают к различным поверхностям, что является нежелательным.
Термин «гранула» означает частицу, которая является стабильным агрегатом (т.е. частицу, которая после гранулирования с использованием гранулирующих жидкостей и высушивания остается полностью или в значительной степени в агрегированной форме), образованным из многих частиц меньшего размера. Обычно в частице, образующей гранулу, могут быть идентифицированы частицы более мелкого размера. Термин «гранула» не означает какого-либо ограничения в отношении размера частицы, образующей гранулу. Тем не менее, как будет более подробно описано ниже, гранулы согласно изобретению могут иметь определенные ограничения в отношении размера частиц гранул. Согласно данному изобретению, все гранулы композиции или, по меньшей мере, гранулы, имеющие размер частиц 90 мкм или более, содержат эсликарбазепина ацетат и одно или более фармацевтически приемлемых вспомогательных веществ. Эти гранулы образуются в ходе процесса гранулирования, при котором с использованием эсликарбазепина ацетата и одного или более фармацевтически приемлемых вспомогательных веществ образуются гранулы для увеличения общего размера частиц компонентов.
Предпочтительно, гранулы (т.е. каждая гранула) содержат связующее вещество, которое помогает соединять эсликарбазепина ацетат и одно или более фармацевтически приемлемых вспомогательных веществ и сохранять их в виде гранулы, так, чтобы они не разбивались на более мелкие частицы.
В одном из вариантов осуществления изобретения, по меньшей мере, 90% гранул композиции имеют размер частиц, по меньшей мере, около 90 мкм. В других вариантах осуществления изобретения, по меньшей мере, 90% гранул композиции имеют размер частиц, по меньшей мере, около 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240 или 250 мкм.
В еще одном из вариантов осуществления изобретения, по меньшей мере, 50% гранул композиции имеют размер частиц, по меньшей мере, около 250 мкм. В других вариантах осуществления изобретения, по меньшей мере, 50% гранул композиции имеют размер частиц, по меньшей мере, около 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400 или 420 мкм.
В еще одном из вариантов осуществления изобретения, по меньшей мере, 90% гранул композиции могут иметь размер частиц, около 1600 мкм или менее. В качестве альтернативы, по меньшей мере, 90% гранул композиции могут иметь размер частиц, около 1550, 1500, 1450, 1400, 1350, 1300, 1250, 1200, 1150, 1100, 1050, 1000, 950, 900, 850, 800, 750, 700, 650, 600, 550, 500, 450, 420, 400, 350 или 300 мкм или менее.
В альтернативном варианте осуществления изобретения, по меньшей мере, 80% гранул композиции имеют размер частиц в диапазоне около 2000 мкм. В других вариантах осуществления изобретения, по меньшей мере, 80% гранул композиции имеют размер частиц в диапазоне около 1800, 1700, 1600, 1500, 1450, 1400, 1350, 1300, 1250, 1200, 1150, 1100, 1050, 1000, 950, 900, 850, 800, 750, 700, 650, 600, 550, 500, 450, 400, 350, 300, 250, 200, 150 или 100 мкм.
Специалистам известны методы измерения размеров частиц гранул, а также распределения гранул по размерам, и эти параметры могут быть легко измерены. Такие измерения могут проводиться с использованием, например, нескольких сит или лазерной дифракции.
Композиция содержит эсликарбазепина ацетат (название ИЮПАК: (S)-10-ацетокси-10,11-дигидро-5Н-дибенз[b,f]азепин-5-карбоксамид), который известен специалистам, также хорошо известны способы получения эсликарбазепина ацетата, например, из патента США №5,753,646.
В одном из вариантов осуществления изобретения композиция содержит от около 2% до около 98 мас. % эсликарбазепина ацетата. В некоторых таких вариантах осуществления изобретения композиция содержит, по меньшей мере, около 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14% или 15 мас. % эсликарбазепина ацетата. В некоторых таких вариантах осуществления изобретения композиция содержит до около 85%, 70%, 60%, 50%, 40%, 35%, 30%, 25%, 20% или 15 мас. % эсликарбазепина ацетата. В определенных вариантах осуществления изобретения количество эсликарбазепина ацетата в композиции может составлять от около 5 мас. % до около 85 мас. %, от около 7 мас. % до около 70 мас. %, от около 10 мас. % до около 50 мас. %, от около 5 мас. % до около 25 мас. % или от около 5 мас. % до около 15 мас. %.
Композиция может содержать наполнитель. В одном из вариантов осуществления изобретения композиция содержит от около 2% до около 98 мас. % наполнителя. В некоторых таких вариантах осуществления изобретения композиция содержит, по меньшей мере, около 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70% или 75 мас. % наполнителя. В некоторых таких вариантах осуществления изобретения композиция содержит до около 95%, 90%, 85%, 80% или 75 мас. % наполнителя. В определенных вариантах осуществления изобретения композиция содержит от около 15 мас. % до около 95 мас. %, от около 30 мас. % до около 90 мас. %, от около 50 мас. % до около 80 мас. %, от около 60 мас. % до около 90 мас. % или от около 70 мас. % до около 80 мас. % наполнителя.
Наполнителем может быть любой фармацевтически приемлемый наполнитель. Специалистам известны виды наполнителей, которые обычно используются в этой области деятельности для приготовления фармацевтических препаративных форм. Например, наполнитель может быть выбран из микрокристаллической целлюлозы, безводной лактозы, Cellactose® 80 (объединенные и переработанные 75% микрокристаллической целлюлозы и 25% лактозы), изомальта, двузамещенного кальция фосфата дигидрата, карбоната кальция, лактата кальция, двухосновного безводного фосфата кальция, трикальцийфосфата, силиката кальция, сульфата кальция, карбомера, кальций-карбоксиметилцеллюлозы, натрий-карбоксиметилцеллюлозы, целлюлозы, силикативированной микрокристаллической целлюлозы, ацетатцеллюлозы, рожкового дерева, хитозана, коповидона, кукурузного крахмала, предварительно клейстеризованного крахмала, декстратов, декстрина, декстрозы, эритритола, этилцеллюлозы, фруктозы, фумаровой кислоты, глицерилмоноолеата, глицерилмоностеарата, глицерилпальмитостеарата, гидроксиэтилцеллюлозы, гидроксиэтилметилцеллюлозы, гидроксипропил бетадекс, гидроксипропил целлюлозы, гидроксипропил-крахмала, гипромеллозы, гипромеллозы ацетатсукцината, каолина, лактитола, безводной лактозы, моногидрата лактозы, карбоната магния, оксида магния, мальтита, мальтодекстрина, мальтозы, маннита, метилцеллюлозы, пектина, полоксамера, поликарбофила, полидекстрозы, поли-D-L-молочной кислоты, полиэтиленгликоля, полиэтиленоксида, полиметакрилатов, полиоксиглицеридов, поливинилового спирта, повидона, шеллака, симетикона, альгината натрия, хлорида натрия, сорбита, крахмала, предварительно клейстеризованного крахмала, сахарозы, сахарной крупки, сульфобутилового эфира бета-циклодекстрина, диоксида титана, трегалозы, микрокристаллического воска, белого воска, желтого воска, ксантановой камеди, ксилита и зеина, или из любых комбинаций этих веществ.
В определенных вариантах осуществления изобретения наполнитель выбран из одного или более следующих материалов: лактоза, двузамещенный кальция фосфат дигидрат и изомальт. Предпочтительно, наполнителем является лактоза и двузамещенный кальция фосфат дигидрат; или изомальт и двузамещенный кальция фосфат дигидрат; или лактоза и изомальт. Более предпочтительно, наполнителем является лактоза и двузамещенный кальция фосфат дигидрат.
Когда наполнитель содержит лактозу, композиция, предпочтительно, содержит от около 5 мас. % до около 90 мас. % лактозы. В других вариантах осуществления изобретения композиция содержит, по меньшей мере, около 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45% или 50 мас. % лактозы. В определенных вариантах осуществления изобретения композиция содержит до около 85%, 80%, 75%, 70%, 65%, 60% или 55 мас. % лактозы. В определенных вариантах осуществления изобретения количество лактозы в композиции может составлять от около 5 мас. % до около 80 мас. %, от около 15 мас. % до около 75 мас. %, от около 25 мас. % до около 60 мас. % или от около 40 мас. % до около 60 мас. %.
Когда наполнитель содержит двузамещенный кальция фосфат дигидрат, композиция, предпочтительно, содержит от около 10 мас. % до около 50 мас. %. двузамещенного кальция фосфата дигидрата. Более предпочтительно, количество двузамещенного кальция фосфата дигидрата в композиции составляет от около 15 мас. % до около 50 мас. %, от около 10 мас. % до около 35 мас. %, от около 15 мас. % до около 30 мас. %, от около 15 мас. % до около 25 мас. % или от около 20 мас. % до около 25 мас. %.
Когда наполнитель содержит изомальт, композиция, предпочтительно, содержит от около 5 мас. % до около 90 мас. % изомальта. В таких определенных вариантах осуществления изобретения композиция содержит, по меньшей мере, около 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45% или 50 мас. % изомальта. В определенных вариантах осуществления изобретения композиция содержит до около 85%, 80%, 75%, 70%, 65%, 60% или 55 мас. % изомальта. В определенных вариантах осуществления изобретения количество изомальта в композиции может составлять от около 5 мас. % до около 80 мас. %, от около 15 мас. % до около 75 мас. %, от около 25 мас. % до около 60 мас. % или от около 40 мас. % до около 60 мас. %.
Композиция может содержать связующее вещество. Связующим веществом может являться любое фармацевтически приемлемое связующее вещество. Специалистам известны виды связующих веществ, которые обычно используются в этой области деятельности для изготовления фармацевтических препаративных форм. Например, связующее вещество может быть выбрано из аравийской камеди, агара, повидона, альгиновой кислоты, альгината кальция, карбоната кальция, лактата кальция, карбомера, кальций-карбоксилметилцеллюлозы, натрий-карбоксилметилцеллюлозы, каррагенана, микрокристаллической целлюлозы, фталата ацетата целлюлозы, рожкового дерева, церезина, хитозана, коповидона, кукурузного крахмала, предварительно клейстеризованного крахмала, кросповидона, декстратов хлопкового масла, декстрина, декстрозы, этилцеллюлозы, желатина, глицерил бегената, гуаровой камеди, гидроксиэтилцеллюлозы, гидроксиэтилметилцеллюлозы, гидроксипропилцеллюлозы, гидрогенизированного растительного масла типа I, гидроксипропил крахмала, гипромеллозы, гипромеллозы ацетатсукцината, гипромеллозы фталата, инулина, изомальта, лактозы, жидкой глюкозы, алюминия-магния силиката, мальтодекстрина, мальтозы, маннита, метилцеллюлозы, пектина, полоксамера, поликарбофила, полидекстрозы, полиэтиленоксида, полиметакрилатов, альгината натрия, крахмала, стеариновой кислоты, сахарозы, масла подсолнечника, трикаприлина, витамина Ε полиэтиленгликольсукцината, ксантановой камеди и зеина, или из любых комбинаций этих веществ.
В одном варианте осуществления изобретения связующее вещество выбрано из ксантановой камеди, гидроксипропил метилцеллюлозы, крахмала, альгината натрия и повидона. Предпочтительно, связующим веществом является повидон.
Композиция может содержать любое соответствующее количество связующего вещества. В определенном варианте осуществления изобретения композиция содержит от около 2 мас. % до около 15 мас. % связующего вещества. В других вариантах осуществления изобретения количество связующего вещества в композиции может составлять от около 5 мас. % до около 12 мас. % или от около 6 мас. % до около 10 мас. %.
В определенных вариантах осуществления изобретения композиция может содержать окрашивающее вещество. Кроме того, это окрашивающее вещество может быть рассредоточено в композиции, так, чтобы гранулы в поперечном сечении имели однородный цвет. Это позволяет определить, был ли процесс производства гранул осуществлен надлежащим образом. Например, если окрашивающее вещество не рассредоточено в композиции так, чтобы гранулы в поперечном сечении имели однородный цвет, это указывает на то, что производственный процесс не был осуществлен надлежащим образом. Такой вид идентификации является относительно несложным по сравнению с проведением тестов с гранулами. Таким образом, при каких-либо проблемах в процессе производства, они могут быть идентифицированы относительно легко и в кратчайшие сроки.
Также, все гранулы в целом могут иметь однородную окраску, так, чтобы каждая гранула в отдельности имела такую же окраску, как и остальные. Это, в свою очередь, также позволяет быстро и легко производить оценку правильности процесса производства. Если не все гранулы имеют однородную окраску, это указывает на то, что производственный процесс не был осуществлен надлежащим образом.
Еще одним преимуществом того, что все гранулы имеют однородную окраску, является то, что это делает гранулы более эстетически привлекательными для пациента, в частности, вследствие того, что в этом случае поврежденные (т.е. раздробленные) гранулы становятся менее заметными. Это означает, что пациенту может быть легче принимать гранулы, и это способствует соблюдению пациентом режима и схемы лечения.
Соответственно, в определенных вариантах осуществления изобретения, изобретение относится к способу оценки качества процесса производства гранул, раскрытых в настоящем документе, причем этот способ включает оценку однородности распределения окраски гранул, окраски одной отдельной гранулы (в поперечном сечении) и/или распределения окраски по всем гранулам композиции.
Однородность распределения окраски гранул (как окраски одной отдельной гранулы в поперечном сечении, так и распределения окраски по всем гранулам композиции) может измеряться с использованием любого метода, известного специалистам. Например, однородность окраски может измеряться с использованием колориметрического анализа.
Для колориметрических измерений может использоваться колориметр, например, Jasco V-650 CFR с программным обеспечением для колориметрического анализа. С помощью такого оборудования можно получить результаты измерений в различных системах цветового измерения:
- цветовое пространство XYZ, цветовая модель, заданная МКО (CIE, Международная комиссия по освещению) в 1931 г., где каждый символ XYZ представляет, соответственно красный, зеленый и синий; или
- цветовое пространство CIE 1976 L* a* b*, где L* означает светлоту, a* обозначает положение цвета в диапазоне от пурпурного до зеленого и b* обозначает положение цвета в диапазоне от желтого до синего, предложенное МКО в 1976 г. Этом метод является предпочтительным методом отражения результатов.
С помощью этого оборудования по нескольким пробам одной серии могут быть получены значения L*a*b*. Это позволить определить однородность окраски проб.
Существует также тест по методике Фармакопеи США (USP) (<1061> ЦВЕТ-ИНСТРУМЕНТАЛЬНЫЕ МЕТОДЫ АНАЛИЗА. См. Фармакопея США 31, Национальный формуляр 26, 2008, Роквилл), который подробно определяет тип инструмента и степень конверсии между двумя вышеуказанными цветовыми системами. Этот метод подробно описан ниже:
Наблюдаемый цвет объекта зависит от спектральной энергии излучения, поглощающих характеристик объекта и чувствительности зрения наблюдателя в пределах диапазона видимости. Подобным образом, важно, чтобы эти факторы учитывались при применении любого инструментального метода.
Любое инструментальное измерение цвета основано на том факте, что человеческий глаз распознает цвет с помощью трех «рецепторов». Следовательно, все цвета могут быть представлены как комбинация из трех цветовых стимулов, подобранных подходящим образом, чтобы они стимулировали все три рецептора в глазу. Несмотря на то, что для соответствия всем цветам не существует единого набора источников естественного света (т.е., для любых выбранных трех характеристик света, некоторые цвета требуют отрицательного количества одной или более характеристик света), были определены три условных стимула, с помощью которых можно определить все реальные цвета. Путем широкомасштабных экспериментальных исследований по цветовому соответствию с участием людей с нормальным цветовым восприятием, были измерены коэффициенты распределения для каждой длины волны видимого света (400 мкм - 700 мкм), и получено относительное количество стимулирования каждого рецептора, на который воздействуют излучением указанной длины волны. Эти коэффициенты распределения x, y, z, показаны ниже. Подобным образом, для любого цвета количество стимулирования каждого рецептора в глазу определяется набором трех цветовых компонентов светового потока (Χ, Υ и Ζ) для этого цвета.
Отношения между коэффициентом распределения (см. Фигуру 1) и тремя цветовыми компонентами приведены в уравнениях:
где
- это спектральная интенсивность источники света и fλ - это либо коэффициент спектрального отражения (ρλ), либо коэффициент спектрального пропускания (τλ) материала.
После того как были определены три цветовых компонента, они могут быть использованы для расчета цветовых координат в идеальном трехмерном цветовом пространстве, которое именуется «визуально однородное цветовое пространство». Было предпринято много попыток определить такое пространство, и было разработано много систем цветовых уравнений. Уравнения, которые приведены в настоящем документе, представляют компромиссное решение между простотой расчетов и соответствием идеальной модели.
Цветовые координаты в визуально однородном цветовом пространстве могут быть использованы для расчета цветового отклонения от выбранной контрольной точки. В случае, когда для определения результата теста используют инструментальный метод, когда требуется сравнение цвета тестового препарата с цветом стандартной или подходящей жидкости, сравниваемым параметром является разница, в визуально однородном цветовом пространстве, между цветом контрольной пробы и цветом тестового образца или стандартом.
ПРОЦЕДУРА
В спектрометрическом методе, значения отражения или пропускания получают на дискретной длине волны по всему спектру видимого излучения, с использованием ширины полосы 10 мкм или менее. Затем эти значения используются для расчета трех цветовых компонентов путем использования факторов взвешивания (типичные факторы взвешивания приведены в ASTM Ζ58.7.1-1951, в соответствии с публикацией в Журнале Американского оптического общества, том 41, 1951 г., стр. 431-439). В колориметрическом методе взвешивание осуществляют путем использования фильтров.
Для измерения спектрального отражения непрозрачных твердых веществ, угол зрения отделяют от угла освещения таким образом, что только лучи, диффузноотраженные от тестового образца попадают в рецептор. Зеркальное отражение и рассеянный свет не учитываются.
Для измерения коэффициента спектрального пропускания прозрачных жидкостей, образец подвергают воздействию излучения под углом 5 градусов от нормали, и измеряется перенесенная энергия исключительно в пределах 5 градусов от нормали. Цвет растворов изменяется в зависимости от толщины измеряемого слоя. За исключением тех случаев, когда из-за каких-либо особых соображений должны использоваться другие параметры, должен использоваться слой толщиной 1 см. Методы, описанные в настоящем документе, не могут применяться к мутным жидкостям или к полупрозрачным твердым веществам.
КАЛИБРОВКА
Для целей калибровки, может использоваться один из следующих эталонных материалов, в соответствии с устройством инструмента. При измерениях значения пропускания в качестве белого эталона может использоваться дистиллированная вода с установленным значением пропускания 1,000 на всех длинах волн. Затем значения трех цветовых компонентов Χ, Υ и Ζ для источника МКО С составляют 98,0, 100,0 и 118,1, соответственно. Для измерения могут использоваться опаковые керамические пластины, эталонным базисом которых является совершенный диффузный рефлектор, характеристики отражения которых определяются соответствующим устройством инструмента (Требующиеся элементы оборудования могут быть приобретены у компании BYK-Gardner, США, 2431 Линден-лэйн, г. Силвер-Спринг, штат Мэрилэнд 20910 или у компании Hunter Associates Laboratory, Inc., 11491 Сансет-Хиллс роуд, г. Рестон, штат Вирджиния 22090). Если из-за каких-либо физических параметров образца такие пластины не могут быть использованы, могут быть использованы сульфатно-бариевые белые стандарты отражения (подходящие материалы могут быть приобретены у компании Eastman Kodak Company, г. Рочестер, штат Нью-Йорк, 14650, наименование «Белый эталонный стандарт»). После калибровки с указанными выше материалами, желательно по возможности произвести измерения в отношении эталонного материала, близкого по цвету к образцу, насколько это возможно. Если тестируемый образец материала не пригоден к использованию его в качестве стандарта в течение долгого времени, могут использоваться цветовые плашки (цветовые карты Centroid Color Charts могут быть приобретены у производителей цветоизмерительных приборов), которые охватывают все визуально однородное цветовое пространство с мелкой градацией. Использование такого эталонного стандарта рекомендовано в качестве средства контроля за рабочими характеристиками прибора даже для абсолютного определения цвета.
СПЕКТРОФОТОМЕТРИЧЕСКИЙ МЕТОД
Отражательная способность или пропускающая способность в диапазоне 380-770 мкм может определяться через интервалы 10 мкм, и результаты могут быть представлены в процентном выражении, максимальное значение - 100,0. Затем три цветовых компонента Χ, Υ и Ζ могут быть рассчитаны следующим образом.
Отражающие материалы - Для отражающих материалов значения Χ, Υ и Ζ определяют следующим образом:
где
- коэффициент спектрального пропускания материала,
, ,
- известные значения, относящиеся к каждому эталонному источнику (типичные факторы взвешивания приведены в соответствии с публикацией в Журнале Американского оптического общества, том 41, 1951 г., стр. 431-439, и требующиеся элементы оборудования могут быть приобретены у компании ΒΥΚ-Gardner, США, 2431 Линден-лэйн, г. Силвер-Спринг, штат Мэрилэнд 20910 или у компании Hunter Associates Laboratory, Inc., 11491 Сансет-Хиллс роуд, г. Рестон, штат Вирджиния 22090) и Δλ выражается в мкм.
Светопропускающие материалы - Для светопропускающих материалов значения Χ, Υ и Ζ рассчитываются методом, указанным выше, где τλ (коэффициент спектрального пропускания) заменяется на ρλ.
КОЛОРИМЕТРИЧЕСКИЙ МЕТОД
Для получения значений, равных трем цветовым компонентам Χ, Υ и Ζ, может использоваться пригодный для этого колориметр (пригодный для получения трех цветовых компонентов колориметр может быть приобретен у компании BYK-Gardner, США, 2431 Линден-лэйн, г. Силвер-Спринг, штат Мэрилэнд 20910, или у компании Hunter Associates Laboratory, Inc., 11491 Сансет-Хиллс роуд, г. Рестон, штат Вирджиния 22090). Точность того, насколько результаты измерений, полученные с использованием фильтрового колориметра, соответствуют трем цветовым компонентам, может быть показана путем определения трех цветовых компонентов пластин с сильно насыщенными цветами и путем сравнения этих значений со значениями, полученными путем спектрометрических измерений с использованием спектрофотометра.
Интерпретация
КООРДИНАТЫ ЦВЕТА
Цветовые координаты, L*, а* и b* определяются следующим образом:
где Хo, Yo и Ζo - три цветовых компонента номинально белого или бесцветного стандарта и Υ/Υo>0,01. Обычно они равны трем цветовым компонентам стандартного источника света, причем значение Υo равняется 100,0. В этом случае Хo=98,0 и Ζo=118,1.
ЦВЕТОВОЕ РАЗЛИЧИЕ
Общее цветовое различие, ΔЕ*,
где ΔL*, Δа* и Δb* означают разницу цветовых координат по сравниваемым образцам. На результаты измерений могут оказывать влияние инструментальные переменные.
Окраска гранулы или гранул считается однородной, если цветовое различие (ΔЕ* (в соответствии с определением выше)) между двумя цветовыми координатами, имеющими наиболее удаленное друг от друга положение в цветовом пространстве, при измерениях в определенном месте гранулы или гранул, составляет менее 2,0. Это означает, что существуют незначительные вариации окраски гранулы или гранул, однако такие вариации могут быть слаборазличимы или полностью неразличимы человеческим глазом. Тестирование цветового различия (ΔЕ*) может осуществляться способом, описанным выше, например, с использованием теста по методике Фармакопеи США (USP) 1061. Предпочтительно, цветовое различие (ΔЕ*) составляет менее, чем около 1,9, 1,8, 1,7, 1,6, 1,5, 1,4, 1,3, 1,2, 1,1, 1,0, 0,9, 0,8, 0,7, 0,6 или 0,5.
Окрашивающим веществом может являться любое фармацевтически приемлемое окрашивающее вещество, которое придаст окраску гранулам. Специалистам известны виды окрашивающих веществ, которые обычно используются в этой области деятельности для изготовления фармацевтических препаративных форм. Например, окрашивающее вещество может содержать пигмент, выбранный из карбоната кальция, оксидов железа, лаков красителей, оксида титана, карамельных красителей, красителя «красный очаровательный АС», красителя «амарант», антоцианинов, азорубина, красителя «свекольный красный», кантаксантина, кармина, красителя D&C red 33, красителя «эозин YS», эритрозина, рубинового литола, флоксина В, понсо 4Р, красителя Red 2G, бета-каротина, каротиновых пигментов, куркумина, красителя «D&C желтый 10», красителя «хинолиновый желтый WS», рибофлавина, красителя «желтый солнечного заката FCF», тартразина, хлорофиллов и хлорофиллинов, медных комплексов хлорофиллов и хлорофиллинов, красителя «зеленый стойкий FCF», красителя «зеленый S», красителя «синий блестящий FCF», индиготина, красителя «синий патентованный V», красителя «бриллиантовый черный ΒΝ» и растительного угля или из комбинаций этих веществ. В одном из вариантов осуществления изобретения, окрашивающим веществом является красный краситель, такой как «Opadry 31K250002 красный» или «AquaPolish D красный». Окрашивающее вещество может также содержать пластификатор, связывающее вещество и, при необходимости, вещество-основу. К окрашивающему веществу может также быть добавлено смазывающее вещество (вещества). Например, пластификатор и/или связывающее вещество могут способствовать присоединению окрашивающего вещества к вспомогательным веществам и/или к внешней поверхности гранул для получения гранул с однородной окраской и с однородным покрытием. Специалистам известны пригодные пластификаторы, связывающие вещества, вещества основы и смазывающие вещества, но они могут также быть выбраны из списков, приведенных ниже.
Пластификаторы могут быть выбраны из ацетилтрибутилцитрата, бензилбензоата, хлорбутанола, декстрина, дибутилфталата, дибутилсебацината, диэтилфталата, диметилфталата, глицерина, глицерин моностеарата, маннита, минерального масла, спиртов ланолина, пальмитиновой кислоты, петролатума, полиэтиленгликоля, поливинилацетата, поливинилацетат фталата, пропиленгликоля, пирролидона, сорбита, стеариновой кислоты, триацетина, трибутилцитрата, триэтаноламина и триэтилцитрата или смеси двух или более этих веществ.
Связывающие вещества могут быть выбраны из карбомеров, декстрина, гипромеллозы и полимера поливинилметилового эфира с малеиновым ангидридом или смеси двух или более этих веществ.
Вещества основы могут быть выбраны из ацетилтриэтилцитрата, карбоната кальция, кальций-карбоксиметилцеллюлозы, натрий-карбоксиметилцеллюлозы, карнаубского воска, ацетата целлюлозы, фталата ацетата целлюлозы, церезина, цетилового спирта, хитозана, этилцеллюлозы, фруктозы, желатина, глицерина, глицерил бегената, глицерил пальмитостеарата, гидроксиэтилцеллюлозы, гидроксиэтилметилцеллюлозы, гидроксипропилцеллюлозы, гипромеллозы, фталата гипромеллозы, изомальта, латексных частиц, глюкозы, лактозы, мальтитола, мальтодекстрина, метилцеллюлозы, микрокристаллического воска, парафина, полоксамера, полидекстрозы, полиэтиленгликоля, полиэтиленоксида, поли-D-L-молочной кислоты, поливинилацетат фталата, поливинилового спирта, хлорида калия, повидона, шеллака, крахмала и его производных, сахарозы, оксида титана, трибутилцитрата, триэтилцитрата, ванилина, белого воска, ксилита и желтого воска или смеси двух или более этих веществ.
Смазывающие вещества могут быть выбраны из стеарата кальция, коллоидного диоксида кремния, глицерил бегената, глицерил моностеарата, глицерил пальмитостеарата, лейцина, оксида магния, силиката магния, стеарата магния, трисиликата магния, миристиновой кислоты, пальмитиновой кислоты, полоксамера, полиэтиленгликоля, бензоата натрия, лаурилсульфата натрия, стеарилфумарата натрия, стеариновой кислоты, талька, гидрогенизированного растительного масла и стеарата цинка или смеси двух или более этих веществ.
Композиция может содержать от около 1 мас. % до около 20 мас. % окрашивающего вещества. В определенных вариантах осуществления изобретения количество окрашивающего вещества в композиции может составлять от около 1 мас. % до около 15 мас. %, от около 1 мас. % до около 10 мас. % или от около 4 мас. % до около 8 мас. %.
Композиция может также содержать ароматизирующее вещество. Ароматизирующим веществом может являться любое фармацевтически приемлемое ароматизирующее вещество. Специалистам известны виды ароматизирующих веществ, которые обычно используются в этой области деятельности для изготовления фармацевтических препаративных форм. Например, ароматизирующее вещество может быть выбрано из шоколадного ароматизатора, ароматизаторов, использующихся при производстве жевательной резинки, кокосового ароматизатора, кофейного ароматизатора, фруктового ароматизатора (такого как ароматизатор «дикая вишня», «клубника», «банан», «виноград», «персик» и «малина»), масла перечной мяты, масла курчавой мяты, апельсинового масла, мятного ароматизатора, анисового ароматизатора, медового ароматизатора, ванильного ароматизатора, чайного ароматизатора, вербенового ароматизатора и различных фруктовых кислот, таких как лимонная кислота, аскорбиновая кислота и винная кислота или из смесей этих веществ. Композиция может содержать от около 0,05 мас. % до около 5 мас. % ароматизирующего вещества.
Композиция может также содержать подсластитель. Подсластителем может являться любой фармацевтически приемлемый подсластитель. Специалистам известны виды подсластителей, которые обычно используются в этой области деятельности для изготовления фармацевтических препаративных форм. Например, подсластитель может быть выбран из ацесульфама калия, аспартама, сахарозы, сукралозы, сахарина натрия, сахара, декстрозы, фруктозы, маннита, ксилита, алитама, глюкозы, лактита, мальтита, мальтозы, цикламата натрия, сорбита, глюконата и цикламата или из смесей этих веществ. Композиция может содержать от около 0,1 мас. % до около 10 мас. % подсластителя.
В определенном варианте осуществления, изобретение предоставляет твердую фармацевтическую композицию для перорального применения, содержащую эсликарбазепина ацетат и одно или более фармацевтически приемлемых вспомогательных веществ, причем композиция находится в виде гранул, и где, по меньшей мере, 90% гранул композиции имеют размер частиц 90 мкм или более, и/или где, по меньшей мере, 50% гранул композиции имеют размер частиц 250 мкм или более, причем композиция содержит от около 5 мас. % до около 15 мас. % эсликарбазепина ацетата, от около 70 мас. % до около 80 мас. % наполнителя, от около 2 мас. % до около 15 мас. % повидона, и от около 1 мас. % до около 10 мас. % окрашивающего вещества, причем наполнитель содержит лактозу и двузамещенный кальция фосфат дигидрат, причем композиция содержит от около 40 мас. % до около 60 мас. % лактозы и от около 15 мас. % до около 30 мас. % двузамещенного кальция фосфата дигидрата, и причем гранулы композиции в поперечном сечении имеют однородный цвет.
Как понятно специалистам, указанным одним или более фармацевтически приемлемыми вспомогательными веществами могут являться любые подходящие вспомогательные вещества, которые обычно используются в этой области деятельности для изготовления фармацевтических препаративных форм. Например, одним или несколькими фармацевтически приемлемыми вспомогательными веществами может являться любой фармацевтически приемлемый носитель, адъювант или вещество-основа. Фармацевтически приемлемые носители, адъюванты или вещества-основы, которые могут использоваться при изготовлении фармацевтических композиций по настоящему изобретению являются вещества, которые обычно используются для изготовления фармацевтических препаративных форм, и которые включают, помимо прочего, сахара, сахарные спирты, крахмалы, ионообменные вещества, оксид алюминия, стеарат алюминия, лецитин, сывороточные белки, такие как человеческий сывороточный альбумин, буферные вещества, такие как фосфаты, глицерин, сорбиновую кислоту, сорбат калия, частичные смеси глицерида с насыщенными растительными жирными кислотами, воду, соли или электролиты, такие как протаминсульфат, динатрия гидрофосфат, гидрофосфат калия, хлорид натрия, соли цинка, коллоидную окись кремния, трисиликат магния, поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, натрий-карбоксилметилцеллюлозу, полиакрилаты, воски, блок-сополимеры полиэтилена и полиоксипропилена, полиэтиленгликоль и шерстяной жир или комбинации этих веществ.
Фар