Способ отбора терапевтических средств
Иллюстрации
Показать всеНастоящее изобретение касается способа предварительной оценки, будет ли терапевтическое средство, выбранное из группы полипептид, антитело или иммуноадгезин, иметь необходимую скорость выведения у яванского макака, человека. Сущность способа заключается в том, что наносят покрытие с баскуловирусными частицами (BV) на микротитрационный планшет. Далее проводят контактирование терапевтического средства с BV и проводят измерение уровня связывания терапевтического средства с BV. Также проводят измерение связывания терапевтического средства с микротитрационным планшетом без BV. Показатель BV рассчитывают из среднего значения, полученного в анализах связывания, в которых измеряют уровень связывания терапевтического средства с BV, деленного на среднее значение, полученное в анализах связывания, в которых измеряют уровень связывания терапевтического средства без BV. Показатель BV выше 5 указывает на повышенную вероятность того, что терапевтическое средство будет иметь быструю скорость выведения, при этом быстрая скорость выведения выше 12 мл/кг/день, а показатель BV ниже 5 указывает на повышенную вероятность того, что терапевтическое средство будет иметь необходимую скорость выведения. Использование способа позволяет выявлять антитела, у которых наблюдается быстрое выведение из организма. 3 н. и 6 з.п. ф-лы, 12 ил., 1 табл., 12 пр.
Реферат
Ссылка на родственную заявку
Согласно настоящей заявке испрашивается приоритет в соответствии с предварительной заявкой на выдачу патента США № 61/650964, поданной 23 мая 2012 года, которая включена в настоящий документ с помощью ссылки в полном ее объеме.
Область техники
Настоящее изобретение относится к способам отбора для выявления терапевтических средств, которые подвержены повышенному риску быстрого выведения из организма людей или людей и яванских макак, и к способам снижения выведения такого терапевтического средства.
Уровень техники
Человеческие или гуманизированные моноклональные антитела стали вполне эффективными в качестве терапевтических средств от заболевания человека. На сегодняшний день более 30 антител получили одобрение FDA для лечения множества нарушений, при этом еще несколько сотен находятся на стадии клинического испытания.1 В дополнение к превосходной избирательности и высокой эффективности, которых можно достичь при помощи терапевтического средства на основе антитела, успех антител в качестве лекарственных средств в значительной степени обусловлен их, как правило, длинным периодом полувыведения из кровотока. Медленное выведение из крови дает возможность достижения необходимых концентраций лекарственного средства при редком введении дозы. Лекарственные средства на основе антитела обычно вводят посредством внутривенной инфузии или подкожного введения инъекцией, и менее частое введение повышает соблюдение больным режима лечения и, таким образом, клинический результат.
Антитела могут быть устранены из общего кровообращения посредством нескольких механизмов - внутриклеточного катаболизма после пиноцитоза (неспецифическое выведение), опосредованного антигеном выведения4 и в некоторых случаях в результате образования антител к терапевтическому средству (ATA). Опосредованное антигеном выведение, которое обычно наблюдают при связывании антител с фиксированным на клетке антигеном, является наиболее выраженным при низких концентрациях антитела, и его обычно можно нейтрализовать посредством повышения дозы антитела. Было отмечено, что АТА появляются через 4-7 дней после введения дозы, что включает образование иммунных комплексов, которые могут быстро выводиться, и иногда их можно легко определить по нетипичной форме профиля ʺконцентрация антител в плазме крови - времяʺ.
Устранение антитела замедляют с помощью FcRn-зависимого механизма рециркуляции. Поскольку антитело проходит по эндоцитозному пути, оно может связываться с FcRn при pH<6. Связывание с FcRn защищает IgG от катаболизма и способствует возврату к апикальной поверхности клетки, где он может быстро высвобождаться при pH (>7) крови. Эти средства в результате дают периоды полувыведения, составляющие 6-32 дней для человеческих или гуманизированных антител у людей (Keizer, R.J., Huitema, A.D.R., Schellens, J.H.M., Beijnen, J.H. Clinical Pharmacokinetics of Therapeutic Monoclonal Antibodies. Clinical Pharmacokinetics 49, 493-507 (2010)). На основании фармакокинетических данных с 12 антителами IgG1 определили среднее значение выведения у людей, составляющее 3,9±1,2 (стандартное отклонение) мл/кг/день с диапазоном ~2-6 мл/кг/день (Deng, R. et al. Projecting human pharmacokinetics of therapeutic antibodies from nonclinical data: What have we learned? 3: 61-66 (2011). Аналогично, исследования таких антител у яванских макак дали среднее выведение, составляющее 6,5±2,9 (стандартное отклонение) мл/кг/день. Конструирование Fc области антитела для увеличения связывания с FcRn при pH 6,0 может увеличить период полувыведения предполагаемых терапевтических антител у яванских макак и у мышей (Dall'Acqua, W.F., Kiener, Р.А. & Wu, Н. Properties of human IgG1s engineered for enhanced binding to the neonatal Fc receptor (FcRn). The Journal of biological chemistry 281, 23514-23524 (2006); Hinton, P.R. et al. An Engineered Human IgG1 Antibody with Longer Serum Half-Life. J Immunol 176, 346-356 (2006); Yeung, Y.A. et al. Engineering human IgG1 affinity to human neonatal Fc receptor: impact of affinity improvement on pharmacokinetics in primates. J Immunol 182, 7663-7671 (2009); Zalevsky, J. et al. Enhanced antibody half-life improves in vivo activity. Nature biotechnology 28, 157-159 (2010)).
Доклиническое тестирование предполагаемого терапевтического антитела у релевантных видов, за исключением человека, необходимо для получения представления о предполагаемой схеме дозирования у людей и для оценки предполагаемых уровней токсичности. С учетом высокой гомологии целевой последовательности антигена между человеком и остальными приматами (NHP) и сходными аффинностями связывания с рециркулирующим рецептором FcRn (Dall'Acqua, Kiener & Wu, supra), яванский макак являет предпочтительным видом для доклинических фармакокинетических (PK) и токсикологических исследований. Ранее мы показали, что неспецифическое выведение терапевтических антител IgG1, выявляемое у людей, составляет обычно половину, измеряемого у яванских макак (Deng, R. et al., supra).
Одним возможным механизмом для более быстрого, чем ожидаемого выведения является нецелевое связывание13-16. Несмотря на то что высокоспецифичное нецелевое связывание иногда можно выявить и устранить14, чаще всего нецелевое связывание имеет неизвестное происхождение и является сложным для нейтрализации путем повышения дозы. Системы in vitro для оценки и прогноза механизмов абсорбции, распространения, метаболизма и выведения in vivo или фармакокинетических свойств антител in vivo на данный момент пока еще не созданы. Мы пытались разработать анализы неспецифичного связывания in vitro, которые могут быть пригодны для определения антител, у которых можно наблюдать быстрое выведение in vivo.
Краткое описание чертежей
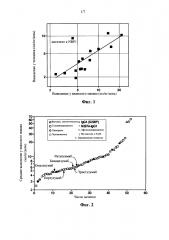
Фигура 1 представляет собой график, на котором отображена корреляция значений выведения антител, измеренных у людей и яванских макак (ρ=0,74, n=16). Для наших анализов выбирали дозы антитело, которые, по предположению, нейтрализуют любое целевое выведение. Сплошная линия представляет собой построенную кривую линейной регрессии логарифма выведения у человека к логарифму выведения у яванского макака. Для большинства показанных антител выведение у человека приблизительно в 2 раза медленнее, чем соответствующее выведение у яванского макака. В противоположность этому, для антитела к NRP1 выведение у человека (9,2 мл/кг/день) в ~2-раза быстрее, чем выведение у яванского макака (4,3 мл/кг/день).
Фигура 2 представляет собой график, на котором представлены значения выведения антител (n=52) у яванских макак. Средние геометрические значения показаны у групп доз, в которых полагали, что вклад любого специфичного выведения для указанного выведения был незначительным. За исключением 4 исследований средние значения составляют 3 или более животных. Показаны гуманизированные (круг), человеческие (квадрат), синтетические человеческие производные от фага (треугольник) и химерные (ромб) антитела. Закрашенные символы указывают на антитела с легкой лямбда-цепью, все остальные имеют легкую каппа-цепь. Антитела изотипа IgG4, имеющие стабилизирующую шарнир мутантную S228P, помечены при помощи ʺxʺ, все другие имеют изотип IgG1. Горизонтальная линия в геометрической форме указывает на афукозилированное антитело. Агликозилированные антитела, полученные посредством замены Asn297 на Ala, указаны с помощью точки в геометрической форме. Антитела с аминокислотными замещениями в Fc для модулирования связывания с FcgammaR указаны посредством вертикальной линии в геометрической форме.
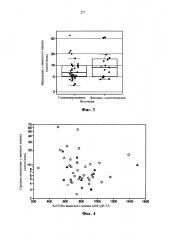
Фигура 3 представляет собой коробчатую диаграмму, на которой показано сравнение значений выведения у яванских макак гуманизированных и синтетических человеческих антител, полученных из библиотек фагового дисплея. Химерные антитела (n=1) и человеческие антитела из нефаговых источников (n=3) не показаны по причине очень малого размера наборов данных. На графиках показаны отдельные значения данных с наложенными коробчатыми диаграммами. С помощью коробчатой диаграммы прямоугольной формы показана межквартильная зона (IQR) между первой квартилью (25-ая процентиль) и третей квартилью (75-ая процентиль); более тонкая горизонтальная линия в коробчатой диаграмме прямоугольной формы соответствует медиане (50-ая процентиль). Нижний ʺусʺ диаграммы вида ʺящик с усамиʺ проходит до наименьшего значения данных, которое все еще находиться в 1,5 IQR нижнего квартиля, а верхний ʺусʺ проходит до наиболее высокого значения данных в 1,5 IQR верхнего квартиля.
На фигуре 4 показано взаимоотношение между выведением антител у яванских макак и аффинностью связывания (KD, pH 5,8) с FcRn яванского макака. Использованы символы, которые определены для фигуры 2. Константы диссоциации (KD) в нМ определяли по результатам статистического анализа данных SPR, как описано в работе Yeung et al., 2010. Используемые символы являются такими же, как и для фигуры 2.
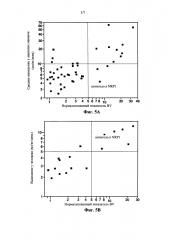
На фигуре 5 показана связь значения выведения антител у А) яванского макака и В) человека с нормализированным показателем BV ELISA. Показатель BV ELISA>5 связан с повышенным риском быстрого выведения у яванского макака (ρ=0,53, n=45). Показатель BV рассчитывали из средних значений 6 определений, каждое определение нормализовали путем деления на сигнал, наблюдаемый для непокрытых лунок на том же аналитическом планшете. Из антител с показателем BV<5, 12% характеризовались выведением >10 мл/кг/день у яванского макак, в то время как для 75% антител с показателем BV>5 выведение превышает 10 мл/кг/день. Оценка по методу максимального правдоподобия соотношения шансов составляет 19,5 (точный критерий Фишера, 95% доверительный интервал (3,3, 165,7)). Доверительный интервал свидетельствует о 3,3-166-кратном повышении вероятности более быстрого выведения при BV>5; такой интервал не содержит 1 и подразумевает статистическую значимость. В) Показатель BV ELISA>5 ассоциирован с повышенным риском быстрого выведения у человека (ρ=0,83, n=16).
На фигурах 6-8 показано взаимоотношение между выведением антител у яванских макак и антителом в отношении A) pI, В) гидрофобности, измеренной посредством HIC, и С) заряда, рассчитанного для домена Fv, соответственно.
На фигуре 9 показано, что выведение и показатели BV ELISA у яванского макака коррелируют.
На фигуре 10 показано, что корреляция между выведением и нормализированным показателем BV у яванского макака сохраняется между тестируемыми антителами IgG1, имеющими каркасные цепи HIII и каппа 1 и различные CDR и положения остатков зоны Вернье.
На фигуре 11 показано, что корреляция между выведением у человека и показателями BV ELISA сохраняется даже для антител к NRP-1.
На фигуре 12 показан возможная каскадная схема скрининга для уменьшения риска быстрого выведения.
Подробное описание изобретения
В настоящем документе описан анализ, основанный на определении связывания с бакуловирусными (BV) частицами, который пригоден для оценки нецелевого связывания терапевтических средств. Этот анализ можно применять, наряду с прочими, в ходе определения потенциальных антител или их оптимизации для повышения вероятности получение подходящего лекарственного средства.
Посредством тестирования крупной панели антител в анализе по настоящему изобретению и анализа результатов тестирования с фармакокинетическими данными таких же антител у яванских макак и, если возможно, у людей, мы определили, что изменение взаимодействия с рециркулирующим рецептором FcRn не обусловливает более быстрое, чем ожидалось, выведение, наблюдаемое для таких антител. Мы не обнаружили, что выведение связано с изоэлектрической точкой (pI) или гидрофобностью интактного антитела, о чем сообщали другие авторы. По нашему мнению, нецелевое связывание обусловливает быстрое выведение большого количества антител, несмотря на то, что в большинстве случаев такие нецелевые связывания не были выявлены. Это затратные по времени и дорогие для осуществления фармакокинетические исследования на приматах, за исключением людей. До настоящего изобретения сложно было прогнозировать потенциальные вклады нецелевых связываний в фармакокинетическом профиле до проведения таких фармакокинетических исследований in vivo. Мы разработали недорогостоящий анализ in vitro с более высокой производительностью, который прост для реализации и который можно применять для облегчения отбора терапевтических кандидатов с более высокой вероятностью наличия соответствующих фармакокинетических свойств и отбраковки терапевтических кандидатов с более высокой вероятностью несоответствующих фармакокинетических свойств у людей и других приматов.
Теперь настоящее изобретение будет подробно описано с помощью простого обзора с применением приведенных далее определений и примеров. Все патенты и публикации, включая все последовательности в таких патентах и публикациях, на которые ссылаются в настоящем описании, однозначно включены при помощи ссылки.
ʺТерапевтическое средствоʺ относится к средству, которое может быть пригодным для лечения заболевания. Согласно одному варианту осуществления терапевтическое средство включает одну или несколько полипептидных последовательностей. Согласно другому варианту осуществления терапевтическое средство включает последовательность антитела. Согласно другому варианту осуществления терапевтическое средство представляет собой иммуноконъюгат.
Применяемое в настоящем документе сокращение ʺBVʺ относится к бакуловирусной частице.
Применяемое в настоящем документе выражение ʺпоказатель BVʺ относится к значению, рассчитанному из среднего значений, полученных по результатам нескольких (2 или более) анализов связывания, в которых измеряют уровень связывания терапевтического средства с бакуловирусной частицей.
ʺНормализированный показатель BVʺ относится к показателю BV, в котором значение, полученное по результатам каждого анализа связывания, было нормализировано перед расчетом среднего значения. Согласно одному варианту осуществления нормализацию осуществляют посредством деления значения, полученного по результатам каждого анализа связывания с BV, на значение, наблюдаемого в анализе необработанного образца (т.е. без BV). Согласно одному примеру, значение OD, полученное по результатам каждого анализа связывания с BV, делят на среднее значение от значений OD, наблюдаемых для лунок без покрытия.
ʺПовышенный рискʺ или ʺповышенная вероятностьʺ относятся к более высокой возможности того, что событие произойдет.
ʺБыстрое выведениеʺ относится к скорости выведения средства у человека или яванского макака. Согласно одному варианту осуществления высокая скорость выведения является любой скоростью, которая составляет больше 10 мл/кг/день. Согласно одному варианту осуществления высокая скорость выведения является любой скоростью, которая составляет больше 12 мл/кг/день.
ʺНеобходимое выведениеʺ относится к необходимой скорости выведения средства у человека или яванского макака. Согласно одному варианту осуществления необходимая скорость выведения является скоростью, которая составляет 8,5 мл/кг/день или менее. Согласно другому варианту осуществления необходимая скорость выведения является скоростью, которая составляет 12 мл/кг/день или менее.
Применяемый в настоящем описании термин ʺиммуноадгезинʺ обозначает антитело-подобные молекулы, которые сочетают в себе специфичность связывания гетерологичного белка (ʺадгезинаʺ) с эффекторными функциями константных доменов иммуноглобулина. Структурно иммуноадгезины представляют собой гибрид аминокислотной последовательности с необходимой специфичностью связывания, которая отличается от участка распознавания и связывания антигена у антитела (т.е. является ʺгетерологичнымʺ), и последовательности константного домена иммуноглобулина. Адгезиновая часть иммуноадгезиновой молекулы, как правило, представляет собой непрерывную аминокислотную последовательность, содержащую по меньшей мере участок связывания рецептора или лиганда. Последовательность константного домена иммуноглобулина в иммуноадгезине можно получить из любого иммуноглобулина, такого как подтипы IgG-1, IgG-2, IgG-3 или IgG-4, IgA (включая IgA-1 и IgA-2), IgE, IgD или IgM.
ʺГибридный белокʺ и ʺгибридный полипептидʺ относятся к полипептиду, имеющему по меньшей мере две ковалентно связанных друг с другом части, причем каждая из частей представляет собой полипептид, имеющий собственное свойство. Свойством может быть биологическое свойство, такое как активность in vitro или in vivo. Свойством также может быть сходное химическое свойство или физическое свойство, такое как связывание с целевой молекулой, катализ реакции и т.п. Части могут быть связаны напрямую посредством отдельной пептидной связи или посредством пептидного линкера, содержащего один или несколько аминокислотных остатков. Обычно, части и линкер будут находиться в рамке считывания друг с другом.
Термин ʺантителоʺ в настоящем документе используется в наиболее широком смысле и охватывает различные структуры по типу антител, в том числе без ограничения моноклональные антитела, поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела) и фрагменты антител при условии, что у них наблюдают необходимую антиген-связывающую активность.
ʺФрагмент антителаʺ относится к отличной от интактного антитела молекуле, которая содержит часть интактного антитела, связывающуюся с антигеном, с которым связывается интактное антитело. Примеры фрагментов антитела включают без ограничения Fv, Fab, Fab', Fab'-SH, F(ab')2; диатела, линейные антитела, молекулы одноцепочечных антител (например, scFv) и мультиспецифические антитела, образованные из фрагментов антител.
ʺАнтитело, которое связывается со тем же эпитопомʺ, в качестве эталонного антитела относится к антителу, которое блокирует связывание эталонного антитела с его антигеном в конкурентном анализе на 50% или более, и наоборот, эталонное антитело блокирует связывание антитела с его антигеном в конкурентном анализе на 50% или более. Иллюстративный конкурентный анализ приведен в настоящем документе.
Термин ʺхимерноеʺ антитело относится к антителу, у которого часть тяжелой и/или легкой цепи происходит от конкретного источника или вида, в то время, как другая тяжелая и/или легкая цепь происходит от другого источника или вида.
ʺКлассʺ антитела относится к типу константного домена или константной области, содержащемуся в его тяжелой цепи. Существует пять основных классов антител: IgA, IgD, IgE, IgG и IgM, и некоторые из них можно дополнительно разделить на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называют α, δ, ε, γ и μ, соответственно.
Используемый в настоящем документе термин ʺцитотоксическое средствоʺ относится к веществу, которое подавляет или препятствует клеточной функции и/или приводит к смерти или разрушению клетки. Цитотоксические средства включают без ограничения радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu), химиотерапевтические средства или лекарственные средства (например, метотрексат, адриамицин, алкалоиды барвинка (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин С, хлорамбуцил, даунорубицин или другие интеркалирующие средства), ингибиторы роста, ферменты и их фрагменты, такие как нуклеолитические ферменты, антибиотики, токсины, такие как низкомолекулярные токсины или ферментативно активные токсины бактериального, грибного, растительного или животного происхождения, включая их фрагменты и/или варианты, и раскрытые ниже различные противоопухолевые и противораковые средства.
ʺЭффекторные функцииʺ относятся к таким биологичеким активностям, которые связаны с Fc-областью антитела и варьируют в зависимости от изотипа антитела. Примеры эффекторных функций антитела включают: связывание C1q и комплементзависимую цитотоксичность (CDC), связывание рецепторов Fc, антителозависимую клеточноопосредованную цитотоксичность (ADCC), фагоцитоз, даун-регуляцию рецепторов на клеточной поверхности (например, рецептора B-клеток) и B-клеточную активацию.
ʺЭффективное количествоʺ средства, например, фармацевтического состава, относится к количеству, эффективному при дозировках и в течение периодов времени, необходимых для достижения необходимого терапевтического или профилактического результата.
Термин ʺFc областьʺ в настоящем документе используют для обозначения C-концевой области иммуноглобулиновой тяжелой цепи, которая содержит по меньшей мере часть константной области. Термин включает Fc области с нативной последовательностью и вариантные Fc области. В соответствии с одним вариантом осуществления Fc область тяжелой цепи IgG человека длиться от Cys226, или от Pro230, до карбоксильного конца тяжелой цепи. Однако, C-концевой лизин (Lys447) Fc области может присутствовать или может не присутствовать. Если в настоящем документе не указано иное, нумерация аминокислотных остатков в Fc области или константной области соответствует системе нумерации EU, также называемой EU-нумерация, которая описана в работе Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, 1991.
ʺКаркасʺ или ʺFRʺ относится к остаткам вариабельного домена, отличным от остатков гипервариабельной области (HVR). FR вариабельного домена обычно состоит из четырех FR доменов: FR1, FR2, FR3 и FR4. Соответственно, последовательности HVR и FR обычно представлены в следующей последовательности в VH (или VL): FR1-Н1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
Термины ʺантитело полной длиныʺ, ʺинтактное антителоʺ и ʺцелое антителоʺ используют в настоящем документе взаимозаменяемо для обозначения антитела со структурой, практически схожей со структурой естественного антитела, или с тяжелыми цепями, которые содержат описываемую в настоящем документе Fc область.
Термины ʺклетка-хозяинʺ, ʺлиния клеток-хозяевʺ и ʺкультура клеток-хозяевʺ используют взаимозаменяемо, и они обозначают клетки, в которые была введена экзогенная нуклеиновая кислота, включая потомство таких клеток. Клетки-хозяева включают ʺтрансформантовʺ и ʺтрансформированные клеткиʺ, которые включают первично трансформированную клетку и полученное от нее потомство без учета числа пересевов. Потомство может не быть полностью идентичным по содержанию нуклеиновых кислот с родительской клеткой, но может содержать мутации. Настоящее изобретение относится к мутантному потомству, которое характеризуется такой же функциональной или биологической активностью, по которой проводят скрининг или отбор у изначально трансформированной клетки.
ʺИммуноконъюгатʺ представляет собой антитело, конъюгированное с одной или несколькими гетерологичными молекулами, включая без ограничения цитотоксическое средство или средство для детекции.
Термин ʺдетекцияʺ понимают как включающий детекцию наличия или отсутствия вещества или определение количества вещества. Таким образом, термин относится к применению материалов, композиций и способов по настоящему изобретению для качественных и количественных определений.
ʺИндивидуумʺ или ʺсубъектʺ является млекопитающим. Млекопитающие включают без ограничения одомашненных животных (например, коров, овец, кошек, собак и лошадей), приматов (например, людей и остальных приматов, таких как макаки), кроликов и грызунов (например, мышей и крыс). В соответствии с некоторыми вариантами осуществления индивидуумом или субъектом является человек.
ʺВыделенноеʺ антитело представляет собой антитело, которое было отделено от компонента его естественного окружения. В соответствии с некоторыми вариантами осуществления антитело очищено до степени чистоты, превышающей 95% или 99%, с помощью, например, электрофореза (например, SDS-PAGE, изоэлектрического фокусирования (IEF), капиллярного электрофореза) или хроматографии (например, ионообменной или обращенно-фазовой HPLC). Обзор способов оценки степени чистоты антитела см., например, в работе Flatman et al. J. Chromatogr. В 848: 79-87 (2007).
ʺВыделеннаяʺ нуклеиновая кислота обозначает молекулу нуклеиновой кислоты, которая была отделена от компонента его естественного окружения. Выделенная нуклеиновая кислота включает молекулу нуклеиновой кислоты, содержащуюся в клетках, которые обычно содержат молекулу нуклеиновой кислоты, но молекула нуклеиновой кислоты присутствует вне хромосомы или в местоположении на хромосоме, которое отличается от его естественного местоположения на хромосоме.
ʺВыделенная нуклеиновая кислота, кодирующая антителоʺ относится к одной или нескольким молекулам нуклеиновой кислоты, кодирующим антитело с тяжелой и легкой цепями (или их фрагментами), включая такую молекулу(ы) нуклеиновой кислоты в отдельном векторе или разделенных векторах, и такая молекула(ы) нуклеиновой кислоты присутствуют в одном или нескольких местоположениях в клетке-хозяине.
Используемый в настоящем документе термин ʺмоноклональное антителоʺ относится к антителу, получаемому из совокупности практически однородных антител, т.е. формирующие популяцию отдельные антитела являются идентичными и/или связываются с одним эпитопом, за исключением возможных вариантных антител, например, содержащих природные мутации или образовавшихся в ходе получения препарата моноклональных антител, причем такие варианты обычно присутствуют в незначительных количествах. В отличие от препаратов поликлональных антител, которые, как правило, включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело из препарата моноклональных антител направлено против одной детерминанты на антигене. Таким образом, определение ʺмоноклональноеʺ указывает на признак антитела как получаемого из практически однородной совокупности антител, и его не следует рассматривать как нуждающееся в получении каким-либо конкретным способом антитело. Например, моноклональные антитела, подлежащие применению в соответствии с настоящим изобретением, могут быть получены с помощью ряда методик, включая без ограничения способ гибридом, способы с использованием рекомбинантной ДНК, способы фагового дисплея и способы с использованием трансгенных животных, содержащих все иммуноглобулиновые локусы человека или их часть, причем в настоящем документе описаны такие способы и другие иллюстративные способы получения моноклональных антител.
Термин ʺголое антителоʺ относится к антителу, которое не конъюгировано с гетерологичной частью (например, цитотоксичной частью) или радиоактивной меткой. Голое антитело может присутствовать в фармацевтическом составе.
Термин ʺестественные антителаʺ относится к встречающимся в природе молекулам иммуноглобулина с различными структурами. Например, естественные IgG-антитела представляют собой гетеротетрамерные гликопротеины массой приблизительно 150000 дальтон, состоящие из двух идентичных легких цепей и двух идентичных тяжелых цепей, которые связаны дисульфидными мостиками. От N- до C-конца каждая тяжелая цепь имеет вариабельную область (VH), также называемую вариабельным тяжелым доменом или вариабельным доменом тяжелой цепи, за которой следует три константных домена (CH1, CH2 и CH3). Аналогично, от N- до C-конца каждая легкая цепь имеет вариабельную область (VL), также называемую вариабельным легким доменом или вариабельным доменом легкой цепи, за которой следует константный домен (CL). Легкая цепь антитела может быть отнесена к одному из двух типов, называемых каппа (κ) и лямбда (λ), на основании аминокислотной последовательности ее константного домена.
Термин ʺлистовка-вкладыш в упаковкеʺ используют для обозначения инструкций, традиционно включаемых в коммерческие упаковки терапевтических продуктов, которые содержат информацию о показаниях, применении, дозировке, введении, комбинированной терапии, противопоказаниях и/или предупреждениях касательно применения таких терапевтических продуктов.
Термин ʺфармацевтический составʺ относится к препарату, который находится в такой форме, которая дает возможность биологической активности описанного в настоящем документе активного ингредиента быть эффективной, и который не содержит дополнительных компонентов, являющихся неприемлемо токсичными для субъекта, которому будет введен состав.
ʺФармацевтически приемлемый носительʺ относится к ингредиенту в фармацевтическом составе, отличному от активного ингредиента, который является нетоксичным для субъекта. Фармацевтически приемлемый носитель включает без ограничения буфер, вспомогательное средство, стабилизирующее средство или консервант.
Применяемый в настоящем описании термин ʺлечениеʺ (и ее грамматические вариации, такие как ʺлечитьʺ или ʺпроведение леченияʺ) относится к клиническому вмешательству в попытке изменить течение болезни подвергаемого лечению индивидуума, и ее можно осуществлять либо для профилактики, либо в ходе протекания клинической патологии. Необходимые эффекты лечения включают без ограничения предупреждение проявления или рецидива заболевания, ослабление симптомов, уменьшение любых прямых или непрямых патологических последствий заболевания, предупреждение метастаза, понижение скорости прогрессирования заболевания, уменьшение интенсивности или ослабление течения заболевания и ремиссию или улучшенный прогноз. В соответствии с некоторыми вариантами осуществления антитела по настоящему изобретению применяют для задержки развития заболевания или замедления прогрессирования заболевания.
Термин ʺвариабельная областьʺ или ʺвариабельный доменʺ относится к домену тяжелой или легкой цепи антитела, который вовлечен в связывание антитела с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL, соответственно) естественного антитела обычно имеют подобные структуры, причем каждый домен содержит четыре консервативных каркасных области (FR) и три гипервариабельных области (HVR). (См., например, Kindt et al. Kuby Immunology, 6th ed., W.H. Freeman and Co., page 91 (2007).) Одного домена VH или VL может быть достаточно для придания антиген-связывающей специфичности. Кроме того, связывающиеся с конкретным антигеном антитела могут быть выделены с помощью домена VH или VL из связывающегося с антигеном антитела для скрининга библиотеки, соответственно, комплементарных доменов VL или VH. См., например, Portolano et al., J. Immunol. 150: 880-887 (1993); Clarkson et al., Nature 352: 624-628 (1991).
Используемый в настоящем документе термин ʺвекторʺ относится к молекуле нуклеиновой кислоты способной, размножить другую нуклеиновую кислоту, с которой она связана. Термин включает вектор как самореплицирующуюся структуру нуклеиновой кислоты, а также вектор, встроенный в геном клетки-хозяина, в которую он был введен. Некоторые векторы способны к управлению экспрессии нуклеиновых кислот, с которыми они функционально связаны. Такие векторы в настоящем документе называют ʺвекторами экспрессии.ʺ
В соответствии со следующим аспектом антитело согласно любому из описанных выше вариантов осуществления может включать любой из признаков, отдельно или в комбинации, которые описаны ниже в разделах 1-7.
1. Аффинность антитела
В соответствии с некоторыми вариантами осуществления приведенное в настоящем описании антитело характеризуется константой диссоциации (Kd)≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ или ≤0,001 нМ (например, 10-8 М или меньше, например, от 10-8 М до 10-13 М, например, от 10-9 М до 10-13 М).
В соответствии с одним вариантом осуществления Kd измеряют посредством анализа связывания с меченным радиоактивным изотопом антигеном (RIA), осуществляемого при помощи Fab версии представляющего интерес антитела и его антигена, которая описана посредством приведенного далее анализа. Аффинность связывания в растворе Fab с антигеном измеряют посредством уравновешивания Fab с минимальной концентрацией (125I)-меченного антигена в присутствии серии титров антигена без метки, затем захвата связанного антигена при помощи планшета с покрытием антителом к Fab (см., например, Chen et al., J. Mol. Biol. 293: 865-881 (1999)). Для создания условий для анализа многолуночные планшеты MICROTITER® (Thermo Scientific) покрывали в течение ночи 5 мкг/мл антитела для захвата Fab (Cappel Labs) в 50 мМ карбоната натрия (pH 9,6), а затем блокировали при помощи 2% (масса/объем) бычьего сывороточного альбумина в PBS в течение от двух до пяти часов при комнатной температуре (примерно 23°C). В планшете без абсорбента (Nunc № 269620) 100 пМ или 26 пМ [1251]-антигена смешивали с серийными разведениями представляющего интерес Fab (например, соответствующих результатам оценки антитела к VEGF, Fab-12, у Presta et al., Cancer Res. 57: 4593-4599 (1997)). Представляющий интерес Fab затем инкубировали на протяжении ночи, однако, инкубацию можно было продолжать в течение более длительного периода (например, приблизительно 65 часов), чтобы убедиться, что равновесие было достигнуто. После этого смеси переносили в планшет для захвата для инкубирования при комнатной температуре (например, в течение одного часа). Затем удаляли раствор, а планшет промывали восемь раз при помощи 0,1% полисорбата 20 (TWEEN-20®) в PBS. После высушивания планшетов добавляли 150 мкл/лунка сцинтиллятора (MICROSCINT-20 ТМ; Packard) и планшеты считывали на счетчике гамма-излучения TOPCOUNT ТМ (Packard) в течение десяти минут. Концентрации каждого Fab, который давал меньше или равно 20% от максимального связывание, отбирали для использования в конкурентно-связывающих анализах.
В соответствии с другим вариантом осуществления Kd измеряли при помощи анализа поверхностного плазмонного резонанса с применением BIACORE®-2000 или BIACORE®-3000 (BIAcore, Inc., Пискатауэй, Нью-Джерси) при 25°C с чипами с иммобилизированным антигеном СМ5 при ~10 единицах ответа (RU). Коротко говоря, микрочипы с карбоксиметилдекстрановым покрытием для биосенсора (СМ5, BIACORE, Inc.) активировали при помощи N-этил-N'-(3-диметиламинопропил)-карбодиимидгидрохлорида (EDC) и N-гидроксисукцинимида (NHS) в соответствии с инструкциями поставщика. Антиген разводили при помощи 10 мМ ацетата натрия, pH 4,8, до 5 мкг/мл (~0,2 мкМ) перед введением инъекцией со скоростью потока 5 мкл/минуту для достижения приблизительно 10 единиц ответа (RU) связавшегося белка. После введения инъекцией антигена вводили 1 М этаноламин инъекцией для блокировки не вступивших в реакцию групп. Для кинетических измерений двухкратные серийные разведения Fab (от 0,78 нМ до 500 нМ) вводили инъекцией в PBS с 0,05% поверхностно-активным средством (PBST) полисорбат 20 (TWEEN-20TM) при 25°C со скоростью потока примерно 25 мкл/мин. Скорости ассоциации (kon) и скорости диссоциации (koff) рассчитали при помощи простой модели связывания Ленгмюра ʺодин к одномуʺ (программное обеспечение BIACORE® Evaluation Software, версия 3.2) посредством одновременного приближения сенсограмм ассоциации и диссоциации. Равновесную константу диссоциации (Kd) рассчитывали как соотношение koff/kon. См., например, работу Chen et al., J. Mol. Biol. 293: 865-881 (1999). Если скорость ассоциации превышала 106 М-1 с-1 по данным описанного выше анализа поверхностного плазмонного резонанса, то скорость ассоциации можно было определить посредством методики гашения флуоресценции, с помощью которой измеряли повышение или понижение интенсивность испускания флуоресценции (возбуждение = 295 нм; испускание = 340 нм, 16 нм полоса пропускания) при 25°C 20 нМ антитела к антигену (форма Fab) в PBS, pH 7,2, в присутствии повышающихся концентраций антигена, которые измеряли в спектрометре, таком как спектрофотометр, оснащенный устройством для остановки потока (Aviv Instruments) или спектрофотометр SLM-AMINCO ТМ серии 8000 (ThermoSpectronic) со встряхиваемой кюветой.
2. Фрагменты антитела
В соответствии с определенными вариантами осуществления приведенное в настоящем документе антитело представляет собой фрагмент антитела. Фрагменты антител включают без ограничения Fab, Fab', Fab'-SH, F(ab')2, Fv и scFv фрагменты и другие описываемые ниже фрагменты. Обзор некоторых фрагментов антител см. в работе Hudson et al. Nat. Med. 9: 129-134 (2003). Обзор scFv фрагментов см., например, в работе Pluckthun, The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., (Springer-Verlag, New York), pp. 269-315 (1994); см. также WO 93/16185; и патентные документы США № 5571894 и № 5587458. Рассмотрение Fab и F(ab')2 фрагментов, содержащих остатки связывающегося с рецептором спасения эпитопа и характеризующихся повышенным периодом полужизни in vivo, см. в патентном документе США № 5869046.
Диатела представляют собой фрагменты антител с двумя антиген-связывающими участками, которые могут быть бивалентными или биспецифичными. См., например, ЕР 404097, WO 1993/01161, Hudson et al., Nat. Med. 9: 129-134 (2003) и Hollinger et al., Proc. Natl. Acad. Sci. USA 90: 6444-6448 (1993). Триотела и тетратела также описаны в работе Hudson et al., Nat. Med. 9: 129-134 (2003).
Однодоменные антитела представляют собой фрагменты антител, содержащие весь вариабельный домен тяжелой цепи антитела или ег