Производные (3-метилпирролидин-3-ил)-метил пиридинилового эфира и их применение в качестве антагонистов рецептора nk-3
Иллюстрации
Показать всеИзобретение относится к соединению общей формулы
в которой A выбирают из групп (a), (b) или (c): (a) или (b) или представляет собой циклоалкил, возможно, замещенный низшим алкилом (c); Ar1 представляет собой фенил или шестичленный гетероарил, содержащий один или два атома азота; X1 представляет собой N или СН; X2 представляет собой N-R1 или О; R1 представляет собой S(O)2-низший алкил, C(O)-циклоалкил, замещенный низшим алкилом, или же представляет собой C(O)-низший алкил, низший алкил, циано-группу, циклоалкил, или представляет собой шестичленный гетероарил, содержащий один или два атома азота, замещенный низшим алкилом, циано-группой, C(O)-низшим алкилом, галогеном, низшим алкилом, замещенным галогеном или низшей алкокси-группой; или представляет собой фенил, замещенный циано-группой или галогеном; R2 представляет собой низший алкил, галоген, пиразолил, 3-метил-[1,2,4]оксазолил, 5-метил-[1,2,4]оксадиазол-3-ил, пиридил, замещенный циано-группой, или представляет собой фенил, замещенный галогеном, или представляет собой циано-группу, низшую алкокси-группу, или представляет собой пиперидин-2-он; или фармацевтически активным солям соединения формулы I. Предложенные соединения являются перспективными антагонистами NK-3 рецептора для лечения депрессии, боли, психоза, болезни Паркинсона, шизофрении, тревожности и синдрома дефицита внимания и гиперактивности (СДВГ). 5 н. и 7 з.п. ф-лы., 1 табл., 27 пр.
Реферат
Настоящее изобретение относится к соединению общей формулы
в которой
А выбирают из групп (a), (b) или (c):
(a) или (b) или представляет собой циклоалкил,
возможно, замещенный низшим алкилом (с);
Ar1 представляет собой фенил или шестичленный гетероарил;
X1 представляет собой N или CH;
X2 представляет собой N-R1 или O;
R1 представляет собой S(O)2-низший алкил, C(O)-циклоалкил, замещенный низшим алкилом, или представляет собой C(O)-низший алкил, низший алкил, циано-группу, циклоалкил, или же представляет собой шестичленный гетероарил, замещенный низшим алкилом, циано-группой, C(O)-низшим алкилом, галогеном, низшим алкилом, замещенным галогеном, или низшей алкокси-группой; или представляет собой фенил, замещенный циано-группой или галогеном;
R2 представляет собой низший алкил, галоген, пиразолил, 3-метил-[1,2,4]оксазолил, 5-метил-[1,2,4]оксадиазол-3-ил, пиридил, замещенный циано-группой, или представляет собой фенил, замещенный галогеном, представляет собой циано-группу, низшую алкокси-группу, или представляет собой пиперидин-2-он;
или к фармацевтически активным солям, стереоизомерным формам, включая индивидуальные диастереомеры и энантиомеры соединения формулы I, a также их рацемические и нерацемические смеси.
Было обнаружено, что представленные соединения являются перспективными антагонистами NK-3 рецептора для лечения депрессии, боли, психоза, болезни Паркинсона, шизофрении, тревожности и синдрома дефицита внимания и гиперактивности (СДВГ).
Три основных тахикинина млекопитающих, вещество Р (SP), нейрокинин А (NKA) и нейрокинин В (NKB) относятся к семейству нейропептидов, имеющих общую COOH-концевую пентапептидную последовательность Phe-X-Gly-Leu-Met-NH2. Как нейротрансмиттеры эти пептиды проявляют свою биологическую активность посредством трех различных рецепторов нейрокининов (NK), обозначаемых как NK-1, NK-2 и NK-3. SP связывается преимущественно с NK-1 рецептором, NKA - с NK-2, а NKB - с NK-3 рецептором.
NK-3 рецептор характеризуется тем, что он преимущественно экспрессируется в ЦНС, и было показано, что он участвует в модулировании центральной моноаминергической системы. Эти свойства NK-3 рецептора делают его потенциальной мишенью для заболеваний центральной нервной системы, таких как тревожность, депрессия, биполярные расстройства, болезнь Паркинсона, шизофрения и боль (Neurosci. Letters, 2000, 283, 185 -188; Exp. Opin. Ther. Patents 2000, 10, 939-960; Neuroscience, 1996, 74, 403-414; Neuropeptides, 1998, 32, 481-488).
Шизофрения является основным нейропсихиатрическим расстройством, для которого характерны серьезные и хронические психические нарушения. Это тяжелое заболевание поражает около 1% мировой популяции. Его симптомы появляются в старшем подростковом возрасте, после чего следует период межличностной и социальной дисфункции. Шизофрения проявляется в виде слуховых или визуальных галлюцинаций, паранойи, бреда (позитивные симптомы), эмоциональной тупости, депрессии, ангедонии, бедности речи, расстройств памяти и внимания, а также социального отчуждения (негативные симптомы).
В течение нескольких десятилетий ученые и клиницисты пытались найти идеальный агент для фармакологического лечения шизофрении. Однако сложность этого расстройства, в виду широкого спектра симптомов, препятствовал этим усилиям. Для диагностики шизофрении нет специфических фокальных характеристик, и нет ни одного симптома, который бы обнаруживался у всех пациентов. Поэтому проблема постановки диагноза шизофрении как отдельного заболевания или комплекса различных расстройств до сих пор является предметом дискуссий, но не является окончательно решенным вопросом. Основной трудностью при разработке лекарства для шизофрении является отсутствие понимания причин и природы этого заболевания. Было выдвинуто несколько нейрохимических гипотез на основании фармакологических исследований, в целях рационализации разработки соответствующей терапии:
дофаминовая, серотониновая и глутаматная гипотезы. Однако, принимая во внимание сложность шизофрении, может потребоваться подходящий мультирецепторный аффинный профиль для достижения эффективного действия против позитивных и негативных признаков и симптомов. Кроме того, желательно, чтобы идеальное лекарство против шизофрении имело низкую дозировку, что позволило бы принимать одну дозу в сутки, в виду низкой способности пациентов с шизофренией строго следовать предписаниям.
В последние годы в литературе появились клинические исследования, касающиеся селективных антагонистов рецепторов NK1 и NK2, которые демонстрируют результаты лечения тошноты, депрессии, тревожности, боли и мигрени (NK1), а также астмы (NK2 и NK1). Наиболее интригующие данные были получены при лечении индуцированной хемотерапией рвоты, тошноты и депрессии с помощью антагонистов NK1 рецептора, и астмы с помощью антагонистов NK2 рецептора. В отличие от этого, клинические данные, касающиеся антагонистов NKS-рецептора, не появлялись в литературе вплоть до 2000 года. Осанетан (osanetant, SR 142,801) от компании Sanofi-Synthelabo был первым идентифицированным сильным и селективным непептидным антагонистом, описанным для NK3 тахикининового рецептора для потенциального лечения шизофрении, о котором появилось сообщение в литературе (Current Opinion in Investigational Drugs, 2001,2(7), 950-956 and Psychiatric Disorders Study 4, Schizophrenia, June 2003, Decision Recources, Inc., Waltham, Massachusetts). Ha II стадии испытаний было показано, что предложенное лекарство SR 142,801 эффективно против позитивных симптомов шизофрении, таких как измененное поведение, бред, галлюцинации, чрезмерная эмоциональность, возбужденная двигательная активность и разорванность речи, но неэффективно для лечения негативных симптомов, какими являются депрессия, ангедония, социальное отчуждение или же нарушения памяти или внимания.
Была описана полезность антагонистов рецептора нейрокинина-3 против боли или воспаления, а также против шизофрении, Exp.Opinion. Ther. Patents (2000), 10 (6), 939-960 and Current Opinion in Investigational Drugs, 2001, 2 (7), 950-956 956 and Psychiatric Disorders Study 4, Schizophrenia, June 2003, Decision Recources, Inc., Waltham, Massachusetts).
Объектами настоящего изобретения являются новые соединения формулы I, их изготовление, лекарственные препараты на основе соединения по настоящему изобретению, а также их производство, а также применение соединения формулы I для контроля или предотвращения расстройств, таких как депрессия, боль, биполярные расстройства, психоз, болезнь Паркинсона, шизофрения, тревожность и синдром дефицита внимания и гиперактивности (СДВГ).
Предпочтительными показаниями для применения соединения по настоящему изобретению являются депрессия, психоз, болезнь Паркинсона, шизофрения, тревожность и синдром дефицита внимания и гиперактивности (СДВГ).
Нижеследующие определения общих терминов, используемых в настоящем описании, применимы независимо от того, встречаются ли обсуждаемые термины по отдельности или в комбинации.
Используемый в данном тексте термин "низший алкил" обозначает алкильную группу с линейной или разветвленной цепью, состоящую из 1-8 атомов углерода, например, метил, этил, пропил, изопропил, н-бутил, изобутил, трет-бутил и т.п. Предпочтительными низшими алкильными группами являются группы, состоящие из 1-4 атомов углерода.
Термин "низший алкил, замещенный галогеном" обозначает алкильную группу, раскрытую выше, в которой по меньшей мере один атом водорода замещен галогеном, например -CF3, -CHF2, -CH2F, -CH2CF3, -CH2CH2CF3, -CH2CF2CF3 и т.п. Предпочтительными низшими алкильными группами, содержащими галоген в качестве заместителя, являются группы, включающие 1-4 атома углерода.
Термин "галоген" обозначает хлор, иод, фтор и бром.
Термин "шестичленный гетероарил" обозначает циклический ароматический углеводородный радикал, содержащий по меньшей мере один N-гетероатом, например пиридинил или пиридазинил.
Термин "фармацевтически приемлемая соль, полученная добавлением кислоты" охватывает соли, образованные неорганическими и органическими кислотами, такими как хлороводородная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота и т.п.
Одним из вариантов осуществления настоящего изобретения являются соединения формулы IA, причем А представляет собой .
X1 представляет собой N или СН;
X2 представляет собой N-R1 или О;
R1 представляет собой S(O)2-низший алкил, C(O)-циклоалкил, замещенный низшим алкилом, или же представляет собой C(O)-низший алкил, низший алкил, циано-группу, циклоалкил, или представляет собой шестичленный гетероарил, замещенный низшим алкилом, циано-группой, C(O)-низшим алкилом, галогеном, низшим алкилом, замещенным галогеном, или низшей алкокси-группой; или представляет собой фенил, замещенный циано-группой или галогеном;
или фармацевтически активные соли, стереоизомерные формы, включая индивидуальные диастереомеры и энантиомеры соединения формулы I, а также их рацемические и нерацемические смеси, например, нижеследующие соединения:
[(3RS,4RS)-4-(4-хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-ил]-(4-метансульфонил-пиперазин-1-ил)-метанон
[(3RS,4RS)-4-(4-хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-ил]-[1-(1-метил-циклопропанкарбонил)-пиперидин-4-ил]-метанон
[(3RS,4RS)-4-(4-хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-ил]-(тетрагидро-пиран-4-ил)-метанон
1-{4-[(3RS,4RS)-4-(4-хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-карбонил]-пиперидин-1-ил}-этанон
[(3RS,4RS)-4-(4-хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-ил]-(1-изобутил-пиперидин-4-ил)-метанон
1-{4-[(3RS,4RS)-4-(4-хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-карбонил]-пиперидин-1-ил}-2-метил-пропан-1-он
[(3RS,4RS)-4-(4-хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-ил]-(1-циклогексил-пиперидин-4-ил)-метанон
[(3RS,4RS)-4-(4-хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-ил]-(5’-метил-3,4,5,6-тетрагидро-2H-[1,2]бипиридинил-4-ил)-метанон
4-[(3RS,4RS)-4-(4-хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-карбонил]-3,4,5,6-тетрагидро-2Н-[1,2’]бипиридинил-5’-карбонитрил
4-{4-[(3RS,4RS)-4-(4-хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-карбонил]-пиперидин-1-ил}-бензонитрил
1-{4-[(3RS,4RS)-4-(4-хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-карбонил]-3,4,5,6-тетрагидро-2H-[1,2’]бипиридинил-5’-ил}-этанон
[(3RS,4RS)-4-(4-хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-ил]-(5’-фтор-3,4,5,6-тетрагидро-2H-[1,2’]бипиридинил-4-ил)-метанон
[(3RS,4RS)-4-(4-хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-ил]-(5’-хлор-3,4,5,6-тетрагидро-2H-[1,2’]бипиридинил-4-ил)-метанон
[(3RS,4RS)4-(4-хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-ил-(5’-трифторметил-3,4,5,6-тетрагидро-2H-[1,2’]бипиридинил-4-ил)-метанон
4-[(3RS,4RS)-4-(4-хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-карбонил]-3,4,5,6-тетрагидро-2H-[1,3’]бипиридинил-6’-карбонитрил или
[(3R,4R)-4-(4-хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-ил]-[1-(6-метокси-пиридазин-3-ил)-пиперидин-4-ил]-метанон.
Еще одним вариантом осуществления настоящего изобретения является соединение формулы IB, в которой A представляет собой
Ar1 представляет собой фенил или шестичленный гетероарил;
R2 представляет собой низший алкил, галоген, пиразолил, 3-метил-[1,2,4]оксазолил, 5-метил-[1,2,4]оксадиазол-3-ил, пиридил, замещенный циано-группой, или представляет собой фенил, замещенный галогеном, или представляет собой циано-группу, низшую алкокси-группу, или представляет собой пиперидин-2-он;
или фармацевтически активные соли, стереоизомерные формы, включая индивидуальные диастереомеры и энантиомеры соединения формулы I, а также их рацемические и нерацемические смеси, например, нижеследующие соединения:
[(3RS,4RS)-4-(4-хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-ил]-(6-метил-пиридазин-4-ил)-метанон
[(3RS,4RS)-4-(4-хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-ил]-(1-метил-циклопропил)-метанон
[(3RS,4RS)-4-(4-хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-ил]-(6-пиразол-1-ил-пиридин-3-ил)-метанон
[(3RS,4RS)-4-(4-хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-ил]-[4-(3-метил-[1,2,4]оксадиазол-5-ил)-фенил]-метанон
4-[(3RS,4RS)-4-(4-хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-карбонил]-бензонитрил
[(3RS,4RS)-4-(4-хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-ил]-(6-метокси-пиридин-3-ил)-метанон
5-[(3RS,4RS)-4-(4-хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-карбонил]-пиридин-2-карбонитрил
[(3RS,4RS)-4-(4-хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-ил]-(4’-фтор-бифенил-4-ил)-метанон
[(3RS,4RS)-4-(4-хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-ил]-[4-(5-метил-[1,2,4]оксадиазол-3-ил)-фенил]-метанон или
1-{4-[(3RS,4RS)-4-(4-хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-карбонил]-фенил}-пиперидин-2-он.
Еще одним вариантом осуществления настоящего изобретения являются соединения формулы I, в которой A представляет собой циклоалкил, возможно, замещенный низшим алкилом (c);
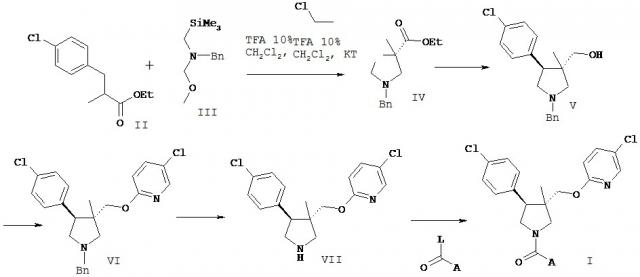
Получение соединения формулы I по настоящему изобретению можно осуществлять последовательными или сходящимися путями синтеза. Синтезы соединения по изобретению показаны в приведенных ниже схемах. Навыки, необходимые для проведения реакции и очистки конечных продуктов, известны специалистам в данной области техники. Заместители и индексы, использованные в нижеследующем описании, имеют значение, раскрытое в выше, если не указано иное.
Соединение формулы I можно получать способами, приведенными ниже, способами, описанными в примерах или аналогичными способами. Подходящие условия реакций для индивидуальных стадий синтеза известны специалисту в данной области техники. Последовательность реакций не ограничена той, которая приведена на схеме 1, и, в зависимости от исходных веществ и их относительной реакционной способности, последовательность реакционных стадий может быть свободно изменена. Исходные вещества могут быть коммерчески доступными, а также их можно получить способами, аналогичными тем, которые приведены ниже, способами, описанными в источниках, на которые даны ссылки в настоящем описании или примерах, или же способами, известными в данной области техники.
Обсуждаемое соединение формулы I и его фармацевтически приемлемые соли можно получать способами, известными в данной области техники, например, по описанному ниже способу, включающему
а) конденсацию соединения формулы
с подходящими хлоридом кислоты или карбоновой кислотой формулы
в которой L представляет собой галоген или гидрокси-группу,
с получением соединения формулы
в которой группа A раскрыта выше, и,
по желанию, превращение соединения формулы I в фармацевтически приемлемую соль, образуемую добавлением кислоты.
Схема 1
Получение производных формулы I
3,4-дизамещенные пирролидины IV получают с помощью стереоспецифичного 1,3-диполярного циклоприсоединения производных этилового эфира (E)-2-метил-3-фенил-акриловой кислоты II к азометин-илиду, который образуется in situ из N-(метоксиметил)-N-(фенилметил)-N-(триметилсилил)метиламина III в присутствии каталитического количества кислоты, например TFA. Производные этилового эфира замещенной фенилом (E)-2-метил-3-фенил-акриловой кислоты II коммерчески доступны, или же могут быть получены по общему способу, описанному в литературе (например, J.Org. Chem. 1966, 31 (12), 4043-7). Восстановление эфирной группы в стандартных условиях, например с помощью LiAlH4, дает спирт V. Обычная реакция Мицунобу, например, с фенолом, пиридин-олом или пиримидин-олом дает ариловый эфир VI. Как вариант, ариловый эфир VI можно получить с помощью реакции нуклеофильного замещения в ароматическом ядре с замещенными производными 2-фтор или 2-хлор пиридина. Затем проводят селективное N-дебензилирование одним из нескольких известных способов, совместимых со схемой замещения в ароматическом кольце, с получением VII. Конденсация с подходящим хлоридом кислоты, карбоновой кислотой или карбамоилхлоридом, с помощью известных способов, дает I.
Сокращения:
CH2Cl2=дихлорметан;
DMAP=диметиламинопиридин;
HOBt=1-гидрокси-бензотриазол гидрат;
EDC=1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид;
EtsN=триэтиламин;
EtOAc=этилацетат;
H=гексан;
KT=комнатная температура;
PPh3=трифенилфосфин;
DBAD=ди-трет-бутил азодикарбоксилат
Общий способ 1
Амидная конденсация (пирролидин VII и карбоновая кислота) К раствору производного карбоновой кислоты (коммерчески доступного или известного из литературы) (1 ммоль) в 10 мл CH2Cl2 при перемешивании добавляли (1.3 ммоль) EDC, (1.3 ммоль) HOBt и Et3N (1.3 ммоль). Выдерживали один час при KT, после чего добавляли промежуточный пирролидин общей формулы (VII). Смесь перемешивали при KT в течение ночи, затем вливали ее в воду и экстрагировали с помощью CH2Cl2. Объединенные органические слои высушивали над Na2SO4 и концентрировали в вакууме. С помощью флэш-хроматографии или препаративной HPLC получали указанное в заголовке соединение.
Общий способ II
Конденсация пирролидина формулы VII с хлоридом кислоты или карбамоилхлоридом
Раствор пирролидина (1 ммоль) формулы (VII) в CH2Cl2 (10 мл) обрабатывали с помощью Et3N (1.2 ммоль) и хлорида кислоты или карбамоилхлорида (1.2 ммоль) и перемешивали при KT в течение ночи. Реакционную смесь затем вливали в воду и экстрагировали с помощью CH2Cl2. Объединенные органические слои высушивали над Na2SO4 и концентрировали в вакууме. В результате очистки с помощью препаративной HPLC получали указанное в заголовке соединение.
Описание промежуточных производных пирролидина формулы VII
Пирролидин VII-1
5-Хлор-2-[(3RS,4RS)-4-(4-хлор-фенил)-3-метил-пирролидин-3-илметокси]-пиридин
a) Этиловый эфир (3RS,4RS)-1-бензил-4-(4-хлор-фенил)-3-метил-пирролидин-3-карбоновой кислоты
Раствор N-(метоксиметил)-N-(фенилметил)-N-(триметилсилил)метиламина (1.55 г, 6.54 ммоль) в CH2Cl2 (5 мл) добавляли по каплям, в течение 30 минут, при перемешивании, к раствору этилового эфира (E)-3-(4-хлор-фенил)-2-метил-акриловой кислоты (1.00 г, 4.45 ммоль; препарат, описанный в J. Org. Chem. 1966, 31: 4043-4047) и трифторуксусной кислоты (0.034 мл, 0.44 ммоль) в CH2Cl2 (10 мл) при 0°C. Ледяную баню убирали, раствор перемешивали при 25°C в течение еще 24 ч. Затем его концентрировали, и в результате очистки с помощью флэш-хроматографии (SiO2, EtOAc/H 1:8) получали 0.85 г (54%) указанного в заголовке соединение в виде бесцветного масла. ES-MS m/e: 358.2 (M+H+).
b) [(3RS,4RS)-1-Бензил-4-(4-хлор-фенил)-3-метил-пирролидин-3-ил]-метанол
К раствору этилового эфира (3RS,4RS)-1-бензил-4-(4-хлор-фенил)-3-метил-пирролидин-3-карбоновой кислоты (5.75 г, 16.7 ммоль) в THF (200 мл) при 0°C, при перемешивании добавляли порциями LiAlH4 (381 мг, 10.0 ммоль) в течение 20 минут. Выдерживали один час при этой температуре, после чего реакционную смесь осторожно гасили добавлением ледяной воды, а затем водного раствора NaHCO3. Продукт экстрагировали с помощью EtOAc несколько раз, объединенные органические слои высушивали над Na2SO4, и в результате хроматографической очистки на колонке (SiO2, EtOAc/H от 1:4 до 1:1) получали указанное в заголовке вещество (4.0 г, 76%) в виде бесцветного вязкого масла. ES-MS m/e: 316.2 (M+H+).
c) 2-[(3RS,4RS)-1-Бензил-4-(4-хлор-фенил)-3-метил-пирролидин-3-илметокси]-5-хлор-пиридин
К раствору [(3RS,4RS)-1-бензил-4-(4-хлор-фенил)-3-метил-пирролидин-3-ил]-метанола (4.0 г, 12.7 ммоль) в DMF (60 мл) при перемешивании, при KT добавляли NaH (608 мг, 60%, 15.2 ммоль). Реакционную смесь нагревали при 50°C в течение 30 минут, затем охлаждали до KT, после чего добавляли 2-бром-5-хлорпиридин (3.66 г, 19.0 ммоль). Полученный коричневатый раствор перемешивали в течение ночи при 60°C, затем концентрировали в высоком вакууме. Остаток растворяли в EtOAc и промывали водой. Органический слой высушивали над Na2SO4, и в результате хроматографической очистки на колонке получали 3.90 г (72%) указанного в заголовке вещества в виде вязкого масла. ES-MS m/e: 427.2 (M+H+).
d) 5-Хлор-24(3RS,4RS)-4-(4-хлор-фенил)-3-метил-пирролидин-3-илметокси]-пиридин
К раствору 2-[(3RS,4RS)-1-бензил-4-(4-хлор-фенил)-3-метил-пирролидин-3-илметокси]-5-хлор-пиридина (0.70 г, 1.64 ммоль) в толуоле (10 мл) при перемешивании, при KT добавляли 1-хлорэтил хлорформиат (0.229 мл, 2.12 ммоль) и iPr2NEt (0.36 мл, 2.12 ммоль). Через 3 часа все летучие компоненты удаляли в высоком вакууме, и остаток растворяли в MeOH (10 мл). Реакционную смесь перемешивали при KT в течение 2 часов, и затем концентрировали в высоком вакууме. С помощью хроматографии на колонке (SiO2, CH2Cl2/MeOH, 9:1) получали 595 мг (97%) указанного в заголовке вещества в виде белой пены. ES-MS m/e: 337.1 (M+H+).
Пример 1
[(3RS,4RS)-4-(4-Хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-ил]-(6-метил-пиридазин-4-ил)-метанон
Амидная конденсация по общему способу I:
- Промежуточное производное пирролидина: 5-хлор-2-[(3RS,4RS)-4-(4-хлор-фенил)-3-метил-пирролидин-3-илметокси]-пиридин (VII-1);
- Карбоновая кислота: 6-метил-пиридазин-4-карбоновая кислота (получение раскрыто BW 02009019163);
ES-MS m/e: 457.2 (M+H+).
Пример 2
[(3RS,4RS)-4-(4-Хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-ил]-(4-метансульфонил-пиперазин-1-ил)-метанон
Конденсация по общему способу II:
- Промежуточное производное пирролидина: 5-хлор-2-[(3RS,4RS)-4-(4-хлор-фенил)-3-метил-пирролидин-3-илметокси]-пиридин (VII-1);
- Карбамоилхлорид: 4-метансульфонил-пиперазин-1-карбонил хлорид (получение раскрыто в WO 2008128891);
ES-MS m/e: 527.3 (M+H+).
Пример 3
[(3RS,4RS)-4-(4-Хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-ил]-[1-(1-метил-циклопропанкарбонил)-пиперидин-4-ил]-метанон
Амидная конденсация по общему способу I:
- Промежуточное производное пирролидина: 5-хлор-2-[(3RS,4RS)-4-(4-хлор-фенил)-3-метил-пирролидин-3-илметокси]-пиридин (VII-1);
- Карбоновая кислота: 1-(1-метил-циклопропанкарбонил)-пиперидин-4-карбоновая кислота (получение раскрыто в US 2009306043);
ES-MS m/e: 530.1 (M+H+).
Пример 4
[(3RS,4RS)-4-(4-Хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-ил]-(1-метил-циклопропил)-метанон
Амидная конденсация по общему способу I:
- Промежуточное производное пирролидина: 5-хлор-2-[(3RS,4RS)-4-(4-хлор-фенил)-3-метил-пирролидин-3-илметокси]-пиридин (VII-1);
- Карбоновая кислота: 1-метил-циклопропанкарбоновая кислота (коммерчески доступная);
ES-MS m/e: 419.2 (M+H+).
Пример 5
[(3RS,4RS)-4-(4-Хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-ил]-(1-метил-циклопропил)-метанон
Амидная конденсация по общему способу I:
- Промежуточное производное пирролидина: 5-хлор-2-[(3RS,4RS)-4-(4-хлор-фенил)-3-метил-пирролидин-3-илметокси]-пиридин (VII-1);
- Карбоновая кислота: 2-хлор-изоникотиновая кислота (коммерчески доступная);
ES-MS m/e: 478.1 (M+H+).
Пример 6
[(3RS,4RS)-4-(4-Хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-ил]-(6-пиразол-1-ил-пиридин-3-ил)-метанон
Амидная конденсация по общему способу I:
- Промежуточное производное пирролидина: 5-хлор-2-[(3RS,4RS)-4-(4-хлор-фенил)-3-метил-пирролидин-3-илметокси]-пиридин (VII-1);
- Карбоновая кислота: 6-пиразол-1-ил-никотиновая кислота (коммерчески доступная);
ES-MS m/e: 508.2 (M+H+).
Пример 7
[(3RS,4RS)-4-(4-Хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-ил]-[4-(3-метил-[1,2,4]оксадиазол-5-ил)-фенил]-метанон
Амидная конденсация по общему способу I:
- Промежуточное производное пирролидина: 5-хлор-2-[(3RS,4RS)-4-(4-хлор-фенил)-3-метил-пирролидин-3-илметокси]-пиридин (VII-1);
- Карбоновая кислота: 4-(3-метил-[1,2,4]оксадиазол-5-ил)-бензойная кислота (коммерчески доступная);
ES-MS m/e: 523.4 (M+H+).
Пример 8
4-[(3RS,4RS)-4-(4-Хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-карбонил]-бензонитрил
Конденсация по общему способу II:
- Промежуточное производное пирролидина: 5-хлор-2-[(3RS,4RS)-4-(4-хлор-фенил)-3-метил-пирролидин-3-илметокси]-пиридин (VII-1);
- Хлорид кислоты: 4-циано-бензоилхлорид (коммерчески доступный);
ES-MS m/e: 466.2 (M+H+).
Пример 9
[(3RS,4RS)-4-(4-Хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-ил]-(6-метокси-пиридин-3-ил)-метанон
Амидная конденсация по общему способу I:
- Промежуточное производное пирролидина: 5-хлор-2-[(3RS,4RS)-4-(4-хлор-фенил)-3-метил-пирролидин-3-илметокси]-пиридин (VII-1);
- Карбоновая кислота: 6-метокси-никотиновая кислота (коммерчески доступная);
ES-MS m/e: 472.3 (M+H+).
Пример 10
[(3RS,4RS)-4-(4-Хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-ил]-(тетрагидро-пиран-4-ил)-метанон
Конденсация по общему способу II:
- Промежуточное производное пирролидина: 5-хлор-2-[(3RS,4RS)-4-(4-хлор-фенил)-3-метил-пирролидин-3-илметокси]-пиридин (VII-1);
- Хлорид кислоты: тетрагидро-пиран-4-карбонилхлорид (коммерчески доступный);
ES-MS m/e: 449.2 (M+H+).
Пример 11
1-{4-[(3RS,4RS)-4-(4-Хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-карбонил]-пиперидин-1-ил}-этанон
Амидная конденсация по общему способу I:
- Промежуточное производное пирролидина: 5-хлор-2-[(3RS,4RS)-4-(4-хлор-фенил)-3-метил-пирролидин-3-илметокси]-пиридин (VII-1);
- Карбоновая кислота: 1-ацетил-пиперидин-4-карбоновая кислота (коммерчески доступная);
ES-MS m/e: 490.2 (M+H+).
Пример 12
[(3RS,4RS)-4-(4-Хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-ил]-(1-изобутил-пиперидин-4-ил)-метанон
Амидная конденсация по общему способу I:
- Промежуточное производное пирролидина: 5-хлор-2-[(3RS,4RS)-4-(4-хлор-фенил)-3-метил-пирролидин-3-илметокси]-пиридин (VII-1);
- Карбоновая кислота: 1-изобутил-пиперидин-4-карбоновая кислота (коммерчески доступная);
ES-MS m/e: 504.2 (M+H+).
Пример 13
1-{4-[(3RS,4RS)-4-(4-Хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-карбонил]-пиперидин-1-ил}-2-метил-пропан-1-он
Амидная конденсация по общему способу I:
- Промежуточное производное пирролидина: 5-хлор-2-[(3RS,4RS)-4-(4-хлор-фенил)-3-метил-пирролидин-3-илметокси]-пиридин (VII-1);
- Карбоновая кислота: 1-изобутирил-пиперидин-4-карбоновая кислота (коммерчески доступная);
ES-MS m/e: 518.5 (M+H+).
Пример 14
[(3RS,4RS)-4-(4-Хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-ил]-(1-циклогексил-пиперидин-4-ил)-метанон
Амидная конденсация по общему способу I:
- Промежуточное производное пирролидина: 5-хлор-2-[(3RS,4RS)-4-(4-хлор-фенил)-3-метил-пирролидин-3-илметокси]-пиридин (VII-1);
- Карбоновая кислота: 1-циклогексил-пиперидин-4-карбоновая кислота (коммерчески доступная);
ES-MS m/e: 530.2 (M+H+).
Пример 15
[(3RS,4RS)-4-(4-Хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-ил]-(5’-метил-3,4,5,6-тетрагидро-2H-[1,2’]бипиридинил-4-ил)-метанон
Амидная конденсация по общему способу I:
- Промежуточное производное пирролидина: 5-хлор-2-[(3RS,4RS)-4-(4-хлор-фенил)-3-метил-пирролидин-3-илметокси]-пиридин (VII-1);
- Карбоновая кислота: 5’-метил-3,4,5,6-тетрагидро-2Н-[1,2’]бипиридинил-4-карбоновая кислота (коммерчески доступная);
ES-MS m/e: 539.4 (M+H+).
Пример 16
4{(3RS,4RS)-4-(4-Хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-карбонил]-3,4,5,6-тетрагидро-2H-[1,2’]бипиридинил-5’-карбонитрил
Амидная конденсация по общему способу I:
- Промежуточное производное пирролидина: 5-хлор-2-[(3RS,4RS)-4-(4-хлор-фенил)-3-метил-пирролидин-3-илметокси]-пиридин (VII-1);
- Карбоновая кислота: 5’-циано-3,4,5,6-тетрагидро-2Н-[1,2’]бипиридинил-4-карбоновая кислота (коммерчески доступная);
ES-MS m/e: 550.3 (M+H+).
Пример 17
4-{4-1(3RS,4RS)-4-(4-Хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-карбонил]-пиперидин-1-ил}-бензонитрил
Амидная конденсация по общему способу I:
- Промежуточное производное пирролидина: 5-хлор-2-[(3RS,4RS)-4-(4-хлор-фенил)-3-метил-пирролидин-3-илметокси]-пиридин (VII-1);
- Карбоновая кислота: 1-(4-циано-фенил)-пиперидин-4-карбоновая кислота (коммерчески доступная);
ES-MS m/e: 549.4 (M+H+).
Пример 18
1-{4-[(3RS,4RS)-4-(4-Хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-карбонил]-3,4,5,6-тетрагидро-2Н-[1,2’]бипиридинил-5’-ил}-этанон
Амидная конденсация по общему способу I:
- Промежуточное производное пирролидина: 5-хлор-2-[(3RS,4RS)-4-(4-хлор-фенил)-3-метил-пирролидин-3-илметокси]-пиридин (VII-1);
- Карбоновая кислота: 5’-ацетил-3,4,5,6-тетрагидро-2Н-[1,2’]бипиридинил-4-карбоновая кислота (получение описано ниже);
ES-MS m/e: 567.4 (M+H+).
Получение 5’-ацетил-3,4,5,6-тетрагидро-2H-[1,2’]бипиридинил-4-карбоновой кислоты:
Первая стадия: к раствору этилового эфира пиперидин-4-карбоновой кислоты (12.6 г, 0.080 моль) в CH3CN (250 моль) при перемешивании добавляли iPr2Net (33.7 мл, 0.193 моль) и 1-(6-хлор-пиридин-3-ил)-этанон (10 г, 0.064 моль). Реакционную смесь нагревали с обратным холодильником в течение ночи, затем летучие компоненты выпаривали в высоком вакууме. В результате хроматографии на колонке (SiO2, EtOAc/гептан, от 1:9 до 1:1) получали 15.9 г (89%) этилового эфира 5’-ацетил-3,4,5,6-тетрагидро-2Н-[1,2’]бипиридинил-4-карбоновой кислоты в виде желтого масла. ES-MS m/e: 277.2 (M+H+).
Вторая стадия: к раствору этилового эфира 5’-ацетил-3,4,5,6-тетрагидро-2Н-[1,2’]бипиридинил-4-карбоновой кислоты (15.8 г, 0.057 моль) в THF (75 мл), H2O (75 мл) и MeOH (8 мл) при перемешивании добавляли LiOH.H2O (2.64 г, 0.0629 моль). Продолжали перемешивание в течение ночи при KT, после чего удаляли органический растворитель в вакууме. Доводили pH до 5 уксусной кислотой, белый преципитат отфильтровали и высушивали с получением 13 г (92%) 5’-ацетил-3,4,5,6-тетрагидро-2Н-[1,2’]бипиридинил-4-карбоновой кислоты. ES-MS m/e: 249.2 (M-H+)
Пример 19
[(3RS,4RS)-4-(4-Хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-ил]-(5’-фтор-3,4,5,6-тетрагидро-2H-[1,2’]бипиридинил-4-ил)-метанон
Амидная конденсация по общему способу I:
- Промежуточное производное пирролидина: 5-хлор-2-[(3RS,4RS)-4-(4-хлор-фенил)-3-метил-пирролидин-3-илметокси]-пиридин (VII-1);
- Карбоновая кислота: 5’-фтор-3,4,5,6-тетрагидро-2Н-[1,2’]бипиридинил-4-карбоновая кислота (получение описано далее);
ES-MS m/e: 543.3 (M+H+).
Получение 5’-фтор-3,4,5,6-тетрагидро-2H-[1,2’]бипиридинил-4-карбоновой кислоты:
Первая стадия: к раствору этилового эфира пиперидин-4-карбоновой кислоты (14.3 г, 0.091 моль) и 2-хлор-5-фтор-пиридина (10 г, 0.076 моль) в толуоле (100 моль) при перемешивании добавляли NaOtBu (8.77 г, 0.091 моль), BINAP (1.42 г, 2.28 ммоль) и трис(дибензилиденацетон)дипалладий(0) (1.39 г, 1.52 ммоль). Реакционную смесь нагревали при 75°C в течение 2 часов, охлаждали до KT и разбавляли с помощью AcOEt (100 мл) и H2O (100 мл). Органический слой отделяли и промывали солевым раствором, высушивали над Na2SO4 и концентрировали в вакууме. С помощью хроматографии на колонке (SiO2, EtOAc / гептан, от 1:9 до 1:1) получали 12.5 г (65%) этилового эфира 5’-фтор-3,4,5,6-тетрагидро-2Н-[1,2’]бипиридинил-4-карбоновой кислоты в виде желтого масла.
ES-MS m/e: 253.3 (M+H+).
Вторая стадия: к раствору этилового эфира 5’-фтор-3,4,5,6-тетрагидро-2Н-[1,2’]бипиридинил-4-карбоновой кислоты (12.5 г, 0.0495 моль) в THF (60 мл), H2O (60 мл) и МеОН (6 мл) при перемешивании добавляли LiOH.H2O (2.6 г, 0.0172 моль). Продолжали перемешивание в течение ночи при KT, после чего органический растворитель удаляли в вакууме. Доводили pH до 5 уксусной кислотой, белый преципитат отфильтровывали и высушивали с получением 9.2 г (83%) 5’-фтор-3,4,5,6-тетрагидро-2Н-[1,2’]бипиридинил-4-карбоновой кислоты.
ES-MS m/e: 223.1 (M-H+)
Пример 20
[(3RS,4RS)-4-(4-Хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-ил]-(5’-хлор-3,4,5,6-тетрагидро-2H-[1,2’]бипиридинил-4ил)-метанон
Амидная конденсация по общему способу I:
- Промежуточное производное пирролидина: 5-хлор-2-[(3RS,4RS)-4-(4-хлор-фенил)-3-метил-пирролидин-3-илметокси]-пиридин (VII-1);
- Карбоновая кислота: 5’-хлор-3,4,5,6-тетрагидро-2Н-[1,2’]бипиридинил-4-карбоновая кислота (коммерчески доступная);
ES-MS m/e: 561.0 (M+H+).
Пример 21
5-[(3RS,4RS)-4-(4-Хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-карбонил]-пиридин-2-карбонитрил
Амидная конденсация по общему способу I:
- Промежуточное производное пирролидина: 5-хлор-2-[(3RS,4RS)-4-(4-хлор-фенил)-3-метил-пирролидин-3-илметокси]-пиридин (VII-1);
- Карбоновая кислота: 6-циано-никотиновая кислота (коммерчески доступная);
ES-MS m/e: 467.2 (M+H+).
Пример 22
[(3RS,4RS)-4-(4-Хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирропидин-1-ил]-(5’-трифторметил-3,4,5,6-тетрагидро-2H-[1,2’]бипиридинил-4-ил)-метанон
Амидная конденсация по общему способу I:
- Промежуточное производное пирролидина: 5-хлор-2-[(3RS,4RS)-4-(4-хлор-фенил)-3-метил-пирролидин-3-илметокси]-пиридин (VII-1);
- Карбоновая кислота: 5’-трифторметил-3,4,5,6-тетрагидро-2Н-[1,2’]бипиридинил-4-карбоновая кислота (коммерчески доступная);
ES-MS m/e: 593.4 (M+H+).
Пример 23
[(3RS,4RS)-4-(4-Хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-ил]-(4’-фтор-бифенил-4-ил)-метанон
- Амидная конденсация по общему способу I:
- Промежуточное производное пирролидина: 5-хлор-2-[(3RS,4RS)-4-(4-хлор-фенил)-3-метил-пирролидин-3-илметокси]-пиридин (VII-1);
- Карбоновая кислота: 5’-трифторметил-3,4,5,6-тетрагидро-2Н-[1,2’]бипиридинил-4-карбоновая кислота (коммерчески доступная);
ES-MS m/e: 535.2 (M+H+).
Пример 24
[(3RS,4RS)-4-(4-Хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-ил]-[4-(5-метил-[1,2,4]оксадиазол-3-ил)-фенил]-метанон
Амидная конденсация по общему способу I:
- Промежуточное производное пирролидина: 5-хлор-2-[(3RS,4RS)-4-(4-хлор-фенил)-3-метил-пирролидин-3-илметокси]-пиридин (VII-1);
- Карбоновая кислота: 4-(5-метил-[1,2,4]оксадиазол-3-ил)-бензойная кислота (коммерчески доступная);
ES-MS m/e: 523.3 (M+H+).
Пример 25
4-[(3RS,4RS)-4-(4-Хлор-фенил)-3-(5-хлор-пиридин-2-илоксиметил)-3-метил-пирролидин-1-карбонил]-3,4,5,6-тетрагидро-2H-[1,3’]бипиридинил-6’-карбонитрил
Амидная конденсация по общему способу I:
- Промежуточное производное пирролидина: 5-хлор-2-[(3RS,4RS)-4-(4-хлор-фенил)-3-метил-пирролидин-3-илметокси]-пиридин (VII-1);
- Карбоновая кислота: 6’-циано-3,4,5,6-тетрагидро-2Н-[1,3’]бипиридинил-4-карбоновая кислота (получение описано ниже);
ES-MS m/e: 550.3 (M+H+).
Получение 6’-циано-3.4,5,6-тетрагидро-2H-[1,3’]бипиридинил-4-карбоновой кислоты:
Первая стадия: к раствору этилового эфира пиперидин-4-карбоновой кислоты (3.70 г, 23.5 ммоль) и 5-бром-пиридин-2-карбонитрила (3.66 г, 20 ммоль) в толуоле (50 моль) при перемешивании добавляли NaOtBu (2.31 г, 24.0 моль), BINAP (374 мг, 0.60 ммоль) и трис(дибензилиденацетон) дипалладий(О) (366 мг, 0.40 ммоль). Реакционную смесь нагревали при 75°C в течение 1 ч, охлаждали до KT и р