Полученные с помощью генной инженерии антитела с цистеиновыми заменами и их конъюгаты
Иллюстрации
Показать всеНастоящее изобретение относится к биохимии, в частности к применению последовательности в тяжёлой цепи CAASGCNIKDT, SADTSCNTAYL, DTSKNCAYLQM или KNTAYCQMNSL, или последовательности в лёгкой цепи DFTLTCSSLQP, YCQQHCTTPPT, VVCLLCNFYPR, VCLLNCFYPRE или AKVQWCVDNAL, для получения с помощью генной инженерии антитела с цистеиновыми заменами, содержащего свободную аминокислоту цистеин со значением реакционноспособности тиольных групп равным примерно 0,8 или выше. Указанные последовательности в тяжёлой или лёгкой цепи применяют также для получения иммуноконъюгата антитела, содержащего цистеин, причём антитело сохраняет способность связываться с антигеном. Указанный иммуноконъюгат содержит антитело, ковалентно присоединённое к метке для захвата, к метке для обнаружения, к остатку лекарственного средства или к твёрдой подложке через указанный цистеин. Настоящее изобретение позволяет получать антитела с повышенной тиореактивностью. 2 н. и 20 з.п. ф-лы, 11 ил., 8 табл., 12 пр.
Реферат
Ссылка на родственные заявки
По настоящей невременной заявке, поданной согласно 37 CFR § 1.53(b), испрашивается приоритет, согласно 35 USC § 119(e), временной заявки на патент США, серийный № 61/352728, поданной 8 июня 2010 года, которая приведена в настоящем описании в качестве ссылки в полном объеме.
Область техники, к которой относится изобретение
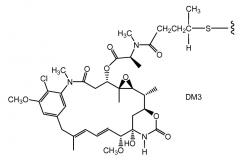
Настоящее изобретение в целом относится к антителам, полученным с помощью генной инженерии, с реакционноспособными цистеиновыми остатками, и, более конкретно, к антителам с терапевтическими или диагностическими применениями. Полученные с помощью генной инженерии антитела с цистеиновыми заменами могут быть конъюгированы с химиотерапевтическими лекарственными средствами, токсинами, аффинными лигандами, такими как биотин, и с метками для обнаружения, такими как флуорофоры. Настоящее изобретение также относится к способам использования антител и соединений конъюгатов антитело-лекарственное средство для диагностики или лечения in vitro, in situ и in vivo клеток млекопитающих или связанных с ними патологических состояний.
Уровень техники
Конъюгаты антитело-лекарственное средство (ADC) являются привлекательными химиотерапевтическими молекулами направленного действия, поскольку они объединяют идеальные свойства, как антител, так и цитотоксических лекарственных средств посредством нацеливания сильнодействующих цитотоксических лекарственных средств на антиген-экспрессирующие опухолевые клетки, тем самым повышая их антиопухолевую активность. Успешная разработка ADC для такого мишеневого антигена зависит от оптимизации выбора антитела, от стабильности линкера, от сильнодействия цитотоксического лекарственного средства и от способа конъюгирования линкера-лекарственного средства с антителом.
Обычные средства присоединения, то есть связывания с помощью ковалентных связей, остатка лекарственного средства с антителом, как правило, приводят к получению гетерогенной смеси молекул, где молекулы остатков лекарственных средств присоединены с помощью ряда активных сайтов на антителе. Например, цитотоксические лекарственные средства, как правило, конъюгируют с антителами посредством часто встречающихся многочисленных лизиновых остатков антитела, с получением гетерогенной смеси конъюгата антитело-лекарственное средство. В зависимости от условий реакции, гетерогенная смесь, как правило, содержит распределение антител с 0 до примерно 8 или более присоединенными остатками лекарственных средств. В дополнение к этому, в каждой подгруппе конъюгатов с конкретным целочисленным отношением остатков лекарственных средств к антителу имеется потенциально гетерогенная смесь, где остатки лекарственного средства присоединены на различных активных сайтах на антителе. Аналитические и препаративные способы являются неадекватными при разделении и характеризации молекул различных видов конъюгатов антитело-лекарственное средство в гетерогенной смеси, образующейся в результате реакции конъюгирования. Антитела представляют собой большие, сложные и структурно разнообразные биологические молекулы, часто имеющие множество реакционноспособных функциональных групп. Их реакционноспособность по отношению к линкерным реагентам и к промежуточным соединениям лекарственное средство-линкер зависит от таких факторов, как pH, концентрация, концентрация соли и сорастворители. Кроме того, многостадийный способ конъюгирования может быть невоспроизводимым из-за сложностей с контролем условий реакции и характеризацией реагентов и промежуточных соединений.
Тиольные группы цистеиновых остатков являются реакционноспособными при нейтральных значениях pH, в отличие от большинства аминов, которые являются протонированными и менее нуклеофильными вблизи pH 7. Поскольку свободные тиольные группы (RSH, сульфогидрил) являются относительно реакционноспособными, белки с цистеиновыми остатками часто существуют в их окисленной форме как дисульфид-связанные олигомеры или имеют внутренние мостиковые дисульфидные группы. Тиольные группы цистеиновых остатков антитела, как правило, являются более реакционноспособными, то есть более нуклеофильными по отношению к электрофильным реагентам конъюгирования, чем аминовые или гидроксильные группы антитела. Генная инженерия тиольных групп цистеиновых остатков посредством мутации различных аминокислотных остатков белка до цистеиновых аминокислот является потенциально проблематичной, особенно, в случае непарных (со свободными Cys) остатков или остатков, которые являются относительно доступными для взаимодействия или окисления. В концентрированных растворах белка, либо в периплазме E. coli, либо в супернатантах культур, либо для частично или полностью очищенного белка, непарные Cys остатки на поверхности белка могут спариваться и окисляться с образованием внутримолекулярных дисульфидов, и, следовательно, димеров или мультимеров белка. Образование дисульфидных димеров делает новые Cys остатки химически неактивными при конъюгировании с лекарственным средством, лигандом или другой меткой. Кроме того, если белок оксидативно образует внутримолекулярную дисульфидную связь между вновь полученным с помощью генной инженерии Cys остатком и существующим Cys остатком, обе Cys группы становятся недоступными для присутствия на активном сайте и для взаимодействий. Кроме того, белок может стать неактивным или неспецифичным, из-за потери укладки или потери третичной структуры (Zhang et al (2002) Anal. Biochem. 311:1-9).
Антитела с цистеиновыми заменами (ThioMab) на активных сайтах, где полученные с помощью генной инженерии цистеиновые остатки являются доступными для конъюгирования, но не изменяют складчатую структуру и сборку иммуноглобулинов или не изменяют связывание с антигенами и эффекторные функции (Junutula, et al., 2008b Nature Biotech., 26(8):925-932; Dornan et al (2009) Blood 114(13):2721-2729; патент США № 7521541; патент США № 7723485; WO2009/052249). Затем эти ThioMab могут быть конъюгированы с цитотоксическими лекарственными средствами посредством полученных с помощью генной инженерии тиольных групп цистеиновых остатков с получением конъюгатов ThioMab-лекарственное средство (TDC) с однородной стехиометрией (~2 остатка лекарственного средства на антитело). Исследования с множеством антител против различных антигенов показали, что TDC являются такими же эффективными как обычные ADC на моделях с привитыми опухолями и переносятся при более высоких дозах на релевантных предклинических моделях. Конъюгаты ThioMab - лекарственное средство получают с помощью генной инженерии с присоединением лекарственных средств в различных частях антитела (легкая цепь-Fab, тяжелая цепь-Fab и тяжелая цепь-Fc). Стабильность in vitro и in vivo, эффективность и PK (фармакокинетические) свойства TDC обеспечивают уникальное преимущество по сравнению с обычными ADC благодаря их гомогенности и сайт-специфичному конъюгированию с цитотоксическими лекарственными средствами.
Сущность изобретения
Настоящее изобретение относится к выделенному, полученному с помощью генной инженерии антителу с цистеиновыми заменами, содержащему свободную цистеиновую аминокислоту в тяжелой цепи или легкой цепи.
В одном из аспектов настоящее изобретение относится к способу получения выделенного, полученного с помощью генной инженерии антитела с цистеиновыми заменами посредством мутагенеза последовательности нуклеиновых кислот исходного антитела посредством замены одного или несколько аминокислотных остатков цистеином с целью кодирования полученного с помощью генной инженерии антитела с цистеиновыми заменами; экспрессирование полученного с помощью генной инженерии антитела с цистеиновыми заменами и изолирование полученного с помощью генной инженерии антитела с цистеиновыми заменами.
В другом аспекте настоящее изобретение относится к конъюгату выделенного, полученного с помощью генной инженерии антитела с цистеиновыми заменами, где антитело является ковалентно связанным с меткой для захвата, с меткой для обнаружения, к остатку лекарственного средства или к твердой подложке.
Краткое описание чертежей
На фигуре 1A показано трехмерное представление фрагмента антитела hu4D5Fabv7, полученное с помощью рентгеновских изображений координат центров атомов в элементарной ячейке кристалла. Положения структуры иллюстративных полученных с помощью генной инженерии Cys остатков тяжелых и легких цепей пронумерованы (в соответствии с системой последовательной нумерации).
На фигуре 1B показана схема последовательной нумерации (верхняя строка), начиная с N-конца в сравнении со схемой нумерации Kabat (нижняя строка) для 4D5v7fabH. Вставки с нумерацией Kabat отмечены как a,b,c.
На фигурах 2A и 2B показаны измерения связывания с детектированием коэффициента поглощения на 450 нм для Cys мутантных (ThioFab) вариантов фаг-hu4D5Fabv8 и -hu4D5Fabv8: (A) не-биотинилированный фаг-hu4D5Fabv8 и (B) биотинилированный фаг-hu4D5Fabv8, с помощью анализа PHESELECTOR для взаимодействия с BSA (белые столбики), HER2 (заштрихованные столбики) или стрептавидином (черные столбики).
На фигурах 3A и 3B показано измерения связывания с детектированием коэффициента поглощения на 450 нм Cys мутантных вариантов hu4D5Fabv8 (слева) и hu4D5Fabv8 (ThioFab): (A) не-биотинилированный фаг-hu4D5Fabv8 и (B) биотинилированный фаг-hu4D5Fabv8, с помощью анализа PHESELECTOR для взаимодействия с: BSA (белые столбики), HER2 (заштрихованные столбики) и стрептавидином (черные столбики). Варианты легких цепей находятся на левой стороне и варианты тяжелых цепей находятся на правой стороне. Реакционноспособность тиола = OD450нм для связывания стрептавидина ÷ OD450нм для связывания HER2 (антитело)(OD-оптическая плотность).
На фигуре 4A показаны значения доли доступной поверхности остатков на hu4D5Fabv8 дикого типа. Активные сайты на легкой цепи находятся на левой стороне, а активные сайты на тяжелой цепи находятся на правой стороне.
На фигуре 4B показаны измерения связывания с детектированием коэффициента поглощения на 450 нм биотинилированных Cys мутантных вариантов hu4D5Fabv8 (слева) и hu4D5Fabv8 (ThioFab) для взаимодействия с HER2 (день 2), стрептавидином (SA) (день 2), HER2 (день 4) и SA (день 4). Cys варианты фаг-hu4D5Fabv8 изолируют и хранят при 4°C. Конъюгирование с биотином осуществляют либо в день 2, либо в день 4, после анализов PHESELECTOR для отслеживания их взаимодействия с Her2 и стрептавидином, как описано в Примере 2, и зондирования стабильности реакционноспособных тиольных групп на полученных с помощью генной инженерии вариантах ThioFab.
На фигуре 5 показаны измерения связывания с детектированием коэффициента поглощения на 450 нм для конъюгированного с биотином-малеимидом hu4D5Fabv8 (A121C) и для небиотинилированного hu4D5Fabv8 дикого типа при связывании со стрептавидином и HER2. Каждый Fab исследуют при концентрации 2 нг и 20 нг.
На фигуре 6 показан анализ ELISA с детектированием коэффициента поглощения на 450 нм для биотинилированного ABP-hu4D5Fabv8 дикого типа (wt) и для мутантов с цистеиновыми заменами ABP-hu4D5Fabv8 V110C и A121C для связывания с альбумином кролика, стрептавидином (SA) и HER2.
На фигуре 7 показан анализ ELISA с детектированием коэффициента поглощения на 450 нм на биотинилированных мутантах с цистеиновыми заменами ABP-hu4D5Fabv8 (вариантов ThioFab): (слева направо) одинарные Cys варианты ABP-V110C, ABP-A121C и двойные Cys варианты ABP-V110C-A88C и ABP-V110C-A121C для связывания с альбумином кролика, HER2 и стрептавидином (SA), и зондирование с помощью Fab-HRP или SA-HRP.
На фигуре 8 показано связывание биотинилированного фага ThioFab и антитела против фагового HRP с HER2 (вверху) и стрептавидином (внизу).
На фигуре 9A показано схематическое изображение связывания биотинилированного антитела с иммобилизованным HER2 со связыванием с меченным HRP вторичным антителом для детектирования поглощения.
На фигуре 9B показаны измерения связывания с детектированием коэффициента поглощения на 450 нм вариантов тио-трастузумаба, конъюгированного с биотином-малеимидом, и небиотинилированного трастузумаба дикого типа со связыванием с иммобилизованным HER2. Слева направо: V110C (одинарный Cys), A121C (одинарный Cys), V110C/A121C (двойной Cys) и трастузумаб. Каждый вариант тио-IgG и трастузумаба исследуют при 1, 10 и 100 нг.
На фигуре 10A показано схематическое изображение связывания биотинилированного антитела с иммобилизованным HER2 со связыванием биотина с анти-IgG-HRP для детектирования поглощения.
На фигуре 10B показаны измерения связывания с детектированием коэффициента поглощения на 450 нм вариантов тио-трастузумаба, конъюгированного с биотином-малеимидом, и небиотинилированного трастузумаба дикого типа со связыванием с иммобилизованным стрептавидином. Слева направо: V110C (одинарный Cys), A121C (одинарный Cys), V110C/A121C (двойной Cys) и трастузумаб. Каждый вариант тио-IgG и трастузумаб исследуют при 1, 10 и 100 нг.
На фигуре 11 показан общий способ получения антитела, полученного с помощью генной инженерии, с цистеиновыми заменами (ThioMab), экспрессируемого из культуры клеток, для конъюгирования.
Подробное описание иллюстративных вариантов осуществления
Далее приведено подробное описание вариантов осуществления настоящего изобретения, примеры которых иллюстрируются в прилагаемых структурах и формулах. Хотя настоящее изобретение будет описано в сочетании с перечисленными вариантами осуществления, понятно, что они не предназначены для ограничения настоящего изобретения этими вариантами осуществления. Наоборот, настоящее изобретение, как предполагается, включает все альтернативы, модификации и эквиваленты, которые могут быть включены в рамки настоящего изобретения, как определяется формулой изобретения.
Специалисту в данной области известно множество способов и материалов, подобных тем, которые описаны в настоящем документе, или эквивалентных им, которые могут использоваться при осуществлении настоящего изобретения. Настоящее изобретение ни в коем случае не ограничивается описанными способами и материалами.
Если не определено иного, технические и научные термины, используемые в настоящем документе, имеют такое же значение, как обычно понимается специалистом в области, к которой принадлежит настоящее изобретение, и соответствуют: Singleton et al (1994) Dictionary of Microbiology and Molecular Biology, 2ND Ed., J. Wiley & Sons, New York, NY; и Janeway, C, Travers, P., Walport, M., Shlomchik (2001) Immunobiology, 5th Ed., Garland Publishing, New York.
Определения
Если не указано иного, то следующие ниже термины и фразы, как используется в настоящем документе, как предполагается, имеют следующие значения:
Если в настоящем документе используются торговые наименования, заявители предполагают независимо включить препарат продукта с этим торговым наименованием, лекарственное средство дженерик и активный фармацевтический ингредиент (ингредиенты) продукта с этим торговым наименованием.
Термин "антитело" используется в настоящем документе в широком смысле и конкретно включает моноклональные антитела, поликлональные антитела, димеры, мультимеры, мультиспецифичные антитела (например, биспецифичные антитела) и фрагменты антител, постольку, поскольку они демонстрируют желаемую биологическую активность (Miller et al (2003) Jour. of Immunology 170:4854-4861). Антитела могут представлять собой антитела мыши, антитела человека, гуманизированные антитела, химерные антитела или антитела, полученные от других видов. Антитело представляет собой белок, вырабатываемый иммунной системой, который способен распознавать конкретный антиген и связываться с ним. (Janeway, C, Travers, P., Walport, M., Shlomchik (2001) Immuno Biology, 5th Ed., Garland Publishing, New York). Мишеневый антиген, как правило, имеет множество сайтов связывания, также называемых эпитопами, распознаваемых с помощью CDR на множестве антител. Каждое антитело, которое специфично связывается с отличным от других эпитопом, имеет отличную от других структуру. Таким образом, один антиген может иметь более одного соответствующего ему антитела. Антитело включает полноразмерную молекулу иммуноглобулина или иммунологически активную часть полноразмерной молекулы иммуноглобулина, то есть, молекулу, которая содержит сайт связывания антигена, которая иммунноспецифично связывает антиген мишени, представляющей интерес, или часть его, такие мишени включают, но, не ограничиваясь этим, раковые клетки или клетки, которые продуцируют аутоиммунные антитела, связанные с аутоиммунным заболеванием. Иммуноглобулин, описываемый в настоящем документе, может принадлежать к любому типу (например, IgG, IgE, IgM, IgD и IgA), класса (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подклассу молекул иммуноглобулина. Иммуноглобулины могут быть получены от любых видов. В одном из аспектов, однако, иммуноглобулин имеет происхождение от людей, мышей или кроликов.
"Фрагменты антител" содержат часть полноразмерного антитела, как правило, его область, связывающуюся с антигеном, или вариабельную область. Примеры фрагментов антител включают фрагменты Fab, Fab’, F(ab’)2 и Fv; диатела; линейные антитела; минитела (Olafsen et al (2004) Protein Eng. Design & Sel. 17(4):315-323), фрагменты, продуцируемые с помощью библиотеки экспрессирования Fab, антиидиотипические (анти-Id) антитела, CDR (комплементарные определяющие области) и фрагменты связывания эпитопов любых объектов, упоминаемых выше, которые иммунноспецифично связываются с антигенами раковых клеток, вирусными антигенами или микробными антигенами, одноцепочечные молекулы антител и мультиспецифичные антитела, сформированные из фрагментов антител.
Термин "моноклональное антитело", как используется в настоящем документе, относится к антителу, получаемому из популяции по существу гомогенных антител, то есть, индивидуальные антитела, составляющие популяцию, являются идентичными, за исключением естественных мутаций, которые могут присутствовать в малых количествах. Моноклональные антитела являются высокоспецифичными, будучи направленными против единственного антигенного активного сайта. Кроме того, в противоположность препаратам поликлональных антител, которые содержат различные антитела, направленные против различных детерминантов (эпитопов), каждое моноклональное антитело направлено против одного детерминанта на антигене. В дополнение к их специфичности, моноклональные антитела являются преимущественными в том, что они могут синтезироваться незагрязненными другими антителами. Прилагательное "моноклональный" показывает характер антитела, как полученного из гомогенной по существу популяции антител, и не должно рассматриваться как требующее получение антитела с помощью какого-либо конкретного способа. Например, моноклональные антитела, которые должны использоваться в соответствии с настоящим изобретением, могут быть получены с помощью гибридомного способа, описанного впервые Kohler et al (1975) Nature 256:495, или могут быть получены с помощью способов с использованием рекомбинантной ДНК (см. например: патент США № 4816567; патент США № 5807715). Моноклональные антитела могут также быть выделены из библиотек фаговых антител с использованием способов, например, описанных в Clackson et al (1991) Nature, 352:624-628; Marks et al (1991) J. Mol. Biol, 222:581-597.
Моноклональные антитела в настоящем документе конкретно включают "химерные" антитела, в которых часть тяжелой и/или легкой цепи является идентичной соответствующим последовательностям антител или гомологичной полученным из конкретных видов, или принадлежащим конкретному классу, или подклассу антителам, в то время как остальная часть цепи (цепей) является идентичной или гомологичной соответствующим последовательностям в антителах, полученных от других видов или принадлежащих к другому классу или подклассу антител, а также фрагменты таких антител, постольку, поскольку они демонстрируют желаемую биологическую активность (патент США № 4816567; и Morrison et al (1984) Proc. Natl. Acad. Sci. USA, 81:6851-6855). Химерные антитела, представляющие интерес в настоящем документе, включают "приматизированные" антитела, содержащие последовательности связывания антигена вариабельного домена, полученные от примата, иного, чем человек (например, от старосветской мартышки, человекообразной обезьяны, и тому подобное) и последовательности из константной области человека.
"Интактное антитело" в настоящем документе представляет собой антитело, содержащее домены VL и VH, а также константный домен легкой цепи (CL) и константные домены тяжелой цепи, CH1, CH2 и CH3. Константные домены могут представлять собой константные домены нативных последовательностей (например, константные домены нативной последовательности человека) или вариант их аминокислотной последовательности. Интактное антитело может иметь одну или несколько "эффекторных функций", которые относятся к их биологическим активностям, приписываемым константной области Fc (область нативной последовательности Fc или область варианта Fc аминокислотной последовательности) антитела. Примеры эффекторных функций антитела включают связывание Clq; комплимент-зависимую цитотоксичность; связывание рецепторов Fc; антитело-зависимая опосредуемая клетками цитотоксичность (ADCC); фагоцитоз и даун-регуляцию поверхностных клеточных рецепторов, таких как рецепторы B лимфоцитов и BCR.
В зависимости от аминокислотной последовательности константного домена их тяжелых цепей, интактные антитела могут быть отнесены к различным "классам". Имеется пять главных классов интактных иммуноглобулиновых антител: IgA, IgD, IgE, IgG и IgM, и несколько из них могут дополнительно быть разделены на "подклассы" (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам антител, называют α, δ, ε, γ и μ, соответственно. Структуры субъединиц и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны. Ig формы включают шарнирные модификации или бесшарнирные формы (Roux et al (1998) J. Immunol. 161:4083-4090; Lund et al (2000) Eur. J. Biochem. 267:7246-7256; US 2005/0048572; US 2004/0229310).
"Рецептор ErbB" представляет собой рецепторный белок тирозинкиназу, который принадлежит семейству рецепторов ErbB, члены которого являются важными медиаторами роста, дифференциации и выживаемости клеток. Семейство рецепторов ErbB включает четыре различных члена, включая рецептор эпидермального фактора роста (EGFR, ErbB1, HER1), HER2 (ErbB2 или p185neu), HER3 (ErbB3) и HER4 (ErbB4 или tyro2). Набор антител анти-ErbB2 характеризуют с использованием линии клеток опухоли груди человека SKBR3 (Hudziak et al (1989) Mol. Cell. Biol. 9(3): 1165-1172. Максимальное ингибирование получают с помощью антитела, называемого 4D5, которое ингибирует пролиферацию клеток на 56%. Другие антитела этого набора при этом анализе уменьшают пролиферацию клеток до меньшей степени. Антитело 4D5, кроме того, как обнаружено, сенсибилизирует линии клеток опухоли груди, сверхэкспрессирующие ErbB2, по отношению к цитотоксичным воздействиям TNF-α (патент США № 5677171). Антитела анти-ErbB2, обсуждаемые Hudziak et al., дополнительно характеризуются Fendly et al (1990) Cancer Research 50: 1550-1558; Kotts et al. (1990) In vitro 26(3):59A; Sarup et al. (1991) Growth Regulation 1:72-82; Shepard et al. J. (1991) Clin. Immunol. 11(3): 117-127; Kumar et al. (1991) Mol. Cell. Biol. 11(2):979-986; Lewis et al. (1993) Cancer Immunol. Immunother. 37:255-263; Pietras et al. (1994) Oncogene 9: 1829-1838; Vitetta et al. (1994) Cancer Research 54:5301-5309; Sliwkowski et al. (1994) J. Biol. Chem. 269(20): 14661-14665; Scott et al. (1991) J. Biol. Chem. 266: 14300-5; D’souza et al. Proc. Natl. Acad. Sci. (1994) 91:7202-7206; Lewis et al. (1996) Cancer Research 56: 1457-1465; и Schaefer et al. (1997) Oncogene 15:1385-1394.
Рецептор ErbB будет, как правило, содержать внеклеточный домен, который может связывать лиганд ErbB; липофильный трансмембранный домен; консервативный внутриклеточный домен тирозинкиназы; а сигнальный домен с карбоксильным концом скрывает несколько тирозиновых остатков, которые могут быть фосфорилированными. Рецептор ErbB может представлять собой рецептор ErbB с "нативной последовательностью" или его "вариант аминокислотных последовательностей". Предпочтительно, рецептор ErbB представляет собой рецептор ErbB с нативной последовательностью человека. Соответственно, "член семейства рецепторов ErbB" включает EGFR (ErbB1), ErbB2, ErbB3, ErbB4.
Термин "вариант аминокислотной последовательности" относится к полипептидам, имеющим аминокислотные последовательности, которые отличаются до некоторой степени от полипептида с нативной последовательностью. Обычно варианты аминокислотных последовательностей будут обладать по меньшей мере примерно 70% идентичностью последовательности, по меньшей мере с одним доменом связывания рецептора нативного лиганда ErbB или, по меньшей мере с одним доменом связывания лиганда нативного рецептора ErbB, предпочтительно, они будут по меньшей мере примерно на 80%, более предпочтительно, по меньшей мере примерно на 90% гомологичными по последовательностям с такими доменами связывания рецептора или лиганда. Варианты аминокислотной последовательности обладают заменами, делециями и/или инсерциями в определенных положениях в нативной аминокислотной последовательности. Аминокислоты обозначаются с помощью обычных наименований, однобуквенных и трехбуквенных кодов.
"Идентичность последовательности" определяют как процент остатков в варианте аминокислотнной последовательности, которые являются идентичными после совмещения последовательностей и введения пробелов, если это необходимо, для достижения максимального процента идентичности последовательности. Способы и компьютерные программы для совмещения хорошо известны в данной области. Одна такая компьютерная программа представляет собой программу "Align 2", разработанную Genentech, Inc., которая подана вместе с документаций для пользователей в United States Copyright Office, Washington, DC 20559, 10 декабря 1991 года.
"Нативные антитела" обычно представляют собой гетеротетрамерные гликопротеины массой примерно 150000 дальтон, состоящие из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей. Каждая легкая цепь связана с тяжелой цепью посредством одной ковалентной дисульфидной связи, в то время как количество дисульфидных связей среди тяжелых цепей различных изотипов иммуноглобулинов изменяется. Каждая тяжелая и легкая цепь также имеет расположенные на одинаковых расстояниях друг от друга межцепные дисульфидные мостики. Каждая тяжелая цепь имеет на одном конце вариабельный домен (VH) за которым следует ряд константных доменов. Каждая легкая цепь имеет вариабельный домен на одном конце (VL) и константный домен на ее другом конце. Константный домен легкой цепи совмещен с первым константным доменом тяжелой цепи, и вариабельный домен легкой цепи совмещен с вариабельным доменом тяжелой цепи. Конкретные аминокислотные остатки, как предполагается, образуют границу раздела между вариабельными доменами легкой цепи и тяжелой цепи.
Термин "вариабельный" относится к тому факту, что определенные части вариабельных доменов сильно различаются по последовательности среди различных антител и используются при связывании и при установлении специфичности каждого конкретного антитела к его конкретному антигену. Однако вариабельность не является равномерно распределенной по вариабельным доменам антител. Она концентрируется в трех сегментах, называемых гипервариабельными областями в вариабельных доменах, как в легкой цепи, так и тяжелой цепи. Более консервативные части вариабельных доменов называют каркасными областями (FR). Вариабельные домены нативных тяжелых и легких цепей, каждый, содержат четыре FR, в основном имеющих β-складчатую конфигурацию, соединенных тремя гипервариабельными областями, которые образуют петли, соединяющие, а в некоторых случаях образующие часть β-складчатой структуры. Гипервариабельные области каждой цепи удерживаются вместе в тесной близости с помощью FR и вместе с гипервариабельными областями из другой цепи вносят вклад в образование сайта связывания антитела с антигеном (смотри Kabat et al (1991) Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD). Константные домены не вовлекаются непосредственно в связывание антитела с антигеном, но демонстрируют различные эффекторные функции, такие как участие антитела в зависимой от антитела клеточной цитотоксичности (ADCC).
Термин "гипервариабельная область", когда используется в настоящем документе, относится к аминокислотным остаткам антитела, которые ответственны за связывание антигена. Гипервариабельная область, как правило, содержит аминокислотные остатки из "области, определяющей комплементарность", или "CDR" (например, остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) в вариабельном домене легкой цепи и 31-35 (H1), 50-65 (H2) и 95-102 (H3) в вариабельном домене тяжелой цепи; Kabat et al, выше) и/или такие остатки из "гипервариабельной петли" (например, остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в вариабельном домене легкой цепи и 26-32 (H1), 53-55 (H2) и 96-101 (H3) в вариабельном домене тяжелой цепи; Chothia and Lesk (1987) J. Mol. Biol., 196:901-917). Остатки "каркасной области" или "FR" представляют собой остатки вариабельных доменов, иные, чем остатки гипервариабельной области, как определено в настоящем документе.
Обработка папаином антител дает два идентичных фрагмента связывания с антигеном, называемые фрагменты "Fab", каждый - с одним сайтом связывания антигена, и фрагмент остатков "Fc", наименование которого отражает его способность к легкой кристаллизации. Обработка пепсином дает фрагмент F(ab’)2, который имеет два сайта связывания с антигеном и по-прежнему способен к перекрестному связыванию антигена.
"Fv" представляет собой минимальный фрагмент антитела, который содержит полный сайт распознавания антигена и связывания антигена. Это область состоит из димера одной тяжелой цепи и одного вариабельного домена легкой цепи в тесной, нековалентной ассоциации. В этой конфигурации происходит то, что три гипервариабельных области каждого вариабельного домена взаимодействуют, определяя сайт связывания антигена на поверхности димера VH-VL. Коллективно, шесть гипервариабельных областей придают антителу специфичность связывания антигена. Однако, даже отдельный вариабельный домен (или половина Fv, содержащая только три гипервариабельных области, специфичных к антигену) обладает способностью к распознаванию и связыванию антигена, хотя и с более низкой аффинностью, чем сайт связывания целиком.
Fab фрагмент также содержит константный домен легкой цепи и первый константный домен (CH1) тяжелой цепи. Фрагменты Fab’ отличаются от фрагментов Fab добавлением нескольких остатков на карбокси конце домена CH1 тяжелой цепи, содержащих один или несколько цистеинов из шарнирной области антитела. Fab’-SH представляет собой обозначение в настоящем документе для Fab’, в котором цистеиновый остаток (остатки) константных доменов несет, по меньшей мере, одну свободную тиольную группу. Фрагменты F(ab’)2 антитела исходно образуются как пары фрагментов Fab’, которые имеют шарнирные цистеиновые остатки между ними. Известны также другие химические связи между фрагментами антител.
"Легкие цепи" антител от любых видов позвоночных могут быть приписаны к одному из двух различных типов, называемых каппа (κ) и лямбда (λ), на основе аминокислотных последовательностей их константных доменов.
"Одноцепочечные Fv" или "scFv" фрагменты антитела содержат домены VH и VL антитела, где эти домены присутствуют в одной полипептидной цепи. Предпочтительно, Fv полипептид дополнительно содержит полипептидный линкер между доменами VH и VL, который дает возможность scFv образовывать желаемую структуру для связывания антигена. Относительно обзора по scFv, смотри Plückthun, Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994). scFv фрагменты антитела анти-ErbB2 описаны в WO 93/16185; в патентах США № 5571894 и 5587458.
"Гуманизированные" формы антител, не происходящих от человека, (например, грызунов) представляют собой химерные антитела, которые содержат минимальную последовательность, полученную из иммуноглобулина, не принадлежащего человеку. Гуманизация представляет собой способ переноса информации для связывания антигена мышей в акцептор неиммуногенного антитела человека и приводит к получению множества терапевтически полезных лекарственных средств. Способ гуманизации, как правило, начинается с переноса всех шести областей, определяющих комплементарность (CDR) мышей, в каркас антитела человека (Jones et al, (1986) Nature 321:522-525). Эти антитела с привитыми CDR, как правило, не сохраняют их исходной аффинности к связыванию антигена, и на самом деле, аффинность часто сильно ослабляется. Кроме CDR, выбранные остатки каркаса антитела, не принадлежащие человеку, должны также включаться для поддержания соответствующей конформации CDR (Chothia et al (1989) Nature 342:877). Перенос ключевых остатков каркаса мышей в акцептор человека для поддержания структурной конформации привитых CDR, как показано, восстанавливает связывание антигена и аффинность к нему (Riechmann et al (1992) J. Mol. Biol. 224, 487-499; Foote и Winter, (1992) J. Mol. Biol. 224:487-499; Presta et al (1993) J. Immunol. 151, 2623-2632; Werther et al (1996) J. Immunol. Methods 157:4986-4995; и Presta et al (2001) Thromb. Haemost. 85:379-389). По большей части, гуманизированные антитела представляют собой иммуноглобулины человека (антитела реципиента), в которых остатки из гипервариабельной области реципиента заменены остатками из гипервариабельной области видов, отличных от человека (донорное антитело), таких как мышь, крыса, кролик или приматы, отличные от человека, имеющие желаемую специфичность, аффинность и емкость. В некоторых случаях, остатки каркасной области (FR) иммуноглобулина человека заменяются соответствующими остатками, не принадлежащими человеку. Кроме того, гуманизированные антитела могут содержать остатки, которые не обнаруживаются в антителе реципиента или в донорном антителе. Эти модификации осуществляют для дополнительного улучшения рабочих характеристик антител. Как правило, гуманизированное антитело будет содержать по существу все по меньшей мере из одного, а, как правило, из двух, вариабельных доменов, в которых все или по существу все гипервариабельные петли соответствуют петлям иммуноглобулина, не принадлежащего человеку, и все или по существу все FR представляют собой остатки последовательностей иммуноглобулина человека. Гуманизированное антитело необязательно также будет содержать, по меньшей мере, часть константной области (Fc) иммуноглобулина, как правило, иммуноглобулина человека. Относительно других деталей см. патент США № 6407213; Jones et al (1986) Nature, 321:522-525; Riechmann et al (1988) Nature 332:323-329; и Presta, (1992) Curr. Op. Struct. Biol, 2:593-596.
"Свободная цистеиновая аминокислота" относится к цистеиновому аминокислотному остатку, который получен с помощью генной инженерии в исходном антителе, имеет тиольную функциональную группу (-SH) и не спаривается в виде внутримолекулярного или межмолекулярного дисульфидного мостика.
Термин "значение реакционноспособности тиола" представляет собой количественную характеризацию реакционноспособности свободных цистеиновых аминокислот. Значение реакционноспособности тиола представляет собой процент свободной цистеиновой аминокислоты в антителе с цистеиновами заменами, полученном с помощью генной инженерии, которая взаимодействует с реагентом, реакционноспособным по отношению к тиолу, и преобразуется в максимальное значение 1. Например, свободная цистеиновая аминокислота в полученном с помощью генной инженерии антителе с цистеиновами заменами, которое взаимодействует при 100% выходе с реагентом, реакционноспособным по отношению к тиолу, таким как реагент биотин-малеимид, с образованием антитела, меченного биотином, имеет значение реакционноспособности по отношению к тиолу, равное 1,0. Другая цистеиновая аминокислота, вводимая с помощью генной инженерии в это же или иное исходное антитело, которое взаимодействует с 80% выходом с реагентом, реакционноспособным по отношению к тиолу, имеет значение реакционноспособности по отношению к тиолу примерно 0,8. Другая цистеиновая аминокислота, вводимая с помощью генной инженерии в это же или в иное исходное антитело, которое вообще не может взаимодействовать с реагентом, реакционноспособным по отношению к тиолу, имеет значение реакционноспособности по отношению к тиолу 0. Определение значения реакционноспособности по отношению к тиолу для конкретного цистеина можно осуществлять с помощью анализа ELISA, масс-спектрометрии, жидкостной хроматографии, ауторадиографии или других количественных аналитических исследований.
"Исходное антитело" представляет собой антитело, содержащее аминокислотную последовательность, в которой один или несколько аминокислотных остатков заменены одним или несколькими цистеиновыми остатками. Исходное антитело может содержать последовательность нативного или дикого типа. Исходное антитело может иметь существующие ранее модификации аминокислотной последовательности (такие как дополнения, делеции и/или замены) по отношению к другим