Способы и промежуточные соединения для получения макроциклических ингибиторов протеазы hcv
Иллюстрации
Показать всеИзобретение относится, в частности, к усовершенствованному способу получения (1R,2R)-4-оксо-1,2-циклопентандикарбоновой кислоты II путем разделения рацемической 4-оксо-1,2-циклопентандикарбоновой кислоты (V), причем указанный способ включает: a) взаимодействие 4-оксо-1,2-циклопентандикарбновой кислоты (V) с бруцином или (1R,2S)-(-)-эфедрином с получением в результате бис-бруциновой или бис-(1R,2S)-(-)-эфедриновой соли соединения (V), и b) селективное осаждение бис-бруциновой или бис-(1R,2S)-(-)-эфедриновой соли (1R,2R)-4-оксо-1,2-циклопентандикарбоновой кислоты II, при этом бис-бруциновая или бис-(1R,2S)-(-)-эфедриновая соль (1S,2S)-4-оксо-1,2-циклопентандикарбоновой кислоты остается в растворе; c) высвобождение кислоты II путем удаления бруцина или (1R,2S)-(-)-эфедрина из осажденной соли, полученной на стадии (b); что в общих чертах представлено на следующей реакционной схеме. Заявленные способы предусматривают возможность производства больших количеств активного ингредиента на основе способов, которые обеспечивают продукт с высоким выходом и с высокой степенью чистоты. 18 н. и 4 з.п. ф-лы, 41 пр.
Реферат
Область техники
Настоящее изобретение относится к синтезу и промежуточным соединениям для синтеза макроциклических ингибиторов протеазы вируса гепатита С (HCV).
Уровень техники
Вирус гепатита С (HCV) является главной причиной хронического гепатита, который может развиться в фиброз печени, приводящий к циррозу, конечной стадии заболевания печени, и к НСС (гепатоцеллюлярная карцинома), что делает его главной причиной пересадки печени. Современная анти-HCV терапия, основанная на пегилированном интерфероне-альфа (IFN-α) в комбинации с рибавирином, имеет ограниченную эффективность, значительные побочные эффекты и плохо переносится многими пациентами. Это побуждает к поиску более эффективного, более удобного и лучше переносимого лечения.
Репликация генома HCV опосредуется рядом ферментов, среди которых находится сериновая протеаза NS3 HCV и ее ассоциированный кофактор, NS4A. Описаны различные средства, которые ингибируют этот фермент. Публикация WO 05/073195 раскрывает линейные и макроциклические ингибиторы сериновой протеазы NS3 с центральным замещенным пролиновым остатком, а публикация WO 05/073216 - с центральным циклопентановым остатком. Среди них макроциклические производные являются привлекательными из-за их заметной активности против HCV и привлекательного фармакокинетического профиля.
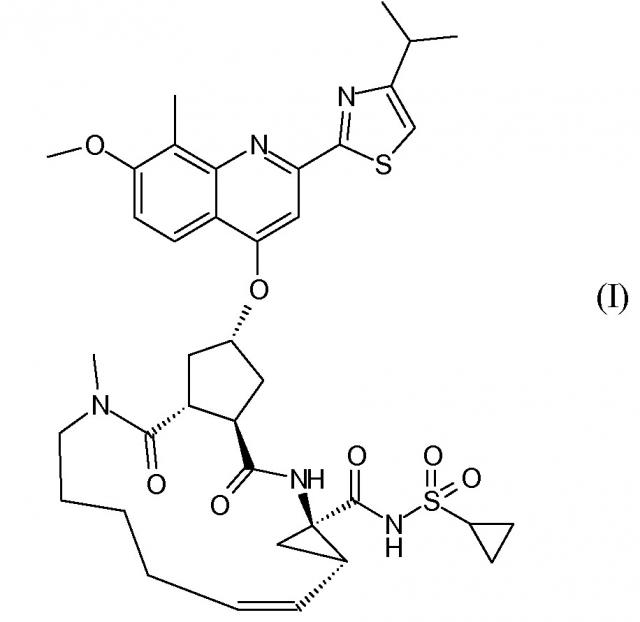
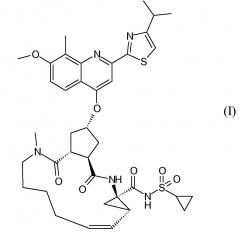
Публикация WO 2007/014926 описывает макроциклические циклопентановые и пролиновые производные, в том числе соединение формулы I, со структурой, представленной далее. Соединение формулы I является очень эффективным ингибитором сериновой протеазы HCV, и особенно привлекательно с точки зрения фармакокинетики. Благодаря своим благоприятным свойствам оно было выбрано в качестве потенциального кандидата для разработки лекарственного средства против HCV. Соответственно существует необходимость производства больших количеств такого активного ингредиента на основе способов, которые обеспечивают продукт с высоким выходом и с высокой степенью чистоты. В публикации WO 2008/092955 описаны способы и промежуточные соединения для получения соединения формулы I.
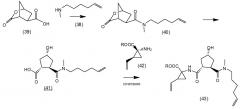
В соответствии с публикацией WO 2007/014926 соединение формулы I может быть получено исходя из бициклического лактона карбоновой кислоты, обозначенного как соединение 39 в примере 4, или в общем описании этой ссылки как соединение 17b, или как соединение VII в настоящем описании и в формуле изобретения. Карбоновую кислоту в бициклическом лактоне карбоновой кислоты сочетают с N-метилгекс-5-ениламином 38, после чего следует раскрытие лактона до 4-гидроксициклопентанового производного 41. Последнее производное 41 затем сочетают с аминоциклопропилкарбоксильным эфиром до диамида циклопентандикарбоновой кислоты 43, который сочетают с хинолином 36 по реакции образования простого эфира Мицуноби (Mitsunobu), которая включает инверсию у несущего гидрокси-группу атома углерода. Полученное промежуточное соединение 44 подвергают циклизации по реакции метатезиса до макроциклического производного, в котором сложноэфирную группу гидролизуют и сочетают с циклопропилсульфониламидом, получая целевой конечный продукт формулы I. Такие реакции проиллюстрированы на приведенной ниже схеме, в которой R представляет собой С1-4-алкил, а в примере 4 заместитель R представляет собой этил.
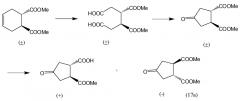
Энантиомерно чистый бициклический лактон 39 получают исходя из энантиомера 3,4-бис(метоксикарбонил)циклопентанона, обозначенного как (17а) в публикации WO 2007/014926. Последний получают, как описано в публикации Rosenquist el al., Acta Chemica Scandinavica 46 (1992), 1127-1129. Рацемический метиловый эфир циклогександикарбоновой кислоты синтезируют по реакции Дильса-Альдера 3-сульфолена и диметилфумарата, после чего следует окислительное расщепление двойной связи, циклизация и декарбоксилирование, приводящие к диметиловому эфиру (±)-4-кетоциклопентандикарбоновой кислоты. Разрешение последнего путем гидролиза с использованием эстеразы свиной печени приводит к соответствующей (+)-монокислоте и (-)-диэфиру, который представляет собой промежуточное соединение (17а) публикации WO 2007/014926.
После удаления (+)-монокислоты диэфир транс-(3R,4R)-3,4-бис(метоксикарбонил)циклопентанона (17а) превращают в бициклический лактон 17b (также обозначаемый как соединение VII, см. выше), вначале путем восстановления кето-группы в спирт, после чего следует гидролиз сложных эфиров и образование лактона.
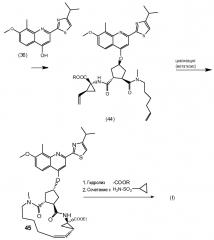
Методика синтеза для получения соединения I, описанная в публикации WO 2008/092955, начинается с промежуточного соединения D, где сложноэфирную группу гидролизуют и сочетают со сложным эфиром циклопропиламинокислоты С. Полученное промежуточное соединение В циклизуют по реакции олефинового метатезиса до макроциклического сложного эфира А, который гидролизуют и сочетают с циклопропилсульфониламидом до конечного продукта I. Такие реакции представлены в общих чертах на приведенной ниже реакционной схеме. В этой и в следующих реакционных схемах R представляет собой С1-4-алкил, в частности, R представляет собой этил. R1 представляет собой С1-4-алкил, в частности, R1 представляет собой метил или этил.
Промежуточное соединение D, в свою очередь, получают, начиная с гидроксициклопентилового бис-эфира формулы Н1, или:
(а) взаимодействием Н1 с тиазолил-замещенным хинолинолом Е с получением хинолинилоксициклопентилового бис-эфира формулы К, после чего следует расщепление группы бензилового эфира до монокарбоновой кислоты J, которую, в свою очередь, сочетают с N-метилгексенамином с образованием промежуточного соединения D; или
(b) расщеплением бензилового эфира в соединении Н1 до монокарбоновой кислоты G, сочетанием последней с N-метилгексенамином с получением гидроксициклопентиламида F, который, в свою очередь, вводят в реакцию с соединением E, получая в результате соединение D; что показано в общих чертах на приведенной ниже реакционной схеме:
Каждый R1 на схеме принимает определенные выше значения, и Bn означает бензил.
Публикация WO 2008/092955 также описывает методики получения промежуточного соединения Н1, начиная с 4-оксо-1,2-циклопентандикарбоновой кислоты О, путем восстановления кето-группы в спиртовую группу, в результате получают 4-гидрокси-1,2-циклопентандикарбоновую кислоту N, которую, в свою очередь, циклизуют до бициклического лактона М. Этерификация карбоксильной группы в последнем дает бензиловый эфир лактона L, где лактон раскрывают реакцией переэтерификации в присутствии С1-4-алканола, получая в результате промежуточное соединение Н, которое разрешают по его энантиомерам Н1 и Н2; что показано в общих чертах на приведенной ниже реакционной схеме:
Недостаток описанного выше способа состоит в том, что он включает разрешение энантиомеров соединения Н с помощью хиральной колоночной хроматографии, обременительной процедуры, которую трудно проводить при крупномасштабном производстве. Другой недостаток состоит в том, что разрешение имеет место на последней стадии синтеза, в результате чего половина структурного блока соединения Н выбрасывается. Присутствие различных хиральных центров в соединении формулы I и его предшественниках представляет собой особую проблему в том, что энантиомерная чистота является существенной для того, чтобы иметь продукт, который приемлем для терапевтического применения. Следовательно, способы получения соединения D должны приводить к продуктам приемлемой энантиомерной чистоты без применения обременительных методик с потерей значительных количеств нецелевых стереоизомерных форм.
В публикации Honda et al., Tetrahedron Letters, Vol. 22, № 28, pp. 2679-2682, 1981, описан синтез (±)-брефелдина А, с использованием следующих исходных материалов:
Синтез Honda с соавторами начинается от dl-транс-4-оксо-циклопентан-1,2-дикарбоновой кислоты 2, которую этерифицируют до соответствующего метилового эфира 3 и восстанавливают с помощью никеля Ренея до спирта 4. Частичный гидролиз соединения 4 до монокарбоновой кислоты и бензилирование с помощью бензилбромида дает преимущественно диастереоизомер 5, а именно диастереоизомер, где гидрокси-группа и бензильная сложноэфирная группа находятся в цис-положении. Последний сложный эфир 5 в публикации Honda с соавторами и соединение Н, оба, являются рацематами, но являются диастереоизомерами друг друга, более точно эпимерами по атому углерода № 4, несущему гидрокси-группу. Соединение Н1 является одним из двух энантиомеров, полученных путем отделения от рацемического соединения Н. Другим энантиомером является соединение Н2.
Бициклический лактон (17b) представляет собой значимый структурный блок в синтезе соединения формулы I. Обнаружение пути синтеза для получения этого лактона с хорошим выходом и высокой энантиомерной чистотой является желаемой для достижения целью. Настоящее изобретение предлагает способ получения (1R,2R)-4-оксо-1,2-циклопентандикарбоновой кислоты, которая может быть легко превращена в бициклический лактон (17b).
Способы настоящего изобретения имеют преимущество в том, что они приемлемы для крупномасштабного производства. Обременительные стадии очистки, в особенности с помощью хроматографии, исключены.
Описание изобретения
Обзор структур, описанных в данном описании и в формуле изобретения.
| Соединение, номер | Структура |
| II | |
| III | |
| IV |
| V | |
| VI | |
| VII | идентично с |
| VIII | |
| IX | идентично с |
| X | |
| Quin | |
| XI |
| XII | |
| XIII | |
| XIV | |
| XV | |
| XVI | |
| XVII | идентично с |
| XVIII |
| XIX | |
| XX | |
| XXI | |
| XXII |
| TCT2,4,6-трихлор-1,3,5-триазин цианурхлорид | |
| CDMTХлордиметокситриазин | |
| DCMTДихлорметокситриазин | |
| DMTMMN-(3,5-диметокситриазинил)-N-метилморфолиний-хлорид |
В одном аспекте настоящее изобретение относится к способу получения (1R,2R)-4-оксо-1,2-циклопентандикарбоновой кислоты II путем разрешения рацемической 4-оксо-1,2-циклопентандикарбоновой кислоты (V), причем указанный способ включает:
(а) взаимодействие 4-оксо-1,2-циклопентандикарбоновой кислоты (V) с бруцином или (1R,2S)-(-)-эфедрином, с получением в результате бис-бруциновой или бис-(1R,2S)-(-)-эфедриновой соли (V), и
(b) селективное осаждение бис-бруциновой или бис-(1R,2S)-(-)-эфедриновой соли (1R,2R)-4-оксо-1,2-циклопентандикарбоновой кислоты II, тогда как бис-бруциновая или бис-(1R,2S)-(-)-эфедриновая соль (1S,2S)-4-оксо-1,2-циклопентандикарбоновой кислоты остается в растворе;
(с) высвобождение кислоты II путем удаления бруцина или (1R,2S)-(-)-эфедрина из осажденной соли, полученной на стадии (b).
Этот способ в общих чертах представлен на приведенной ниже реакционной схеме:
Изобретение также относится к промежуточному соединению соли (1R,2R)-4-оксо-1,2-циклопентандикарбоновой кислоты с бруцином (1:2), имеющей структуру III, и соли (1R,2R)-4-оксо-1,2-циклопентандикарбоновой кислоты с (1R,2S)-(-)-эфедрином (1:2), имеющей структуру IV.
Бруциновая соль III может быть получена путем смешения бруцина и транс-4-оксо-1,2-циклопентандикарбоновой кислоты в присутствии растворителя, нагревания смеси до тех пор, пока все твердые вещества не растворяться, и обеспечения возможности смеси охладиться, в результате чего бруциновая соль кристаллизуется.
Растворителями являются спирты, такие как метанол или этанол, и водные спирты, такие как водный метанол или этанол. Интерес представляют смеси спирт/вода с небольшим количеством воды, например, с содержанием воды в интервале от приблизительно 2 до приблизительно 20%, или от приблизительно 5 до приблизительно 10% (масс./масс.). В частности, можно использовать смесь вода/метанол с содержанием воды в интервале от приблизительно 5 до приблизительно 10%, например, приблизительно 5% (масс./масс.). В одном варианте осуществления готовят смесь водного спирта и бруцина и слегка нагревают до температуры в интервале от приблизительно 30 до приблизительно 50°С, например, до приблизительно 40°С, после чего добавляют раствор транс-4-оксо-1,2-циклопентандикарбоновой кислоты. Полученную смесь нагревают до тех пор, пока все твердые вещества не растворяться, в частности, путем нагревания при температуре кипения с обратным холодильником. Затем смеси дают охладиться, предпочтительно медленно, до комнатной температуры. Образовавшиеся твердые вещества отфильтровывают. Они могут быть перекристаллизованы, например, из воды.
Аналогично может быть получена (1R,2S)-(-)-эфедриновая соль IV, но вместо водных спиртов могут быть использованы водные кетоны, такие как водный ацетон. Интерес представляют смеси ацетон/вода с небольшим количеством воды, например, с содержанием воды в интервале от приблизительно 2 до приблизительно 25%, или от приблизительно 10 до приблизительно 20% (масс./масс.), например, приблизительно 16% (масс./масс.).
Разрешение может быть осуществлено с помощью (1S,2R)-(+)-эфедрина с получением (1S,2R)-(+)-эфедриновой соли (1S,2S)-4-оксо-1,2-циклопентандикарбоновой кислоты (2:1) в виде белого твердого вещества.
Разрешение транс-4-оксо-1,2-циклопентандикарбоновой кислоты также предпринимали с помощью цинхонидина с получением цинхонидиновой соли (1S,2S)-4-оксо-1,2-циклопентандикарбоновой кислоты (1:2), выделяемой в виде твердого вещества.
Разрешение также предпринимали с помощью цинхонина, однако соль, в ее рацемической форме, может быть выделена только в виде стекловидного твердого вещества.
Разрешение также предпринимали с помощью никотина, и снова неуспешно, так как соль транс-4-оксо-1,2-циклопентандикарбоновой кислоты была выделена в виде масла.
Бруциновая и (1R,2S)-(-)-эфедриновая соль (1R,2R)-4-оксо-1,2-циклопентандикарбоновой кислоты может быть превращена в свободную кислоту формулы II. На первой стадии бруцин и (1R,1S)-(-)-эфедрин удаляют обработкой водных суспензий соли основанием, например, гидроксидом аммония. Это предпочтительно проводят при повышенной температуре, например, при температуре, которая находится в интервале от 60 до 100°С, например, при 80°С. Охлаждение до комнатной температуры приводит к кристаллизации твердого бруцина, который может быть выделен фильтрованием. Обработка оставшегося раствора может быть проведена упариванием досуха и повторным растворением остатка в воде. К этому раствору добавляют кислоту, например, HCl, получая при осаждении (1R,2R)-4-оксо-1,2-циклопентандикарбоновую кислоту. Полученное твердое вещество может быть отфильтровано и промыто холодной водой.
Также может быть получена и выделена бис-соль щелочного металла.
Выделенный бруцин может быть высушен и перекристаллизован из смеси вода-этанол (50:50), чтобы очистить бруцин, который может быть использован повторно при разрешении.
В другом аспекте (R,R)-4-оксо-1,2-циклопентандикарбоновую кислоту II, полученную описанным выше способом, или бруциновую соль III, или (1R,2S)-(-)-эфедриновую соль (IV) используют в качестве исходного материала в способе получения бициклического лактона (VII) путем восстановления кето-группы до спиртовой группы, получая 4-гидрокси-1,2-циклопентандикарбоновую кислоту (VI), которую циклизуют до лактона (VII).
Рацемическая 4-оксо-1,2-циклопентандикарбоновая кислота V в качестве исходного материала может быть получена, как описано выше в разделе изобретения «Уровень техники». Восстановление кето-группы в гидрокси-группу, соединения II до соединения VI, может быть осуществлено с использованием подходящего восстановителя, в частности, с помощью водорода в присутствии металлического катализатора, например, родия на угле или на оксиде алюминия или никеля Ренея, в инертном растворителе, например, в водной среде, такой как вода, в присутствии основания, например, NaOH, KOH, или органического основания, такого как триэтиламин, N-метилморфолин или основание Ханига (диизопропилэтиламин).
Полученная 4-гидроксициклопентан-1,2-дикарбоновая кислота VI может быть превращена в соль, например, бис-соль третичного амина, такую как бис(триэтиламинная) соль, или бис-соль щелочного металла, такую как бис-натриевая или бис-калиевая соли.
Промежуточное соединение VI может быть подвергнуто циклизации с образованием лактона VII по реакции с хлорформиатом, например, этил- или метилхлорформиатом. Эту реакцию можно провести в инертном для реакции растворителе, таком как кетон, в особенности ацетон, или простой эфир, такой как ТГФ, или MeТГФ, или ацетонитрил. Может быть добавлено основание, например, третичный амин, такой как триэтиламин или N-метилморфолин (NMM). В альтернативном варианте осуществления лактон-образующим агентом является 2,4,6-трихлор-1,3,5-триазин (TCT) или его производное.
В конкретном варианте осуществления промежуточное соединение II превращают в 4-гидрокси-1,2-циклопентандикарбоновую кислоту VI по реакции восстановления, описанной выше, которая циклизует лактон VII с использованием триазинового производного, по методике «одного горшка» без выделения промежуточных продуктов. Соединение VI получают в воде после стадии восстановления, к которой может быть добавлен органический со-растворитель на второй стадии, например, ацетон, метилэтилкетон (МЕК), тетрагидрофуран (ТГФ) или 2-метилтетрагидрофуран (МеТГФ). Триазиновые производные для этой реакции включают такие агенты, как 2,4,6-трихлор-1,3,5-триазин (TCT), хлордиметокситриазин (CDMT), N-(3,5-диметокситриазинил)-N-метилморфолинийхлорид (DMTMM) или дихлорметокситриазин (DCMT). Такая реакционная последовательность дает простую, короткую и экономичную методику получения лактона VII с высоким выходом и высокой чистотой. Воду, используемую в качестве растворителя на стадии восстановления, нет необходимости удалять и никакого отделения промежуточного соединения 4-гидрокси-1,2-циклопентандикарбоновой кислоты VI не требуется.
Бруциновая и (1R,2S)-(-)-эфедриновая соли (1R,2R)-4-оксо-1,2-циклопентандикарбоновой кислоты III или IV могут быть превращены непосредственно в диметиловый эфир (1R,2R)-4-оксо-1,2-циклопентандикарбоновой кислоты. На первой стадии удаляют бруцин и (1R,2S)-(-)-эфедрин, как описано выше, и выделяют твердый бруцин и (1R,2S)-(-)-эфедрин. Маточные жидкости после выделения бруцина и (-)-эфедрина упаривают с получением энантиомерно чистой (1R,2R)-4-оксо-1,2-циклопентандикарбоновой кислоты. Она может быть использована для получения соединения I, как описано в публикации WO 2007/014926. Таким образом, остаток, который получен после упаривания, забирают в смесь метанол/толуол и добавляют сильную кислоту, например, серную кислоту. Реакционную смесь нагревают, предпочтительно, до кипения с обратным холодильником, после чего растворитель отгоняют из реакционной смеси, пока не будет достигнута внутренняя температура >70°С. Затем смесь охлаждают приблизительно до 30°С и добавляют воду. Полученную смесь перемешивают при комнатной температуре и дополнительно обрабатывают, выделяя образовавшийся органический слой. Упаривание дает целевой диметиловый эфир.
Последнее соединение может быть превращено в диметиловый эфир (1R,2R)-4-оксо-1,2-циклопентандикарбоновой кислоты VIII, как описано выше, и затем превращено в другие промежуточные соединения в синтезе соединения формулы I. Кето-группу в соединении VIII восстанавливают, получая промежуточное соединение IX, которое превращают в соединение Х по реакции переэтерификации по ОН-группе. Гидроксильную группу в соединении Х превращают в простую хинолинилэфирную группу в соединении XI по реакции Мицуноби, которая включает инверсию гидрокси-несущего атома углерода. Бензильную группу в соединении XI снимают, получая затем промежуточное соединение XII, и последнее сочетают со сложным эфиром циклопропиламинокислоты XXII, получая соединение XIII, в котором метиловый эфир гидролизуют с получением соединения XIV. Последнее сочетают с N-метил-5-гексен-1-амином XVI, получая промежуточное соединение XV, которое представляет собой соединение, описанное выше, и которое может быть подвергнуто циклизации до макроциклического промежуточного соединения А, которое превращают в конечный продукт I.
Такая реакционная последовательность проиллюстрирована на приведенной ниже схеме, где Quin представляет собой хинолиновую группу формулы:
Такая методика синтеза обеспечивает преимущество в том, что некоторые промежуточные соединения могут быть кристаллизованы, что дает возможность исключить примеси. Конечный продукт получают с высоким выходом и высокой чистотой, в частности, с высокой стереохимической чистотой. Промежуточные соединения, которые могут быть выделены в виде твердого вещества, представляют собой промежуточные соединения XI, XII, XIII и XIV.
В другом аспекте, соединение XVIII, полезное промежуточное соединение для получения соединения I, готовят из промежуточного соединения Х по схеме, описанной ниже:
В приведенной выше схеме и далее заместитель R2 представляет собой атом водорода, С1-4-алкил, арил, атом галогена, -SO2-C1-4-алкил, CN или NO2. R2 может быть замещен в о-, м- или, в особенности, в п-положении. Интерес представляет группа NO2, в особенности п-NO2 (4-NO2). R1 имеет значения, определенные выше, и в частности, представляет собой метил.
Соединение Х вводят в реакцию с ароматической кислотой, азодикарбоксилатом и фосфином в реакции Мицуноби с получением соединения XIX, которое выделяют из реакционной смеси в виде кристаллического твердого вещества, обеспечивая в результате эффективную очистку от обеих примесей в соединении Х, а также примесей от реакции Мицуноби. Соединение XIX обрабатывают ацетатом палладия и формиатом натрия, получают соединение ХХ, которое сочетают с N-метил-5-гексен-1-амином XVI, получая соединение XXI, которое обрабатывают основанием в метаноле, получая соединение XVIII (R1 = Ме).
Методики синтеза настоящего изобретения обеспечивают преимущество в том, что получают правильную стереохимию при циклопентановом остатке без использования хиральной хроматографии. Бруциновая соль III и эфедриновая соль IV, как установлено, селективно кристаллизуются с высокой диастереомерной чистотой (содержат кислоту II с высокой энантиомерной чистотой).
Открытие, что соли III и IV могут быть выделены путем кристаллизации, дает элегантный путь получения (R,R)-4-оксо-1,2-циклопентандикарбоновой кислоты II и затем бициклического лактона VII с высокой энантиомерной чистотой. Перекристаллизация или повторное суспендирование обеспечивают дополнительную очистку таких солей. Соли III и IV могут быть использованы в качестве исходного материала в дальнейшем синтезе кислоты VI, как описано выше. Последняя, в свою очередь, может быть превращена в лактон VII, важный структурный блок при получении соединения формулы I.
В другом варианте осуществления настоящее изобретение относится к соединениям per se формулы III или IV.
Циклический лактон кислоты VII может быть выделен либо в виде кислоты, либо в виде ее соли, но получаемый водно-органический раствор соединения VII, полученного в реакционной последовательности, описанной выше, может быть использован непосредственно в реакции сочетания с амином XVI с получением амида XVII.
В еще одном аспекте бициклический лактон кислоты VII или его соль, либо выделенные, либо невыделенные, используют в качестве исходного материала в способе получения циклопентанового производного XVIII реакцией бициклического лактона VII с N-метил-5-гексен-1-амином (NMHA) по реакции амидообразования с получением амида бициклического лактона XVII, в котором лактоновую группу открывают, получая целевой продукт XVIII. Такие реакции проиллюстрированы ниже на схеме, где R1 имеет значения, определенные выше.
Дальнейшую обработку соединения формулы XVIII до конечных продуктов формулы I проводят, как описано в приведенных выше реакционных схемах, и в особенности, как описано в публикации WO 2008/092955. Взаимодействие бициклического лактона VII с N-метил-5-гексен-1-амином XVI представляет собой реакцию амидообразования, которая включает взаимодействие исходных веществ с амид-сочетающим реагентом в растворителе необязательно в присутствии основания, как описано в публикациях WO 05/073195 и WO 2007/014926. Такая реакция может быть проведена, например, с использованием N-этоксикарбонил-2-этокси-1,2-дигидрохинолина (EEDQ) в качестве сочетающего агента в дихлорметане (DCM), тетрагидрофуране (ТГФ) или 2-метилтетрагидрофуране (МеТГФ) в качестве растворителя; или может быть проведена с использованием TCT или его производных (CDMT, DCMT, DMTMM) в воде или в смеси воды и органического растворителя. Органическими растворителями для такой реакции являются ацетон, метилэтилкетон (MEK), тетрагидрофуран (ТГФ), МеТГФ, CPME (циклопентилметиловый эфир), С1-4-алкилацетат, С1-4-алкилпропионат, С1-4-алкилбутират и толуол.
Выше и далее используют следующие обозначения, если не указано другое. Определение «С1-4-алкил» означает линейные или разветвленные насыщенные углеводородные радикалы, содержащие от 1 до 4 атомов углерода, такие как, например, метил и этил; а также 1-пропил, 2-пропил, 1-бутил, 2-бутил, 2-метил-1-пропил, 2-метил-2-пропил.
Общепринятое обозначение для представления стереохимических соединений, которого также придерживаются в данном описании, состоит в следующем:
- Соединение, представленное без стереосвязей, является рацемическим, или конфигурация стереогенного(ых) центра(ов) не определена.
- Соединение, представленное со стереосвязями и одним из дескрипторов «(±)», «rel» или «рац», является рацемическим, и стереохимия является относительной.
- Соединение, представленное со стереосвязями, но без одного из дескрипторов «(±)», «rel» или «рац», относится к нерацемическому соединению (скалемическое вещество), то есть, к энантиообогащенному соединению.
Например, в публикации Honda с соавторами ссылку на обозначение «(±)» используют в названии статьи, показывая, что описан рацемический синтез с рацемическими промежуточными соединениями. Однако приведенному выше правилу не обязательно следовать во всех публикациях.
Энантиомерную чистоту указывают в виде энантиомерного отношения (э.о.). Для солей значение «э.о.» относится к отношению двух энантиомеров кислоты в смеси диастереомерных солей.
Примеры
Приведенные ниже примеры предназначены для иллюстрации настоящего изобретения и их не следует рассматривать в качестве ограничения объема настоящего изобретения.
Пример 1: Разрешение 4-оксо-1,2-циклопентандикарбоновой кислоты с помощью бруцина
Получение бис-бруциновой соли 4-оксо-1,2-циклопентандикарбоновой кислоты, то есть, соли (1R,2R)-4-оксо-1,2-циклопентандикарбоновой кислоты с бруцином (1:2)
Бруцин (288,7 г, 0,73 моль) добавляют к раствору воды (87 мл) в метаноле (1653 мл). Смесь нагревают до 40°С и по каплям в течение 15 минут добавляют раствор рац-транс-4-оксо-1,2-циклопентандикарбоновой кислоты (60 г, 0,35 моль) в метаноле (665 мл) и воде (35 мл). Полученную суспензию кипятят с обратным холодильником до тех пор, пока все твердые вещества не растворятся. Смеси дают медленно охладиться до 22°С. Твердые вещества отфильтровывают и промывают небольшим количеством воды. Твердый материал сушат в вакууме при 50°С в течение 16 часов, получают 265 г бруциновой соли (смесь диастереомеров, приблизительно 1:1). Затем эту соль перекристаллизовывают из воды (1026 мл), после сушки получают 120,6 г (36%) соли (1R,2R)-4-оксо-1,2-циклопентандикарбоновой кислоты с бруцином (1:2) в виде не совсем белого кристаллического вещества.
[α]D: -91,4.
Пример 2: Разрешение 4-оксо-1,2-циклопентандикарбоновой кислоты с помощью (-)-эфедрина
Получение бис-эфедриновой соли 4-оксо-1,2-циклопентандикарбоновой кислоты, то есть, с (1R,2S)-(-)-эфедрином [соединение (1R,2R)-4-оксо-1,2-циклопентандикарбоновой кислоты с (1R,2S)-(-)-эфедрином (1:2)]
(1R,2S)-(-)-Эфедрин (20,16 г, 0,12 моль) добавляют к суспензии транс-4-оксо-1,2-циклопентандикарбоновой кислоты (10 г, 58 ммоль) в ацетоне (200 мл) и воды (26 мл). Смесь кипятят с обратным холодильником до тех пор, пока не образуется гомогенный раствор. Смеси дают медленно охладиться до 22°С. Твердые вещества отфильтровывают и промывают ацетоном. Твердое вещество сушат в вакууме при 50°С, получают 10,3 г (35%) соединения (1R,2R)-4-оксо-1,2-циклопентандикарбоновой кислоты с (1R,2S)-(-)-эфедрином (1:2) в виде белого твердого вещества.
[α]D: -69,1.
1H-ЯМР (400 МГц, ДМСО-d6) δ м.д. 0,86 (д, J=6,8 Гц, 6H), 2,29-2,39 (м, 1H), 2,39-2,47 (м, 1H), 2,49 (с, 6H), 2,96-3,12 (м, 4H), 4,89 (д, J=3,3 Гц, 2H), 7,19-7,32 (м, 2H), 7,33-7,54 (м, 8H).
13C-ЯМР (150 МГц, ДМСО-d6) 11,17, 31,81, 42,12, 44,06, 59,55, 71,08, 125,97, 126,92, 127,93, 142,17, 175,74, 176,47, 215,40.
Разрешение также проводят с помощью (1S,2R)-(+)-эфедрина, получают с выходом 32% соединение (1S,2S)-4-оксо-1,2-циклопентандикарбоновой кислоты с (1S,2R)-(+)-эфедрином (1:2) в вид белого твердого вещества.
[α]D: +66,3.
Пример 3: (1R,2R)-4-оксо-1,2-циклопентандикарбоновая кислота и выделение эфедрина
К раствору соли (1R,2R)-4-оксо-1,2-циклопентандикарбоновой кислоты с (1R,2S)-(-)-эфедрином (1:2) (251 г, 0,5 моль) добавляют 8 н. водный раствор КОН (199,21 г, 1,10 моль) и смесь перемешивают 5 минут. Добавляют 2-метилтетрагидрофуран (688 мл) и смесь интенсивно перемешивают 20 минут. Два слоя разделяют и водную фазу подкисляют с помощью HCl. Органическая фаза 2-метилтетрагидрофурана содержит эфедрин, который может быть рециркулирован из этой фазы. Водный слой затем упаривают досуха на роторном испарителе и остаток перекристаллизовывают из воды (50 мл), получают 55,15 г (выход 64%) (1R,2R)-4-оксо-1,2-циклопентандикарбоновой кислоты в виде не совсем белого твердого вещества.
2-Метилтетрагидрофурановый раствор эфедрина упаривают досуха на роторном испарителе, получают сырой эфедрин в виде желтого масла, которое затвердевает при стоянии через три дня. Сырой эфедрин растворяют в 2-метилтетрагидрофуране (400 мл) и смесь подкисляют с помощью HCl в изопропаноле. Твердое вещество отфильтровывают и промывают 2-метилтетрагидрофураном (50 мл). Твердый гидрохлорид эфедрина сушат в вакууме при 50°С перед его растворением в воде (300 мл) при 40°С. К теплому водному раствору порциями добавляют достаточное количество карбоната калия, пока не образуется двухфазная система. Добавляют 2-метилтетрагидрофуран (200 мл) и смесь интенсивно перемешивают 5 минут. Два слоя разделяют и водную фазу экстрагируют 2-метилтетрагидрофураном (200 мл). Объединенные органические слои сушат над Na2SO4, фильтруют и упаривают досуха, получают 124,7 г (выход 75%) выделенного эфедрина в виде белого твердого вещества.
Пример 4: Получение бициклического лактона карбоновой кислоты VII
К суспензии 32,7 г (