Пегилированные липосомы для доставки кодирующей иммуноген рнк
Иллюстрации
Показать всеИзобретение относится к области биохимии. Описана группа изобретений, включающая липосому для доставки РНК в клетку, способ повышения защитного иммунного ответа у позвоночного животного, включающий стадию введения эффективного количества вышеуказанной липосомы, композиция для повышения защитного иммунного ответа у позвоночного животного, способ повышения защитного иммунного ответа у позвоночного животного, включающий стадию введения эффективного количества вышеуказанной композиции. Липосома для доставки РНК в клетку содержит в себе инкапсулированную РНК, кодирующую представляющий интерес иммуноген, где липосома содержит по меньшей мере один липид, который присоединен к полиэтиленгликолевой составляющей таким образом, что полиэтиленгликолевая составляющая присутствует на наружной поверхности липосомы. 4 н. и 17 з.п. ф-лы, 5 ил., 11 табл., 6 пр.
Реферат
Настоящая заявка испрашивает приоритет предварительной заявки на патент США № 61/529,878, которая была подана 31 августа 2011 г, полное содержание которой во всех аспектах включено в настоящее описание путем ссылки.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к области невирусной доставки РНК для иммунизации.
УРОВЕНЬ ТЕХНИКИ
Доставка нуклеиновых кислот для иммунизации животных являлась целью в течение нескольких лет. Испытывались различные подходы, включая применение ДНК или РНК, вирусных или невирусных векторов доставки (или даже без вектора доставки, в «голой» вакцине), реплицирующихся или нереплицирующихся векторов или вирусных или невирусных векторов.
Остается потребность в дополнительных и усовершенствованных вакцинах из нуклеиновых кислот и, в частности, в усовершенствованных путях доставки вакцин из нуклеиновых кислот.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В соответствии с изобретением иммунизация нуклеиновой кислотой достигается доставкой РНК, инкапсулированной внутрь липосомы. РНК кодирует представляющий интерес иммуноген. Липосома включает пегилированный липид, т.е., липид модифицирован ковалентным присоединением полиэтиленгликоля. ПЭГ обеспечивает липосомы покрытием, которое может обеспечить благоприятные фармакокинетические характеристики, например, он может увеличить устойчивость и предотвратить неспецифическое всасывание липосом. Заявители обнаружили, что длина ПЭГ может воздействовать на экспрессию in vivo инкапсулированной РНК, и, таким образом, в изобретении используются липосомы, которые содержат ПЭГ, имеющий среднюю молекулярную массу более 3 кДа, но меньше, чем 11 кДа. ПЭГ с молекулярной массой меньше 1 кДа (например, 500 или 750 Да) не образует устойчивые липосомы, и липосомы, образованные с ПЭГ в диапазоне 1-3 кДа, проявили более низкую эффективность в экспериментах по изучению иммуногенности (см. ниже).
Таким образом, изобретение относится к липосоме, внутрь которой инкапсулирована РНК, кодирующая представляющий интерес иммуноген, причем липосома содержит по меньшей мере один липид, который включает полиэтиленгликолевую составляющую, так что полиэтиленгликоль присутствует на наружной поверхности липосомы, причем средняя молекулярная масса полиэтиленгликоля составляет более 3 кДа, но меньше, чем 1 кДа. Эти липосомы пригодны для доставки in vivo РНК в клетку позвоночного, и поэтому они могут применяться в качестве компонентов в фармацевтических композициях для иммунизации индивидов против различных заболеваний.
Изобретение также относится к способу получения содержащей РНК липосомы, включающему стадию смешивания РНК с одним или несколькими липидами, в таких условиях, чтобы липиды образовывали липосому, в которой инкапсулирована РНК, причем по меньшей мере один липид включает полиэтиленгликолевую составляющую, которая становится расположенной на наружной поверхности липосомы в течение выполнения способа, и причем средняя молекулярная масса полиэтиленгликоля составляет более 3 кДа, но меньше, чем 1 кДа.
Липосома
В изобретении используются липосомы, внутрь которых инкапсулирована кодирующая иммуноген РНК. Таким образом, РНК (как в натуральном вирусе) отделена от любой внешней среды. Было обнаружено, что инкапсуляция внутрь липосомы защищает РНК от переваривания РНКазой. Липосомы могут включать некоторое количество наружной РНК (например, на их поверхности), но по меньшей мере половина РНК (а в идеале она вся) инкапсулирована в ядре липосомы. Инкапсуляция внутрь липосом отличается, например, от комплексов липид/РНК, описанных в ссылке 1, где РНК смешивается с предварительно образованными липосомами.
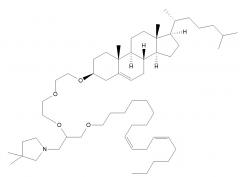
Различные амфифильные липиды могут образовывать бислои с водной средой для инкапсуляции содержащего РНК водного ядра в качестве липосомы. Эти липиды могут иметь анионную, катионную или цвиттерионную гидрофильную головную группу. Образование липосом из анионных фосфолипидов было описано еще в 1960-е годы, а катионные образующие липосомы липиды исследовали с 1990-х годов. Некоторые фосфолипиды являются анионными, тогда как другие являются цвиттерионными, а еще одни являются катионными. Подходящие классы фосфолипидов включают без ограничения фосфатидилэтаноламины, фосфатидилхолины, фосфатидилсерины и фосфатидилглицерины, и некоторые полезные фосфолипиды перечислены в таблице 1. Полезные катионные липиды включают без ограничения диолеоилтриметиламмонийпропан (DOTAP), 1,2-дистеарилокси-N,N-диметил-3-аминопропан (DSDMA), 1,2-диолеилокси-N,N-диметил-3-аминопропан (DODMA), 1,2-дилинолеилокси-N,N-диметил-3-аминопропан (DLinDMA), 1,2-дилиноленилокси-N,N-диметил-3-аминопропан (DLenDMA); дополнительные полезные катионные липиды описаны в ссылках 2 и 3. Цвиттерионные липиды включают без ограничения цвиттерионные липиды с ацильной группой и цвиттерионные липиды с группами простого эфира. Примерами полезных цвиттерионных липидов являются DPPC, DSPC, DOPC, додецилфосфохолин, 1,2-диолеоил-sn-глицеро-3-фосфатидилэтаноламин (DOPE) и 1,2-дифитаноил-sn-глицеро-3-фосфоэтаноламин (DPyPE). Липиды могут быть насыщенными или ненасыщенными. Предпочтительно использование по меньшей мере одного ненасыщенного липида для получения липосом. Если ненасыщенный липид имеет два «хвоста», то оба «хвоста» могут быть ненасыщенными, или он может иметь один насыщенный «хвост» и один ненасыщенный «хвост». Липид может включать стероидную группу в одном «хвосте», например, как в RV05.
Таким образом, в одном варианте осуществления изобретение относится к липосоме, имеющей липидный бислой, инкапсулирующий водное ядро, причем: (i) липидный бислой содержит по меньшей мере один липид, который включает полиэтиленгликолевую составляющую, так что полиэтиленгликоль присутствует на наружной поверхности липосомы, причем средняя молекулярная масса полиэтиленгликоля составляет более 3 кДа, но меньше, чем 11 кДа; и (ii) водное ядро включает РНК, которая кодирует иммуноген.
Липосомы по изобретению могут быть образованы из одного липида или из смеси липидов. Смесь может содержать (i) смесь анионных липидов, (ii) смесь катионных липидов, (iii) смесь цвиттерионных липидов, (iv) смесь анионных липидов и катионных липидов, (v) смесь анионных липидов и цвиттерионных липидов, (vi) смесь цвиттерионных липидов и катионных липидов или (vii) смесь анионных липидов, катионных липидов и цвиттерионных липидов. Аналогичным образом, смесь может содержать и насыщенные, и ненасыщенные липиды. Например, смесь может содержать DSPC (цвиттерионный, насыщенный), DlinDMA (катионный, ненасыщенный), и/или DMG (анионный, насыщенный). Когда используется смесь липидов, то не все составляющие липиды в смеси должны быть амфифильными, например, один или несколько амфифильных липидов могут быть смешаны с холестерином.
Когда липосома по изобретению образована из смеси липидов, то предпочтительно, чтобы доля этих липидов, которые являются пегилированными, как описано здесь, составляла меньше, чем 10% от общего количества липидов, например, от 0,5 до 5%, от 1 до 4%, или примерно 2%. Например, ниже показаны липосомы, в которых 2% общего количества липидов составляет ПЭГ-DMG. Остальная часть может быть получена, например, их холестерина (например, 35-50% холестерина) и/или катионного липида (например, 30-70%) и/или DSPC (например, 5-15%). Такие смеси используются ниже. Эти процентные величины представляют собой моль проценты.
Таким образом, липосома может быть образована из катионного липида (например, DlinDMA, RV05), цвиттерионного липида (например, DSPC, DPyPE), холестерина и пегилированного липида. Смесь DSPC, DlinDMA, ПЭГ-DMG и холестерина используется в примерах, а также несколько других смесей.
По меньшей мере один липид внутри липосомы включает полиэтиленгликолевую составляющую. Липосомы, которые включают эти пегилированные липиды, имеют ПЭГ, ориентированный так, чтобы он присутствовал по меньшей мере на наружной поверхности липосомы (но некоторое количество ПЭГ может быть также подвержено воздействию внутренней среды липосомы, т.е., водного ядра). Эта ориентация может быть достигнута прикреплением ПЭГ к соответствующей части липида. Например, в амфифильном липиде ПЭГ следовало бы прикрепить к гидрофильной головке, поскольку именно эта головка ориентируется в сторону обращенной к воде наружной поверхности липидного бислоя. Пегилирование такого типа может быть достигнуто ковалентным присоединением ПЭГ к липиду, например, с использованием таких технологий как технологии, описанные в ссылках 4 и 5.
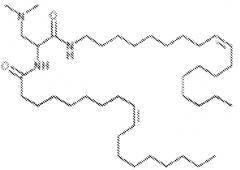
Таким образом, пегилированные липиды содержат ПЭГ, имеющий структуру:
где n обозначает молекулярную массу для ПЭГ выше 3 кДа, но меньше, чем 11 кДа, например, 69 или более, или от 70 до 240, или примерно 113 для пегилирования 5 кДа.
Составляющая ПЭГ может заканчиваться -O-метильной группой, и, таким образом, пегилированный липид может содержать:
Поэтому, включающий присоединение к азоту в головной группе липида, пегилированный липид, используемый в настоящем изобретении, может содержать:
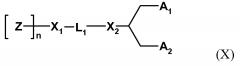
Один пригодный пегилированный липид для использования в изобретении представляет собой ПЭГ-DMG, используемый в примере. Могут использоваться другие пегилированные липиды, например, липиды формулы (X):
где Z обозначает компонент гидрофильной головной группы, выбранный из ПЭГ и полимеров на основе поли(оксазолина), поли(этиленоксида), поли(винилового спирта), поли(глицерина), поли(N-винилпирролидона), поли[N-(2-гидроксипропил)метакриламида] и поли(аминокислот), причем полимер может быть линейным или разветвленным, и причем полимер может быть необязательно замещенным;
Z полимеризирована n субъединицами;
n обозначает среднечисловую степень полимеризации от 10 до 200 единиц Z (и может оптимизироваться для различных групп Z);
L1 обозначает необязательно замещенный C1-10 алкиленовый или C1-10 гетероалкиленовый линкер, включающий ноль, один или два из простого эфира (например, -O-), сложного эфира (например, -C(O)O-), сукцината (например, -O(O)C-CH2-CH2-C(O)O-)), карбамата (например, -OC(O)-NR'-), карбоната (например, -OC(O)O-), (например, -NRC(O)NR'-), амина (например, -NR'-), амида (например, -C(O)NR'-), имина (например, -C(NR')-), тиоэфира (например, -S-), ксантана (например, -OC(S)S-) и фосфодиэфира (например, -OP(O)2O-), где R' независимо выбран из -H, -NH-, -NH2, -O-, -S-, фосфата или необязательно замещенного C1-10 алкилена;
X1 и X2 независимо выбраны из углерода или гетероатома, выбранного из - NH-, -O-, -S- или фосфата;
A1 и A2 независимо выбраны из C6-30 алкила, C6-30 алкенила и C6-30 алкинила, где A1 и A2 могут быть одинаковыми или различными, или A1 и A2 вместе с атомом углерода, к которому они присоединены, образуют необязательно замещенный стероид.
Липосома по изобретению обычно включает большое число ПЭГ составляющих, которые могут быть одинаковыми или различными. Средняя молекулярная масса ПЭГ в липосоме по изобретению составляет более 3 кДа, но меньше, чем 11 кДа, например, от 3,5 до 9 кДа, от 4 до 7,5 кДа, от 4,5 до 6 кДа, от 4,8 до 5,5 кДа или 5 кДа. Таким образом, ПЭГ может представлять собой ПЭГ, который общеизвестен как «ПЭГ 5000» или «ПЭГ 5k». В некоторых вариантах осуществления изобретение не охватывает липосомы, которые содержат конъюгированный с ПЭГ липид, в котором ПЭГ имеет среднюю молекулярную массу 8 кДа; в некоторых вариантах осуществления изобретение не включает липосомы, которые содержат конъюгированный с ПЭГ липид, в котором ПЭГ имеет среднюю молекулярную массу от 7,9 до 8,1 кДа.
ПЭГ обычно содержит линейные полимерные цепи, но в некоторых вариантах осуществления ПЭГ может содержать разветвленные полимерные цепи.
В некоторых вариантах осуществления ПЭГ может представлять собой замещенный ПЭГ, например, в котором один или несколько атомов углерода в полимере замещен одним или несколькими алкильными, алкокси, ацильными или арильными группами.
В некоторых вариантах осуществления ПЭГ может включать coполимерные группы, например, один или несколько пропиленовых мономеров, для образования ПЭГ полипропиленового полимера.
В качестве альтернативы пегилированию, липид может быть модифицирован ковалентным присоединением составляющей, отличной от ПЭГ. Например, в некоторых вариантах осуществления липид может включать полифосфазен. В некоторых вариантах осуществления липид может включать поли(винилпирролидон). В некоторых вариантах осуществления липид может включать поли(акриламид). В некоторых вариантах осуществления липид может включать поли(2-метил-2-оксазолин). В некоторых вариантах осуществления липид может включать поли(2-этил-2-оксазолин). В некоторых вариантах осуществления липид может включать фосфатидилполиглицерин. В некоторых вариантах осуществления липид может включать поли[N-(2-гидроксипропил)метакриламид]. В некоторых вариантах осуществления липид может включать полиалкиленэфирный полимер, отличный от ПЭГ.
Липосомы обычно делятся на три группы: мультиламеллярные везикулы (MLV); мелкие униламеллярные везикулы (SUV); и крупные униламеллярные везикулы (LUV). MLV имеют множественные бислои в каждой везикуле, образующие несколько отдельных водных компартментов. SUV и LUV имеют один бислой, инкапсулирующий водное ядро; SUV обычно имеют диаметр ≤50 нм, и LUV имеют диаметр >50 нм. Липосомы по изобретению представляют собой в идеале LUV с диаметром в диапазоне 60-180 нм и предпочтительно в диапазоне 80-160 нм.
Липосома по изобретению может представлять собой часть композиции, содержащей множество липосом, и липосомы внутри множества могут иметь диапазон диаметров. Для композиции, содержащей популяцию липосом с различными диаметрами: (i) по меньшей мере 80% по числу липосом должны иметь диаметры в диапазоне 60-180 нм и предпочтительно в диапазоне 80-160 нм, и/или (ii) средний диаметр (по интенсивности, например, Z-средний) популяции находится в идеале в диапазоне 60-180 нм и предпочтительно в диапазоне 80-160 нм. Диаметры внутри множества в идеале должны иметь индекс полидисперсии <0,2. Ожидается, что комплексы липосомы/РНК согласно ссылке 1 имеют диаметр в диапазоне 600-800 нм и имеют высокую полидисперсность.
Технологии получения пригодных липосом хорошо известны в данной области техники, например, см. ссылки 6-8. Один полезный способ описан в ссылке 9 и включает смешивание (i) этанолового раствора липидов, (ii) водного раствора нуклеиновой кислоты и (iii) буфера, с последующим смешиванием, уравновешиванием, разбавлением и очисткой. Предпочтительные липосомы по изобретению могут быть получены этим способом смешивания.
Для получения липосом с желательным диаметрами, смешивание можно выполнять, используя способ, при котором два потока подачи водного раствора РНК объединяются в одной зоне с одним потоком этанольного раствора липида, все с одинаковой скоростью потока, например, в микрожидкостном канале, как описано ниже.
РНК
Липосомы по изобретению включают молекулу РНК, которая (в отличии siРНК (малой интерферирующей РНК), как в ссылке 4) кодирует иммуноген. После введения частиц in vivo, РНК высвобождается из частиц и транслируется внутрь клетки для обеспечения иммуногена in situ.
РНК является +-нитевой, и поэтому она может транслироваться клетками без необходимости каких-либо промежуточных стадий репликации, таких как обратная транскрипция. Она может также связываться с рецепторами TLR7, экспрессируемыми иммунными клетками, посредством этого, инициируя адъювантный эффект.
Предпочтительные +-нитевые РНК являются самореплицирующимися. Самореплицирующаяся молекула РНК (репликон) может при доставке в клетку позвоночного даже без каких-либо белков привести к продукции множественных дочерних РНК путем транскрипции из нее самой (через антисмысловую копию, которую она генерирует из нее самой). Таким образом, самореплицирующаяся молекула РНК представляет собой обычно молекулу +-нити, которая может быть непосредственно транслирована после доставки в клетку, и эта трансляция обеспечивает РНК-зависимую РНК-полимеразу, которая затем продуцирует и антисмысловые, и смысловые транскрипты из доставленной РНК. Таким образом, доставленная РНК ведет к продукции множественных дочерних РНК. Эти дочерние РНК, а также коллинеарные субгеномные транскрипты могут сами транслироваться для обеспечения экспрессии in situ кодированного иммуногена или могут быть транскрибированы для обеспечения дополнительных транскриптов с таким же смыслом как доставлен, которые транслируются для обеспечения экспрессии иммуногена in situ. Общим результатом этой последовательности транскрипций является огромная амплификация ряда внесенных РНК репликона, и, таким образом, кодированный иммуноген становится основным полипептидным продуктом клеток.
Одна подходящая система для достижения саморепликации представляет собой использование РНК репликона на основе альфавируса. Эти +-нитевые репликоны транслируются после доставки в клетку для получения репликазы (или репликазы-транскриптазы). Репликаза транслируется в виде полипротеина, который ауторасщепляется для обеспечения репликационного комплекса, который создает геномные --нитевые копии +-нитевой доставленной РНК. Эти --нитевые транскрипты могут сами быть транскрибированы для получения дополнительных копий +-нитевой материнской РНК, а также для получения субгеномного транскрипта, который кодирует иммуноген. Таким образом, трансляция субгеномного транскрипта ведет к экспрессии in situ иммуногена инфицированной клеткой. Подходящие алфавирусные репликоны могут использовать репликазу из вируса Синдбис, вируса леса Семлики, вируса восточного лошадиного энцефалита, вируса Венесуэльского лошадиного энцефалита (VEEV) и т.д. Могут использоваться последовательности мутантных вирусов или вирусов дикого типа, например, в репликонах использовался аттенуированный мутант TC83 VEEV [10].
Таким образом, предпочтительная самореплицирующаяся молекула РНК кодирует (i) РНК-зависимую РНК-полимеразу, которая может транскрибировать РНК из самореплицирующейся молекулы РНК и (ii) иммуноген. Полимераза может представлять собой репликазу альфавируса, например, содержащую один или несколько альфавирусных белков nsP1, nsP2, nsP3 и nsP4.
В то время как натуральные альфавирусные геномы кодируют структурные белки вириона в дополнение к неструктурному полипротеину репликазы, предпочтительно, чтобы самореплицирующаяся молекула РНК по изобретению не кодировала альфавирусные структурные белки. Таким образом, предпочтительная самореплицирующаяся РНК может вести к продукции собственных копий геномной РНК в клетке, но не к продукции содержащих РНК вирионов. Неспособность продуцировать эти вирионы означает, что, в отличие от алфавируса дикого типа, сама самореплицирующаяся молекула РНК не может сохраняться в инфекционной форме. Альфавирусные структурные белки, которые необходимы для сохранения в вирусах дикого типа, отсутствуют в самореплицирующихся РНК по изобретению, и их место занимают ген(-ы), кодирующие представляющий интерес иммуноген, с тем, чтобы субгеномный транскрипт кодировал иммуноген, а не структурные белки вириона альфавируса.
Таким образом, самореплицирующаяся молекула РНК, полезная для изобретения, может иметь две открытые рамки считывания. Первая (5') открытая рамка считывания кодирует репликазу; вторая (3') открытая рамка считывания кодирует иммуноген. В некоторых вариантах осуществления РНК может иметь дополнительные (например, находящиеся ниже по ходу транскрипции) открытые рамки считывания, например, для кодирования дополнительных иммуногенов (см. ниже) или для кодирования дополнительных полипептидов.
Самореплицирующаяся молекула РНК может иметь 5'-последовательность, которая совместима с кодированной репликазой.
Самореплицирующиеся молекулы РНК могут иметь различные длины, но они обычно имеют длину 5000-25000 нуклеотидов, например, 8000-15000 нуклеотидов или 9000-12000 нуклеотидов. Таким образом, РНК длиннее, чем наблюдаемая при доставке миРНК.
Молекула РНК, полезная для изобретения, может иметь 5'-кэп (например, 7-метилгуанозин). Этот кэп может усилить трансляцию РНК in vivo.
5'-Нуклеотид молекулы РНК, полезной для изобретения, может иметь группу трифосфата на 5' конце. В кэппированной РНК она может быть связана с 7-метилгуанозином через мостик 5'-к-5'. Трифосфат на 5' конце может усиливать связывание RIG-I и, таким образом, может стимулировать адъювантные эффекты.
Молекула РНК может иметь поли-A хвост на 3' конце. Она может также включать последовательность, отвечающую за распознавание поли-A полимеразы (например, AAUAAA) около ее 3' конца.
Молекула РНК, полезная для изобретения, обычно является однонитевой. Однонитевые РНК могут в целом инициировать адъювантный эффект связыванием с TLR7, TLR8, геликазами РНК и/или PKR. РНК, доставленная в двухнитевой форме (dsРНК), может связываться с TLR3, и этот рецептор может также запускаться dsРНК, которая образуется или во время репликации однонитевой РНК, или внутри вторичной структуры однонитевой РНК.
Молекула РНК, полезная для изобретения, может быть для удобства получена транскрипцией in vitro (IVT). При IVT может использоваться матрица (кДНК), созданная и распространенная в форме плазмиды в бактерии, или созданная синтетически (например, способами генной инженерии в виде синтеза генов и/или полимеразной цепной реакции (ПЦР)). Например, ДНК-зависимая РНК-полимераза (такая как РНК-полимеразы бактериофага T7, T3 или SP6) может использоваться для транскрипции РНК с ДНК-матрицы. При необходимости, могут использоваться соответствующие реакции кэппирования и поли-присоединения (хотя Поли-A репликонов обычно кодируется в пределах ДНК-матрицы). Эти РНК-полимеразы могут иметь жесткие требования к нуклеотиду(-ам) с 5'-конца, и в некоторых вариантах осуществления эти требования должны соответствовать требованиям кодированных репликаз для обеспечения того, чтобы IVT-транскрибированная РНК могла эффективно функционировать в качестве субстрата для ее самокодирующихся репликаз.
Как обсуждается в ссылке 11, самореплицирующаяся РНК может включать (в дополнение к любой структуре 5'-кэпа) один или несколько нуклеотидов, имеющих модифицированное нуклеооснование. Например, самореплицирующиеся РНК могут включать одно или несколько модифицированных пирмидиновых нуклеооснований, таких как псевдоуридинновые и/или 5-метилцитозиновые остатки. Однако в некоторых вариантах осуществления РНК не включает модифицированные нуклеооснования и может не включать модифицированные нуклеотиды, т.е., все нуклеотиды в РНК являются стандартными A, C, G и U рибонуклеотиды (за исключением, любой структуры 5'-кэпа, которая может включать 7'-метилгуанозин). В других вариантах осуществления РНК может включать 5'-кэп, содержащий 7'-метилгуанозин, и первые 1, 2 или 3 рибонуклеотида 5'-конца могут быть метилированы в положении 2' рибозы.
РНК, используемая в изобретении, в идеале включает только фосфодиэфирные связи между нуклеозидами, но в некоторых вариантах осуществления она может содержать фосфорамидатные, фосфортиоатные и/или метилфосфонатные связи.
В идеале, липосома включает менее 10 различных видов РНК, например, 5, 4, 3 или 2 различных вида; наиболее предпочтительно, липосома включает один вид РНК, т.е., все молекулы РНК в липосоме имеют одинаковую последовательность и одинаковую длину.
Количество РНК на липосому может варьироваться. Число отдельных молекул самореплицирующейся РНК на липосому составляет обычно ≤50, например, <20, <10, <5 или 1-4 на липосому.
Иммуноген
Молекулы РНК, используемые в изобретении, кодируют полипептидный иммуноген. После введения липосомы РНК транслируется in vivo, и иммуноген может вызвать иммунный ответ у реципиента. Иммуноген может вызвать иммунный ответ на бактерию, вирус, гриб или паразит (или в некоторых вариантах осуществления на аллерген; и в других вариантах осуществления на опухолевой антиген). Иммунный ответ может включать реакцию антител (обычно включающую IgG) и/или клеточно-опосредованный иммунный ответ. Полипептидный иммуноген обычно вызывает иммунный ответ, который распознает соответствующий бактериальный, вирусный, грибковый или паразитарный (или алергенный или опухолевой) полипептид, но в некоторых вариантах осуществления полипептид может действовать в качестве мимотопа для вызова иммунного ответа, который распознает бактериальный, вирусный, грибковый или паразитарный сахарид. Иммуноген обычно представляет собой поверхностный полипептид, например, адгезин, гемагглютинин, оболочечный гликопротеин, спайковый гликопротеин и т.д.
Молекула РНК может кодировать один полипептидный иммуноген или множество полипептидов. Множественные иммуногены могут быть представлены в виде одного полипептидного иммуногена (слитого полипептида) или в виде отдельных полипептидов. Если иммуногены экспрессируются в виде отдельных полипептидов из репликона, то один или несколько из них могут быть обеспечены находящимся выше по ходу транскрипции IRES или дополнительным вирусным промоторным элементом. Альтернативно, множественные иммуногены могут быть экспрессированы из полипротеина, который кодирует отдельные иммуногены, слитые с короткой аутокаталитической протеазой (например, белка вируса ящура 2A), или в виде интеинов.
В отличие от ссылок 1 и 12, РНК кодирует иммуноген. Во избежание сомнений, изобретение не охватывает РНК, которая кодирует люциферазу светляков, или которая кодирует слитый белок β-галактозидазы E.coli, или которая кодирует зеленый флуоресцентный белок (GFP). Такие полипептиды могут использоваться в качестве маркеров, или даже в контексте генной терапии, но изобретение относится к доставке РНК для вызова системы иммунологического ответа. Таким образом, иммуноген также сам не является белком, который подается для дополнения или замещения дефективного белка хозяина (в качестве генной терапии). РНК также не является полностью РНК мышиного тимуса.
В некоторых вариантах осуществления иммуноген вызывает иммунный ответ на одну из этих бактерий:
Neisseria meningitidis: полезные иммуногены включают без ограничения мембранные белки, такие как адгезины, аутотранспортеры, токсины, белки приобретения железа и фактор H связывающий белок. Комбинация трех полезных полипептидов описана в ссылке 13.
Streptococcus pneumoniae: полезные полипептидные иммуногены описаны в ссылке 14. Они включают без ограничения субъединицу фимбрии RrgB, предшественник бета-N-ацетилгексозаминидазы (spr0057), spr0096, Общий стрессовый белок GSP-781 (spr2021, SP2216), серин/треонинкиназу StkP (SP1732) и пневмококковый поверхностный адгезин PsaA.
Streptococcus pyogenes: полезные иммуногены включают без ограничения полипептиды, описанные в ссылках 15 и 16.
Moraxella catarrhalis.
Bordetella pertussis: Полезные коклюшные иммуногены включают без ограничения коклюшный токсин или токсоид (PT), нитевидный гемагглютинин (FHA), пертактин и агглютиногены 2 и 3.
Staphylococcus aureus: Полезные иммуногены включают без ограничения полипептиды, описанные в ссылке 17, такие как гемолизин, esxA, esxB, связывающий феррихром белок (sta006) и/или липопротеин sta0l1.
Clostridium tetani: типичный иммуноген представляет собой столбнячный токсоид.
Cornynebacterium diphtheriae: типичный иммуноген представляет собой дифтерийный токсоид.
Haemophilus influenzae: Полезные иммуногены включают без ограничения полипептиды, описанные в ссылках 18 и 19.
Pseudomonas aeruginosa
Streptococcus agalactiae: полезные иммуногены включают без ограничения полипептиды, описанные в ссылке 15.
Chlamydia trachomatis: Полезные иммуногены включают без ограничения PepA, LcrE, ArtJ, DnaK, CT398, OmpH-подобный, L7/L12, OmcA, AtoS, CT547, Eno, HtrA и MurG {например, как описано в ссылке 20. LcrE [21] и HtrA [22] представляют собой два предпочтительных иммуногена.
Chlamydia pneumoniae: Полезные иммуногены включают без ограничения полипептиды, описанные в ссылке 23.
Helicobacter pylori: Полезные иммуногены включают без ограничения CagA, VacA, NAP и/или уреазу [24].
Escherichia coli: Полезные иммуногены включают без ограничения иммуногены, происходящие из энтеротоксигенной E. coli (ETEC), энтероагрегативной E. coli (EAggEC), диффузно сцепляющейся E. coli (DAEC), энтеропатогенной E. coli (EPEC), внекишечной патогенной E. coli (ExPEC) и/или энтерогеморрагической E. coli (EHEC). Штаммы ExPEC включают уропатогенную E.coli (UPEC) и связанную с менингитом/сепсисом E.coli (MNEC). Полезные полипептидных иммуногенов UPEC описаны в ссылках 25 и 26. Полезные иммуногены MNEC описаны в ссылке 27. Полезный иммуноген для нескольких типов E.coli является AcfD [28].
Bacillus anthracis
Yersinia pestis: Полезные иммуногены включают без ограничения те, которые описаны в ссылках 29 и 30.
Staphylococcus epidermis
Clostridium perfringens или Clostridium botulinums
Legionella pneumophila
Coxiella burnetii
Brucella, такая как B.abortus, B.canis, B.melitensis, B.neotomae, B.ovis, B.suis, B.pinnipediae.
Francisella, такая как F.novicida, F.philomiragia, F.tularensis.
Neisseria gonorrhoeae
Treponema pallidum
Haemophilus ducreyi
Enterococcus faecalis или Enterococcus faecium
Staphylococcus saprophyticus
Yersinia enterocolitica
Mycobacterium tuberculosis
Rickettsia
Listeria monocytogenes
Vibrio cholerae
Salmonella typhi
Borrelia burgdorferi
Porphyromonas gingivalis
Klebsiella
В некоторых вариантах осуществления иммуноген вызывает иммунный ответ на один из этих вирусов:
Orthomyxovirus: Полезные иммуногены могут быть из вируса A, B или C, такие как гемагглютинин, нейраминидаза или матричные белки M2. Когда иммуноген представляет собой гемагглютинин вируса гриппа, то он может быть из любого подтипа, например, H1, H2, H3, H4, H5, H6, H7, H8, H9, H10, H11, H12, H13, H14, H15 или H16.
Вирусы Paramyxoviridae: Вирусные иммуногены включают без ограничения те, которые происходят из пневмовирусов (например, респираторный синцитиальный вирус, RSV), рубулавирусов (например, вирус эпидемического паротита), парамиксовирусов (например, вирус парагриппа), метапневмовирусов и морбилливирусов (например, вирус кори).
Poxviridae: Вирусные иммуногены включают без ограничения те, которые происходят из ортопоксивируса, таких как Variola vera, включая без ограничения Variola major и Variola minor.
Picornavirus: Вирусные иммуногены включают без ограничения те, которые происходят из пикорнавирусов, таких как энтеровирусы, риновирусы, гепаранвирусы, кардиовирусы и афтовирусы. В одном варианте осуществления энтеровирус представляет собой полиовирус, например, полиовирус типа 1, типа 2 и/или типа 3. В другом варианте осуществления энтеровирус представляет собой EV71 энтеровирус. В другом варианте осуществления энтеровирус представляет собой вирус коксаки или вирус B.
Bunyavirus: Вирусные иммуногены включают без ограничения те, которые происходят из Orthobunyavirus, таких как вирус калифорнийского энцефалита, из флебовируса, такого как вирус лихорадки Рифтовой долины, или из Nairovirus, такого как вирус Крымской-Конголезской геморрагической лихорадки.
Heparnavirus: Вирусные иммуногены включают без ограничения те, которые происходят из гепарнавируса, такого как вирус гепатита A (HAV).
Filovirus: Вирусные иммуногены включают без ограничения те, которые происходят из филовируса, такого как вирус Эбола (включая эболавирус Заира, Берега Слоновой Кости, Рестона или Судана) или Марбургский вирус.
Togavirus: Вирусные иммуногены включают без ограничения те, которые происходят из Togavirus, такие как Rubivirus, Alphavirus или Arterivirus. Он включает вирус краснухи.
Flavivirus: Вирусные иммуногены включают без ограничения те, которые происходят из флавивируса, такого как вирус клещевого энцефалита (TBE), вирус денге (типов 1, 2, 3 или 4), вирус желтой лихорадки, вирус японского энцефалита, вирус Кьясанурского леса, вирус энцефалита Западного Нила, вирус энцефалита Сент-Луис, вирус русского весенне-летнего энцефалита, вирус энцефалита Повассан.
Pestivirus: Вирусные иммуногены включают без ограничения те, которые происходят из пестивируса, такого как вирус бычьей вирусной диареи (BVDV), вирус классической свиной лихорадки (CSFV) или вирус болезни Бордера (BDV).
Hepadnavirus: Вирусные иммуногены включают без ограничения те, которые происходят из гепаднавируса, такого как вирус гепатита B. Композиция может включать поверхностный антиген вируса гепатита B (HBsAg).
Другие вирусы гепатита: Композиция может включать иммуноген из вируса гепатита C, вирус гепатита дельта, вирус гепатита E или вирус гепатита G.
Rhabdovirus: Вирусные иммуногены включают без ограничения те, которые происходят из рабдовируса, такие как лиссавирус (например, вирус бешенства) и везикуловирус (VSV).
Caliciviridae: Вирусные иммуногены включают без ограничения те, которые происходят из Calciviridae, такие как вирус Норфолк (норовирус) и вирусы, подобные Норфолк, такие как гавайский вирус и вирус Снежных Гор.
Coronavirus: Вирусные иммуногены включают без ограничения те, которые происходят из коронавируса SARS (тяжелого острого респираторного синдрома), вируса птичьего инфекционного бронхита (IBV), вируса мышиного гепатита (MHV) и вируса свиного трансмиссивного гастроэнтерита (TGEV). Коронавирусный иммуноген может представлять собой спайковый полипептид.
Retrovirus: Вирусные иммуногены включают без ограничения те, которые происходят из онковируса, лентивируса (например, ВИЧ-1 или ВИЧ-2) или спумавируса.
Reovirus: Вирусные иммуногены включают без ограничения те, которые происходят из ортореовируса, ротавируса, орбивируса или колтивируса.
Parvovirus: Вирусные иммуногены включают без ограничения те, которые происходят из парвовируса B19.
Herpesvirus: Вирусные иммуногены включают без ограничения те, которые происходят из человеческого герпесвируса, такие как, только в качестве примера, вирусы простого герпеса (HSV) (например, HSV 1 и 2 типа), вирус опоясывающего лишая (VZV), вирус Эпштейна-Барра (EBV), цитомегаловирус (CMV), человеческий герпесвирус 6 (HHV6), человеческий герпесвирус 7 (HHV7) и человеческий герпесвирус 8 (HHV8).
Papovaviruses: Вирусные иммуногены включают без ограничения те, которые происходят из вирусов папилломы и вирусов полиомы. (Человеческий) вирус папилломы может относиться к серотипу 1, 2, 4, 5, 6, 8, 11, 13, 16, 18, 31, 33, 35, 39, 41, 42, 47, 51, 57, 58, 63 или 65, например, из одного или нескольких серотипов 6, 11, 16 и/или 18.
Adenovirus: Вирусные иммуногены включают те, которые происходят из аденовируса серотипа 36 (Ad-36).
В некоторых вариантах осуществления иммуноген вызывает иммунный ответ на вирус, который инфицирует рыбу, такой как: вирус инфекционной анемии лососевых (ISAV), вирус болезни поджелудочной железы лососевых (SPDV), вирус инфекционного пенкреонекроза (IPNV), вирус канального сомика (CCV), вирус рыбьей лимфоцистозной болезни (FLDV), вирус инфекционного гематопоэтического некроза (IHNV), герпесвирус карпа кои, пикорна-подобный вирус лососевых (также известный как пикорна-подобный вирус атлантического лосося), вирус атлантического лосося (LSV), ротавирус атлантического лосося (ASR), вирус «клубничной» болезни форели (TSD), вирус опухоли кижуча (CSTV) или вирус вирусной геморрагической септицемии (VHSV).
Грибковые иммуногены могут доставляться из возбудителей дерматофитозов, включая: Epidermophyton floccusum, Microsporum audouini, Microsporum canis, Microsporum distortum, Microsporum equinum, Microsporum gypsum, Microsporum nanum, Trichophyton concentricum, Trichophyton equinum, Trichophyton gallinae, Trichophyton gypseum, Trichophyton megnini, Trichophyton mentagrophytes, Trichophyton quinckeanum, Trichophyton rubrum, Trichophyton schoenleini, Trichophyton tonsurans, Trichophyton verrucosum, T. verrucosum var. album, var. discoides, var. ochraceum, Trichophyton violaceum и/или Trichophyton faviforme; или из Aspergillus fumigatus, Aspergillus flavus, Aspergillus niger, Aspergillus nidulans, Aspergillus terreus, Aspergillus sydowi, Aspergillus flavatus, Aspergillus glaucus, Blastoschizomyces capitatus, Candida albicans, Candida enolase, Candida tropicalis, Candida glabrata, Candida krusei, Candida parapsilosis, Candida stellatoidea, Candida kusei, Candida parakwsei, Candida lusitaniae, Candida pseudotropicalis, Candida guilliermondi, Cladosporium carrionii, Coccidioides immitis, Blastomyces dermatidis, Cryptococcus neoformans, Geotrichum clavatum, Histoplasma capsulatum, Klebsiella pneumoniae, Microsporidia, виды Encephalitozoon, Septata intestinalis и Enterocytozoon bieneusi; менее часто встречающимися являются виды Brachiola, виды Microsporidium, виды Nosema, виды Pleistophora, виды Trachipleistophora, виды Vittaforma, Paracoccidioides brasiliensis, Pneumocystis carinii, Pythiumn insidiosum, Pityrosporum ovale, Sacharomyces cerevisae, Saccharomyces boulardii, Saccharomyces pombe, Scedosporium apiosperum, Sporothrix schenckii, Trichosporon beigelii, Toxoplasma gondii, Penicillium marneffei, виды Malassezia, виды Fonsecaea, виды Wangiella, виды Sporothrix, виды Basidiobolus, виды Conidiobolus, виды Rhizopus, виды Mucor, виды Absidia, виды Mortierella, виды Cunninghamella, виды Saksenaea, виды Alternaria, виды Curvularia, виды Helminthosporium, виды Fusarium, виды Aspergillus, виды Penicillium, виды Monolinia, виды Rhizoctonia, виды Paecilomyces, виды Pithomyces и виды Cladosporium.
В некоторых вариантах осуществления иммуноген вызывает иммунный ответ на паразит из рода Plasmodium, такой как P. falciparum, P.vivax, P.malariae или P.ovale. Таким образом, изобретение может применяться для иммунизации против малярии. В некоторых вариантах осуществления иммуноген вызывает иммунный ответ на паразит из семейства Caligidae, в частности, паразит из родов Lepeophtheirus