Способ получения порошка пирофосфата кальция
Иллюстрации
Показать всеИзобретение относится к способам получения порошков фосфатов кальция, которые могут быть использованы для производства медицинских материалов, стимулирующих восстановление дефектов костной ткани, для производства косметических средств, сорбентов и других функциональных материалов. Описан способ получения порошка пирофосфата кальция, включающий подготовку и взаимодействие водных растворов, содержащих ионы кальция, пирофосфат-ионы и ионы аммония, остаривание осадка в маточном растворе в течение 30-60 мин, фильтрование, сушку, дезагрегацию, термообработку в интервале 300-600°C в течение 2-4 ч. При этом после подготовки раствора, содержащего пирофосфат-ионы, его смешивают с ионообменной смолой в H+-форме при соотношении «масса ионообменной смолы/ масса соли» в интервале 3-5 в течение 30-60 мин, причем концентрация раствора, содержащего пирофосфат-ионы, составляет 0,1 М - 0,5 М. Затем смолу отделяют фильтрованием, в полученный раствор добавляют равный объем раствора соли кальция, взятый в количестве, обеспечивающем соотношение ионов Ca/Р=1, а pH полученного раствора изменяют до выпадения осадка. Техническим результатом является получение порошка с частицами с формой, близкой к равноосной, размером 100-200 нм, обеспечивающими активность порошка в различных процессах. 3 з.п. ф-лы, 7 ил., 1 табл., 5 пр.
Реферат
Область техники
Изобретение относится к способам получения порошков фосфатов кальция, которые могут быть использованы для производства медицинских материалов, стимулирующих восстановление дефектов костной ткани, для производства косметических средств, сорбентов и других функциональных материалов.
Уровень техники
Фосфаты кальция с мольным соотношением Са/Р, равным 1, могут служить основой для создания биодеградируемых материалов как керамических, так и композиционных с полимерной или аморфной неорганической матрицей. Такими фосфатами являются брушит CaHPO4*2H2O, монетит CaHPO4, кальция пирофосфат дигидрат Ca2P2O7*2H2O, кальций пирофосфат тетрагидрат Ca2P2O7*4H2O и пирофосфат Ca2P2O7 (ПФК) [Liam М. Grover, Uwe Gbureck, Adrian J. Wright, Jake E. Barralet J. Cement Formulations in the Calcium Phosphate H2O-Н3РO4-Н4Р2O7 System // Am. Ceram. Soc, 88 [11] 3096-3103 (2005)].
Известен способ получения порошка ПФК твердофазным методом взаимодействием в смеси порошков карбоната кальция CaCO3 и гидрофосфата аммония (NH4)2HPO4 [Jian-jiang Bian, Dong-Wan Kim, Kug Sun Hong. Microwave dielectric properties of Ca2P2O7 // Journal of the European Ceramic Society 2003 [23] 2589-2592]. Частицы порошка ПФК, полученного твердофазным способом имеют низкую активность из-за большого размера частиц и низкой удельной поверхности порошка.
Известны различные способы получения ПФК с использованием высокотемпературной обработки продукта (брушита или монетита), полученного в результате взаимодействия фосфорной кислоты или растворимых фосфатов аммония, калия, натрия, а также и хорошо растворимых солей кальция (нитрата, хлорида, ацетата) или трудно растворимых (гидроксида или сульфата кальция) [Е.J. Griffith, W.С. McDaniel Calcium phosphates // Патент США US 4,721,615, January 26, 1988; Т.В. Сафронова, В.И. Путляев, М.А. Шехирев, А.В. Кузнецов Композиционная керамика, содержащая биорезорбируемую фазу // Стекло и керамика, 2007, №3, с. 31-35]. Частицы ПФК наследуют после термообработки пластинчатую форму частиц брушита или монетита, что снижает активность порошка к спеканию, если его используют для получения керамического материала. Недостатком данного способа является получение частиц с пластинчатой формой, которая препятствует получению плотных керамических биодеградируемых материалов, а также препятствует однородному распределению частиц при получении композиционных материалов с полимерной матрицей.
Для получения сферических частиц ПФК применяют пиролиз при распылении жидкости [L.F. Trudeau, C.F. Chenot, R. G. W. Gingerich Synthesis of beta phase spherical calcium pyrophosphate powder// Патент США US 5,676,917, October 14, 1997; Forster; Cheryl M. (Granville, OH), Meilicke; Scott A. (Seattle, WA) Synthesis of gamma calcium pyrophosphate // Патент США US 5,667,761, September 16, 1997], представляющей собой растворенный в разбавленной азотной кислоте СаНРО4. После распыления образуются сферические частицы монетита, которые затем при термообработке преобразуются в ПФК. Реализация такого метода требует применения специального оборудования.
Существует способ [Margaret R. Christofersen, Tonci Balic-Zunic, S+ren Pehrson, Jergen Christofersen Growth and precipitation of a monoclinic calcium pyrophosphate tetrahydrate indicating auto-inhibition at pH // Journal of Crystal Growth 212 (2000) 500-506] получения порошка гидратированного ПФК, который включает взаимодействие растворимой соли кальция (CaCl2, Ca(NO3)2 и растворимого пирофосфата (Na4P2O7), остаривание, фильтрование. Термообработка гидратированного ПФК, которая использована как термический анализ, приводит к дегидратации и получению ПФК. Недостатком данного способа является применение длительного (до 7 дней) остаривания, которое неизбежно способствует увеличению размера частиц, которые достигают 20-40 мкм. Выращенные таким образом кристаллы использованы в публикации для уточнения структуры и модификации гидратированного ПФК.
Наиболее близким к настоящему изобретению является способ получения порошка пирофосфата кальция из растворимых солей кальция (нитрата Ca(NO3)2, хлорида CaCl2, ацетата Ca(CH3COO)2) и растворимых пирофосфатов (пирофосфата аммония (NH4)4P2O7, пирофосфата натрия Na4P2O7, пирофосфата калия K4P2O7) [Сафронова Т.В., Путляев В.И., Шехирев М.А., Третьяков Ю.Д. Способ получения активного к спеканию порошка пирофосфата кальция, патент // Патент RU 2395450 С1, 27.07.2010]. Способ включает подготовку и взаимодействие водных растворов, содержащих ионы кальция, пирофосфат-ионы и ионы аммония, остаривание осадка в маточном растворе в течение 30-60 мин, фильтрование, сушку, дезагрегацию, термообработку в интервале 300-600°C в течение 2-4 часов. Недостатком синтеза из пирофосфатов щелочных металлов в данном способе является присутствие в синтезированных порошках гидратированного пирофосфата кальция сопутствующих продуктов реакции (СПР) - солей калия или натрия, которые при нагревании вступают с ним в реакцию с образованием двойных орто- и пирофосфатов кальция/натрия или кальция/калия. Такое изменение фазового состава порошка в некоторых случаях недопустимо. При синтезе гидратированного пирофосфата кальция из пирофосфата аммония образуется удаляемый при нагревании СПР. Пирофосфат аммония как реактив не относится к числу коммерчески доступных. Недостатком естественного способа его синтеза - нейтрализации аммиаком пирофосфорной кислоты - является низкое качество промышленной H4P2O7, получаемой методом термической конверсии H3PO4. Продукты термической конверсии помимо пирофосфорной и ортофосфорной кислот содержат различные полифосфорные кислоты [Жданов Ю.Ф. Химия и технология полифосфатов. М.: Химия, 1979. 240 с.].
Раскрытие изобретения
Задачей настоящего изобретения является разработка способа получения активного порошка пирофосфата кальция с формой частиц, близкой к равноосной, содержащего удаляемый при нагревании СПР и не содержащий примесей орто- или полифосфатов кальция.
Поставленная задача решается способом получения порошка пирофосфата кальция с формой частиц, близкой к равноосной, включающего приготовление ионообменной смолы в Н+-форме с последующим ее введением в избытке в раствор пирофосфата натрия или суспензию пирофосфата кальция с концентрацией 0,1 М-0,5 М, полученную смесь выдерживают до завершения ионного обмена, после чего образовавшуюся пирофосфорную кислоту, не содержащую орто- и/или полифосфат-ионы, отделяют от смолы и в кислоту добавляют раствор соли кальция в количестве, необходимом для получения пирофосфата кальция при соотношении Са/Р=1, затем pH полученного раствора изменяют до выпадения осадка, который остаривают, затем отделяют от маточного раствора и высушивают, дезагрегируют и подвергают термообработке для дегидратации гидратированного пирофосфата кальция.
Предпочтительно смесь раствора пирофосфата натрия или суспензии пирофосфата кальция с ионообменной смолой выдерживать в течение 30-60 минут.
Предпочтительно раствор соли кальция брать в количестве, равном количеству образовавшейся пирофосфорной кислоты.
Предпочтительно обработку раствора до выпадения осадка осуществлять доведением уровня pH до 7-9.
Предпочтительно в качестве раствора соли кальция использовать соли нитрата, хлорида, ацетата. Концентрация раствора соли кальция берется в интервале 0,2 М-1,0 М.
Техническим результатом заявляемого изобретения является получение порошка с частицами с формой, близкой к равноосной, размером 100-200 нм, обеспечивающими активность порошка в различных процессах (спекании при получении керамики, взаимодействии с различными средами или веществами).
Синтез аморфного гидратированного порошка пирофосфата кальция проводили в соответствии со схемами (фигуры 1, 2, 3).
Подготовка ионообменной смолы в Н+-форме. Ионообменную смолу выдерживают в дистиллированной воде (соотношение смола : вода = 1:6±1:8) при постоянном перемешивании. При этом сухая ионообменная смола вбирает в себя воду и набухает. Активированную водой ионообменную смолу в Н+-форме отделяют от воды любым методом и в таком виде используют для преобразования раствора пирофосфата натрия или суспензии пирофосфата кальция в пирофосфорную кислоту.
Подготовка раствора пирофосфата натрия/суспензии пирофосфата кальция. В раствор пирофосфата натрия с концентрацией 0,1-0,5 М или суспензию, содержащую 0,1-0,5 М пирофосфата натрия, помещают ионообменную смолу, масса которой превышает навеску пирофосфата натрия или пирофосфата кальция в 2-4 раза. Протекающие при этом процессы могут быть отражены ниже представленными схемами (1, 2 и 3):
Для более полного превращения раствора и/или суспензии пирофосфатов металлов в пирофосфорную кислоту ионообменная смола должна быть взята с избытком по массе. Если смолу берут в избытке меньшем, чем в 2 раза, то преобразование пирофосфатов металлов в пирофосфорную кислоту происходит не полностью. Если смолу берут в избытке большем, чем в 4 раза, то необходимое при проведении ионного обмена перемешивание затруднено. При использовании растворов с концентрацией, меньшей 0,1 М, или суспензий с содержанием менее 0,1 М выход пирофосфорной кислоты не достаточен. При использовании растворов с концентрацией, большей 0,5 М, или суспензий с содержанием более 0,5 М необходимое для ионного обмена количество ионообменной смолы перемешивание затруднительно. Выход пирофосфорной кислоты не достаточен. Преобразование пирофосфатов металлов в пирофосфорную кислоту происходит не полностью. При проведении взаимодействия раствора пирофосфата натрия/суспензии пирофосфта кальция с ионообменной со смолой в Н+-форме в течение менее 30 минут ионный обмен проходит не полностью. Проведении взаимодействия раствора пирофосфата натрия/суспензии пирофосфта кальция с ионообменной со смолой в Н+-форме в течение более 60 минут нецелесообразно, поскольку ионный обмен завершен. Затем полученную пирофосфорную кислоту с концентрацией 0,1-0,5 М отделяют от ионообменной смолы. К полученному раствору пирофосфорной кислоты добавляют раствор соли кальция (нитрата, хлорида или ацетата) в количестве, рассчитанном по реакции (4):
где X=NO3-, С1-, СН3СОО-; 2≤z≤4.
При проведении синтеза в соответствии с реакцией (4) используют равные объемы растворов соли кальция и пирофосфорной кислоты. Раствор остается прозрачным. При этом pH раствора равно 1. Для выпадения осадка необходимо изменение pH в зоне реакции до 7-9. Добавление водного раствора аммиака приводит к изменению pH раствора в зоне реакции до 7-9 и выпадению гелеобразного осадка, рентгенограмма которого представлена на рисунке (фигура 4). Если уровень pH меньше 7, то выход целевого продукта этой реакции (гидратированного пирофосфата кальция) снижается. Повышение уровня pH выше 9 нецелесообразно, поскольку максимальный выход продукта реакции уже достигнут.
Полученный гелеобразный осадок гидратированного ПФК выдерживают в маточном растворе 30-60 минут. Выдерживание осадка менее 30 минут снижает выход продукта. Осадок остается аморфным при выдерживании в маточном растворе в течение 3 суток, а затем кристаллизуется с образованием смеси 2- и 4-водного ПФК, а частицы теряют равноосную форму и приобретают форму параллелепипедов. Однако выдерживание осадка дольше 60 минут организационно не целесообразно.
Полученный осадок отделяют от маточного раствора фильтрованием, а затем выкладывают тонким слоем на поднос (поддон) и сушат на воздухе при комнатной температуре. Полученный продукт дезагрегируют в ацетоне в шаровой планетарной мельнице. Микрофотография частиц после синтеза представлена на рисунке (фигура 5). Дезагрегированный порошок сушат, а затем прокаливают в течение 2-4 часов при 300-600°C. При высокотемпературной обработке происходит разложение гидратированного ПФК в соответствии с реакцией (3).
Обработка порошка ниже температуры 300°C менее 2 часов недостаточна для полной дегидратации аморфного ПФК, тогда как обработка порошка при температуре выше 600°C более 4 часов приводит к огрублению порошка, т.е. образованию более крупных частиц вследствие спекания. Микрофотография частиц порошка после термообработки представлена на рисунке. Данные РФА порошка после термообработки (фигура 6) и микрофотография частиц порошка (фигура 7) свидетельствуют о том, что заявленный способ позволяет получить частицы ПФК равноосной формы.
Краткое описание чертежей
Фигура 1. Схема получения порошка пирофосфата кальция β- Ca2P2O7 с формой, близкой к равноосной, из водного раствора пирофосфата натрия Na4P2O7.
Фигура 2. Схема получения порошка пирофосфата кальция β- Ca2P2O7 с формой, близкой к равноосной, из суспензии частиц Ca2P2O7 с пластинчатой морфологией в водном растворе пирофосфата натрия Na4P2O7.
Фигура 3. Схема получения порошка пирофосфата кальция β-Ca2P2O7 с формой, близкой к равноосной, из суспензии частиц Ca2P2O7 с пластинчатой морфологией в воде.
Фигура 4. Данные рентгенофазового анализа для порошка ПФК, синтезированного из раствора, содержащего ионы кальция, пирофосфат-ионы и ионы аммония.
Фигура 5. Электронно-микроскопическая фотография частиц порошка после синтеза.
Фигура 6. Данные рентгенофазового анализа для порошка ПФК после термообработки.
Фигура 7. Электронно-микроскопическая фотография частиц порошка после термообработки при 600°C.
Осуществление изобретения
Термин «частица равноосной формы» согласно заявляемому изобретению означает, что частица имеет приблизительно одинаковые размеры во всех направлениях. Частица в форме шара является идеальной равноосной частицей.
Все используемые реагенты являются коммерчески доступными, все процедуры, если не оговорено особо, осуществляли при комнатной температуре или температуре окружающей среды, то есть в диапазоне от 18 до 25°C; контроль pH осуществляли при помощи лакмусовой бумаги. Для отделения ионообменной смолы от воды после промывания используют бумажные фильтры «белая лента». Для отделения осадков от маточного раствора после синтеза используют фильтры «синяя лента».
В способе получения активного порошка пирофосфата кальция с формой частиц, близкой к равноосной, используют подготовку и взаимодействие водных растворов, содержащих ионы кальция, пирофосфат-ионы и ионы аммония, остаривание осадка в маточном растворе в течение 30-60 мин, фильтрование, сушку, дезагрегацию, термообработку в интервале 300-600°C в течение 2-4 часов. Согласно изобретению при получении активного к спеканию порошка ПФК для подготовки раствора, содержащего пирофосфат-ионы, используют обработку (ионный обмен) растворов и/или суспензий пирофосфатов металлов, ионы которых являются биосовместимыми, с концентрацией/содержанием в интервале 0,1 М-0,5 М ионообменной смолой в Н+-форме при соотношении «масса ионообменной смолы/ масса соли» в интервале 3-5 в течение 30-60 минут. При этом в качестве пирофосфатов металлов, ионы которых являются биосовместимыми, используют пирофосфат натрия и/или пирофосфат кальция, а уровень pH при синтезе поддерживается в интервале 7-9.
Представленные ниже примеры конкретного осуществления изобретения приведены для предоставления специалистам в данной области техники полного описания проведения и применения анализа по изобретению, но не ограничивают предлагаемый авторами изобретения объем изобретения.
Пример 1. Подготовка (активирование) ионообменной смолы
Ионообменную смолу в Н+-форме (например, марки КУ-2-8) готовят к использованию, выдерживая ее в дистиллированной воде при постоянном перемешивании в течение 30 мин при соотношении 50 г смолы/ 300 мл воды. Смолу после промывания отделяют от жидкости фильтрованием на воронке Бюхнера. Подготовленную таким образом смолу используют для получения пирофосфорной кислоты Н4Р2О7 из водного раствора пирофосфата натрия Na4P2O7, суспензии пирофосфата кальция Ca2P2O7 в воде или из суспензии пирофосфата кальция Ca2P2O7 в водном растворе пирофосфата натрия Na4P2O7.
Пример 2. Пирофосфат натрия/ацетат кальция
После активирования ионообменную смолу в количестве 8 г добавляют к 100 мл 0,1 М раствора пирофосфата натрия Na4P2O7, для приготовления которого используют дистиллированную воду и 4,5 г пирофосфата натрия декагидрата Na4P2O7*10H2O. Протекающий при этом ионный обмен может быть отражен схемой (1).
Синтез гидратированного аморфного пирофосфата кальция Ca2P2O7*zH2O проводят, используя 100 мл водного 0,2 М раствора ацетат кальция, для приготовления которого используют 3,5 г ацетата кальция моногидрата. Полученный раствор остается прозрачным. pH раствора, содержащего ионы H+, пирофосфат-ионы и ионы Ca2+, при этом равен 1. Затем к полученному раствору добавляют 30% раствор аммиака до достижения pH в зоне реакции = 7.
Полученный гелеобразный осадок выдерживают в маточном растворе в течение 30 минут, а затем фильтруют на воронке Бюхнера для отделения осадка от маточного раствора. Полученный продукт сушат, а затем дезагрегируют в шаровой планетарной мельнице в ацетоне. После сушки порошок прокаливают при 600°C в течение 4 часов. Дегидратированный порошок дезагрегируют в шаровой планетарной мельнице в ацетоне. По данным РФА порошок представляет собой β- Ca2P2O7. Размер частиц порошка, форма которых близка к равноосной, составляет 100-200 нм.
Пример 3. Подготовка порошка пирофосфата кальция пластинчатой морфологии
Брушит CaHPO4*H2O синтезируют из 1 М водных растворов гидрофосфата аммония и нитрата кальция при комнатной температуре, без регулирования pH в соответствии реакцией
Полученный осадок отделяют от маточного раствора на воронке Бюхнера и сушат при комнатной температуре. Пирофосфат кальция получают, проводя термолиз при 500°C в течение 2 часов в соответствии с реакцией:
Топотактический характер реакции дегидратации (7) приводит к тому, что агрегаты частиц порошка пирофосфата кальция в виде γ-модификации наследую исходную пластинчатую форму частиц брушита.
Пример 4. Пирофосфат кальция/натрия/хлорид кальция
Для приготовления раствора пирофосфата натрия используют 6,7 г пирофосфата натрия декагидрата Na4P2O7*10H2O. Пирофосфат кальция Ca2P2O7 пластинчатой морфологии используют в количестве 3,8 г. После активирования ионообменную смолу в количестве 31,2 г добавляют к 100 мл суспензии, содержащей 0,15 М пирофосфата кальция Ca2P2O7 в 0,15 М растворе пирофосфата натрия в дистиллированной воде. Протекающий при этом ионный обмен может быть отражен схемой (2).
Синтез гидратированного аморфного Ca2P2O7*zH2O проводят, используя 100 мл водного 0,6 М раствора хлорида кальция CaCl2, для приготовления которого используют 6,7 г безводного хлорида кальция CaCl2. Полученный раствор остается прозрачным. pH раствора, содержащего ионы Н+, пирофосфат-ионы и ионы Са2+, при этом равен 1. Затем к полученному раствору добавляют 30% раствор аммиака до достижения pH в зоне реакции = 8.
Полученный гелеобразный осадок выдерживают в маточном растворе в течение 45 минут, а затем фильтруют на воронке Бюхнера для отделения осадка от маточного раствора. Полученный продукт сушат, а затем дезагрегируют в шаровой планетарной мельнице в ацетоне. После сушки порошок прокаливают при 450°C в течение 4 часов. Дегидратированный порошок дезагрегируют в шаровой планетарной мельнице в ацетоне. По данным РФА порошок представляет собой β- Ca2P2O7. Размер частиц порошка, форма которых близка к равноосной, составляет 100-200 нм.
Пример 5. Пирофосфат кальция/нитрат кальция
После активирования ионообменную смолу в количестве 63,5 г добавляют к 100 мл суспензии, содержащей 0,5 М пирофосфата кальция Ca2P2O7, для приготовления которой используют дистиллированную воду и 12,7 г пирофосфата кальция Ca2P2O7 пластинчатой морфологии. Протекающий при этом ионный обмен может быть отражен схемой (3).
Синтез гидратированного аморфного Ca2P2O7*zH2O проводят, используя 100 мл водного 1,0 М раствора нитрата кальция Са(NO3)2, для приготовления которого используют 23,6 г нитрат кальция тетрагидрат Са(NO3)2*4H2O. Полученный раствор остается прозрачным. pH раствора, содержащего ионы Н+, пирофосфат-ионы и ионы Са2+, при этом равен 1. Затем к полученному раствору добавляют 30% раствор аммиака до достижения pH в зоне реакции =9.
Полученный гелеобразный осадок выдерживают в маточном растворе в течение 60 минут, а затем фильтруют на воронке Бюхнера для отделения осадка от маточного раствора. Полученный продукт сушат, а затем дезагрегируют в шаровой планетарной мельнице в ацетоне. После сушки порошок прокаливают при 300°C в течение 2 часов. Дегидратированный порошок дезагрегируют в шаровой планетарной мельнице в ацетоне. По данным РФА порошок представляет собой β- Ca2P2O7. Размер частиц порошка, форма которых близка к равноосной, составляет 100-200 нм.
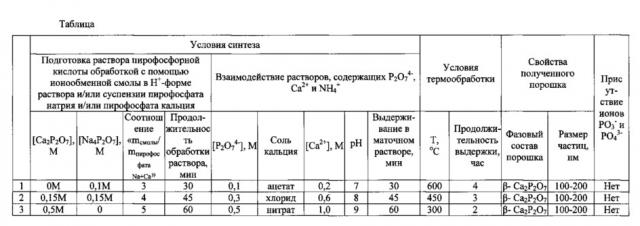
Результаты примеров 1-3 представлены в табл. 1.
Для получения раствора пирофосфорной кислоты в заявляемом способе применяют вещества, не содержащие орто- и/или полифосфат ионов. При конверсии Ca2P2O7 в Н4Р2О7 происходит лишь обмен катионами. Таким образом в заявляемом способе нет процессов, которые могли бы спровоцировать образование поли- или ортофосфатов. В известных из уровня техники способах при термическом получении пирофосфорной кислоты H3PO4 нагревают, и идет поликонденсация в основном по первой ступени (т.е. димеризация: 2H3PO4=H4P2O7+H2O), но реакция может пройти не до конца, и останется (РО4)3-, или процесс поликонденсации пройдет глубже, и тогда образуется (PO3)n(n+1)- (H4P2O7=2HPO3+H2O). Присутствие этих ионов изменяет химический состав целевого продукта, поскольку ортофосфатный анион будет реагировать с ионами кальция, формируя брушит (фосфат кальция с пластинчатой морфологией), а полифосфатные ионы являются ингибиторами кристаллизации целевого фосфата кальция.
1. Способ получения порошка пирофосфата кальция с формой частиц, близкой к равноосной, включающий подготовку и смешивание водных растворов, содержащих ионы кальция, пирофосфат-ионы и ионы аммония, остаривание осадка в маточном растворе в течение 30-60 мин, фильтрование, сушку, дезагрегацию, термообработку в интервале 300-600°C в течение 2-4 ч, отличающийся тем, что после подготовки раствора, содержащего пирофосфат-ионы, его смешивают с ионообменной смолой в H+-форме при соотношении «масса ионообменной смолы/ масса соли» в интервале 3-5 в течение 30-60 мин, при этом концентрация раствора, содержащего пирофосфат-ионы, составляет 0,1 М - 0,5 М, затем смолу отделяют фильтрованием, в полученный раствор добавляют равный объем раствора соли кальция, взятый в количестве, обеспечивающем соотношение ионов Ca/Р=1, а pH полученного раствора изменяют до выпадения осадка.
2. Способ по п.1, отличающийся тем, что для приготовления раствора, содержащего пирофосфат-ионы, используют пирофосфаты металлов, ионы которых являются биосовместимыми, а именно используют пирофосфат натрия и/или пирофосфат кальция.
3. Способ по п.1, отличающийся тем, что для выпадения осадка уровень pH изменяют до интервала 7-9.
4. Способ по п.1, отличающийся тем, что в качестве раствора соли кальция используют соли нитрата, хлорида, ацетата.