Сухие порошковые композиции в виде частиц, которые содержат два или более активных ингредиента, для лечения обструктивных или воспалительных заболеваний дыхательных путей
Иллюстрации
Показать всеОписаны сухие порошковые композиции для ингаляции, содержащие высушенные распылением частицы, и их применение в лечении обструктивного или воспалительного заболевания дыхательных путей. Каждая частица имеет ядро из первого активного ингредиента в, по существу, кристаллической форме, которое покрыто слоем второго активного ингредиента в, по существу, аморфной форме, который диспергирован в фармацевтически приемлемом гидрофобном эксципиенте. Гидрофобный эксципиент представляет собой фосфолипид в количестве от 40 до 99 вес.% от веса композиции. Также описан способ получения таких композиций и система доставки, содержащая ингалятор и сухую порошковую композицию. Изобретение решает задачу совместного формулирования двух или более фармацевтически активных агентов в единую порошковую лекарственную форму, которая подходит для ингаляции, с улучшенными аэрозольными характеристиками. 4 н. и 11 з.п. ф-лы, 3 ил., 9 табл., 7 пр.
Реферат
Область техники, к которой относится изобретение
[1] Настоящее изобретение относится к органическим соединениям и их применению в качестве фармацевтических препаратов, более конкретно к сухим порошковым композициям, которые содержат высушенные распылением частицы, которые содержат комбинации фиксированных доз двух или более активных ингредиентов, которые пригодны для лечения обструктивных или воспалительных заболеваний дыхательных путей, в особенности астмы и хронического обструктивного заболевания легких (COPD).
Уровень техники настоящего изобретения
[2] Активные фармацевтические ингредиенты (API), пригодные для лечения респираторных заболеваний, обычно составляют для введения посредством ингаляции с помощью портативных ингаляторов. Двумя наиболее популярными видами портативных ингаляторов являются дозирующие ингаляторы под давлением (pMDI) и ингаляторы сухого порошка (DPI).
[3] Значительное большинство ингаляторов сухого порошка зависят от дыхательного усилия пациента, прилагаемого для флюидизирования и диспергирования частиц препарата. Обычно принято считать, что для того, чтобы препарат эффективно осаждался в легких, аэродинамический диаметр частиц должен лежать между 1 мкм и 5 мкм. В результате, API, как правило, микронизируют для получения тонкодисперсных частиц с масс-медианным диаметром (определяемым посредством лазерной дифракции) в данном диапазоне размеров. К сожалению, тонкодисперсные микронизированные частицы препарата обычно проявляют низкие качества в отношении текучести порошка, флюидизации и диспергирования. Текучесть порошка или "сыпучесть порошка" представляет собой способность порошка течь. Она важна с точки зрения дозирования частиц препарата на единичные дозы, как из резервуара, так и в заранее упакованные контейнеры для единичных доз (например, капсулы или блистеры). Флюидизация порошка, которая представляет собой включение порошка в воздушный поток во время дыхания пациента, воздействует на доставляемую из ингалятора дозу. Наконец, диспергирование порошка представляет собой разрушение агломератов порошка до исходных частиц препарата. Плохое диспергирование порошка отрицательно воздействует на распределение по аэродинамическому размеру частиц, и, в конечном счете, на доставку API в легкие.
[4] В предлагаемых в настоящее время на рынке продуктах реализовано два подхода к улучшению текучести, флюидизации и диспергирования тонкодисперсных частиц препарата.
[5] Первый подход использует контролируемую агрегацию неразбавленного препарата для образования легко слипающихся гранул. Агрегаты формируются в ротационных смесителях с результирующим распределением с большим размером частиц, что обеспечивает требуемые текучие свойства, нужные для точного дозирования и улучшенной флюидизации порошка. В устройстве TURBUHALER™ (Astra-Zeneca) диспергирование агрегатов происходит посредством турбулентного смешивания. Энергии диспергирования при оптимальных скоростях вдоха достаточно для преодоления сил сцепления между частицами, удерживающими микронизированные частицы вместе. Поскольку диспергирование порошка существенно зависит от энергии, необходимой для разрушения агрегатов, качество аэрозоля гранулированных композиций обычно проявляет сильную зависимость от скорости вдоха пациента. В одном исследовании общее отложение в легких для гранулированного будесонида составило 28%, когда пациентов просили дышать через устройство TURBUHALER™ быстро, и 15%, когда их просили дышать через устройство TURBUHALER™ слабее (смотри Borgstrom L, Bondesson E, Moren F et al: Lung deposition of budesonide inhaled via TURBUHALER: a comparison with terbutaline sulphate in normal subjects, European Respiratory Journal, 1994, 7, 69-73).
[6] Второй подход использует бинарную упорядоченную смесь, содержащую тонкодисперсные частицы препарата, смешенные с крупными частицами носителя. Чаще всего в качестве носителя используют моногидрат α-лактозы, и он, как правило, имеет размер частиц между 30 и 90 мкм. В большинстве сухих порошковых композиций частицы препарата представлены в низких концентрациях, причем типичным является отношение препарата к носителю, равное 1:67,5 (вес/вес). Микронные кристаллы проявляют силы притяжения, в первую очередь обусловленные ван-дер-ваальсовыми, электростатическими и капиллярными силами, на которые влияют размер, форма и химические свойства (например, поверхностная энергия) кристалла. К сожалению, силы сцепления между кристаллами препарата и носителем труднопредсказуемы и могут различаться для разных препаратов в комбинации фиксированных доз. Во время ингаляции частицы препарата диспергируются с поверхности частиц носителя энергией потока вдыхаемого воздуха. Большие частицы носителя воздействуют в первую очередь на ротоглотку (т.е. область глотки, расположенную в задней части рта), тогда как маленькие частицы препарата проникают в легкие.
[7] Основным требованием к однородности смешивания в упорядоченной смеси является достаточное взаимодействие частиц препарата и носителя для предотвращения разделения. К сожалению, это может уменьшить легочное отложение препарата вследствие плохого диспергирования препарата из носителя. Среднее отложение в легких для препаратов в упорядоченных смесях составляет, как правило, 10-30% от измеренной дозы. Недостаточное направленное воздействие на легкие, наблюдаемое в упорядоченных смесях, приводит к большому отложению в ротоглотке, к возможности локальных побочных действий и к повышенной вариабельности. Наблюдаемая высокая вариабельность доставки в легкие является результатом вариабельности в инерционной импакции в ротоглотке, что является следствием свойств порошка и анатомических различий между субъектами. Средняя вариабельность в легочной дозе для микронизированных композиций смесей частиц препарата составляет, как правило, между приблизительно 30% и 50% (смотри Olsson B, Borgstrom L: Oropharyngeal deposition of drug aerosols from inhalation products. Respiratory Drug Delivery, 2006, страницы 175-182). Она еще ухудшается, когда доставка аэрозоля зависит от максимальной скорости вдоха пациента.
[8] Вышеупомянутые проблемы становятся особенно существенными при составлении фармацевтических продуктов, содержащих два или более активных ингредиента в комбинации фиксированных доз.
[9] Это проиллюстрировано в опубликованном недавно исследовании Taki et al, Respiratory Drug Delivery 2006, страницы 655-657. В данном исследовании измеряли распределения по аэродинамическому размеру частиц двух активных ингредиентов SERETIDE™, а именно салметерола ксинафоата (SX) и флутиказона пропионата (FP), как функции скорости потока в каскадном импакторе ANDERSEN™ (ACI). Две исследованные композиции SERETIDE™, S100 и S500, соответствуют разным количествам ингаляционного кортикостероида (ICS) флутиказона пропионата, т.е. 100 мкг и 500 мкг. Дозу длительно действующего β2-агониста (LABA) салметерола ксинафоата поддерживали постоянной и равной 72,5 мкг. Распределение по аэродинамическому размеру частиц (aPSD) значительно различалось для двух активных ингредиентов в смешанной композиции (смотри таблицу 1). Кроме того, aPSD оказалось существенно различным для двух композиций. Масс-медианные аэродинамические диаметры (MMAD) лежали в диапазоне от 1,8 мкм до 3,6 мкм, геометрические стандартные отклонения от 1,7 до 3,9. Отношение двух активных ингредиентов во фракции тонкодисперсных частиц (FPF<3мкм и FPF<5мкм) также значительно различалось при двух исследованных скоростях потока. Следовательно, свойства адгезии между препаратами и носителем значительно различались для каждого активного ингредиента, а также между композициями. Номинальное отношение SX/FP (вес/вес) в S100 составляло 0,725, и 0,145 в S500. Отношение SX/FP в доле тонкодисперсных частиц, обычно обогащенной компонентом FP, значительно отличается от номинального отношения. Отношение SX/FP изменяется от +3,5% до -28% от номинальных отношений доз при изменении скорости потока и соотношения компонентов смеси. Наблюдаемые отличия, вероятно, являются результатом отличий в распределении по размеру частиц API и отличий в отношениях доз, которые могут проистекать от недостаточного смешивания. Кроме того, один API может иметь более низкое сродство к носителю, и может выделяться в композиции на любой стадии производственного процесса. Поглощение влаги также может отличаться для двух API, что ведет к отличиям в слипании при хранении. Все приведенные факторы совокупно существенно увеличивают сложность процесса разработки и общую вариабельность в доставке препарата.
| Таблица 1 | ||||||
| Распределения по аэродинамическому размеру частиц комбинаций фиксированных доз салметерола ксинафоата и флутиказона пропионата, составленных в виде упорядоченных смесей с крупными частицами моногидрата лактозы (Taki et al. Respiratory Drug Delivery 2006, страницы 655-657) | ||||||
| Среднее (n=4) | ||||||
| MMAD (мкм) | ГСО | FPF<3мкм (%) | FPF<5мкм (%) | |||
| Q=30 л/мин | S100 | SX | 3,6 | 1,9 | 10,3 | 18,2 |
| FP | 3,2 | 2,1 | 14,5 | 22,9 | ||
| t-критерий (p-значение) SX от FP | 0,030 | 0,440 | 0,013 | 0,011 | ||
| SX/FP (% от номинального) | 0,52 (-28%) | 0,58 (-20%) | ||||
| S500 | SX | 2,8 | 1,8 | 12,9 | 19,9 | |
| FP | 2,7 | 1,8 | 17,3 | 25,9 | ||
| t-критерий (p-значение) SX от FP | 0,250 | 0,470 | 0,015 | 0,005 | ||
| SX/FP | 0,11 (-24%) | 0,11 (-24%) | ||||
| Q=66 л/мин | S100 | SX | 1,9 | 2,5 | 22,0 | 26,9 |
| FP | 2,1 | 2,0 | 21,3 | 27,0 | ||
| t-критерий (p-значение) SX от FP | 0,018 | 0,170 | 0,318 | 0,898 | ||
| SX/FP | 0,75 (+3,5%) | 0,72 (-0,7%) | ||||
| S500 | SX | 1,8 | 3,9 | 17,6 | 21,3 | |
| FP | 2,1 | 1,7 | 21,2 | 26,6 | ||
| t-критерий (p-значение) SX от FP | 0,304 | 0,370 | 0,007 | 0,001 | ||
| SX/FP | 0,12 (-17%) | 0,12 (-17%) |
[10] Для преодоления проблемы составления множества активных ингредиентов в одной смеси известны устройства (например, устройство GEMINI из WO 05/14089), которые включают в себя два отдельных блистера, каждый из которых содержит индивидуальную смесь препаратов, которые затем задействуют одновременно. Хотя такие варианты устройств для комбинированной терапии могут минимизировать возможные взаимодействия между активными ингредиентами и компонентами устройства, они никак не помогают решению других свойственных лактозным смесям проблем направленного воздействия препарата и вариабельности. Следовательно, имеет место потребность в улучшенных композициях, которые преодолеют проблемы дозирования, связанные со смесями множества активных ингредиентов, и которые обеспечат улучшения постоянства доз и направленного воздействия на легкие. Особенно острой является потребность в API с сильно различающимися физико-химическими свойствами (например, растворимостью), когда подбор общего растворителя для конструирования частиц является проблематичным.
[11] В настоящее время обнаружено, что ингаляционные сухие порошковые композиции, которые содержат два или более активных ингредиента и при этом имеют требуемые свойства флюидизации и диспергирования частиц препарата, могут быть получены посредством включения активных ингредиентов внутрь высушенных распылением ингаляционных частиц.
Сущность изобретения
[12] В первом аспекте настоящее изобретение относится к сухой порошковой композиции для ингаляции, содержащей высушенные распылением частицы, которые содержат ядро из первого активного ингредиента в по существу кристаллической форме, которое покрыто слоем второго активного ингредиента в по существу аморфной форме, который диспергирован в фармацевтически приемлемом гидрофобном эксципиенте.
[13] Первый активный ингредиент, второй активный ингредиент и гидрофобный эксципиент являются по существу фазово-разделенными в высушенных распылением частицах.
[14] Такая композиция, содержащая частицы, которые таким образом структурированы или "сконструированы", устраняет значительные различия в распределении по аэродинамическому размеру частиц и в доле тонкодисперсных частиц, которые имеют место, когда те же активные ингредиенты составляют в виде упорядоченных смесей. Частицы также проявляют улучшенное направленное воздействие на легкие (например, более высокую эффективность доставки в легкие, уменьшенное орофарингеальное и системное отложение) и улучшенное постоянство доз (благодаря уменьшенным межиндивидуальной вариабельности и зависимости от скорости потока) по отношению к стандартным лактозным смесям и гранулированным композициям.
[15] Активные ингредиенты могут представлять собой любые активные фармацевтические ингредиенты, применяемые для лечения обструктивных или воспалительных заболеваний дыхательных путей, в частности астмы и COPD. Подходящие активные ингредиенты включают длительно действующие β2-агонисты, такие как салметерол, формотерол, индакатерол и их соли, мускариновые атнагонисты, такие как тиотропий и гликопирроний и их соли, и кортикостероиды, включая будесонид, циклезонид, флутиказон и мометазон и их соли. Подходящие комбинации включают (формотерола фумарат и будесонид), (салметерола ксинафоат и флутиказона пропионат), (салметерола ксинафоат и тиотропия бромид) и (индакатерола малеат и гликопиррония бромид).
[16] Обычно нежелательным считается присутствие доменов аморфного препарата в кристаллических микронизированных препаратах для ингаляции. Аморфные домены термодинамически нестабильны и могут со временем превращаться в стабильный кристаллический полиморф. Процесс рекристаллизации часто приводит к укрупнению микронизированных частиц препарата и снижению качества аэрозоля. Аморфные домены с более высокой энергией могут также проявлять большую растворимость, более быстрое растворение и сниженную химическую стабильность по сравнению с кристаллическим препаратом. В результате, общепринятой практикой является стремление к уменьшению аморфного содержимого в микронизированных частицах препарата, и компании прикладывают большие усилия, для того чтобы "улучшить" порошки, уменьшив аморфное содержимое.
[17] Сушка распылением представляет собой способ получения сухого порошка из жидкости или дисперсии в жидкости посредством быстрого высушивания с помощью горячего газа. К ее принципиальным преимуществам для получения сконструированных частиц для ингаляции относится способность к быстрому получению сухого порошка и к управлению свойствами частиц, включая размер, строение, плотность и состав поверхности. Процесс высушивания является очень быстрым (порядка миллисекунд). В результате наиболее активные фармацевтические ингредиенты, которые растворены в жидкой фазе, оседают в виде аморфных твердых веществ, поскольку у них нет времени на кристаллизацию.
[18] Для комбинации фиксированных доз обычной практикой является стремление найти общий растворитель, в котором растворимы оба препарата. Составление двух препаратов в одной аморфной фазе приводит к возможным проблемам несовместимости. Один из препаратов, вероятно, обладает улучшенной физической и химической стабильностью, тогда как другой обладает пониженной стабильностью.
[19] При разработке аэрозольных композиций, содержащих комбинации фиксированных доз двух или более препаратов, не всегда возможно определить растворитель, в котором каждый из препаратов является смешивающимся или несмешивающимся. Следовательно, для составления комбинаций фиксированных доз данных препаратов может оказаться необходимым высушить распылением сложную дисперсию одного препарата в растворе и другого в суспензии. Это приводит к образованию кристаллических и аморфных доменов в высушенном распылением продукте препарата. Было неожиданно обнаружено, что могут быть получены стабильные композиции, содержащие такие кристаллические и аморфные домены препарата. Посредством включения гидрофобного эксципиента, которое эффективно сконцентрировано на границе раздела частиц, также становится возможным регулировать поверхностную энергию и строение высушенных распылением частиц, что приводит к уменьшению силы сцепления между частицами и повышению качества аэрозоля.
[20] В частицы может быть включен третий активный ингредиент или в качестве дополнительного нерастворимого кристаллического активного ингредиента, или в качестве дополнительного аморфного активного ингредиента. Третий активный ингредиент может быть выбран, например, из бронходилататоров, противовоспалительных средств и их смесей, в частности β2-агонистов, мускариновых атнагонистов, стероидов, двойных β2-агонистов-мускариновых атнагонистов, ингибиторов PDE4, агонистов A2A, блокаторов кальция и их смесей. Подходящие тройные комбинации включают (салметерола ксинафоат, флутиказона пропионат и тиотропия бромид), (индакатерола малеат, мометазона фуроат и гликопиррония бромид) и (индакатерола ацетат, мометазона фуроат и гликопиррония бромид).
[21] Во втором аспекте настоящее изобретение относится к способу получения сухой порошковой композиции высушенных распылением частиц, которые содержат первый активный ингредиент и второй активный ингредиент, причем данный способ включает стадии:
(a) получения исходного материала, содержащего второй активный ингредиент, растворенный в фазе растворителя, гидрофобный эксципиент и кристаллические частицы первого активного ингредиента, причем указанные кристаллические частицы являются по существу нерастворимыми в упомянутой фазе растворителя; и
(b) сушки распылением упомянутого исходного материала для получения композиции, причем указанные частицы содержат ядро из первого активного ингредиента в по существу кристаллической форме, которое покрыто слоем второго активного ингредиента в по существу аморфной форме, который диспергирован в фармацевтически приемлемом гидрофобном эксципиенте.
[22] В предпочтительном варианте осуществления фаза растворителя представляет собой воду или смесь этанола и воды.
[23] В третьем аспекте настоящее изобретение относится к способу лечения обструктивного или воспалительного заболевания дыхательных путей, который включает введение субъекту, нуждающемуся в этом, эффективного количества вышеупомянутой сухой порошковой композиции. Данное обструктивное или воспалительное заболевание дыхательных путей может представлять собой астму или COPD.
[24] В четвертом аспекте настоящее изобретение относится к применению вышеупомянутой сухой порошковой композиции в производстве лекарственного препарата для лечения обструктивного или воспалительного заболевания дыхательных путей. Данное обструктивное или воспалительное заболевание дыхательных путей может представлять собой астму или COPD.
[25] В пятом аспекте настоящее изобретение относится к вышеупомянутой сухая порошковой композиции для применения в лечении обструктивного или воспалительного заболевания дыхательных путей. Данное обструктивное или воспалительное заболевание дыхательных путей может представлять собой астму или COPD.
[26] В шестом аспекте настоящее изобретение относится к системе доставки, которая содержит ингалятор, который содержит вышеупомянутую сухую порошковую композицию.
[27] Седьмой аспект настоящего изобретения содержит любые два или более вышеизложенных аспекта, варианта осуществления или признака.
Термины
[28] Термины, используемые в данном описании, имеют следующие значения:
[29] "Активный ингредиент" или "препарат", как применяется в настоящем описании, обозначает активный ингредиент фармацевтического препарата, также известный как активный фармацевтический ингредиент (API).
[30] "Аморфный", как применяется в настоящем описании, относится к состоянию, в котором материал не имеет дальнего порядка на молекулярном уровне и, в зависимости от температуры, может проявлять физические свойства твердого тела или жидкости. Как правило, такие материалы не дают четких картин рентгеновской дифракции и, проявляя свойства твердого тела, более формально описываются как жидкость. При нагревании происходит изменение со свойств твердого тела на свойства жидкости, которое характеризуется фазовым переходом, как правило второго порядка ("стеклование").
[31] "Кристаллический", как применяется в настоящем описании, соответствует твердой фазе, в которой материал имеет регулярную упорядоченную внутреннюю структуру на молекулярном уровне и дает четкую картину рентгеновской дифракции с определенными пиками. Такие материалы при достаточном нагреве также проявляют свойства жидкости, но превращение из твердого тела в жидкость характеризуется фазовым переходом, как правило первого рода ("точка плавления"). В контексте настоящего изобретения кристаллический активный ингредиент обозначает активный ингредиент с кристалличностью, составляющей более чем 85%. В определенных вариантах осуществления кристалличность может составлять более чем 90%. В других вариантах осуществления кристалличность может составлять более чем 95%.
[32] "Доставляемая доза" или "DD", как применяется в настоящем описании, соответствует показателю доставки сухого порошка из ингаляторного устройства после приведения в действие или диспергирования из отделения для порошка. DD определяют как отношение дозы, доставленной ингаляторным устройством, к номинальной или измеренной дозе. DD является экспериментально определяемым параметром и может определяться с применением установки in vitro устройства, которое воспроизводит дозирование пациенту. Иногда ее также называют испущенной дозой (ED).
[33] "Содержание тонкодисперсных частиц" или "FPF", как применяется в настоящем описании, обозначает массу активных ингредиентов с аэродинамическим размером, меньшим определенного минимального по отношению к номинальной дозе. Например, FPF<3,3мкм соответствует процентной доле от номинальной дозы частиц, которые имеют аэродинамический размер менее чем 3,3 мкм. Значения FPF определяют с применением каскадной импакции, или в каскадном импакторе ANDERSEN™, или в каскадном импакторе NEXT GENERATION IMPACTOR™. Для того чтобы минимизировать межиндивидуальную вариабельность и улучшить направленное воздействие на легкие, предпочтительно, чтобы содержание тонкодисперсных частиц, меньших чем 3,3 мкм, (FPF<3,3мкм) составляло более чем 40% вес/вес от номинальной дозы.
[34] "Комбинация фиксированных доз", как применяется в настоящем описании, соответствует фармацевтическому продукту, который содержит два или более активных ингредиента, которые составлены вместе в единичной лекарственной форме, доступной в определенных фиксированных дозах.
[35] "Масс-медианный диаметр", или "MMD", или "x50", как применяется в настоящем описании, обозначает медианный диаметр множества частиц, как правило в полидисперсной популяции частиц, т.е. имеющей диапазон размеров частиц. Значения MMD, как приводятся в настоящем описании, определяются посредством лазерной дифракции (Sympatec Helos, Clausthal-Zellerfeld, Германия), если иное не указано в контексте. В определенных вариантах осуществления настоящего изобретения частицы ингаляционного лекарственного препарата имеют MMD, составляющий от 1 до 10 микрон.
[36] "Масс-медианный аэродинамический диаметр" или "MMAD", как применяется в настоящем описании, относится к медианному аэродинамическому размеру множества частиц, как правило в полидисперсной популяции. "Аэродинамический диаметр" представляет собой диаметр сферы единичной плотности, имеющей ту же скорость осаждения, обычно в воздухе, что и порошок, и поэтому он подходит для того, чтобы характеризовать аэрозолированный порошок или другую композицию диспергированных частиц или частиц с точки зрения их осаждения. MMAD определяют в настоящем описании посредством каскадной импакции. В одном или нескольких вариантах осуществления порошок настоящего изобретения имеет масс-медианный аэродинамический диаметр от приблизительно 1 мкм до 5 мкм, как например от приблизительно 1,5 мкм до приблизительно 4,0 мкм или от приблизительно 2,0 мкм до 4,0 мкм. Вообще, если частицы слишком большие, то меньше частиц проникнет глубоко в легкое. Если частицы слишком малы, большая процентная доля частиц может выйти при выдохе. В определенных вариантах осуществления настоящего изобретения частицы ингаляционного лекарственного препарата имеют MMAD от 1 до 5 микрон.
[37] "Складчатый", как применяется в настоящем описании, обозначает имеющий многочисленные морщины или складки, т.е. изборожденный складками или морщинами.
[38] "Складчатость", как применяется в настоящем описании, представляет собой меру шероховатости поверхности сконструированной частицы. Для целей настоящего изобретения складчатость вычисляют из определенной площади поверхности, получаемой из измерений методом БЭТ, истинной плотности, получаемой из гелиевой пикномерии, и отношения поверхности к объему, получаемого посредством лазерной дифракции (Sympatec), а именно:
Складчатость=(SSA∙ρtrue)/Sv,
где Sv=6/D32, где D32 представляет собой средний диаметр на основании единичной площади поверхности. Ожидается, что повышение шероховатости поверхности уменьшит силы сцепления между частицами и улучшит направленное воздействие аэрозоля на легкие. Ожидается, что улучшенное направленное воздействие на легкие уменьшит межиндивидуальную вариабельность и уровень препарата в ротоглотке и системной циркуляции. В одном или нескольких вариантах осуществления складчатость Sv составляет от 3 до 20, например от 5 до 10.
[39] "Нерастворимый", как применяется в настоящем описании, обозначает имеющий растворимость в растворителе, равную менее чем 1 мг/мл. В определенных вариантах осуществления настоящего изобретения растворимость, например активного ингредиента, может составлять менее чем 0,1 мг/мл, или, предпочтительно, менее чем 0,01 мг/мл.
[40] "Растворимый", как применяется в настоящем описании, обозначает имеющий растворимость в растворителе, равную 1 мг/мл или более. В определенных вариантах осуществления настоящего изобретения растворимость, например активного ингредиента, может составлять более чем 10 мг/мл, или, предпочтительно, более чем 20 мг/мл.
[41] Следует понимать, что на протяжении настоящего описания изобретения и в нижеследующей формуле изобретения предполагается, если иное не требуется контекстом, что слово "содержать" или его варианты, такие как "содержит" или "содержащий", включают указанное число или стадию или группу чисел или стадий, но не исключают какое-либо другое число или стадию или группу чисел или стадий.
[42] Полное раскрытие всех патентов Соединенных Штатов и международных патентных заявок, упомянутых в настоящем описании изобретения к патенту, полностью включено посредством ссылки в настоящее описание для всех целей.
Подробное описание чертежей
[43] Сухая порошковая композиция настоящего изобретения может быть описана со ссылкой на прилагаемые чертежи. На данных чертежах:
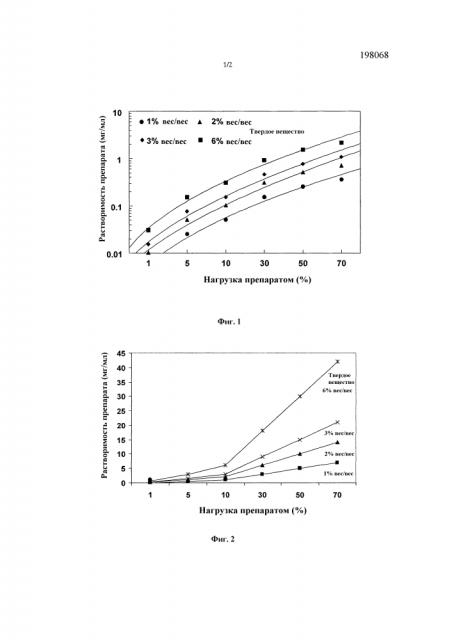
[44] Фигура 1 представляет собой график требуемой растворимости препарата для "нерастворимого" API для достижения общей растворенной доли менее чем 5% вес/об в исходном материале как функции от нагрузки препаратом и содержания твердого вещества. Ожидается, что растворимый препарат превратится в аморфное твердое вещество в высушенных распылением частицах.
[45] Фигура 2 представляет собой график требуемой растворимости препарата для "растворимого" API для полного смешивания в исходном материале как функции от вариаций нагрузки препаратом и содержания твердого вещества.
[46] Фигура 3 демонстрирует картины широкоугольной порошковой рентгеновской дифракции: (a) высушенной распылением композиции основы, содержащей DSPC:CaCl2 в соотношении 2:1 моль/моль; (b) микронизированного кристаллического индакатеролового API (QAB149); (c) высушенной распылением композиции, содержащей 6% вес/вес индакатерола (QAB149) и 2% вес/вес гликопирролата (NVA237); (d) высушенной распылением композиции, содержащей 45% индакатерола (QAB149) и 15% гликопирролата (NVA237). Порошковые картины продуктов высушенной распылением комбинации фиксированных доз иллюстрируют, что два препарата и гидрофобный эксципиент являются фазово-разделенными в отдельных доменах: индакатерол присутствует в кристаллической форме, гликопирролат присутствует в виде аморфного твердого тела, и DSPC присутствует в фосфолипидной гелевой фазе.
Подробное описание изобретения
[47] Настоящее изобретение касается сухих порошковых композиций для ингаляции, содержащих высушенные распылением частицы. Эти высушенные распылением частицы содержат комбинации фиксированных доз двух или более активных ингредиентов, которые подходят для лечения обструктивных или воспалительных заболеваний дыхательных путей, в частности астмы и COPD.
[48] В одном аспекте или варианте осуществления высушенные распылением частицы содержат первый активный ингредиент, который имеет по существу кристаллическую форму, второй активный ингредиент в по существу аморфной форме и фармацевтически приемлемый гидрофобный эксципиент, причем данные три материала являются по существу фазово-разделенными в высушенных распылением частицах. Данные частицы можно, следовательно, описать как "структурированные" или "сконструированные".
[49] Активные ингредиенты могут представлять собой любые активные фармацевтические ингредиенты, которые пригодны для лечения обструктивных или воспалительных заболеваний дыхательных путей, в частности астмы и COPD. Их можно выбирать, например, из бронходилататоров, противовоспалительных средств и их смесей, в частности β2-агонистов, мускариновых атнагонистов, стероидов, двойных β2-агонистов-мускариновых атнагонистов, ингибиторов PDE4, агонистов A2A, блокаторов кальция и их смесей.
[50] Подходящие активные ингредиенты включают β2-агонисты. Подходящие β2-агонисты включают арформотерол (например, тартрат), альбутерол/сальбутамол (например, рацемат или один энантиомер, такой как R-энантиомер, или его соль, в особенности сульфат), AZD3199, бамбутерол, BI-171800, битолтерол (например, мезилат), кармотерол, кленбутерол, этантерол, фенотерол (например, рацемат или один энантиомер, такой как R-энантиомер, или его соль, в особенности гидробромид), флербутерол, формотерол (например, рацемат или один диастереомер, такой как R,R-диастереомер, или его соль, в особенности фумарат или фумарата дигидрат), GSK-159802, GSK-597901, GSK-678007, индакатерол (например, рацемат или один энантиомер, такой как R-энантиомер, или его соль, в особенности малеат, ацетат или ксинафоат), LAS100977, метапротеренол, милветерол (например, гидрохлорид), наминтерол, олодатерол (например, рацемат или один энантиомер, такой как R-энантиомер, или его соль, в особенности гидрохлорид), PF-610355, пирбутерол (например, ацетат), прокатерол, репротерол, салмефамол, салметерол (например, рацемат или один энантиомер, такой как R-энантиомер, или его соль, в особенности ксинафоат), тербуталин (например, сульфат) и вилантерол (или его соль, в особенности трифенатат). В некоторых предпочтительных вариантах осуществления β2-агонист представляет собой β2-агонист сверхдлительного действия, такой как индакатерол, или, возможно, кармотерол, LAS-100977, милветерол, олодатерол PF-610355 или вилантерол.
[51] В предпочтительном варианте осуществления один из активных ингредиентов представляет собой индакатерол (т.е. (R)-5-[2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-1H-хинолин-2-он) или его соль. Он является агонистом β2-адренорецептора, который имеет особенно большую продолжительность действия (т.е. свыше 24 часов) и малую продолжительность начала действия (т.е. приблизительно 10 минут). Данное соединение получают посредством способов, описанных в международных патентных заявках WO 2000/75114 и WO 2005/123684. Оно способно к образованию солей присоединения кислоты, в частности фармацевтически приемлемых солей присоединения кислоты. Фармацевтически приемлемые соли присоединения кислоты соединения формулы I включают соли неорганических кислот, например галогенводородных кислот, таких как фтористоводородная кислота, соляная кислота, бромистоводородная кислота или йодистоводородная кислота, азотной кислоты, серной кислоты, фосфорной кислоты; и органических кислот, таких как муравьиная кислота, уксусная кислота, пропионовая кислота, масляная кислота, бензойная кислота, о-гидроксибензойная кислота, п-гидроксибензойная кислота, п-хлорбензойная кислота, дифенилуксусная кислота, трифенилуксусная кислота, 1-гидроксинафталин-2-карбоновая кислота, 3-гидроксинафталин-2-карбоновая кислота, алифатические гидроксикислоты, такие как молочная кислота, лимонная кислота, винная кислота или яблочная кислота, дикарбоновые кислоты, такие как фумаровая кислота, малеиновая кислота или янтарная кислота, и сульфоновые кислоты, такие как метансульфоновая кислота или бензолсульфоновая кислота. Эти соли могут быть получены из данного соединения посредством известных способов образования солей. Предпочтительной солью (R)-5-[2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-1H-хинолин-2-она является малеат. Другой предпочтительной солью является (R)-5-[2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-1H-хинолин-2-она ацетат. Другой предпочтительной солью является (R)-5-[2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-1H-хинолин-2-она ксинафоат. Другие полезные соли включают гидросукцинат, фумарат, гиппурат, мезилат, гидросульфат, гидротартрат, гидрохлорид, гидробромид, формат, эзилат, тозилат, гликолят и гидромалонат, которые, как соли ацетат и ксинафоат, раскрыты в международной патентной заявке WO 2008/000839 вместе с соответствующими способами их получения.
[52] Подходящие активные ингредиенты включают мускариновые атнагонисты или противомускариновые средства. Подходящие мускариновые атнагонисты включают аклидиний (например, бромид), BEA-2108 (например, бромид), BEA-2180 (например, бромид), CHF-5407, дарифенацин (например, бромид), даротропий (например, бромид), гликопирролат (например, рацемат или один энантиомер или его соль, в особенности бромид), декспирроний (например, бромид), iGSK-202405, GSK-203423, GSK-573719, GSK-656398, ипратропий (например, бромид), LAS35201, LAS186368, отилоний (например, бромид), окситропий (например, бромид), оксибутинин, PF-3715455, PF-3635659, пирензепин, реватропат (например, гидробромид), солифенацин (например, сукцинат), SVT-40776, TD-4208, теродилин, тиотропий (например, бромид), толтеродин (например, тартрат) и троспий (например, хлорид). В некоторых предпочтительных вариантах осуществления мускариновые атнагонисты представляют собой длительного действующие мускариновые антагонисты, такие как даротропия бромид, гликопирролат или тиотропия бромид.
[53] В предпочтительном варианте осуществления один из активных ингредиентов представляет собой соль гликопиррония. Соли гликопиррония включают гликопиррония бромид, также известный как гликопирролат, о к