2-амино-5,6-дифтор-1-(бета-d-рибофуранозил)-бензимидазол, способ получения и противовирусная активность его в отношении вируса герпеса простого 1-го типа
Иллюстрации
Показать всеИзобретение относится к пригодному для лечения герпеса 2-амино-5,6-дифтор-1-(бета-D-рибофуранозил)-бензимидазолу формулы (I) и способу его получения, который может быть использован в фармацевтической промышленности:
(I)
Предложенный способ включает конденсацию орто-фенилендиамина с бромцианом с последующим удалением бромгидрата карбонатом натрия и реакцию трансрибозилирования полученного основания с уридином в присутствии каталитических количеств уридинфосфорилазы и пуриннуклеозидфосфорилазы. Предложено новое эффективное против вируса герпеса соединение, в том числе против вариантов вируса, резистентных к действию базовых противогерпетических препаратов, а также новый эффективный способ его получения. 2 н. и 1 з.п. ф-лы, 3 пр., 4 ил.
Реферат
Изобретение относится к биотехнологии и медицине, в частности к получению нового нуклеозида 2-амино-5,6-дифтор-1-(бета-D-рибофуранозил)-бензимидазола, обладающего специфической активностью в отношении вируса герпеса простого первого типа. Изобретение может быть использовано для лечения и профилактики герпетической инфекции человека, в химико-фармацевтической промышленности.
Модифицированные нуклеозиды, по своей природе являющиеся антиметаболитами, проявляют широкий спектр противовирусной активности. В современной лечебной практике активно используются препараты ацикловир, азидотимидин и рибавирин в комплексной терапии герпетических инфекций, ВИЧ и гепатита С соответственно [Looking Back in 2009 at the Dawning of Antiviral Therapy Now 50 Years Ago: An Historical Perspective. Erik De Clercq. Advances in Virus Research, Volume 73, 2009 Elsevier Inc.]. Кроме пуриновых и пиримидиновых производных отдельного внимания заслуживают нуклеозиды бензимидазола, проявляющие селективную активность против цитомегаловируса (ЦМВ), вируса простого герпеса 1 и 2 типов (ВПГ-1 и ВПГ-2), вируса герпеса 6 типа. На сегодняшний день среди всех синтезированных нуклеозидов бензимидазола только Марибавир (5,6-дихлор-2-изопропиламино-1-(бета-L-рибофуранозил)бензимидазол) проявляет селективную противовирусную активность в отношение ЦМВ, но только при использовании его в высоких терапевтических дозах [Maribavir Use in Practice for Cytomegalovirus Infection in French Transplantation Centers. S. Alain, M. Revest, D. Veyer et al. Transplantation Proceedings, 45, 1603-1607, 2013]. У некоторых галогенированных по остатку бензимидазола нуклеозидов, включая 4,5,6,7-тетрабром-1-(бета-L-2'-дезоксирибофуранозил)бензимидазол, была обнаружена высокая цитотоксичность в экспериментах in vitro, но не было обнаружено селективной противовирусной активности. Работы по созданию новых нуклеозидов на основе бензимидазола, обладающих низкой цитотоксичностью и высокой противовирусной активностью, носят актуальный характер.
Известен способ получения агликона - 2-амино-5,6-дифтор-бензимидазола [Polysubstituted benzimidazoles as antiviral agents. L.B. Townsend, J.C. Drach. US 5360795, 01 Nov. 1994; Polysubstituted benzimidazoles as antiviral agents. L.B. Townsend, J.C. Drach. US 5574058, 12 Nov. 1996], синтез рибозида на его основе не описан. В патенте [Modified benzimidazole nucleosides as antiviral agents J.C. Drach, G.A. Freeman and L.B. Townsend. WO 97/27204, 31 Jul. 1997] описаны способы получения нуклеозидов, имеющих в качестве углеводного остатка фторированные по 2 и 3 положениям сахара. Синтез пиранозидов 2-амино-5,6-дифтор-бензимидазола приведен в следующем патенте [Benzimidazole derivatives. J.C. Drach, L.B. Townsend, F.L. Boyd JR. US 2002/0094963 A1, 18 Jul. 2002].
Химический синтез 2-амино-5,6-дифтор-1-(бета-D-рибофуранозил)-бензимидазола (АмБИР) не описан. Вероятно, это связано с трудностями реализации синтеза по схеме классической реакции гликозилирования, в результате которой возможно образование плохо разделимой смеси альфа и бета-аномеров целевого соединения, как и указано в патенте US 2002/0094963 A1 (Benzimidazole derivatives. J.C. Drach, L.B. Townsend, F.L. Boyd J.R., 18 Jul. 2002), а также образование побочных продуктов гликозилирования основания бензимидазола по 2-амино группе.
В настоящее время к лекарственным средствам, используемым для лечения вируса герпеса простого, относятся в основном нуклеозидные аналоги - предшественники ингибиторов ДНК-полимеразы вируса герпеса, в первую очередь - ациклические нуклеозидные аналоги: ацикловир (АЦВ), валацикловир (валиновый эфир ацикловира), ганцикловир, пенцикловир и фамцикловир и цидофовир. Однако известно, что со временем у штаммов вируса герпеса простого развивается резистентность к действию АЦВ и других вышеуказанных соединений. В литературе описаны аминокислотные замены в ДНК-полимеразе и тимидинкиназе различных штаммов вируса простого герпеса типа 1 (ВПГ-1) относительно эталонного штамма L2 [Heterogeneity and evolution of thymidine kinase and DNA polymerase mutants of herpes simplex virus type 1: implications for antiviral therapy. Andrei G., Georgala A., Topalis D., Fiten P., Aoun M., Opdenakker G., Snoeck R. J Infect Dis. 2013; 207(8):1295-305; Activity and mechanism of action of HDVD, a novel pyrimidine nucleoside derivative with high levels of selectivity and potency against gammaherpesviruses. Coen N., Singh U., Vuyyuru V., Van den Oord J.J., Balzarini J., Duraffour S., Snoeck R., Cheng Y.C., Chu C.K., Andrei G. J Virol. 2013; 87(7): 3839-51; Characterization of Herpes Simplex Virus Type 1 Thymidine Kinase Mutants Selected under a Single Round of High-Dose Brivudin. Andrei G., Balzarini J., Fiten P., De Clercq E., Opdenakker G., Snoeck R. J Virol. 2005; 79(9): 5863-9; Ферментативная активность тимидинкиназы штаммов вируса простого герпеса, резистентных к Н-фосфонату ацикловира. Гуськова А.А., Скоблов М.Ю., Андронова В.Л., Галегов Г.А., Кочетков С.Н., Скоблов Ю. Биоорг. химия, 2011; 17(5): 627-630; Diagnosis of genital herpes simplex virus infection in the clinical laboratory. LeGoff J., H., L. Virol J. 2014; 11(1): 83; Genotypic characterization of UL23 thymidine kinase and UL30 DNA polymerase of clinical isolates of herpes simplex virus: natural polymorphism and mutations associated with resistance to antivirals. Burrel S., C. Deback H. Agut, Boutolleau D. Antimicrob. Agents Chemother. 2010; 54(11): 4833-4842]. Именно эти замены, локализованные в консервативных участках фермента, могут быть ассоциированы с изменением лекарственной чувствительности у ВПГ-1.
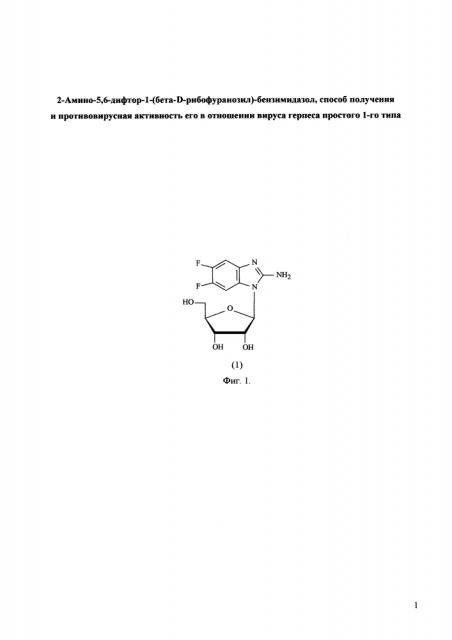
Технической задачей изобретения является разработка эффективного способа получения нуклеозида АмБИР (соединение 1, фиг. 1). Модифицированный нуклеозид (соединение 1) синтезирован впервые, в литературе в открытой печати не описан. Предлагаемое соединение обладает активностью в отношении вируса герпеса простого 1-го типа, в том числе штаммов вируса с лекарственной устойчивостью.
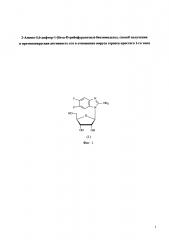
Поставленная задача разработки эффективного способа синтеза АмБИР решена за счет использования химико-ферментативного подхода, приведенного на схеме (фиг. 2). В качестве исходного соединения на первой стадии синтеза используют дифтор-орто-фенилендиамин (соединение 2, фиг. 2). На первой стадии проводят циклизацию фенилендиамина (соединение 2) при добавлении бромциана в среде ацетонитрила при комнатной температуре без нагревания реакционной смеси. В отличие от описанных ранее способов циклизации диамина цианбромидом в водной среде [Polysubstituted benzimidazoles as antiviral agents. L.B. Townsend, J.C. Drach. US 5574058, 12 Nov. 1996], в предложенном нами способе не образуются побочные продукты по нитрильной группе. Выход 2-амино-5,6-дифтор-бензимидазола (соединение 4, фиг. 2) составляет 70%.
На следующей стадии синтеза для осуществления переноса остатка рибозы с природного нуклеозида уридина (соединение 5, фиг. 2) на модифицированное основание (соединение 4, фиг. 2) используют генно-инженерные ферменты нуклеозидфосфорилазы: пуриннуклеозидфосфорилазу (ПНФ, КФ 2.4.2.1) и уридинфосфорилазу (УФ, КФ 2.4.2.3). Использование реакции ферментативного трансгликозилирования позволяет синтезировать 2-амино-5,6-дифтор-1-(бета-D-рибофуранозил)-бензимидазол (АмБИР, соединение 1, фиг. 2) с выходом 70% и с чистотой >99%.
Противовирусное действие АмБИР впервые изучено в отношении шести штаммов вируса герпеса простого типа 1 (ВПГ-1), включая штаммы, устойчивые к действию базовых противогерпетических препаратов: ацикловира и родственных соединений, а также фосфономуравьиной кислоты, цидофовира (фиг. 3). Установлено противогерпетическое действие, выраженное в ингибировании развития вирусиндуцированного цитопатического эффекта в культуре клеток Vero Е6, инфицированных различными штаммами ВПГ-1 (фиг. 4).
Соединение 1 (АмБИР) может входить в эффективной терапевтической дозе в качестве действующего вещества в состав фармацевтической композиции для использования в виде лекарственного средства, обладающего активностью против вируса простого герпеса.
Изобретение иллюстрируют графические изображения.
Фиг. 1. Структурная формула соединения 2-Амино-5,6-дифтор-1-(бета-D-рибофуранозил)-бензимидазол (АмБИР).
Фиг. 2. Схема получения соединения 2-амино-5,6-дифтор-1-(бета-D-рибофуранозил)-бензимидазола (АмБИР).
Схема получения соединения АмБИР состоит из двух этапов. Первый этап синтеза включает конденсацию орто-фенилендиамина (2) с бромцианом с последующим удалением бромгидрата карбонатом натрия. В результате образуется основание 4. Второй этап включает реакцию трансрибозилирования полученного основания 4 с уридином (5) в присутствии каталитических количеств уридинфосфорилазы и пуриннуклеозидфосфорилазы. Условия реакций и реагенты даны в подписи к Фиг. 2.
Фиг. 3. В Табл. 1. представлены аминокислотные замены в ДНК-полимеразе и тимидинкиназе различных штаммов вируса простого герпеса типа 1 относительно эталонного штамма L2. В таблице жирным шрифтом выделены аминокислотные замены, которые могут быть ассоциированы с изменением лекарственной чувствительности, локализованные в консервативных участках фермента.
Фиг. 4. В Табл. 2. представлены цитотоксические свойства и противовирусная активность соединения АмБИР на модели ряда штаммов ВПГ-1 с различной лекарственной чувствительностью в культуре клеток Vero Е6. В таблице жирным шрифтом выделены величины ИД50, ИД95 и ХТИ, указывающие на существенное снижение чувствительности вируса к тестируемому соединению. Цитотоксическое действие соединений оценивали визуально по состоянию клеточного монослоя через 72 ч. За максимально переносимую концентрацию (МПК) принимают концентрацию соединения, не вызывающую видимых под микроскопом деструктивных изменений клеток. Величины химиотерапевтических индексов (ХТИ), вычисляемые как отношение ЦД50 к ИД50, характеризуют уровень селективности соединений.
Изобретение иллюстрируют примеры.
Пример 1. Синтез 2-амино-5,6-дифтор-бензимидазола (соединение 4, фиг. 2)
К раствору 7.2 г (50 ммоль) орто-фенилендиамина (соединение 2) в 100 мл ацетонитрила при перемешивании добавляют раствор 5.86 г (60 ммоль) бромциана в 100 мл ацетонитрила при температуре реакционной массы не более 30°С. Реакционную массу выдерживают при комнатной температуре 2 часа. Образовавшийся осадок гидробромида 2-амино-5,6-дифтор-бензимидазола (соединение 3) отфильтровывают, суспендируют в 100-150 мл воды и добавляют при перемешивании 25 мл (50 ммоль) 2 М раствора карбоната натрия. Образовавшийся осадок 2-амино-5,6-дифтор-бензимидазола (соединение 4) отфильтровывают, высушивают, очищают флэш-хроматографией (элюент этанол) с последующей перекристаллизацией осадка из ацетонитрила. Получают продукт (соединение 4) - кристаллы кремового цвета - в количестве 6.51 г (выход 70%, C7H4F2N3×H2O) с чистотой 98.81%, Rt=9.3 мин (метод 0-70% В за 20 мин, здесь и далее во всех случаях: хроматограф Waters, Breeze (США), колонка Nova-Pak С18, 4.6×150 мм, 4 мкм, детекцию осуществляют при 280 нм, элюент А - вода с 0.1% ТФУ, элюент В - 70% ацетонитрила в воде с 0.1% ТФУ).
Масс-спектр (соединение 2), m/z: [М+Н]+=302.0955, расч.=302.0952; [основание+Н]+=170.0529, расч.=170.0530. Т.пл. 151-152°С, Rf 0.65 (ТСХ на пластинах «Сорбфил» («Merck») в системе этилацетат - этанол, 7:3).
1Н NMR (400 MHz) ДМСО-d6, внутренний стандарт - ТМС, (δ, мд, КССВ (J), Гц): 7.09, 7.07, 7.05 (2Н, т, J=9.3); 6.30 (2Н, уш. с, NH2).
Пример 2. Синтез 2-амино-5,6-дифтор-1-(бета-D-рибофуранозил)-бензимидазола (АмБИР, соединение 1, фиг. 2)
2-Амино-5,6-дифтор-бензимидазол (соединение 4) 0.68 г (4.0 ммоль) растворяют в 1 л воды, в полученном растворе при небольшом нагревании растворяют 4.89 г (20 ммоль) уридина (соединение 5, фиг. 2) и 2.72 г (20 ммоль) дигидроортофосфата калия. Доводят рН реакционной смеси до 7.0. В реакционную смесь добавляют 4280 ед. ПНФ и 1770 ед. УФ. Раствор термостатируют при 50°С. Реакцию проводят до тех пор, пока конверсия основания (соединение 4) в целевое соединение (соединение 1) не составит 87%. По окончании процесса реакционную смесь концентрируют в вакууме (15 мм рт.ст.) до объема 15 мл и хроматографируют на обращенно-фазовом сорбенте октадецилсиликагеле (Merck, Германия) (0.03 mm), размеры колонки: 30×320 мм. Целевое соединение элюируют раствором метанола в воде в градиенте от 5 до 30%. Фракции содержащие продукт объединяют, растворитель удаляют в вакууме (15 мм рт.ст.). Продукт сушат в вакууме (5 мм рт.ст.) над пятиокисью фосфора. Выход: 0.835 г (70%). Чистота продукта (соединение 1) по данным ВЭЖХ 99.86% (Rt=15.0 мин, градиент элюента В 0-30% за 20 минут).
λmax 288 нм. Масс-спектр, m/z: [М+Н]+=302.0915, расч. 302.0952; [α]D25 +43.6 (с 0.5, H2O).
1Н-ЯМР (WM-700 Bruker, США, ДМСО-d6, 30°С): 7.53 (дд, J=7.6, 11.4, 1H, Н4), 7.10 (дд, J=7.4, 11.4, 1H, Н7), 6.64 (уш. с, 2Н, NH2), 5.70 (д, J=7.6, 1H, Н1'), 5.46 (т, J=4.6, 1Н, 5'-ОН), 5.19 (д, J=3.1, 1Н, 2'-ОН), 5.18 (уш. с, 1H, 3'-ОН), 4.32 (м, 1Н, Н2'), 4.09 (м, 1H, Н3'), 3.96 (м, 1Н, Н4'), 3.70, 3.67 (2 м, 2Н, Н5');
13С-ЯМР: 156.32 (с, С2), 146.1 (дд, J=235.0, 15.4, С5), 144.15 (дд, J=231.6, 15.4, С6), 139.11 (д, J=11.7, С9), 128.99 (д, J=11.0, С8), 102.76 (д, J=20.0, С4), 98.88 (д, J=24.0, С7), 88.04 (С1'), 86.09 (С4'), 71.62 (С2'), 70.41 (С3'), 61.56 (С5'),
15N ЯМР: 309.7 (NH2), 194.9 (N3), 132.12 (N1).
Пример 3. Изучение противовирусной активности 2-амино-5,6-дифтор-1-(бета-D-рибофуранозил)-бензимидазола (АмБИР) в отношении шести различных штаммов вируса герпеса простого типа 1 (ВПГ-1), включая штаммы вируса, резистентные к действию ацикловира (ациклогуанозина) и родственных соединений, а также цидофовира и фосфономуравьиной кислоты
Пример 3.1. Генотипическая характеристика штаммов вируса простого герпеса типа 1, использованных для оценки антивирусной активности АмБИР
Для определения противогерпетической активности используют эталонный штамм L2 вируса герпеса простого типа 1 (ВПГ-1/L2), полученный из Государственной коллекции вирусов Института вирусологии им. Д.И. Ивановского (ФГНИЦЭМ им. Н.Ф. Гамалеи МЗ РФ). Штаммы ВПГ-1 с лекарственной резистентностью получены путем проведения серийного пассирования вируса в присутствии ацикловира (ВПГ-1/L2/RАЦВ), Н-фосфоната ациклогуанозина (ВПГ-1/L2/RФ-АЦГ/2), фосфономуравьиной кислоты (ВПГ-1/F(+)/RФМК) с последующим клонированием. Штамм ВПГ-1/L2/ТК-ФМКR) получен генно-инженерным путем. Штамм ВПГ-1/Avd представляет собой клинический изолят.
Пример 3.2. Изучение цитотоксического действия АмБИР на культуру клеток Vero Е6
При изучении токсического действия АмБИР (соединение 1, Фиг. 1) в культуре клеток Vero Е6 с использованием метода окрашивания клеток трипановым голубым, основанного на способности мертвых клеток окрашиваться красителем, после 72-часовой инкубации клеточной монослойной культуры в присутствии изучаемого соединения клетки подсчитывали с помощью гемоцитометра и определяли величину ЦД50 - концентрацию соединения, в присутствии которой погибает не более 50% клеток по сравнению с контролем, инкубируемым без препарата. Установлено, что соединение 1 малотоксично: при использовании в диапазоне концентраций, обеспечивающих активное подавление герпес-вирусной инфекции, величина ЦЦ50 не достигается. Даже при инкубации культуры клеток Vero Е6 в присутствии соединения 1 в максимальной исследованной концентрации 1000 мкг/мл выживаемость клеток превышала 50%: количество мертвых клеток составило 26.75±0.57%. В контроле клеток, инкубируемых в тех же экспериментальных условиях, но без тестируемого соединения в среде поддержки, погибло 4.91±0.04% клеток (по результатам двух независимых опытов).
Пример 3.3. Биологическая активность АмБИР
Изучение противовирусной активности соединения 1 (АмБИР) проводили in vitro в культуре клеток Vero Е6. При изучении противогерпетической активности соединения 1 in vitro культуру клеток Vero Е6 инфицировали различными штаммами ВПГ-1 с множественностью 0.1 БОЕ/кл (где БОЕ - бляшкообразующая единица) и инкубировали под жидкой средой поддержки, состоящей из сред Игла и 199, соединенных в равных соотношениях, содержащей соединение 1 в известных концентрациях. После 48 часов инкубации, когда в контроле вируса развивался 95-100% цитопатический эффект (ЦПЭ), определяли концентрации, ингибирующие развитие вирусиндуцированного цитопатического эффекта по сравнению с контролем на 50% (ИД50) и практически полностью (ИД95).
В качестве референс-препаратов использовали ацикловир (АЦВ, ациклогуанозин, АЦГ, 9-[(2-гидроксиэтокси)-метил]гуанин, acyclovir, зовиракс) производства Sigma Aldrich, США (брутто-формула: C8H11N5O3, Mr: 225.20, кат. номер: 59277-89-3), гексагидрат тринатриевой соли фосфономуравьиной кислоты (ФМК, фоскарнет, фоскавир) производства Sigma Aldrich, США (брутто-формула: Na3CO5P×6H2O, Mr: 300.04; кат. номер: 34156-56-3), цидофовир (ЦДВ, Cidovir, Vistide) производства Sigma Aldrich, США (брутто-формула: C8H14N3O6P, Mr: 279.19; кат. номер: 113852-37-2), рибавирин (Ribavirin, виразол, 1-β-D-рибофуранозил-1,2,4-триазол-3-карбоксамид) производства Sigma Aldrich, США (брутто-формула: C8H12N4O5, 244.20, кат. номер: 36791-04-5).
В таблице 2 приведены результаты изучения противогерпетической активности соединения 1 и референсных препаратов в культуре клеток Vero Е6. Не выявлено значимых различий в активности соединения 1 при подавлении герпетической инфекции, вызываемой различными штаммами вируса герпеса простого типа 1. Как видно из данных таблицы 2, соединение 1 обеспечивает достижение 50% ингибирования развития вирусиндуцированного ЦПЭ при использовании в нецитотоксичной концентрации, превышающей 1/16÷1/32 ЦЦ50. Выраженность противовирусного эффекта соединения 1 не зависит от чувствительности вируса к ацикловиру (штаммы ВПГ-1/L2/RАЦВ, ВПГ-1/L2/RФ-АЦГ/2, ВПГ-1/L2/RАЦВ+ФМК, ВПГ-1/Avd), фосфономуравьиной кислоте (штаммы ВПГ-1/F(+)/RФМК и ВПГ-1/L2/RАЦВ+ФМК) и цидофовиру (штамм ВПГ-1/Avd).
Существенно, что предлагаемое соединение способно полностью ингибировать развитие вирусиндуцированного ЦПЭ в диапазоне нецитотоксических концентраций (ИД95). Селективность противогерпесвирусного действия соединения 1 сравнима или превосходит активность таких известных лекарственных препаратов, как фосфономуравьиная кислота или рибавирин.
Фармацевтические композиции на основе соединения 1 могут быть перспективны для создания новых противовирусных средств.
1. Соединение 2-амино-5,6-дифтор-1-(бета-D-рибофуранозил)-бензимидазол, имеющее структурную формулу:
2. Способ получения соединения по п. 1, включающий конденсацию 4,5-дифтор-орто-фенилендиамина с бромцианом с последующим удалением бромгидрата карбонатом натрия и реакцию трансрибозилирования полученного основания с уридином в присутствии каталитических количеств уридинфосфорилазы и пуриннуклеозидфосфорилазы.
3. Соединение по п. 1, обладающее активностью в отношении вируса герпеса простого 1-го типа, в том числе штаммов вируса с лекарственной устойчивостью.