Бактериальные штаммы, принадлежащие к роду bifidobacterium, для применения в лечении гиперхолестеринемии
Иллюстрации
Показать всеГруппа изобретений относится к медицине и касается пищевой композиции, содержащей бактериальную композицию. Композиция содержит по меньшей мере один бактериальный штамм, принадлежащий к виду Bifidobacterium bifidum, выбранный из группы, состоящей из бактериального штамма В. bifidum ВВ06 (МВ107) DSM 24688 и бактериального штамма B. bifidum МВ109 DSM 23731, способный адсорбировать холестерин на поверхности клеточной стенки, и по меньшей мере один бактериальный штамм, принадлежащий к виду Bifidobacterium lactis или Bifidobacterium breve, выбранный из группы, состоящей из бактериального штамма В. lactis МВ2409 DSM 23733 и бактериального штамма В. breve (МВ113) DSM 23732, способный гидролизовать соли желчных кислот на внутриклеточном и/или внеклеточном уровне, для предупреждения гиперхолестеринемии и снижения уровня ЛПНП холестерина в крови. Также предложены пищевая добавка и фармацевтическая композиция, содержащие указанную бактериальную композицию. Группа изобретений обеспечивает профилактику гиперхолестеринемии и снижение уровня ЛПНП холестерина в крови у пациента. 3 н. и 21 з.п. ф-лы, 3 ил., 6 табл.
Реферат
Настоящее изобретение относится к отобранным бактериальным штаммам, принадлежащим к роду Bifidobacterium, для применения в лечении гиперхолестеринемии. В частности, настоящее изобретение относится к пищевой композиции, или пищевой добавке, или медицинскому устройству, или фармацевтической композиции, содержащим указанные бактериальные штаммы в сочетании со стеринами или фитостеринами, и/или станолами или фитостанолами, и/или глюкоманнаном, и/или конжаковой камедью, и/или пребиотическими волокнами, и/или ферментированным красным рисом, и/или бета-глюканами из овса, овсяных отрубей, ячменя, ячменных отрубей, и/или гелем алоэ древовидного в лиофилизированной форме.
Хорошо известно, что все клетки организма способны синтезировать холестерин из ацетилкоэнзима А, но большая часть холестерина вырабатывается в пероксисомах клеток печени, которые переносят его в кровь для транспортировки по всему организму.
Когда мы говорим о «холестерине» с медицинской точки зрения, мы не подразумеваем холестерин как химический продукт, а скорее фактически говорим о классе липопротеинов (хиломикроны, транспортные агрегаты), которые циркулируют в крови. Концентрация вышеуказанных липопротеинов называется «холестерин крови». В зависимости от состава по холестерину, фосфолипидам, протеинам, триглицеридам и жирным кислотам эти агрегаты дополнительно подразделяют на несколько классов (согласно удельному весу, составляющему от 0,98 до 1,17 г/см3): ЛПОНП (липопротеины очень низкой плотности), ЛППП (липопротеины промежуточной плотности), ЛПНП (липопротеины низкой плотности), ЛПВП2 и ЛПВП3 (липопротеины высокой плотности).
Биосинтез холестерина регулируется внутриклеточной концентрацией холестерина и гормонами инсулином и глюкагоном, так что холестерин синтезируется только в случае необходимости, чтобы избежать потери энергии. Фактически, высокая внутриклеточная концентрация холестерина, связанная с гормонами инсулином и глюкагоном, ингибирует фермент ГМГ-КоА редуктазу (гидроксиметилглутарил-кофермент А-редуктазу), тем самым блокируя биосинтез нового холестерина. По этой причине количество синтезируемого холестерина обратно пропорционально количеству холестерина, получаемому с пищей.
В случае гиперхолестеринемического питания количество холестерина, синтезируемого с помощью биосинтеза холестерина, уменьшается, но анализируемые показатели холестерина могут, тем не менее, превышать пороговые значения, рекомендованные Всемирной организацией здравоохранения: общий холестерин крови ниже 200 мг/дл и соотношение общий холестерин/ЛПВП менее чем 5 (для мужчин) и менее чем 4,5 (для женщин). Приблизительно, следующие значения являются общепринятыми:
1) Нормальные уровни холестерина в крови со значением менее чем 200 мг/дл холестерина крови.
2) Легкая гиперхолестеринемия со значением, составляющим от 200 до 249 мг/дл.
3) Умеренная гиперхолестеринемия со значением, составляющим от 250 до 299 мг/дл.
4) Тяжелая гиперхолестеринемия со значением более чем 300 мг/дл.
Зафиксированное превышение пороговых значений (200 мг/дл) анализируемых показателей холестерина ограничивает множество людей в выборе пищевых продуктов, которые они могут употреблять в пищу, и в образе жизни, которого они могут придерживаться. Эти ограничения/лишения также могут иметь последствия для настроения самих людей, которые видят себя лишенными свободы в выборе пищи, поскольку они осознают тот факт, что выбор для приема в пищу блюда с высоким содержанием холестерина означает либо ряд ограничений в последующие дни, либо, в некоторых случаях, чувство вины из-за «непослушания», или способствования повышению значений холестерина крови.
Поэтому, было бы полезно и желательно иметь композицию, способную нормализовать анализируемые показатели холестерина у субъектов, которые периодически злоупотребляют пищевыми продуктами с высоким содержанием холестерина.
Хорошо известно о существовании лекарственных средств, таких как статины, которые ингибируют синтез эндогенного холестерина посредством воздействия на фермент 3-гидрокси-3-метилглутарил-КоА-редуктазу, фермент, который превращает молекулы 3-гидрокси-3-метилглутарил-КоА в мевалоновую кислоту, предшественник холестерина.
Проблема, возникающая из-за приема указанных лекарственных средств, например, статинов, заключается в том, что при снижении уровня эндогенного холестерина указанные лекарственные средства способствуют увеличению биосинтеза внутриклеточного холестерина.
Увеличение биосинтеза внутриклеточного холестерина означает то, что когда пациент, например, прекращает принимать статины, биосинтез внутриклеточного холестерина не нормализуется (снижается) сразу после прерывания приема статинов, а наоборот, продолжается, как будто пациент все еще принимает лекарственное средство (так называемая «память на прошлые события»).
Таким образом, например, когда прием статинов прерывается, биосинтез внутриклеточного холестерина продолжается некоторое время, до тех пор, пока не будет нормализован, то есть до снижения указанного биосинтеза до уровней, существовавших до начала приема лекарственного средства на основе статинов. Эта неконтролируемая и излишняя выработка холестерина представляет собой серьезный недостаток.
Таким образом, было бы желательно иметь лечение, например, в качестве альтернативы статинам, но не только. Требуемое лечение должно представлять собой лечение, которое может быть легко прервано субъектом без какой-либо дальнейшей выработки холестерина. В практическом смысле, было бы желательно иметь новое лечение, которое, с одной стороны, способно снижать уровень эндогенного холестерина, и, с другой стороны, в случае, если лечение само по себе будет прервано, способно нормализовать биосинтез внутриклеточного холестерина так, чтобы нормализовать физиологический уровень холестерина.
Заявитель предложил решение проблемы вышеупомянутых потребностей после интенсивного научного исследования, в результате которого из весьма обширной группы штаммов был проведен отбор бактериальных штаммов, принадлежащих к роду Bifidobacterium. Указанные штаммы проявляют заметную способность снижать уровень холестерина в крови, в частности уровень ЛПНП холестерина.
Объект настоящего изобретения относится к бактериальному штамму, принадлежащему к роду Bifidobacterium и обладающему свойствами, раскрытыми в прилагаемой формуле изобретения.
Указанный штамм принадлежит к виду Bifidobacterium bifidum. Заявитель провел отбор среди множества бактериальных штаммов, принадлежащих к виду Bifidobacterium bifidum. Штаммы, отобранные за их свойства, представляют собой:
1) Bifidobacterium bifidum BB06, депонированный компанией Probiotical S.p.A, Новара (Италия) в DSMZ (Немецкая коллекция микроорганизмов и клеточных культур) 29.03.2011, с номером доступа DSM 24688.
2) Bifidobacterium bifidum MB109, депонированный компанией Probiotical S.p.A, Новара (Италия) в DSMZ 29.06.2010, с номером доступа DSM 23731.
Заявитель провел отбор среди множества бактериальных штаммов, принадлежащих к виду Bifidobacterium lactis. Штаммы, отобранные за их свойства, представляют собой:
1) Bifidobacterium lactis MB2409, депонированный компанией Probiotical S.p.A, Новара (Италия) в DSMZ 29.06.2010, с номером доступа DSM 23733.
2) Bifidobacterium lactis BS07 (MB243), депонированный компанией Probiotical S.p.A, Новара (Италия) в DSMZ 29.03.2011, с номером доступа DSM 24690.
Заявитель провел отбор среди множества бактериальных штаммов, принадлежащих к виду Bifidobacterium breve. Штамм, отобранный за его свойства, представляет собой Bifidobacterium breve MB113, депонированный компанией Probiotical S.p.A, Новара (Италия) в DSMZ 29.06.2010, с номером доступа DSM 23732.
Заявитель провел отбор среди множества бактериальных штаммов, принадлежащих к виду Bifidobacterium infantis. Штамм, отобранный за его свойства, представляет собой Bifidobacterium infantis BI02 (MB287), депонированный компанией Probiotical S.p.A, Новара (Италия) в DSMZ 29.03.2011, с номером доступа DSM 24687.
В контексте настоящего изобретения бактерии могут находиться в изолированном виде или с соответствующей надосадочной жидкостью. Они могут находиться в виде живых или убитых бактерий или их клеточных компонентов или в виде клеточного экстракта или ферментного экстракта.
Объект настоящего изобретения относится к пищевой композиции, или пищевой добавке, или медицинскому устройству, или фармацевтической композиции, обладающим свойствами, раскрытыми в прилагаемой формуле изобретения.
Пищевая композиция, или пищевая добавка, или медицинское устройство, или фармацевтическая композиция содержат смесь бактериальных штаммов, состоящую по меньшей мере из одного бактериального штамма, принадлежащего к роду Bifidobacterium, обладающего способностью снижать уровень холестерина в крови, в частности ЛПНП холестерина.
В другом предпочтительном воплощении указанный по меньшей мере один бактериальный штамм выбран из группы, содержащей бактериальные штаммы, принадлежащие к видам Bifidobacterium bifidum, Bifidobacterium lactis, Bifidobacterium breve и Bifidobacterium infantis.
Пищевая композиция, или пищевая добавка, или медицинское устройство, или фармацевтическая композиция содержат смесь бактериальных штаммов, состоящую по меньшей мере из одного бактериального штамма, выбранного из группы, содержащей или, альтернативно, состоящей из:
1) Bifidobacterium bifidum BB06 (MB107), депонированного компанией Probiotical S.p.A, Новара (Италия) в DSMZ 29.03.2011, с номером доступа DSM 24688; и/или
2) Bifidobacterium bifidum MB109, депонированного компанией Probiotical S.p.A, Новара (Италия) в DSMZ 29.06.2010, с номером доступа DSM 23731; и/или
3) Bifidobacterium lactis MB2409, депонированного компанией Probiotical S.p.A, Hosapa (Италия) в DSMZ 29.06.2010, с номером доступа DSM 23733, и/или
4) Bifidobacterium lactis BS07 (MB243), депонированного компанией Probiotical S.p.A, Новара (Италия) в DSMZ 29.03.2011, с номером доступа DSM 24690; и/или
5) Bifidobacterium breve MB113, депонированного компанией Probiotical S.p.A, Новара (Италия) в DSMZ 29.06.2010, с номером доступа DSM 23732; и/или
6) Bifidobacterium infantis BI02 (MB287), депонированного компанией Probiotical S.p.A, Новара (Италия) в DSMZ 29.03.2011, с номером доступа DSM 24687.
Объект настоящего изобретения относится к пищевой композиции, или пищевой добавке, или медицинскому устройству, или фармацевтической композиции, которые содержат бактериальную композицию, состоящую из (1) по меньшей мере одного бактериального штамма, принадлежащего к виду Bifidobacterium bifidum, способного адсорбировать холестерин на поверхности клеточной стенки, и (2) по меньшей мере одного бактериального штамма, принадлежащего к виду Bifidobacterium lactis, Bifidobacterium breve или Bifidobacterium infantis, способного гидролизовать соли желчных кислот на внутриклеточном и/или внеклеточном уровне, для применения в профилактическом или терапевтическом лечении гиперхолестеринемии.
Пищевая композиция, или пищевая добавка, или медицинское устройство, или фармацевтическая композиция предназначены для применения для снижения уровня ЛПНП холестерина в крови. Более того, указанный штамм, принадлежащий к виду Bifidobacterium bifidum, выбран из группы, состоящей из бактериального штамма B. bifidum BB06 (MB107) DSM 24688 и бактериального штамма B. bifidum (MB109) DSM 23731. Кроме того, указанный штамм, принадлежащий к виду Bifidobacterium lactis, выбран из группы, состоящей из бактериального штамма B. lactis (MB2409) DSM 23733 и бактериального штамма B. lactis BS07 (MB243) DSM 24690. Более того, указанный штамм, принадлежащий к виду Bifidobacterium breve, представляет собой бактериальный штамм B. breve (MB113) DSM 23732. Кроме того, указанный штамм, принадлежащий к виду Bifidobacterium infantis, представляет собой бактериальный штамм B. infantis BI02 (MB287) DSM 24687.
Пищевая композиция, или пищевая добавка, или медицинское устройство, или фармацевтическая композиция дополнительно содержат бактериальный штамм, принадлежащий к виду Bifidobacterium longum, способный образовывать конъюгированную линолевую кислоту (КЛК) из линолевой кислоты (ЛК). Более того, указанный штамм, принадлежащий к виду Bifidobacterium longum, представляет собой Bifidobacterium longum (BL04) DSM 23233.
Объект настоящего изобретения относится к пищевой композиции, или пищевой добавке, или медицинскому устройству, или фармацевтической композиции, которые содержат бактериальную композицию, состоящую из по меньшей мере одного бактериального штамма, принадлежащего к виду Bifidobacterium bifidum, по меньшей мере одного бактериального штамма, принадлежащего к виду Bifidobacterium lactis и по меньшей мере одного бактериального штамма, принадлежащего к виду Bidifobacterium longum, для применения в профилактическом или терапевтическом лечении гиперхолестеринемии. Указанный штамм, принадлежащий к виду Bifidobacterium bifidum, выбран из группы, состоящей из бактериального штамма B. bifidum BB06 (MB107) DSM 24688 и бактериального штамма B. bifidum (MB109) DSM 23731; предпочтительно он представляет собой бактериальный штамм B. bifidum (MB109) DSM 23731. Более того, указанный штамм, принадлежащий к виду Bifidobacterium lactis, выбран из группы, состоящей из бактериального штамма B. lactis (MB2409) DSM 23733 и бактериального штамма B. lactis BS07 (MB243) DSM 24690; предпочтительно он представляет собой бактериальный штамм B. lactis (MB2409) DSM 23733. Более того, указанный штамм, принадлежащий к виду Bifidobacterium longum, представляет собой Bifidobacterium longum (BL04) DSM 23233.
В пищевой композиции, или пищевой добавке, или медицинском устройстве, или фармацевтической композиции дополнительно присутствует по меньшей мере одно растительное вещество, выбранное из группы, содержащей стерины или фитостерины, станолы или фитостанолы, глюкоманнан, конжаковую камедь, и/или по меньшей мере одно пребиотическое волокно, выбранное из группы, содержащей фруктоолигосахариды - FOS, галактоолигосахариды - GOS, ксилоолигосахариды - XOS, инулин, волокна лиственницы или арабиногалактан, и/или ферментированный красный рис, и/или бета-глюканы из овса, овсяных отрубей, ячменя, ячменных отрубей, и/или гель алоэ древовидного в лиофилизированной форме.
В пищевой композиции, или пищевой добавке, или медицинском устройстве, или фармацевтической композиции дополнительно присутствует: (1) по меньшей мере одно растительное вещество, выбранное из группы, содержащей стерины или фитостерины, и/или станолы или фитостанолы, в сочетании с по меньшей мере одним растительным веществом, выбранным из группы, содержащей глюкоманнан, конжаковую камедь, ферментированный красный рис, бета-глюканы из овса, овсяных отрубей, ячменя, ячменных отрубей и гель алоэ древовидного в лиофилизированной форме;
(2) по меньшей мере одно растительное вещество, выбранное из группы, содержащей стерины или фитостерины, и/или станолы или фитостанолы, в сочетании с по меньшей мере одним растительным веществом, выбранным из группы, содержащей глюкоманнан, конжаковую камедь, ферментированный красный рис, бета-глюканы из овса, овсяных отрубей, ячменя, ячменных отрубей и гель алоэ древовидного в лиофилизированной форме, в сочетании с по меньшей мере одним пребиотическим волокном, выбранным из группы, содержащей FOS, GOS, XOS, инулин, волокно лиственницы или арабиногалактан.
Преимущественно, пищевая композиция, или пищевая добавка, или медицинское устройство, или фармацевтическая композиция содержат смесь бактериальных штаммов, содержащую или, альтернативно, состоящую из по меньшей мере двух бактериальных штаммов. По меньшей мере первый штамм должен обладать механизмом неспецифической адсорбции холестерина (адсорбция холестерина на поверхности клеточной стенки бактерии), тогда как по меньшей мере второй штамм должен обладать специфической BSH (гидролаза солей желчных кислот) ферментативной активностью.
Пищевая композиция, или пищевая добавка, или медицинское устройство, или фармацевтическая композиция по настоящему изобретению имеют обоснованное применение в профилактическом или терапевтическом лечении расстройств или патологий, связанных с высокими уровнями холестерина в крови, то есть уровнями холестерина, превышающими 200 мг/дл; и в лечении гиперхолестеринемии.
Вышеописанные композиции, к которым относится настоящее изобретение, имеют обоснованное применение при снижении уровня холестерина в крови, в частности ЛПНП холестерина.
В предпочтительном воплощении пищевая композиция, или пищевая добавка, или фармацевтическая композиция по настоящему изобретению дополнительно содержат по меньшей мере одно растительное вещество, выбранное из группы, содержащей или, альтернативно, состоящей из стеринов или фитостеринов, и/или станолов или фитостанолов. Количество стеринов/станолов в суточной дозе композиции должно составлять более чем 0,8 г, предпочтительно от 1 г до 3 г, например, от 1,5 до 2,0 г.
В предпочтительном воплощении, пищевая композиция, или пищевая добавка, или медицинское устройство, или фармацевтическая композиция по настоящему изобретению дополнительно содержат по меньшей мере одно растительное вещество, выбранное из группы, содержащей или, альтернативно, состоящей из глюкоманнана, конжаковой камеди, ферментированного красного риса, бета-глюканов из овса, овсяных отрубей, ячменя, ячменных отрубей и геля алоэ древовидного в лиофилизированной форме. Количество глюкоманнана/конжаковой камеди в суточной дозе композиции должно составлять более чем 4 г, предпочтительно от 5 г до 10 г, например, от 6 до 8 г.
Если используют бета-глюканы из овса, овсяных отрубей, ячменя или ячменных отрубей, необходимо обеспечить прием 3 грамм в сутки для того, чтобы способствовать поддержанию нормальных уровней холестерина в крови.
В предпочтительном воплощении пищевая композиция, или пищевая добавка, или медицинское устройство, или фармацевтическая композиция по настоящему изобретению дополнительно содержат по меньшей мере одно растительное вещество, выбранное из группы, содержащей или, альтернативно, состоящей из стеринов и станолов, в сочетании с по меньшей мере одним другим веществом растительного происхождения, выбранным из группы, содержащей или, альтернативно, состоящей из глюкоманнана и конжаковой камеди. Рекомендованные суточные дозы указаны выше.
В предпочтительном воплощении пищевая композиция, или пищевая добавка, или фармацевтическая композиция по настоящему изобретению дополнительно содержат по меньшей мере одно пребиотическое волокно, выбранное из группы, содержащей или, альтернативно, состоящей из FOS, GOS, XOS и инулина.
В предпочтительном воплощении пищевая композиция, или пищевая добавка, или фармацевтическая композиция по настоящему изобретению дополнительно содержат по меньшей мере одно растительное вещество, выбранное из группы, содержащей или, альтернативно, состоящей из стеринов и станолов, в сочетании с по меньшей мере одним пребиотическим волокном, выбранным из группы, содержащей или, альтернативно, состоящей из FOS, GOS, XOS и инулина.
В предпочтительном воплощении пищевая композиция, или пищевая добавка, или фармацевтическая композиция по настоящему изобретению дополнительно содержат по меньшей мере одно растительное вещество, выбранное из группы, содержащей или, альтернативно, состоящей из глюкоманнана и конжаковой камеди, в сочетании с по меньшей мере одним пребиотическим волокном, выбранным из группы, содержащей или, альтернативно, состоящей из FOS, GOS, XOS и инулина.
В предпочтительном воплощении пищевая композиция, или пищевая добавка, или фармацевтическая композиция по настоящему изобретению дополнительно содержат по меньшей мере одно растительное вещество, выбранное из группы, содержащей или, альтернативно, состоящей из стеринов и станолов, в сочетании с по меньшей мере одним растительным веществом, выбранным из группы, содержащей или, альтернативно, состоящей из глюкоманнана и конжаковой камеди, в сочетании с по меньшей мере одним пребиотическим волокном, выбранным из группы, содержащей или, альтернативно, состоящей из FOS, GOS, XOS, инулина.
Вышеописанные композиции имеют обоснованное применение в лечении здоровых субъектов, имеющих уровень холестерина крови, который находится в пределах нормы, но который периодически, вследствие приема некоторого количества жиров с пищей, может увеличиваться, приводя к «временной» гиперхолестеринемии. В этом случае прием этими субъектами композиции по настоящему изобретению может восстанавливать уровень холестерина в крови до нормальных пределов, поскольку имеет место снижение избыточного холестерина.
Более того, вышеописанные композиции также имеют обоснованное применение в лечении субъектов, у которых обычно уровень холестерина в крови является высоким. В этом случае прием этими субъектами композиции по настоящему изобретению может ограничить повышение уровня холестерина в крови.
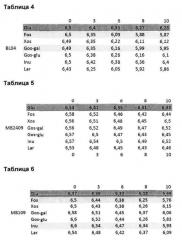
Как показано на кривых окисления, которые следуют далее, штамм BL04 предпочитает растительное вещество, такое как FOS, волокна лиственницы или арабиногалактан и GOS-Gal (галактоза), штамм MB2409 предпочитает растительное вещество, такое как FOS и GOS-Gal, и штамм MB109 предпочитает растительное вещество, такое как FOS и инулин.
Экспериментальная часть
Заявитель провел интенсивные научные исследования с целью отбора бактериальных штаммов.
Исследование in vivo
В общей сложности 32 крысы помещали в клетки. После нескольких суток адаптации к привычной пище (Т0) все крысы начинали получать одинаковое 100% гиперхолестеринемическое питание. После 15 суток такого питания (Т15) крыс случайным образом разделяли на 4 подгруппы (8 крыс на подгруппу). Крысы начинали получать дифференцированные виды обработки с Т15 по Т45. Эти виды обработки длились в течение 30 суток до умерщвления (Т45):
Группа 1: 30% гиперхолестеринемическое питание и Lactobacillus reuteri NCIMB 701359 (Kandler et al.; 1982), 1×109/сутки (эталон). Этот штамм известен своей способностью снижать уровни холестерина (эталон);
Группа 2: 30% гиперхолестеринемическое питание и смесь пробиотиков [B. lactis MB2409 DSM 23733 (0,33×109/сутки), B. breve MB113 DSM 23732 (0,33×109/сутки) и B. bifidum MB109 DSM 23731 (0,33×109/сутки)];
Группа 3: 30% гиперхолестеринемическое питание (контроль).
Суточная доза для крысы составляла 1 мл суспензии, содержащей 1×109 колониеобразующих единиц (КОЕ)/мл бактериальных штаммов, указанных выше. Дозу вводили крысам посредством желудочного зонда.
Образцы крови отбирали натощак в моменты времени Т0, Т15 и Т45. Сыворотку отделяли от полученной крови и определяли следующие параметры сыворотки: а) ЛПНП холестерин, б) ЛПВП холестерин, в) общий холестерин и г) триглицериды.
Этапы исследования
Этап I. Нормальное предварительное питание для всех крыс в течение 7 суток (Т-7).
Этап II. 100% гиперхолестеринемическое питание для всех крыс с нулевых суток (Т0) по пятнадцатые сутки (Т15).
Этап III. Дифференцированное питание, как описано выше, для 4 групп с шестнадцатых по сорок пятые сутки (Т45).
Результаты экспериментов
1) Изменение массы тела
Первым исследуемым параметром был прирост массы тела крыс для контроля надлежащего приема пищи. Данные показывают, что крысы принимали пищу надлежащим образом.
2) Влияние гиперхолестеринемического питания
Поскольку все крысы получали одинаковое питание на этом первом этапе, все они были объединены. Затем было проведено сравнение уровней ЛПНП холестерина, ЛПВП холестерина, общего холестерина и триглицеридов в крови в нулевой момент времени (Т0) и через 15 суток (Т15). Также подсчитывали соотношение ЛПВП/ЛПНП, смотри таблицу 1.
| Таблица 1 | ||
| Параметры крови | ТО | Т15 |
| ЛПНП холестерин (мг/дл) | 18,52±1,07 | 22,31±3,86° |
| ЛПВП холестерин (мг/дл) | 65,22±3,10 | 21,85±4,50* |
| ЛПВП/ЛПНП | 3,54±0,25 | 1,00±0,22* |
| Статистический анализ проводили с помощью t-критерия Стьюдента: ° p<0,01; * p<0,001. |
Данные, представленные в таблице 1, показывают, что гиперхолестеринемическое питание приводило к значительному возрастанию ЛПНП холестерина (плохой холестерин) и даже более значительному снижению ЛПВП холестерина (хороший холестерин). Соотношение ЛПВП/ЛПНП, которое в нормальном состоянии должно быть более чем 3, снижалось при гиперхолестеринемическом питании.
3) Влияние различных видов обработки (группы 1-3) на ЛПНП холестерин
1 и 2 виды обработки (группы 1 и 2) приводили к значительному снижению ЛПНП холестерина (p<0,001) по сравнению с величинами в момент времени Т15. При 3 виде обработки (группа 3), основанном только на 30% гиперхолестеринемическом питании, уровни ЛПНП не изменялись по сравнению с моментом времени Т15.
Количество холестерина снижалось посредством двух механизмов:
I) Механизм 1: неспецифическая адсорбция холестерина (на поверхности клеточной стенки бактерии),
II) Механизм 2: специфическая ферментативная активность BSH (гидролазы солей желчных кислот).
Заявитель провел скрининг среди весьма обширной группы бактерий с помощью оценки внутриклеточной активности BSH.
По сути дела, каждый бактериальный штамм культивировали в течение ночи в питательной среде MRS (deMann-Rogosa-Sharpe, среда де Манн-Рогоза-Шарпа) с цистеином, 0,05% масс./об., и затем центрифугировали, чтобы собрать клеточный осадок. Этот осадок дважды промывали 0,1 М натрий-фосфатным буфером с pH 6 для удаления внеклеточной BSH.
Клетки ресуспендировали в 1 мл натрий-фосфатного буфера с pH 6; лизировали стеклянными бусинами посредством трех 5-минутных циклов вихревого встряхивания с максимальной скоростью при 4°C и инкубировали на льду в течение 10 минут. В конце третьего цикла образец центрифугировали при 13000 об/мин в течение 5 минут, и весь продукт распада клеток и макромолекулы осаждали, чтобы можно было использовать надосадочную жидкость, которая также содержит белки.
Надосадочную жидкость подвергали анализу с целью определить количество общих белков; содержавшихся в ней.
Для этой цели использовали метод Лоури для определения общего количества белка, присутствующего в экстракте. По сути дела, один миллилитр реактива Лоури добавляют к 200 микролитрам экстракта, разбавленного соответствующим образом.
Базовые растворы:
Лоури А: Na2CO3 в 0,1 М NaOH (автоклавировать),
Лоури В: CuSO4 1% в H2O (стерилизовать фильтрацией),
Лоури С: 2% тетрагидрат тартрата Na-K в H2O (стерилизовать фильтрацией).
Реактив Лоури (на 50 мл-50 образцов): Лоури А 49 мл + Лоури В 0,5 мл + Лоури С 0,5 мл.
200 мкл разбавленного соответствующим образом образца и 1 мл реактива Лоури объединяют при комнатной температуре. Их оставляют для инкубации в течение 10 минут при комнатной температуре и затем добавляют 100 микролитров реактива Фолина-Чокальтеу, разбавленного водой 1:1. После 30 минут инкубации измеряют оптическую плотность при 500 нм. Полученные данные интерполируют вдоль линии регрессии с BSA (бычий сывороточный альбумин). Затем определяют содержание общего белка в экстракте и выражают в мг/мл.
Удельную активность BSH титруют (единицы BSH/мг общего белка), чтобы определить долю белков, присутствующих в клеточном экстракте, которые обладают ферментативной активностью BSH.
Для этой цели 20 микролитров субстрата, содержащего тауродезоксихолевую кислоту (TDCA) - TCDA образец - или гликохолевую кислоту (GCA) - GCA образец - добавляют к 20 микролитрам вышеописанного экстракта в концентрации 200 мМ. Добавляют 360 микролитров 0,1 М натрий-фосфатного буфера с pH 6. Экспериментальная контрольная проба представляет собой 20 микролитров экстракта, а 380 микролитров 0,1 М натрий-фосфатного буфера с pH 6 - слепая проба.
Образцы (TDCA образец, GCA образец и слепую пробу) инкубируют при 37°C. Это повторяют для экстракта, полученного из каждого штамма.
После 10 и 30 минут инкубации собирают 100 микролитров вышеописанных образцов и добавляют 100 микролитров ТХУ (15% трихлоруксусная кислота) для осаждения белков. За этим следует 5-минутное центрифугирование при 13000 об/мин для получения кислотной смеси, и надосадочную жидкость, которая будет содержать аминокислоты глицин и таурин, собирают.
50 микролитров кислотной смеси (для каждой полученной кислотной смеси, то есть слепой пробы, TDCA образца и GCA образца), собранной в моменты времени 10 и 30 минут, анализировали как есть и в разведенном виде в соотношении 1:5. Конкретно, образцы как есть оценивали при использовании соотношений 50 микролитров кислотной смеси и 950 микролитров нингидриновой смеси, тогда как разведение 1:5 оценивали посредством добавления 10 микролитров кислотной смеси к 40 микролитрам деминерализованной воды и добавления 950 микролитров нингидриновой смеси. Нингидриновую смесь получали следующим образом: 2 миллилитра 1% нингидрина в 0,5 М цитратном буфере с pH 5,5; 4,8 миллилитра глицерина и 0,8 миллилитра 0,5 М цитратного буфера с pH 5,5. Образцы кипятили в течение 14 минут и охлаждали в течение 3 минут в воде. Оптическую плотность каждого образца считывали при 570 нанометрах.
Количественное определение таурина и глицина требует специфической калибровочной кривой при стандартной концентрации таурина или глицина.
Определение единиц ферментативной активности BSH на мл экстракта:
- Ед/мл = микромоли высвобождаемого таурина или глицина в минуту/мл = [[Оптическая плотность при 570 нм неизвестного образца - оптическая плотность при 570 нм слепой пробы]/10 минут]⋅1/[(1,25×1000)⋅(коэффициент разведения 1 или 5)]
Единицы BSH (Ед)/мл экстракта преобразовывают в единицы BSH (Ед)/мг общих белков на основании концентрации общего белка, определенной методом Лоури.
В конце этого скрининга, проводимого среди всех штаммов (посредством определения удельной активности BSH (Лоури и нингидрин)), проводили дополнительный анализ, заключающийся в определении биоконверсии GCA целыми клетками, поскольку это является «внеклеточной активностью».
По сути дела, в течение ночи проводили получение бульонной культуры в среде MRS с цистеином, 0,05% масс./об., и затем измеряли оптическую плотность (ОП) при 600 нанометрах для стандартизации клеточной концентрации.
Готовят слепую пробу, содержащую MRS с 0,05% цистеина. Добавляют 20 микролитров 200 мМ раствора гликохолевой кислоты (GCA) к 1 мл каждого образца; далее следует инкубация при 37°C в течение 20 минут. Затем отбирают 100 микролитров и добавляют 100 микролитров 15% трихлоруксусной кислоты для остановки реакции. Затем образцы центрифугируют при 12000 об/мин в течение 5 минут для того, чтобы отделить целые клетки и белки; их разбавляют в 25 раз деминерализованной водой и вводят в систему ВЭЖХ-МС для вычисления % превращения по сравнению со слепой пробой.
Рабочие условия ВЭЖХ (высокоэффективной жидкостной хроматографии):
Колонка: Zorbax Eclipse,
Скорость потока: 0,2 мл/мин,
Объем вводимой пробы: 1 мкл,
λ=200 нм,
Растворитель: A=dd H2O (бидистиллированная вода); B=ACN (ацетонитрил),
Градиент: В% Т(мин); 10%, 5 мин; 100%, 30 мин; 100%, 50 мин; 10%, 55 мин.
Время удержания: GCA (MM (молекулярная масса) = 464):33,04 мин; СА (холевая кислота) (ММ=407):35,41 мин.
Рабочие условия МС (масс-спектроскопии):
Полярность: отрицательная,
Время накопления: 300,
Напряжение на капилляре: 3500 В,
Давление на распылителе: 30 ф/кв дюйм (0,2068 МПа),
Скорость осушающего газа: 8,0 л/мин,
Температура осушающего газа: 325°C,
Т(мин): 0-30, 30-40, 40-55.
Проводят вычисление % превращения, то есть сколько присутствует СА и GCA, для того чтобы определить наличие внеклеточной BSH.
Таким образом; проводили отбор среди 32 исходных штаммов, оценивая величину активности внутриклеточной BSH (метод Лоури и нингидриновый анализ) и биоконверсию GCA в СА - внеклеточной BSH (хроматография ВЭЖХ с МС), смотри таблицу 2.
| Таблица 2 | |||||
| Бактерия | % биоконверсии (внеклеточная активность BSH) | % средней биоконверсии GCA | Средняя внутриклеточная активность BSH в отношении GCA | Стандартное отклонение | |
| L. reuteri NCIMB 701359 | 98 | 82,7 | 90,4 | 1,12 | 0,13 |
| B. lactis DSM 24690 | 100 | 100 | 100 | 0,59 | 0,15 |
| B. lactis DSM 23733 | 79,8 | 63,9 | 71,9 | 0,77 | 0,20 |
| B. bifidum DSM 23731 | 64,2 | 71,2 | 67,7 | 0,10 | 0,03 |
| B. breve DSM 23732 | 14,7 | 14,7 | 14,7 | 1,18 | 0,29 |
| B. infantis DSM 24687 | 6,6 | 6,9 | 6,8 | 0,67 | 0,06 |
| B. Bifidum DSM 24688 | - | - | - | 0,15 | 0,07 |
Затем штаммы подвергали анализу для определения их способности снижать уровень холестерина посредством адсорбции.
Способность адсорбировать холестерин оценивали посредством культивирования штаммов в среде MRS с цистеином, в которую добавляли 100 миллиграмм/литр холестерина. Культуры инкубировали при 37°C в течение 48 часов. Через 24 и 48 часов после начала инкубации отбирали образцы и анализировали оставшийся в надосадочной жидкости холестерин посредством ВЭЖХ. Определяли количество холестерина, адсорбированного на клетках, и сравнивали с неинокулированным контролем (среда MRS плюс цистеин плюс 100 мг/л холестерина). % адсорбированного холестерина также рассматривали относительно оптической плотности культуры (% адсорбированного холестерина/ОП), так как это соотношение выражает способность клетки адсорбировать холестерин на своей мембране. Концентрации холестерина неизвестных образцов определяли посредством калибровочной кривой с известными концентрациями холестерина (от 0,00 мг/л до 100 мг/л).
ВЭЖХ способ
Колонка: Zorbax Eclipse XBD-C18 Rapid Resolution HT 4,6×50 мм, 1,8 мкм,
Подвижная фаза: ACN,
Световой поток ДМД (диодно-матричного детектора): 200 нм,
Rt (время удержания) холестерина: 4,0 мин.
Условия культивирования
Среда
Глюкоза: 20 г/л,
протеозопептон Bacto №3: 10 г/л,
Мясной экстракт Bacto: 10 г/л,
Дрожжевой экстракт Bacto: 5 г/л,
Ацетат натрия: 5 г/л,
K2HPO3: 2 г/л,
Цитрат аммония: 2 г/л,
MgSO4: 0,1 г/л,
MnSO4: 0,05 г/л,
Цистеин: 0,5 г/л,
Смесь твин-80 - холестерин
Автоклавировать при 110°C в течение 30 минут.
Условия роста
Внесение 10% посевного материала, полученного из ночной культуры,
T=37°C,
Анаэробные условия в газовой среде,
Начальный холестерин 0,08 г/л,
Время составляет 18 часов.
Величины адсорбции холестерина показаны в таблице 3.
| Таблица 3 | |||||||
| ОП | % адсорбции | % адсорбции/ОП | |||||
| Бактерия | 1 | 2 | 1 | 2 | 1 | 2 | Среднее |
| L. reuteri NCIMB 701359 | 6,5 | 5,5 | 19,1 | 18,5 | 2,9 | 3,4 | 3,1 |
| S. bifidum DSM 24688 | 1,6 | 1,5 | 55,9 | 43,5 | 34,4 | 29,9 | 32,2 |
| B. bifidum DSM 23731 | 2,3 | 3,4 | 49,4 | 46,9 | 21,1 | 14,0 | 20,1 |
| B. lactis DSM 23733 | 2,7 | 2,2 | 18,6 | 17,7 | 6,8 | 8,2 | 7,5 |
| B. breve DSM 23732 | 1,0 | 1,3 | 6,9 | 8,9 | 7,3 | 6,6 | 7,0 |
| B. infantis DSM 24687 | 10,4 | 9,8 | 32,9 | 28,1 | 3,2 | 2,9 | 3,0 |
| B. lactis DSM 24690 | 2,1 | 2,2 | 18,4 | 13,0 | 8,8 | 6,0 | 7,4 |
Штамм B. bifidum BB06 (MB107) DSM 24688 и штамм B. bifidum MB109 DSM 23731 демонстрируют высокую способность а