Система консервирования напитков, основанная на использовании пимарицина и газа в свободном пространстве над продуктом
Иллюстрации
Показать всеИзобретение относится к системе консервирования напитков и питьевым продуктам, содержащим такие системы консервирования. Питьевой продукт в герметичном контейнере содержит напиток с рН от 2,4 до 5,6, пирамицин в количестве от 0,1 до 6 ppm, циклодекстрин и газ в свободном пространстве над продуктом, инертный для ингредиентов в напитке. При этом давление газа составляет по меньшей мере 2 абсолютных атмосферы, а пирамицин и циклодекстрин используют в комплексе при соотношении по меньшей мере 1:1. Способ предусматривает добавление в контейнер напитка, имеющего рН от 2,4 до 5,6 и содержащего циклодекстрин и пирамицин, и газа в свободное пространство над продуктом, инертного для ингредиентов, и герметизацию. При этом кислород присутствует в напитке в количестве менее 8300 ppb. Изобретение позволяет улучшить органолептические показатели и стабильность получаемого напитка. 2 н. и 12 з.п. ф-лы, 1 табл., 6 ил., 5 пр.
Реферат
По данной заявке испрашивается приоритет заявки № 61/758988, поданной 31 января 2013 г., полное содержание которой включено в настоящий документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к системам консервирования напитков и питьевым продуктам, содержащим такие системы консервирования. В частности, данное изобретение относится к системам консервирования напитков, включающим препараты, подходящие для удовлетворения потребительского спроса на здоровые и экологически безвредные ингредиенты.
УРОВЕНЬ ТЕХНИКИ
Многие пищевые продукты и напитки содержат химические консерванты для продления срока годности продукта за счет ингибирования роста вызывающих порчу микроорганизмов (например, плесени, дрожжей, бактерий). Однако некоторые консерванты, используемые в настоящее время, как установлено, либо наносят ущерб здоровью и несут угрозу для окружающей среды, либо недостаточно стабильны. Таким образом, на рынке существует спрос на пищевые продукты и напитки, которые не содержат эти вредные консерванты и при этом имеют продолжительный срок годности.
Например, бензойную кислоту и ее соли широко используют в пищевых продуктах в качестве консервантов. Однако в некоторых напитках, содержащих витамин C и имеющих относительно высокое значение pH, небольшая часть бензойной кислоты и ее солей имеет тенденцию превращаться в бензол (количество часть на миллиард, (ppb)). Тепло и свет с определенными длинами волн увеличивают скорость этой реакции, так что необходимо принимать дополнительные меры предосторожности при производстве и хранении таких питьевых продуктов, в которых ингредиентами являются как бензоат, так и аскорбиновая кислота. Потребление бензола в питьевой воде также является проблемой общественного здравоохранения.
Этилендиаминтетрауксусная кислота (ЭДТА) и ее соли также являются обычными консервантами в питьевых продуктах. ЭДТА связывает ионы металлов и может влиять на их участие в разных химических реакциях. При повышенных концентрациях ЭДТА может служить для очистки сточных вод. ЭДТА стала серьезной экологической проблемой из-за ее устойчивости и сильных хелатообразующих свойств с металлами.
Полифосфаты представляют собой другой тип комплексообразователей, используемых в питьевых продуктах в качестве консервантов. Однако полифосфаты нестабильны в водном растворе и быстро распадаются при температуре окружающей среды. Распад полифосфатов приводит к органолептическим проблемам при употреблении питьевого продукта, например, вследствие изменения кислотности. Кроме того, срок хранения питьевых продуктов может не соблюдаться, поскольку концентрация полифосфатов снижается.
Необходимы новые системы консервирования для использования в напитках в качестве замены для систем консервирования, которые оказывают вредное воздействие на здоровье и/или окружающую среду, или недостаточно стабильны. Такие системы должны иметь улучшенные органолептические показатели. В публикации заявки США 2010/0323065 предложена система консервирования напитков, включающая комплекс пимарицин-циклодекстрин, для использования в напитках.
Целью настоящего изобретения является улучшение показателей стабильности и органолептических характеристик пимарицина и комплексов пимарицин-циклодекстрин, в частности, в кислых напитках. Другой целью является повышение эффективности пимарицина в низких концентрациях для предоставления потребителям доступных вариантов выбора.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Один из аспектов изобретения относится к питьевому продукту в герметичном контейнере. В частности, напиток содержит пимарицин в количестве от 0,1 до 1 ppm (часть на миллион) и циклодекстрин, а также газ в свободном пространстве над продуктом, инертный для ингредиентов в напитке, при этом давление газа в свободном пространстве над продуктом составляет по меньшей мере примерно 2 абсолютные атмосферы. Напиток имеет pH от 2,4 до 5,6 и количество кислорода, присутствующего в газе в свободном пространстве над продуктом, составляет менее 8300 микрограмм («мкг»).
Способ изготовления напитка в герметичном контейнере. Напиток, содержащий пимарицин в количестве от 0,1 до 1 ppm и циклодекстрин, добавляют в контейнер, при этом напиток имеет pH от 2,4 до 5,6. К напитку добавляют достаточное количество газа в свободное пространство над продуктом, инертного для ингредиентов, для создания давления по меньшей мере 2 абсолютные атмосферы, при этом количество кислорода, присутствующего в газе в свободном пространстве над продуктом, составляет менее 8300 мкг, и герметизируют контейнер.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1 демонстрирует рост вызывающих порчу микроорганизмов при низкой концентрации O2.
Фигура 2 демонстрирует кинетику распада пимарицина в суррогатных напитках в отсутствие β-циклодекстрина.
Фигура 3 демонстрирует убыль пимарицина с течением времени в зависимости от содержания O2 (ppb) и наличия или отсутствия комплекса (смоделированного) при стандартной процедуре анализа (STP).
Фигура 4 демонстрирует кинетику распада пимарицина и начало порчи продукта.
Фигура 5 демонстрирует распад пимарицина в присутствии равного количества β-циклодекстрина, когда напиток подвергают давлению 3,7 объемов CO2.
Фигура 6 демонстрирует, что при наличии давления от CO2 пимарицин в очень низкой концентрации (0,8 промилле) в присутствии равного количества циклодекстрина обеспечивает защиту от порчи, вызываемой дрожжами Zygosaccharomyces и Brettanomyces.
ПОДРОБНОЕ ОПИСАНИЕ
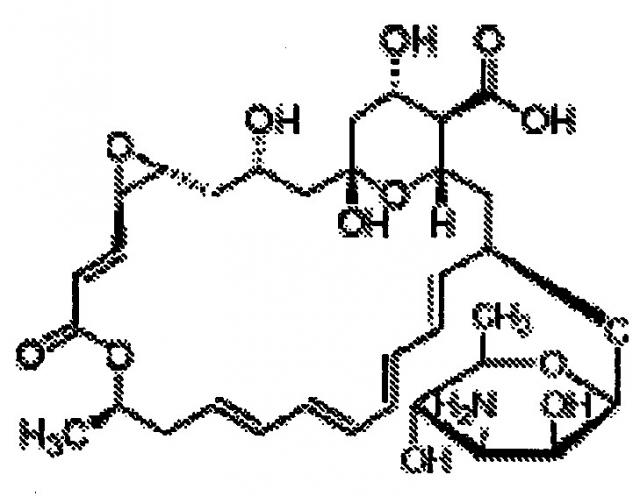
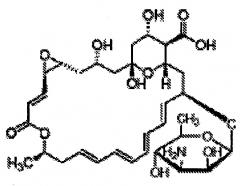
Настоящее изобретение относится к способу стабилизации пищевого противогрибкового средства, пимарицина, против разрушающего действия кислорода таким образом, что это не снижает активность пимарицина в отношении грибков, которые обычно вызывают порчу напитков с высокой кислотностью. Согласно изобретению не требуется исключение кислорода из напитков. Фактически, содержание кислорода в газированных напитках, как правило, является довольно высоким, составляя примерно половину от содержания кислорода в негазированных напитках. Удивительно, но количество пимарицина, необходимое для сохранения продукта, составляет всего 0,5 ppm(50 ppb), что по меньшей мере на порядок меньше, чем сообщается в литературе или раскрыто в различных патентах.
Настоящее изобретение основано на взаимодействии между газами, отличными от кислорода, давлении, оказываемом газами, отличными от кислорода, и комплексе циклодекстрина с пимарицином. Без привязки к какой-либо теории, изобретение может отражать тот факт, что давление вызывает размещение пимарицина в ядре молекулы циклодекстрина таким образом, что обычно реакционно-способные химические связи между атомами в пимарицине становятся недоступными для кислорода. Как показано в различных исследованиях, изобретение не зависит от уменьшения концентрации кислорода в напитке. Фактически, полученные данные свидетельствуют о том, что общая стабильность пимарицина в водной суспензии в виде комплекса с циклодекстрином лишь слегка улучшена по сравнению с одним только пимарицином на протяжении 16-недельного срока хранения. Даже в отсутствие зависимости от уменьшения содержания или удаления кислорода из жидкости, настоящее изобретение все же будет иметь преимущества в случае любого уменьшения содержания кислорода в напитке, которое удастся достигнуть.
Настоящее изобретение может быть понято в контексте физической химии, которая объясняет взаимодействие жидкостей и газов в контакте с жидкостью. Вода или любой водный напиток с водной фазой (>95% воды), поверхность которого соприкасается с атмосферой, будет содержать некоторое количество газов, присутствующих в атмосфере. Воздух состоит на 78,08% из азота (N2), содержит 20,95% кислорода (O2), 0,93% аргона и меньшие количества CO2, гелия, криптона и водорода. N2 и O2 в совокупности составляют 99,04% от общего содержания газов в воздухе. Количество газа каждого типа, который поступает в раствор, легко определять, используя закон Генри и зная величину, известную как константа Генри (KH). Закон Генри гласит, что при постоянной температуре количество газа, растворенного в жидкости определенного типа и объема, прямо пропорционально парциальному давлению этого газа в равновесии с жидкостью. Это соотношение может быть выражено математически следующим образом:
Из данного уравнения следует, что концентрация газового компонента X в водной фазе равна произведению константы Генри для газа на парциальное давление этого газа в равновесии с жидкостью. Величина px представляет собой давление, оказываемое рассматриваемой молекулой в виде газа. При давлении в одну атмосферу парциальное давление N2 составляет 0,78 и для O2 оно составляет 0,2095. Константы Генри известны и легко доступны из различных литературных источников. Форма, в которой константа может быть выражена, варьируется. При выражении ее в размерности [моль газа/л*атм) значение KH для N2 составляет 6,48×10-4 и для O2 оно составляет 1,28×10-3 в воде при 25°C. Значения будут немного меняться в зависимости от pH, наличия растворенного вещества и температуры. При одном и том же давлении значения KH указывают на то, что азот будет хуже растворим в воде в расчете моль на моль. Разница в молекулярных массах для O2 и N2 (31,9988 против 28,0134, соответственно) подчеркивает различие, когда величину, выраженную в молях на литр, переводят в размерность граммов на литр. Концентрацию газов в жидкости можно выражать по-разному. В настоящем документе используют размерность количество частей на миллиард (ppb) (микрограмм⋅л-1, мкг⋅л-1, ppb).
Небольшое количество паров воды будет занимать газовую фазу, которая находится в контакте с жидкой водой. Если газовая фаза представляет собой воздух при температуре 25°C, парциальное давление для N2 и O2 составляет, соответственно, 0,7566 и 0,203 атмосферы. Используя соответствующие значения для константы Генри, можно установить, что концентрация N2 в воде составляет 1,372,84 ppb и концентрация O2 в воде составляет 8,320 ppb. Вычисленные значения можно подтверждать аналитическими методами.
В зависимости от высоты над уровнем моря и погодных условий атмосфера создает давление примерно в 1 атмосферу, что соответствует 14,7 фунтов на квадратный дюйм (psi). Если жидкость, такую как напиток, не подвергали обработке для удаления газа (деаэрации) или не вводили в нее газ под давлением, содержание газа в напитке при герметизации в контейнере не будет отличаться от того, которое имеет место в случае, если жидкость оставлять открытой на воздухе. Жидкость будет содержать количество газа O2, аналогичное тому, которое рассчитано выше, примерно 8300 ppb.
Кроме того, поскольку контейнер закрывается крышкой, как правило, его нельзя заполнять до краев. Пространство, не занимаемое жидкостью, будет занято некоторым количеством газа. Как правило, объем, не занятый жидкостью, называют «свободным пространством над продуктом». Если свободное пространство над продуктом не продувать или не заменять газом, отличным от воздуха, атмосфера в свободном пространстве над продуктом будет представлять собой воздух. Если жидкость при 25°C находится в равновесии с воздухом в момент ее заполнения и герметизации в контейнере, воздух в области свободного пространства над продуктом в контейнере не будет создавать манометрическое давление выше нуля. Давление газа внутри контейнера (абсолютное) является таким же, как давление с внешней стороны контейнера, а манометры, как правило, показывают значения (манометрическое давление) только тогда, когда давление превышает абсолютное давление.
Как известно, водные напитки могут быть «газированными». Газирование представляет собой процесс растворения диоксида углерода в воде. Количество диоксида углерода, которое может поступать в раствор, определяется законом Генри таким же образом, как и в случае газов, содержащихся в воздухе. Константа Генри для CO2 составляет примерно 3,4×10-2 (моль/л*атм). При одном и том же парциальном давлении CO2 растворяется в 26 раз лучше, чем O2. При использовании специально сконструированных сосудов можно создавать для воды атмосферу практически чистого, находящегося под давлением CO2, так что в воде растворяется заранее определенный объем CO2. В научной литературе принято выражать поглощение газа жидкостью в размерности миллилитров газа на литр жидкости. Литр воды при 15,5°C (60°F), которая находится в непосредственном контакте с газовой фазой, представляющей собой 1 атмосферу CO2, будет поглощать ровно 1 миллилитр CO2. Поскольку CO2 имеет плотность 1,96 г/мл при 15,5°C, также верно то, что при 15,5°C 1 атмосфера CO2 в непосредственном контакте с водой приведет к концентрации CO2 1,96 г на литр. Поскольку давление газа составляет 1 атм, такая жидкость, заключенная в герметичный контейнер, будет иметь манометрическое давлением в 0 psi (абсолютное давление 1 атмосфера).
Основополагающие уравнения состояния газа определяют, что, если объемы жидкости и газа и температура остаются неизменными, удвоение количества газа в газовой фазе приведет к удвоению давления газа. Литр воды при 15,5°C (60°F), которая находится в контакте с CO2, присутствующим при давлении 2 атмосферы (манометрическое давление 14,7 psi), будет поглощать 2 объема CO2 или 2*1,96 грамм CO2. Именно с помощью такого процесса получают газированные напитки. Типичные объемы CO2 в напитках находятся в диапазоне от 2 до 4,5 объемов CO2. Как правило, добавление к продукту диоксида углерода (CO2) (газирование) осуществляют, подвергая поток напитка воздействию находящегося под давлением газообразного CO2 в сосуде высокого давления.
Газирование не преследует цель удаления других газов из воды. Для удаления измеримых количеств кислорода из воды воду необходимо подвергать процессу, известному как деаэрация. Воду, используемую в изготовлении напитка, можно подвергать или не подвергать деаэрации. Более того, степень или мера деаэрации варьируется в зависимости от категории продукта. Производители пива, как правило, используют интенсивный процесс деаэрации так, что содержание кислорода в упакованном пиве составляет менее 0,2 ppm (200 ppb). Производители газированных напитков используют менее интенсивные процессы деаэрации. Как правило, ингредиенты или готовые напитки не подвергают деаэрации какого-либо типа, чтобы избежать удаления летучих ароматических добавок. При заливке газированного напитка в контейнер небольшое количество CO2 выходит из напитка и поступает в область свободного пространства над продуктом. Вследствие этого, некоторое, но не все, количество воздуха, который занимал свободное пространство над продуктом, вытесняется. Данные исследования продукта с прилавков магазинов показывают, что содержание кислорода в разлитом в герметичную тару газированном напитке может находиться в диапазоне от 500 до >4500 ppb, и в среднем очень близко к 1200 ppb. Продукты, упакованные в стеклянную тару, как правило, имеют более высокие концентрации O2, в пределах 750-4500 ppb, о чем свидетельствуют данные исследования продуктов от различных производственных компаний и из разных районов производства. Продукт в ПЭТ контейнерах изначально содержит O2 в концентрации примерно 1000-1500 ppb. Через некоторое время концентрация возрастает до 2500-3000 ppb. Это отражает тот факт, что ПЭТ является проницаемым для O2 и что в течение определенного периода времени сохраняется тенденция к возрастанию концентрации O2 в контейнере для достижения равновесия с атмосферой (примерно 8300 ppb). Начальная концентрация O2 в газированных напитках отражает ряд явлений. Как отмечалось ранее, воду, используемую для производства, обычно подвергают деаэрации. Воду, как правило, смешивают в различных соотношениях с концентратами. Как правило, концентраты не подвергают деаэрации, и они содержат измеримые количества кислорода. Кроме того, сразу после заливки в контейнеры определенное количество CO2 в свободном пространстве над продуктом заменяет некоторое количество воздуха.
Тот факт, что газированные напитки содержат измеримое количество кислорода, связан с двумя важными соображениями, касающимися устойчивости к порче, вызываемой различными микроорганизмами. Во-первых, некоторое количество кислорода доступно для микроорганизмов и избавляет микроорганизмы от использования менее эффективных метаболических путей выработки энергии, таких как брожение или анаэробное дыхание. Энергия, выработанная в метаболических путях, используется при сборке сложных молекул, необходимых для роста и размножения. Литературные данные свидетельствуют, что способность вызывать порчу продуктов у тех микроорганизмов, которые могут портить газированные напитки, не ограничивается из-за ограниченного содержания O2. Это верно по крайней мере тогда, когда начальные концентрации кислорода превышают 200 ppb. Данные, полученные в настоящем исследовании, подтверждают это (пример предшествующего уровня 1, фигура 1). Как указано ранее, большинство газированных продуктов, включая пиво, имеют начальную концентрацию O2, превышающую 1000 ppb. Во-вторых, количество кислорода, превышающее 1000 ppb, составляет относительно большую долю от количества кислорода, который присутствовал бы в необработанной воде (8350 ppb), соприкасающейся с воздухом.
В дополнение к подпитывающей функции O2 с точки зрения роста вызывающих порчу микроорганизмов, также верно то, что O2 может вызывать распад соединений через механизмы, которые не требуют расхода кислорода в реакции. Такие реакции являются следствием образования активных форм кислорода (ROS), при этом кислород служит лишь в качестве промежуточного соединения при переносе электронов в реакциях окислительно-восстановительного типа, которые в конечном счете приводят к распаду более сложных молекул, таких как пимарицин. В этом отношении, O2 действует как катализатор. Как и во многих реакциях с участием катализатора, количество кислорода, необходимое для протекания таких реакций, очень мало. В связи с этим, представляет интерес оценка стабильности пимарицина в растворе при различных условиях давления кислорода. Очевидно, что также представляет интерес установление того, способствует ли образование комплекса между пимарицином и β-циклодекстрином устойчивости пимарицина к распаду в результате реакции с кислородом. В предпосылочном примере 2, на фигуре 2, показано, как можно определять степень распада пимарицина в растворе. Вкратце, пимарицин имеет очень характерный спектр в УФ-видимой области с 3 отдельными максимумами поглощения. По мере распада пимарицина высота пиков уменьшается. Распад можно отслеживать по уменьшению высоты какого-либо одного пика максимума или по изменениям относительной высоты пиков.
При наличии метода мониторинга изменений концентрации пимарицина можно определять, распадается ли пимарицин по-разному в зависимости от таких переменных, как начальное давление кислорода в растворе. В примере предшествующего уровня 3, на фигуре 3, приведены результаты изучения распада пимарицина в течение периода времени в несколько месяцев в зависимости от начального давления кислорода и наличия или отсутствия комплекса между пимарицином и β(бета)-циклодекстрином. Судя по всему, пимарицин довольно быстро распадается, если он не входит в комплекс и если находится в воде, содержащей кислород в концентрации, превышающей 8500 ppb. Снижение концентрации кислорода до 3500 ppb заметно не влияет на скорость распада. Когда пимарицин находится в комплексе с β(бета)-циклодекстрином в присутствии 8500 ppb O2, распад замедляется, но не предотвращается.
Известно, что пимарицин (натамицин) является противогрибковым средством, в значительной степени подверженным окислению. Распад пимарицина приводит к утрате противогрибковой активности. Было бы неверным предположение, что добавление пимарицина к суспензии микроорганизмов приводит к мгновенной ликвидации всех жизнеспособных микроорганизмов. В равной степени неверно считать, что все микроорганизмы уничтожаются или прекращают размножаться после воздействия пимарицина в течение нескольких часов или даже дней. Следует отметить, что измеряемые величины, такие как минимальная ингибирующая концентрация (MIC) или минимальная летальная концентрация (MLC), могут некоторым образом вводить в заблуждение. Технически, MLC представляет собой минимальную концентрацию, которая приводит к гибели некоторых, но не обязательно всех, микроорганизмов в популяции или образце. Аналогично, MIC представляет собой концентрацию вещества, которая служит для снижения скорости роста большинства, но не всех микроорганизмов в популяции. Через некоторое время микроорганизмы, которые являются более устойчивыми, чем средние микроорганизмы в популяции, могут продолжать расти с почти обычной скоростью. Важно отметить, что, если начальная концентрация противогрибкового средства была фактически ингибирующей для всей популяции, возможно, что распад противогрибкового средства вызовет падение эффективной концентрации, так что подгруппа микроорганизмов может возобновлять рост.
Фактически, именно этот результат был получен, когда микроорганизмы, способные вызывать порчу газированных напитков, присутствовали в напитке с различными начальными концентрациями пимарицина. В примере 2, таблице 1, приведены данные, свидетельствующие о том, что через несколько недель после начала исследования, в котором вызывающие порчу дрожжи были инокулированы в газированный напиток, содержащий пимарицин, начиналась порча продукта.
Начало порчи с течением времени зависит от начальной концентрации пимарицина. Данные таблицы подчеркивают относительно медленное начало развития порчи в течение относительно длительного периода времени, что, однако, также является неприемлемым с точки зрения ожидаемого срока годности. Важно отметить, что только те образцы, которые содержали 25 ppm пимарицина, не подвергались порче в течение срока годности.
В отсутствие аналитических данных о стабильности пимарицина в растворе данные о стабильности продукта с течением времени могут быть интерпретированы двояко. Либо распад пимарицина не происходит, и продукт портится из-за усиленного роста тех немногих микроорганизмов, которые были устойчивы к тому количеству пимарицина, которое присутствовало в продукте, либо порча происходит вследствие выживания и последующего усиленного роста микроорганизмов из-за распада пимарицина до концентрации ниже критической. Сильный аргумент в пользу последнего варианта приведен в примере предшествующего уровня 4, на фигуре 4. В нем распад пимарицина отслеживали от начальной концентрации 13 и 25 ppm параллельно с ранее установленной частотой порчи в образцах, которые изначально содержали 13 и 25 ppm. Следует напомнить, что среди оцениваемых образцов продукт, содержащий 25 ppm пимарицина, не подвергался порче и образцы, содержащие пимарицин в концентрации 13 ppm, в 33% случаев подвергались порче, но только через 80 дней инкубации. Совмещение времени начала порчи с графиком распада пимарицина в концентрации 13 ppm указывает на то, что порча возникает, когда концентрация пимарицина падает ниже 1,5-2 ppm. Не удивительно, что концентрация пимарицина в образцах, которые изначально содержали 25 ppm, не падала ниже диапазона 1,5-2 ppm во время ожидаемого срока хранения и, таким образом, порча не возникала. Следует отметить, что тест проводили в газированном напитке, содержащем 3,6 объемов CO2. Продукт содержал свыше 2000 ppb O2.
Данные результаты важны по двум причинам. Во-первых, если бы можно было поддерживать концентрацию пимарицина на уровне 2-3 ppm, то продукт можно было бы уберечь от порчи дрожжевыми микроорганизмами, вызывающими порчу газированных напитков, в течение периода времени, равного требуемому сроку годности продукта. Эти результаты просто удивительны и, в целом, являются неожиданными для специалистов в данной области. Как правило, известные значения MIC для разновидностей дрожжей, которые могут вызывать порчу газированных напитков, находятся в диапазоне по меньшей мере ≥10 ppm. Другим важным моментом является то, что любая возможность сохранения продукта при помощи пимарицина, судя по всему, предполагает исходное добавление вплоть до 25 ppm пимарицина. Это является проблематичным, поскольку добавление 25 ppm пимарицина является, в целом, нерентабельным и, что еще более важно, это количество выходит за пределы того, что разрешено регулирующими органами. Регулирующие органы часто накладывают ограничение на общее количество вещества, которое можно употреблять из всего количества продуктов, в которые добавлено вещество. Для пимарицина допустимая суточная доза (ДСД) (ADI) составляет порядка 0,3 мг на кг массы тела. Очень большая доля ДСД для пимарицина приходится на потребляемые мясные и сырные продукты. Поскольку регулирующие органы оценивают ДСД на основании начальной концентрации ингредиента, то не существует резерва на случай распада пимарицина с течением времени. Считается, что предельное содержание пимарицина в напитке не должно превышать 10 ppm и может составлять всего 5 ppm.
Учитывая все вышесказанное, нельзя использовать пимарицин в качестве консерванта в напитке, если только его начальная концентрация не будет менее 6 ppm и не будет сохраняться на протяжении периода времени, эквивалентного сроку годности (120 дней), на уровне по меньшей мере 2 ppm. Полученные результаты свидетельствуют, что пимарицин недостаточно стабилен в газированных напитках, несмотря на заметно сниженное содержание O2 по сравнению с негазированными жидкостями на водной основе. Кроме того, пимарицин, находящийся в комплексе с β-циклодекстрином, незначительно защищен от распада. Пимарицин в комплексе с β-циклодекстрином распадается со скоростью примерно 60% от скорости, с которой распадается пимарицин в отсутствие β-циклодекстрина. Хотя налицо определенное улучшение, начальная концентрация пимарицина в напитке все еще должна составлять 17-20 ppm для гарантии стабильности продукта.
Таким образом, было неожиданным и удивительным установление того факта, что пимарицин в комплексе с β-циклодекстрином остается в значительной степени стабильным, когда присутствует в растворе, находящемся под давлением газа, отличного от кислорода, в свободном пространстве над продуктом. В равной степени удивительно и неожиданно, что продукт может сохраняться при начальной концентрации пимарицина всего лишь 0,1-5 ppm. Особенно неожиданно было обнаружить, что продукт может сохраняться при концентрации пимарицина, составляющей 0,5-1 ppm, поскольку известно только одно другое вещество, которое является измеримо биостатическим при таких концентрациях (низин). Можно лишь предполагать, каким образом давление может способствовать эффективности. Точно так же, неясно, каким образом давление газа в свободном пространстве над продуктом может действовать в совокупности с β-циклодекстрином таким образом, что изменяет скорость распада пимарицина. Без привязки к какой-либо теории, возможно, что давление приводит к расположению части пимарицина, связанного ядром циклодекстрина, в таком положении, которое делает одну или более двойных связей менее доступными, чем в отсутствие градиента давления.
В случае раствора, подвергающегося давлению, производимому 3,7 объемами CO2 (32 psi при 60°F), картина распада пимарицина в комплексе с β-циклодекстрином сильно отличается от картины распада пимарицина без β-циклодекстрина. В первую очередь, относительная высота пика максимума сохраняется в течение долгого времени. Во-вторых, скорость распада, судя по всему, является двухрежимной (пример предшествующего уровня 5, фигура 5). В целом, химическая структура пимарицина, как правило, сохраняется в течение времени тестирования, и вполне вероятно, что это является очень важным фактором, благодаря которому пимарицин способен демонстрировать величину MIC, соответствующую невероятно низкой концентрации 0,8 ppm. Двухрежимная картина распада вероятно отражает тот факт, что пимарицин в отсутствие β-циклодекстрина распадается с иной скоростью, чем пимарицин, связанный с β-циклодекстрином. Фактически, при концентрациях ниже 20 ppm очень небольшое количество пимарицина будет связано с β-циклодекстрином. Похоже, что давление от газа в свободном пространстве над продуктом действительно может индуцировать образование комплекса (по оценкам, может быть связано до 37% пимарицина).
Вкратце, считается, что существует сильная корреляция между степенью окисления пимарицина и потерей им противогрибковой активности. Пимарицин может быть защищен от окисления путем двухэтапного процесса. Благодаря двухстадийному процессу биологическая активность пимарицина не только сохраняется, но, может быть даже усилена.
На первой стадии процесса пимарицин образует комплекс с β-циклодекстрином. Полученный комплекс относится к типу, известному как комплекс включения; один компонент (хозяин) образует полость, в которую вторая молекула (гость) может встраиваться без ковалентного присоединения. За счет образования комплекса пимарицин может присутствовать в водных растворах в концентрации, превышающей 400 промилле. Это особенность важна при формулировании продукта для подготовки к розливу. Как правило, ингредиенты при подготовке к формулированию смеси должны присутствовать в концентрации, которая по меньшей мере в 5 раз превышает концентрацию в конечном продукте. Именно поэтому ингредиенты готовят в виде концентрата и затем смешивают с водой таким образом, что происходит разбавление концентрата в 4 или 5 раз.
Разбавление, в результате которого концентрация пимарицина становится менее 20 ppm, является причиной того, что весь пимарицин не связан с β-циклодекстрином. Тем не менее имеющиеся на сегодняшний день данные свидетельствуют, что в случае раствора, содержащего пимарицин в концентрации ≤25 промилле, пимарицин будет вынужденно возвращаться в комплекс с β-циклодекстрином. Количество пимарицина в комплексе в несколько раз меньше, чем оно имеет место в комплексе, когда концентрация пимарицина превышает 25 ppm. Однако пимарицин, связанный с циклодекстрином, ощутимо защищен от распада. Кислород обычно присутствует в напитке в концентрации по меньшей мере 2500 ppb и вплоть до 5500 ppb. Распад имеет место, но в меньшей степени по сравнению с тем, что происходит в отсутствие β-циклодекстрина.
Очень важно понимать природу связи между пимарицином и β-циклодекстрином. Действие β-циклодекстрина заключается не в «растворении» пимарицина. Скорее, β-циклодекстрин служит в качестве молекулы-хозяина для пимарицина, гостевой молекулы. Полученный комплекс относится к типу, известному как комплекс включения; один компонент (хозяин) образует полость, в которую вторая молекула (гость) может встраиваться без ковалентного присоединения. Полученный комплекс относится к типу, известному как комплекс включения. Гостевая молекула предпочтительно располагается в пространстве, предоставленном хозяином, за счет ван-дер-ваальсовых взаимодействий. В отличие от образований, известных как клатраты, гостевая молекула не полностью заключена в оболочку, а располагается в отверстии кольца. В биохимическом смысле термина меньшую по размеру гостевую молекулу также можно называть «лигандом». Как правило, образование включения происходит только в том случае, когда концентрация гостевой молекулы превышает нормальный предел растворимости. В случае пимарицина нормальный предел растворимости находится в диапазоне 20-25 ppm в напитке с кислым pH при температуре 25°C. Однако под влиянием давления газа в свободном пространстве над продуктом пимарицин стимулируется к образованию комплекса с β-циклодекстрином даже когда концентрация пимарицина составляет менее 20 ppm. Часть пимарицина, которая вступает в комплекс с циклодекстрином, фактически очень мала по сравнению с константой связывания циклодекстрина для пимарицина, однако количества пимарицина, которое связывается, достаточно для целей сохранения от порчи газированного напитка.
В данном изобретении гостевым лигандом является пимарицин (натамицин) и молекулой-хозяином является β-циклодекстрин. Следует отметить, что пимарицин является относительно большой молекулой по сравнению со многими лигандами, которые, как правило, образуют комплекс с β-циклодекстрином. Вследствие этого, весь пимарицин не может разместиться в полости, образованной циклодекстрином. Это легко подтверждается при оценке размера полости в сравнении с размером молекулы пимарицина. Следовательно, часть молекулы выступает над плоскостью, образованной кольцевой структурой циклодекстрина. В условиях стандартной температуры окружающей среды и давления (25°C и 1 атм) комплекс включения из пимарицина с β-циклодекстрином позволяет пимарицину присутствовать в водной системе в гораздо большей концентрации, чем та, которая достижима в отсутствие β-циклодекстрина. В отсутствие β-циклодекстрина предел растворимости для пимарицина в водном растворе составляет примерно 20-25 мг⋅л-1. В случае образования комплекса с β-циклодекстрином возможно достигать концентрации 400 мг⋅л-1.
Напиток на водной основе, имеющий pH в диапазоне 2,4-5,6, содержится в герметичном контейнере и в непосредственном контакте с газом в свободном пространстве над продуктом, при этом концентрация пимарицина в растворе составляет не более 5 ppm. Возможно присутствие пимарицина в концентрации 1 промилле. Менее предпочтительной, но приемлемой является концентрация 0,5 ppm. Также должен присутствовать β-циклодекстрин в количестве, которое обеспечивает отношение пимарицина и β-циклодекстрина по меньшей мере 1:1. Данное отношение допускает образование достаточного количества комплекса, чтобы достаточное количество пимарицина сохранялось в течение 120 дней. Только часть пимарицина будет оставаться в комплексе с β-циклодекстрином, если общая концентрация пимарицина составляет менее 20-25 ppm. Эта часть будет зависеть от давления, оказываемого на жидкую часть напитка.
Напиток на водной основе содержится в герметичном контейнере и в непосредственном контакте с газом в свободном пространстве над продуктом. В конечном итоге, по прошествии времени (часов) будет достигнуто равновесие между газом, абсорбированном в жидкости, и газом, присутствующим в свободном пространстве над продуктом. По достижении равновесия, часть газа, который присутствует в жидкости и в свободном пространстве над продуктом, будет представлять собой кислород. По данному изобретению необходимо, чтобы количество кислорода составляло менее 8300 мкг. Предпочтительно, количество кислорода будет составлять не более 5000 мкг. Особенно предпочтительно, если содержание кислорода будет составлять менее 500 мкг. Следует отметить, что общее количество кислорода в свободном пространстве над продуктом можно выражать либо в виде концентрации (ppb), либо в виде количества (микрограмм). В настоящем документе и в прилагаемой формуле изобретения используют размерность «мкг», поскольку свободное пространство над продуктом не является постоянным для всех типов напитков и, таким образом, размерность «мкг» является немного более точной, если не известен тип напитка. Например, в примере предшествующего уровня 3 напиток известен, следовательно, размерность ppb является точной.
Кислород можно удалять из напитка несколькими способами. Газ, отличный от кислорода, можно пропускать через жидкость и это будет приводить к вытеснению O2 из раствора при условии, что газовая фаза над жидкостью будет содержать тот же газ, который использован для барботирования. Например, можно вытеснять O2 из раствора при помощи пропускания N2, однако пространство над поверхностью жидкости следует освобождать от кислорода, вытесняемого из напитка потоком газа N2.
Напиток на водной основе содержится в герметичном контейнере и в непосредственном контакте с газом в свободном пространстве над продуктом. Газ в свободном пространстве над пр