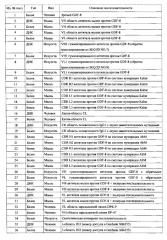
Улучшенные антитела-антагонисты против gdf-8 и их применения
Иллюстрации
Показать всеИзобретение относится к биохимии. Описано антитело или его антигенсвязывающий фрагмент, которые специфически связываются с GDF-8, причем антитело или фрагмент включают: вариабельную тяжелую (VH) область антитела, включающую первую, вторую и третью определяющие комплементарность области (CDR) из VH области, определяемой аминокислотной последовательностью SEQ ID NO: 44; и вариабельную легкую (VL) область антитела, включающую первую, вторую и третью определяющие комплементарность области (CDR) из VL области, определяемой аминокислотной последовательностью SEQ ID NO: 46; причем вышеупомянутая VH область включает лейцин в аминокислотной позиции, соответствующей номеру остатка 111 SEQ ID NO: 44 (позиция 108 по Kabat). Представлена фармацевтическая композиция, содержащая описанное антитело. Также представлены нуклеиновые кислоты, кодирующие лёгкую и тяжёлую цепь описанного антитела. Изобретение позволяет получать улучшенные нейтрализующие антитела против GDF-8, способные на существенно более высоком уровне экспрессироваться в клетках-хозяевах по сравнению с ранее применявшимися антителами против GDF-8. Изобретение также расширяет арсенал средств и способов для увеличения мышечной массы или силы и лечения или профилактики мышечных нарушений, нервно-мышечных нарушений, нарушений обмена веществ, расстройств жировой ткани или костных нарушений. 19 н. и 46 з.п. ф-лы, 12 ил., 10 табл., 11 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
[0001] Эта заявка испрашивает приоритет по предварительной заявке США №61/660,232, поданной 15 июня 2012 г., содержание которой включено в данное описание путем ссылки в полном объеме.
ССЫЛКА НА СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[0002] Список последовательностей, представленный вместе с этой заявкой под номером 37 CFR §1.821 в машиночитаемой форме (CRF) через EFS-Web в виде файла PC071914_SEQLIST_ST25.txt, включается в это описание путем ссылки. Электронная копия списка последовательностей была создана 14 мая 2013 г., с размером файла 71 килобайт.
ДЕПОНИРОВАНИЕ БИОЛОГИЧЕСКОГО МАТЕРИАЛА
[0003] Репрезентативные материалы согласно настоящему изобретению были депонированы в Американской коллекции типовых культур ("АТСС"), 10801 University Boulevard, Manassas, VA 20110-2209, USA, 14 июня 2012 г. Вектор OGD1.0.0-HC, имеющий учетный номер АТСС РТА-12980, представляет собой полинуклеотид, кодирующий вариабельный участок тяжелой цепи OGD 1.0.0, и вектор OGD1.0.0-LC, имеющий учетный номер АТСС РТА-12981, представляет собой полинуклеотид, кодирующий вариабельный участок легкой цепи OGD 1.0.0.
[0004] Депонирование осуществляют в соответствии с положениями Будапештского договора о международном признании депонирования микроорганизмов для целей патентной процедуры и его подзаконными актами ("Будапештский договор"). Это обеспечивает поддержание жизнеспособности депонируемой культуры в течение 30 лет со дня депонирования. Депонированный образец может быть предоставлен со стороны АТСС согласно условиям Будапештского договора и в соответствии с договором между Pfizer Inc. и АТСС, который гарантирует постоянный и неограниченный открытый доступ к потомству депонированной культуры после выдачи соответствующего патента США или после публикации любой патентной заявки США или иностранной патентной заявки, то есть более ранней з них, и гарантирует доступ к потомству лицам, определяемым Комиссаром США по патентам и товарным знакам, которые получают на это право в соответствии с Разделом 35 Кодекса законов США, § 122, и установленными Комиссаром соответствующими правилами (включая 37 CFR § 1.14 с конкретной ссылкой на 886 OG 638).
[0005] Правообладатель настоящей заявки согласился, что в случае гибели или потери культуры депонируемых материалов или ее уничтожения при культивировании в соответствующих условиях, материалы должны быть после уведомления безотлагательно заменены на другие такие же. Доступ к депонированному материалу не следует рассматривать как разрешение на практическое воплощение изобретения в нарушение прав, предоставляемых правительством любой страны в соответствии с действующими в ней патентными законами.
УРОВЕНЬ ТЕХНИКИ
[0006] Фактор роста и дифференцировки 8 (GDF-8), также известный как миостатин, представляет собой секретируемый белок и относится к надсемейству трансформирующих ростовых факторов бета (TGF-) структурно связанных факторов роста. Представители этого надсемейства обладают свойствами, регулирующими рост, и морфогенетическими свойствами (Kingsley et al. (1994) Genes Dev. 8:133-46; Hoodless et al. (1998) Curr. Topics Microbial. Immunol. 228:235-72). Человеческий GDF-8 синтезируют как состоящий из 375 аминокислот белок-предшественник, образующий гомодимерный комплекс. Во время обработки аминоконцевой пропептид, известный как "латентно-ассоциированный пептид" (LAP), расщепляется и может оставаться нековалентно связанным с гомодимером, образуя неактивный комплекс, называемый как "малый латентный комплекс" (Miyazono et al. (1988) J. Biol. Chem. 263:6407-15; Wakefield et al. (1988) J. Biol. Chem. 263:7646-54; Brown et al. (1999) Growth Factors 3:35-43; Thies et al. (2001) Growth Factors 18:251-59; Gentry et al. (1990) Biochemistry 29:6851-57; Derynck et al. (1995) Nature 316:701-05; Massague (1990) Ann. Rev. Cell Biol 12:597-641). Белки, такие как фоллистатин и родственные с ним белки, также связываются со зрелыми гомодимерами GDF-8 и ингибируют биологическую активность GDF-8 (Gamer et al. (1999) Dev. Biol. 208:222-32).
[0007] Выравнивание аминокислотной последовательности GDF-8 из разных видов демонстрирует, что GDF-8 является высококонсервативным (McPherron et al. (1997) Proc. Natl. Acad. Sci. U.S.A. 94:12457-61). Последовательности GDF-8 человека, мыши, крысы, свиньи и курицы являются на 100% идентичными на С-концевом участке, a GDF-8 бабуина, крупного рогатого скота и овцы отличаются всего на 3 аминокислоты на С-конце. Высокая степень консервативности GDF-8 в разных видах свидетельствует о том, что GDF-8 выполняет существенную физиологическую функцию.
[0008] Было продемонстрировано, что GDF-8 играет главную роль в регуляции развития и гомеостаза мышц путем подавления пролиферации и дифференциации миобластов и сателлитоцитов (Lee and McPherron (1999) Curr. Opin. Genet. Dev. 9:604- 07; McCroskery et al. (2003) J. Cell. Biol. 162:1135-47). Он демонстрирует раннюю экспрессию в развивающихся скелетных мышцах и продолжает экспрессироваться в развитых скелетных мышцах, преимущественно быстросокращающегося типа. Кроме того, GDF-8, который демонстрирует сверхэкспрессию у взрослых мышей, приводит к значительной атрофии мышечной ткани (Zimmers et al. (2002) Science 296:1486-88). К тому же, было продемонстрировано, что природные мутации, в результате которых ген GDF-8 становится неактивным, вызывают гипертрофию и гиперплазию у животных и у человека (Lee and McPherron (1997) supra). Например, трансгенные мыши с выключением гена GDF-8 характеризуются выраженной гипертрофией и гиперплазией скелетных мышц и измененной структурой кортикальной кости (McPherron et al. (1997) Nature 387:83-90; Hamrick et al. (2000) Bone 27:343-49). Подобное повышение массы скелетных мышц является очевидным при природных мутациях GDF-8 у крупного рогатого скота (Ashmore et al. (1974) Growth 38:501-07; Swatland et al. (1994) J. Anim. Sci. 38:752-57; McPherron et al, supra; Kambadur et al. (1997) Genome Res. 7:910-15). Кроме того, различные исследования показывают, что повышенная экспрессия GDF-8 связана с ВИЧ-индуцированной мышечной атрофией (Gonzalez-Cadavid et al. (1998) Proc. Natl. Acad Sci. U.S.A. 95:14938-43). GDF-8 также участвует в продуцировании мышечно-специфичных ферментов (например, креатинкиназы) и пролиферации миобластов (WO 00/43781).
[0009] Считается, что, помимо его свойств, регулирующих рост, и морфогенетических свойств, GDF-8 участвует во многих других физиологических процессах, включая гомеостаз глюкозы во время развития диабета 2 типа, нарушение толерантности к глюкозе, метаболические синдромы (т.е., такой синдром, как, например, синдром X, связанный с одновременным наличием группы состояний, к которым могут относиться резистентность к инсулину, абдоминальное ожирение, дислипидемия, гипертензия, хроническое воспаление, протромботическое состояние и т.п., что связано с возникновением высокого риска диабета 2 типа и/или сердечного заболевания у пациента), резистентность к инсулину (например, резистентность, вызванная травмой, такой как ожог, или дисбалансом азота) и расстройства жировой ткани (например, ожирение, дислипидемия, неалкогольная жировая болезнь печени и т.п.) (Kim et al. (2000) Biochem. Biophys. Res. Comm. 281:902-06).
[00010] Многие расстройства у человека и животных связаны с функциональными расстройствами мышечной ткани, например, амиотрофический латеральный склероз ("ALS"), мышечная дистрофия ("MD"; включая мышечную дистрофию Дюшенна), мышечная атрофия, атрофия органов, слабость, застойное обструктивное заболевание легких (COPD), саркопения, кахексия и синдромы мышечной атрофии, вызванные другими болезнями и состояниями. В настоящее время существует мало надежных и эффективных способов терапии для лечения этих нарушений. Патология этих заболеваний указывает на возможную роль сигнала GDF-8 в качестве объекта в лечении этих заболеваний.
[00011] ALS является нейродегенеративным заболеванием с поздним началом и смертельным исходом, характеризующимся дегенерацией центральной нервной системы и мышечной атрофией. ALS, как правило, вызывает отклонения в походке и потерю физической ловкости, а затем прогрессирует до паралича конечностей и диафрагмы. Хотя большинство случаев ALS являются спорадическими и имеют невыясненную этиологию, было обнаружено 5-10% случаев являются результатом доминантной семейной (FALS) наследственности. Приблизительно 10-20% случаев FALS объясняются мутациями в ген Cu/Zn супероксиддисмутазы (SOD1) (см. обзор в Bruijn et al. (2004) Ann. Rev. Neurosci. 27:723-49). SOD1 является гетеродимерным металлопротеином, катализирующим реакцию супероксида до перекиси водорода и двухатомного кислорода, и поскольку потеря SOD1 не приводит к болезни двигательного нейрона (Reaume et al. (1996) Nat. Genet. 13:43- 47), но считается, что он вызывает болезнь через токсическое усиление функции (см. обзор в Bruijn et al., supra). Конкретные механизмы вызываемой SOD1 гибели нейронных клеток остаются неизвестными и могут быть связаны с изменениями в аксональном транспорте, клеточными реакциями та неправильно свернутый белок, митохондриальной дисфункцией и усилением токсичности (Bruijn et al., supra).
[00012] Дегенерация двигательных нейронов, наблюдаемая при ALS, может осуществляться через различные механизмы, включая прерывание поглощения или транспорта трофических факторов двигательными нейронами (см. обзор в Holzbaur (2004) Trends Cell Biol. 14:233-40). Таким образом, ALS может поддаваться лечению с применением способов терапии, которые омолаживают дегенерирующий нейрон путем обеспечения оптимальной среды для выживания. Среда для нерва включает ненейронные клетки, такие как глиальные и мышечные клетки, иннервированные двигательным нейроном. Эта среда предусматривает трофические факторы и факторы роста, которые эндоцитозируются нейроном и переносятся через ретроградный аксональный транспорт в клеточное тело (Chao (2003) Neuron 39:1-2; Holzbaur, supra).
[00013] FALS моделировали у мышей и крыс путем сверхэкспрессии мутантного SOD1 (Howland et al. (2002) Proc. Natl. Acad. Sci. U.S.A.99:1604-09). Трансгенные мыши, сверхэкспрессирующие форму G93A мутантного SOD1, демонстрируют мышечную слабость и атрофию к 90-100-дневному возрасту и обычно умирают в возрасте приблизительно 130 дней (Gurney et al. (1994) Science 264:1772-75). Однако лежащая в основе 800093А-индуцируемая патология, включающая слабость захвата и потерю нервно-мышечного соединения, является значительной уже к 50-дневному возрасту (Frey et al. (2000) J. Neurosci. 20:2534-42; Fisher et al. (2004) Exp. Neuro. 185:232-40; Ligon et al. (2005) NeuroReport 16:533-36; Wooley et al. (2005) Muscle Nerve 32:43-50). Трансгенные крысы, экспрессирующие мутацию SODG93A, демонстрируют ту же динамику дегенерации (Howland et al., supra). Работы последнего времени показывают, что развитие патологии не является клеточно-автономным, что согласуется с гипотезой, согласно которой дегенерация двигательных нейронов, наблюдаемая при ALS, происходит путем различных механизмов, включая прерывание поглощения или транспорта трофических факторов двигательным нейроном (см. выше). Clement и сотрудники использовали химерных мышей, чтобы продемонстрировать, что ненейронные клетки дикого типа могут продлевать выживание двигательных нейронов, экспрессирующих мутантный SOD1 (Clement et al. (2003) Science 302:113-17). Эти наблюдения привели к исследованию средств терапии, которые могли бы замедлить дегенерацию нейронов, обеспечивая оптимальную микросреду для выживания. Например, лечение мышей SODG93A путем прямой внутримышечной инъекции вирусно-экспрессируемых факторов роста (включая IGF-1, GDNF и VEGF) продлевает выживаемость животных (Kaspar et al. (2003) Science 301:839-42; Azzouz et al. (2004) Nature 429:413-17; Wang et al. (2002) J. Neurosci. 22:6920-28). Кроме того, мышечно-специфичная экспрессия местной IGF-1-специфичной изоформы (mlGF-1) стабилизирует нервно-мышечные соединения, повышает выживаемость двигательных нейронов и задерживает начало и прогрессирование болезни в модели трансгенных мышей SODG93A, указывая на то, что прямое воздействие на мышцы может влиять на начало и прогрессирование заболевания у SOD 1-трансгенных животных (Dobrowolny et al. (2005) J. Cell Biol. 168:193-99). Связь между мышечным гиперметаболизмом и чувствительностью двигательных нейронов также отмечалась у мышей с ALS, что подтверждало гипотезу о том, что дефекты в мышцах могут быть задействованы в этиологии болезни (Dupois et al. (2004) Proc. Natl. Acad Sci. U.S.A. 101:11159-64). Таким образом, усиление роста мышц должно обеспечивать местную поддержку для двигательных нейронов, а значит, обеспечивать благоприятный терапевтический эффект.
[00014] Ингибирование экспрессии миостатина ведет к гипертрофии и гиперплазии мышц (Lee and McPherron, supra; McPherron et al., supra). Миостатин отрицательно регулирует регенерацию мышц после повреждения, и недостаток миостатина у мышей с нулевым GDF-8 ведет к ускоренной регенерации мышц (McCroskery et al., (2005) J. Cell. Sci. 118:3531-41). Нейтрализующие миостатин антитела повышают массу тела, массу скелетных мышц и размер и силу скелетных мышц мышей дикого типа (Whittemore et al. (2003) Biochem. Biophys. Res. Commun. 300:965-71) и mdx-мышей, модели мышечной дистрофии (Bogdanovich et al. (2002) Nature 420:418-21; Wagner et al. (2002) Ann. Neural. 52:832-36). Кроме того, антитело против миостатина у этих мышей снижало повреждение диафрагмы, мышцы, которая также является объектом во время патогенеза ALS. Была высказана гипотеза, что действие на мышцы факторов роста, таких как HGF, может быть обусловлено ингибированием экспрессии миостатина (McCroskery et al. (2005), supra), таким образом, способствуя сдвигу "push and pull" или баланса между регенерацией и дегенерацией в положительном направлении. Таким образом, ингибирование GDF-8 представляет потенциальное фармакологическое действие для лечения ALS, мышечной дистрофии (MD) и других GDF-8-ассоциированных нарушений, например, нервно-мышечных нарушений, при которых желательно повышение массы, силы, размера мышц и т.п. При наличии животных моделей (мышиных и крысиных) ALS существует возможность испытания терапевтических средств в двух разных видах, таким образом, повышая достоверность терапевтического эффекта для человека in vivo.
[00015] Помимо нервно-мышечных нарушений у человека, также существуют состояния, зависящие от фактора роста, связанные с потерей костной ткани, такие как остеопороз и остеоартрит, которые преимущественно поражают пожилых людей и/или женщин в период постменопаузы. Кроме того, к метаболическим болезням или костным расстройствам относятся низкая костная масса вследствие хронической глюкокортикоидной терапии, преждевременной гонадной дисфункции, подавления андрогена, дефицита витамина D, вторичного гиперпаратиреоза, пищевой недостаточности и нервной анорексии. Хотя многие применяемые в настоящее время средства терапии действуют путем ингибирования резорбции костной ткани, терапия, способствующая образованию костной ткани, была бы полезной в качестве альтернативного лечения. Поскольку GDF-8 играет роль в развитии костей, а также развитии мышц, регуляция GDF-8 также является отличным фармакологическим способом для лечения костно-дегенеративных нарушений.
[00016] Мышиное моноклональное антитело, специфично антагонизирующее GDF-8, было ранее описано как повышающее мышечную массу и силу в моделировании ALS на грызунах, помимо других биологических эффектов (Holzbaur, EL, et al, Myostatin inhibition slows muscle atrophy in rodent models of amyotrophic lateral sclerosis, Neurobiology of Disease (2006) 23(3):697-707). Таким образом, ожидается, что мышиное антитело и его гуманизированный аналог должны быть эффективными для увеличения мышечной массы и силы у пациентов с ALS, а также у пациентов, страдающих от других болезней и нарушений, характеризуемых или опосредованных избыточным количеством GDF-8, таких как описанные выше.
[00017] Гуманизированный вариант вышеупомянутого антитела мыши против GDF-8, как и многие моноклональные антитела и другие терапевтические средства на белковой основе, требует немалых усилий и материальных затрат для производства, поскольку для этого обычно требуется продуцирование в живых клетках млекопитающих. Таким образом, улучшение выработки этого антитела или других антител с подобной специфичностью позволяло бы получать такое же количество активного препарата с меньшими затратами. Это обеспечивает двойное преимущество снижения стоимости производства с одновременным освобождением ограниченных производственных мощностей для производства других биологических медикаментов. Оба преимущества способствуют повышению доступности для пациентов терапевтических антител против GDF-8, а также других биологических средств. Соответственно, в данной отрасли существует потребность в улучшенных вариантах антител против GDF-8, обеспечивающих больший выход продукции в клетках млекопитающих.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[00018] Настоящее изобретение обеспечивает гуманизированные антитела против GDF-8 или их антигенсвязывающие фрагменты, которые могут экспрессироваться на более высоком уровне в клетках-хозяевах по сравнению с более ранними вариантами таких антител, имеющих общие определяющие комплементарность области (CDR). Также обеспечиваются композиции, включающие такие антител, для применения в соответствии со способами согласно настоящему изобретению.
[00019] В некоторых вариантах воплощения эти антитела имеют вариабельную тяжелую (VH) область, в которой CDR1 определяется аминокислотной последовательностью SEQ ID NO: 10 или SEQ ID NO: 20, CDR2 определяется аминокислотной последовательностью SEQ ID NO: 11 или SEQ ID NO: 21, CDR3 определяется аминокислотной последовательностью SEQ ID NO: 12, и в которой VH область является модифицированной таким образом, что аминокислота в позиции 108 по Kabat является лейцином вместо метионина. В других вариантах воплощения эти антитела имеют VH область, которая включает одинаковые CDR, и в которой четвертая каркасная область VH области включает аминокислоты 106-116 SEQ ID NO: 44. В других вариантах воплощения этих антител CDR прививают к сегменту VH-гена зародышевой линии человека DP-47, а затем соединяют с геном тяжелого J-сегмента человека JH4. В других вариантах воплощения VH область этих антител включает аминокислотную последовательность SEQ ID NO: 44.
[00020] Антитела согласно настоящему изобретению, имеющие лейцин в позиции 108 по Kabat, такие как приведенные для примера выше, характеризуются повышенным уровнем экспрессии по сравнению с вариантами, в которых метионин находится в той же позиции. В некоторых вариантах воплощения более ранний вариант экспрессируется на более высоком уровне в подобных условиях по сравнению с последним более, чем приблизительно на 50%, 100%, 150%, 200%, 250%, 300%, 400%, 500%, 600%, 700%, 800%, 900%, 1000%, 1200%, 1400%, 1600%, 1800% или даже 2000%.
[00021] В соответствии с другими вариантами воплощения для антител согласно изобретению, VH области, описанные в предыдущем абзаце, могут быть соединены с вариабельными легкими (VL) областями, в которых CDR1 определяется аминокислотной последовательностью SEQ ID NO: 13, CDR2 определяется аминокислотной последовательностью SEQ ID NO: 14 и CDR3 определяется аминокислотной последовательностью SEQ ID NO: 15, и в которых аминокислота в позиции 100 по Kabat VL области является глицином или глутамином. В других вариантах воплощения VH область соединяют с VL областью, в которой CDR легкой цепи привиты к сегменту VL-гена зародышевой линии человека DPK-9, а затем соединяют с геном легкого J-сегмента человека JH4. Согласно некоторым другим вариантам воплощения этих антител, ранее описанные VH области соединяют с VL областями, которые имеют вышеописанные CDR VL области и в которых четвертая каркасная область VL области включает аминокислоты 98-107 SEQ ID NO: 9 или SEQ ID NO: 46. В других вариантах воплощения ранее описанные VH области соединяют с VL областями, включающими аминокислотную последовательность SEQ ID NO: 9 или SEQ ID NO: 46.
[00022] В некоторых других вариантах воплощения вышеописанные VH области соединяют с константными областями тяжелой цепи подтипов человеческого антитела, включая IgA, IgG, IgD, IgE или IgM. Если константная область тяжелой цепи взята из IgG, в других вариантах воплощения константные области тяжелой цепи антитела взяты из подтипов IgG: IgG1, IgG2, IgG3 или IgG4. Константные области тяжелой цепи могут быть модифицированы, например, для устранения одной или нескольких эффекторных функций Fe домена, как показано на примере SEQ ID NO: 57. В других вариантах воплощения описанные выше VL области связывают с константными областями легкой цепи, которые могут относиться к лямбда или каппа подтипам.
[00023] В соответствии с другими вариантами воплощения VH область SEQ ID NO: 44 связывают с модифицированной тяжелой областью аминокислотной последовательности SEQ ID NO: 57 для создания тяжелой цепи антитела полной длины аминокислотной последовательности SEQ ID NO: 58. И наоборот, в других вариантах воплощения VL область SEQ ID NO: 46 может быть связана с каппа-константной легкой цепью аминокислотной последовательности SEQ ID NO: 17 для создания легкой цепи антитела полной длины аминокислотной последовательности SEQ ID NO: 59. В других вариантах воплощения каждая из тяжелой и легкой цепей антитела полной длины может комбинироваться для создания антитела против GDF-8, имеющего два антигенсвязывающих центра. В других вариантах воплощения антитела могут включать фрагменты или производные таких интактных антител полного размера, включая, например Fab, F(ab')2, scFv, scFv-Fc, scFv-CH, scFab, scFv-"молнию", диатело, триатело, тетратело, миниантитело, Fv и биспецифическое антитело.
[00024] Антитела согласно изобретению могут иметь различную аффинность связывания к GDF-8, например, приблизительно 5000 нМ или даже выше, например, как минимум примерно 4000 нМ, 3000 нМ, 2000 нМ, 1000 нМ, 900 нМ, 800 нМ, 700 нМ, 600 нМ, 500 нМ, 400 нМ, 300 нМ, 200 нМ, 100 нМ, 90 нМ, 80 нМ, 70 нМ, 60 нМ, 50 нМ, 40 нМ, 30 нМ, 25 нМ, 20 нМ, 15 нМ, 10 нМ, 7 нМ, 6 нМ, 5 нМ, 4 нМ, 3 нМ, 2 нМ, 1 нМ, 0,1 нМ, 0,01 нМ или 0,001 нМ.
[00025] Изобретение также обеспечивает нуклеиновые кислоты, кодирующие антитела против GDF-8, а также векторы экспрессии, включающие такие нуклеиново-кислотные последовательности, и клетки-хозяева для экспрессии антител.
[00026] Настоящее изобретение также обеспечивает способы, применимые для лечения или профилактики у пациентов мышечных нарушений, характеризуемых сниженной мышечной массой или силой. Такие способы применяются при введении пациентам, нуждающимся в лечении или профилактике таких нарушений, терапевтически или профилактически эффективного количества композиции, включающей антитело или его антигенсвязывающий фрагмент, которые специфически связываются с GDF-8. К антителам, применимым для этих способов, относятся антитела, описанные выше и по всему тексту этой заявки.
[00027] В соответствии с некоторыми вариантами воплощения, композиции антитела согласно настоящему изобретению вводят в терапевтически или профилактически эффективном количестве пациенту, нуждающемуся в лечении или профилактике мышечного расстройства, включая выбранные из группы, к которой относятся мышечная дистрофия, мышечная атрофия, саркопения, кахексия, синдром мышечной атрофии, возрастная потеря мышечной массы или силы и слабость. В других вариантах воплощения мышечным расстройством является кахексия, вызванная раком. В других вариантах воплощения мышечным расстройством является мышечная дистрофия Дюшенна. В некоторых из последних вариантов воплощения введение антител против GDF-8 является эффективным для улучшения показателей пациента в тесте с шестиминутной ходьбой.
[00028] В некоторых вариантах воплощения изобретение также применяют для лечения пациента, страдающего от мышечной дистрофии, например, мышечной дистрофии Дюшенна, путем введения композиции, включающей антитело согласно настоящему изобретению, до, одновременно или после применения другого средства, эффективного для лечения мышечной дистрофии. В некоторых вариантах воплощения такое средство может быть глюкокортикоидом, таким как преднизон.
[00029] Также обеспечиваются способы увеличения массы или силы мышц млекопитающих путем введения млекопитающему композиции, включающей антитело против GDF-8 согласно изобретению в количестве, эффективном для увеличения массы или силы мышц млекопитающего. Во многих вариантах воплощения мышцы являются скелетными мышцами, включая одну или несколько мышц, активных при дыхании, или сердечную мышцу.
[00030] Также обеспечиваются способы лечения или профилактики нервно-мышечных нарушений путем введения субъекту, нуждающемуся в лечении или профилактике нервно-мышечного расстройства, терапевтически или профилактически эффективного количества антитела против GDF-8 согласно настоящему изобретению. В некоторых вариантах воплощения нервно-мышечным расстройством, подлежащим лечению или профилактике, является ALS.
[00031] Также обеспечиваются способы лечения или профилактики нарушений обмена веществ путем введения субъекту, нуждающемуся в лечении или профилактике нарушений обмена веществ, терапевтически или профилактически эффективного количества антитела против GDF-8 согласно настоящему изобретению. Во многих вариантах воплощения к расстройствам обмена веществ, подлежащим лечению или профилактике, относятся сахарный диабет 2 типа, метаболический синдром, синдром X, резистентность к инсулину и нарушение толерантности к глюкозе.
[00032] Также обеспечиваются способы лечения или профилактики нарушений жировой ткани путем введения субъекту, нуждающемуся в лечении или профилактике нарушений жировой ткани, терапевтически или профилактически эффективного количества антитела против GDF-8 согласно настоящему изобретению. Во многих вариантах воплощения к расстройствам жировой ткани, подлежащим лечению или профилактике, относятся ожирение и чрезмерно высокий индекс массы тела.
[00033] Также обеспечиваются способы лечения или профилактики нарушений, связанных с потерей костной массы, путем введения субъекту, нуждающемуся в лечении или профилактике нарушений, связанных с потерей костной массы, терапевтически или профилактически эффективного количества антитела против GDF-8 согласно настоящему изобретению. Во многих вариантах воплощения к расстройствам, связанным с потерей костной массы, подлежащим лечению или профилактике, относятся остеопороз, остеопения, остеоартрит и связанные с остеопорозом переломы костей.
[00034] В некоторых других вариантах воплощения к антителам против GDF-8, применимым для осуществления способов согласно изобретению, относятся антитела, конъюгированные с компонентами, которые благоприятно изменяют их функцию или характеристики, например, помимо прочего, увеличивают период полувыведения из сыворотки. В других вариантах воплощения аминокислотные изменения могут осуществляться с подобной целью или с другими целями.
[00035] Композиции антител для применения в соответствии со способами согласно изобретению могут быть получены в форме различных композиций, включая, помимо прочих, водную суспензию для введения различными путями, включая, помимо прочих, подкожное введение, внутривенное введение, внутримышечное введение, внутрибрюшинное введение, инфузионное введение или болюсное введение.
[00036] В некоторых вариантах воплощения эффективная доза антител против GDF-8 согласно изобретению составляет от 0,001 мг/кг до приблизительно 250 мг/кг, которая может быть введена за один раз или за несколько раз с интервалами.
[00037] Изобретение также обеспечивает фармацевтические наборы для применения клиническими врачами и другими специалистами для облегчения введения композиций антитела против GDF-8 пациентам. В некоторых вариантах воплощения комплекты включают антитело против GDF-8, согласно изобретению, в лиофилизированной форме или в форме водного раствора, разбавитель, такой как вода или буфер фармацевтической степени чистоты, и устройство для введения антитела против прогастрина, такое как шприц и игла. В других вариантах воплощения наборы дополнительно могут включать второе терапевтическое средство.
КРАТКОЕ ОПИСАНИЕ ФИГУР
[00038] На ФИГ. 1А представлено выравнивание аминокислотных последовательностей VH областей некоторых антител против GDF-8 согласно изобретению, включая VH область мышиного антитела и две VH области гуманизированного антитела, созданные путем прививки мышиных CDR тяжелой цепи к VH области зародышевой линии человека DP-47 (т.е., VH0 и VH1). Дополнительно представлено выравнивание аминокислотных последовательностей других гуманизированных VH областей VH2-VH5. Аминокислотная последовательность CDR тяжелой цепи выделена жирным подчеркнутым шрифтом. Аминокислота в позиции 108 по Kabat выделена жирным шрифтом под звездочкой.
[00039] На ФИГ. 1 В представлено выравнивание аминокислотных последовательностей VL областей некоторых антител против GDF-8 согласно изобретению, включая VL область мышиного антитела и две VL области гуманизированного антитела, созданные путем прививки мышиных CDR легкой цепи к VL области зародышевой линии человека DPK-9 (т.е., VL0 и VL1). Дополнительно представлено выравнивание аминокислотных последовательностей других гуманизированных VL областей VL2-VL5. Аминокислотная последовательность CDR легкой цепи выделена жирным подчеркнутым шрифтом. Аминокислота в позиции 100 по Kabat выделена жирным шрифтом под звездочкой.
[00040] На ФИГ. 2А представлен график, на котором показано увеличение массы икроножной мышцы (GAS) и четырехглавой мышцы (QUAD) мышей С57 В1/6, получавших в течение двух недель 10 мг/кг антитела OGD 1.0.0, по сравнению с контрольной группой, получавшей носитель. На ФИГ. 2 В представлены те же данные, что и на ФИГ. 2А, как процент увеличения массы мышц у мышей получавших антитело OGD 1.0.0, относительно контрольной группы. На ФИГ. 2 В дополнительно показано процент увеличения мышечной массы длинного разгибателя пальцев (EDL) из одних и тех же групп мышей, получавших антитело и контрольный носитель.
[00041] На ФИГ. 3 представлен график, на котором показано увеличение общего тетанического усилия, создаваемого EDL-мышцей мышей С57 В1/6, получавших в течение двух недель 10 мг/кг антитела OGD 1.0.0 по сравнению с контрольной группой, получавшей носитель.
[00042] На ФИГ. 4А представлен график, на котором показано зависящее от дозы увеличение массы икроножной мышцы (Gastroc) и четырехглавой мышцы (Quad) мышей С57 В1/6, получавших еженедельно в течение четырех недель PBS-носитель и 0,3, 1,3, 10 и 30 мг/кг антитела OGD1.0.0. Данные представляют мышечную массу, измеряемую по окончании четвертой недели. На ФИГ. 4 В представлены те же данные, что и на ФИГ. 4А как процентное увеличение массы икроножной мышцы и четырехглавой мышцы у мышей получавших антитело OGD 1.0.0, относительно контрольной группы.
[00043] На ФИГ. 5А представлен график, на котором показано зависящее от дозы увеличение общей безжировой массы тела мышей С57 В1/6, получавших еженедельно в течение четырех недель PBS-носитель и 0,3, 1, 3, 10 и 30 мг/кг антитела OGD1.0.0. Данные представляют безжировую массу, измеряемую в конце каждой недели в течение четырех недель. На ФИГ. 5 В представлен график, на котором показано увеличение общей безжировой массы тела мышей С57 В1/6, получавших еженедельно в течение четырех недель PBS-носитель и 0,3, 1, 3, 10 и 30 мг/кг антитела OGD1.0.0, в конце четырехнедельного исследования.
[00044] На ФИГ. 6А представлен график, на котором показано увеличение общей безжировой массы тела мышей mdx, получавших еженедельно в течение восьми недель 10 мг/кг антитела OGD 1.0.0, относительно контрольной группы мышей mdx, получавших PBS-носитель. На ФИГ. 6 В представлен график, на котором показано увеличение максимального пикового усилия захвата мышей mdx, получавших еженедельно в течение восьми недель 10 мг/кг антитела OGD 1.0.0, относительно контрольной группы мышей mdx, получавших PBS-носитель.
[00045] На ФИГ. 7А представлен график, на котором показано увеличение массы икроножной мышцы и четырехглавой мышцы мышей mdx и мышей С57В1/6, получавших еженедельно в течение восьми недель 10 мг/кг антитела OGD1.0.0, относительно контрольной группы мышей, получавших PBS-носитель. Данные представляют мышечную массу, измеряемую по окончании восьмой недели. На ФИГ. 7В представлены те же данные, что и на ФИГ. 7А, как процентное увеличение массы икроножной мышцы и четырехглавой мышцы у мышей тех, получавших антитело OGD 1.0.0, относительно контрольной группы.
[00046] На ФИГ. 8 представлен график, на котором показано зависящее от дозы увеличение общей безжировой массы тела и безжировой массы конечности у яванских макак, получавших 0, 3, 10 и 30 мг/кг антитела OGD1.0.0.
[00047] На ФИГ. 9 представлен график, на котором показано, что увеличение общей безжировой массы тела яванских макак, получавших 10 мг/кг и 30 мг/кг антитела OGD1.0.0, сохранялось в течение нескольких недель после прекращения лечения с применением антитела.
[00048] На ФИГ. 10А представлен график, на котором показано, что объем эпаксиальных мышц, расположенных над позвонками L3-L5 яванских макак, получавших 10 мг/кг и 30 мг/кг антитела OGD1.0.0 в течение 8 недель, увеличился относительно контрольной группы животных, получавших PBS-носитель.
[00049] На ФИГ. 11 представлено трехмерное изображение эпаксиальной мышцы типичного подопытного животного до и после 4 недель лечения с применением антитела OGD1.0.0.
[00050] На ФИГ. 12А представлена аминокислотная последовательность типичной тяжелой цепи антитела против GDF-8, содержащей вариабельную тяжелую область, указанную в данном описании как VH0.
[00051] На ФИГ. 12В представлена аминокислотная последовательность типичной легкой цепи антитела против GDF-8, содержащей вариабельную легкую область, указанную в данном описании как VL0.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[00052] Настоящее изобретение обеспечивает улучшенные варианты гуманизированного антитела против GDF-8, которые могут экспрессироваться в клетках на гораздо более высоком уровне по сравнению с предыдущими вариантами антитела. Соответственно, ожидается получение описываемых авторами улучшенных вариантов антитела против GDF-8 в большем количестве и с меньшими материальными затратами при таких же исходных материалах, как и в предыдущих вариантах. Настоящее изобретение также раскрывает различные способы лечения или профилактики с применением улучшенных антител. Таким образом, в некоторых типичных не ограничительных вариантах воплощения могут применяться улучшенные антитела против GDF-8 для лечения мышечной дистрофии, кахексии и других нарушений, при которых увеличение мышечной массы или силы субъекта может обеспечивать терапевтический эффект.
Структура и разнообразие антител
[00053] В контексте данного описания термин "антитело" означает интактный иммуноглобулин (Ig) или любой его антигенсвязывающий фрагмент, часть или составляющую и охватывает, помимо прочего, любой полипептид, включающий полный или частичный антигенсвязывающий центр, сохраняющий как минимум некоторую антигенсвязывающую специфичность. Антитело также может означать комбинацию антигенсвязывающих фрагментов, частей или составляющих, взятых из интактного антитела, с другой молекулой, включая другое антитело, белок из надсемейства Ig или белки или другие типы молекул, не относящиеся к иммунной системе. Такие производные антител могут включать небелковые составляющие или компоненты.
[00054] Антиген означает вещество, белковое или иное, способное специфически связываться антителом. Антиген может иметь более одной антигенной детерминанты или более одного эпитопа, представляющих часть антигена, связываемую антителом.
[00055] Иммуноглобулины (Ig) представляют собой гетеротетрамерные белки, включающие две тяжелые цепи приблизительно по 50 кДа каждая, и две легкие цепи приблизительно по 25 кДа каждая. Каждая цепь включает несколько Ig-доменов. Начиная с амино-конца, тяжелая цепь содержит один вариабельный участок (VH), за которым следуют, в зависимости подтипа Ig, три или четыре константных области, которые называются CH1, СН2, СН3 и, в случае наличия, СН4. Подобным образом, в легкой цепи один вариабельный участок (VL) находится на амино-конце полипептида, а за ним следует одна константная область (CL). Между областями СН1 и СН2 находится шарнирная область переменной длины, в зависимости от изотипа, которая придает молекуле гибкость. Карбокси-конец тяжелой цепи СН1, включая шарнир, СН2, СН3 и, в случае наличия, СН4, составляет Fe-область. Каждая вариабельная или константная область включает один Ig домен.
[00056] Легкие цепи Ig связываются с тяжелыми цепями Ig, и пары тяжелых цепей Ig связываются между собой через дисульфидные связи. Нековалентная взаимосвязь также может способствовать стабилизации межцепочечной четвертичной структуры между тяжелыми и легкими цепями и между спаренными тяжелыми цепями. В интактных молекулах Ig области VH и VL спаренных тяжелых и легких цепей располагаются по соседству одна с другой и взаимодействуют для образования антиген-связывающего центра. Поскольку интактные молекулы Ig содержат две пары спаренных тяжелых и легких цепей, т.е., всего две тяжелые и две легкие цепи, молекулы Ig содержат два антигенсвязывающих центра. Наличие шарнирной области обеспечивает гибкость между антигенсвязывающими центрами и остальной частью молекулы.
[00057] Константные области тяжелой и легкой цепей не принимают непосредственного участия в распознавании антигена. Однако тяжелая цепь, в частности, Fe область, содержит последовательности, способные взаимодействовать с эффекторными молекулами и клетками иммунной системы, что позволяет