Способ защиты легких при операциях на сердце с искусственным кровообращением
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к сердечно-сосудистой хирургии. Выполняют интубацию трахеи, проводят искусственную вентиляцию легких (ИВЛ) и ультрагемофильтрацию во время искусственного кровообращения. При этом после начала ИВЛ и катетеризации центральной вены в нее осуществляют инфузию алпростадила в дозе 0,002- 0,005 мкг/кг/мин в течение проведения всей операции до перевода больного в реанимацию. Проводят перфузию легочной артерии через дополнительную канюлю, установленную выше клапана легочной артерии. Подключают ее к дополнительному перфузионному насосу через дополнительную трассу с оксигенированной кровью, в которую вводят алпростадил в дозе 0,002-0,005 мкг/кг/мин в течение всего времени перфузии легочной артерии, которую выполняют с объемной скоростью 250-300 мл/мин. Во время искусственного кровообращения продолжают ИВЛ, уменьшая дыхательный объем до 50% от исходного, но не более 5 мл/кг, снижая частоту дыхания до 5-6 раз в минуту. Способ позволяет повысить эффективность защиты легких за счет предупреждения увеличения альвеолярно-артериального кислородного градиента (ААКГ), снизить индекс оксигенации и легочного комплайнса, а также увеличить внутрилегочное шунтирование после искусственного кровообращения. 1 табл., 1 пр.
Реферат
Предлагаемое изобретение относится к области медицины, а именно к сердечно-сосудистой хирургии, и может быть использовано при проведении операции на сердце с искусственным кровообращением.
При выполнении основного этапа операции на сердце с искусственным кровообращением (ИК) отсутствует кровоток по легочной артерии. Кровоснабжение легких осуществляется бронхиальными артериями через систему анастомозов. Однако известно, что кровоток по бронхиальным артериям обеспечивает не более 5% потребности легочной ткани в кислороде. В результате гипоперфузии развивается ишемия ткани легких с развитием регионального воспалительного ответа (Schlensak С. et al., 2001).
Кроме этого во время ИК отсутствует механическая вентиляция легких, что приводит к развитию микроателектазов, гидростатического отека легких, снижению легочного комплайнса и ассоциируется с более высокой частотой инфекционных осложнений (Magnusson L. et al., 1998).
Все эти факторы (гипоперфузия и гиповентиляция легких) в совокупности приводят к развитию легочной дисфункции после операций. Степень выраженности легочной дисфункции варьирует от кратковременного нарушения оксигенации до развития тяжелого респираторного дистресс-синдрома. Развитие легочной дисфункции после операции требует проведения комплекса дорогостоящей интенсивной терапии после операции, что приводит к более долгому пребыванию пациента в ОРИТ и увеличивает частоту неблагоприятных исходов.
Известные способы защиты легких при операциях с искусственным кровообращением.
1. Фармакологические
Обычно применяемые фармакологические агенты для предупреждения легочной дисфункции - кортикостероиды и апротинин. Было показано, что назначение кортикостероидов перед искусственным кровообращением снижало выброс провоспалительных медиаторов, таких как IL-6, IL-8 и TNF-α (Wan S., LeClerc J.L., Vincent J.L. Inflammatory response to cardiopulmonary bypass: mechanisms involved and possible therapeutic strategies [review] // Chest. - 1997. - Vol. 112. - P. 676-692), хотя мало влияло на активацию комплемента.
В экспериментах на свиньях было показано, что постперфузионная легочная функция, определяемая по альвеолярно-артериальному кислородному градиенту, легочному сосудистому сопротивлению и аккумуляции внеклеточной жидкости, была лучше сохранена в случаях подготовки метилпреднизолоном (Lodge A.J., Chai P.J., Daggett C.W. Methylprednisolone reduces the inflammatory response to cardiopulmonary bypass in neonatal piglets: timing of dose is important // Thorac. Cardiovasc. Surg. - 1999. - Vol. 117. - P. 515-522). Однако в рандомизированном клиническом исследовании пациенты, получавшие метилпреднизолон во время стернотомии или перед началом ИК, имели одинаковый или более высокий альвеолярно-артериальный кислородный градиент, показатели легочной шунтирующей функции и более длительное время интубации по сравнению с контрольной группой (Chaney М.А., Durazo-Arvizu R.A., Nikolov М.Р. Methylprednisolone does not benefit patients undergoing coronary artery bypass grafting and early tracheal extubation // Thorac. Cardiovasc. Surg. - 2001. - Vol. 121. - P. 561-569). Кроме того, терапия метилпреднизолоном была неспособна предотвратить снижение послеоперационной эластичности легких [28; 29].
Известно, что апротинин уменьшает легочное повреждение, увеличивая способность нейтрофила к деформации и ингибируя активность молекул адгезии в нейтрофилах. Повышение уровня IL-8 в бронхоальвеолярной жидкости и легочная нейтрофильная секвестрация после ИК были ингибированы после назначения апротинина (Hill G.E., Pohorecki R., Alonso A. Aprotinin reduces interleukin-8 production and lung neutrophil accumulation after cardiopulmonary bypass // Anesth. Analg. - 1996. - Vol. 83. - P. 696-700).
2. Лейкоцитарное обеднение (фильтрация) во время ИК может ограничивать послеоперационный воспалительный ответ, так как уменьшает продукцию IL-8, хотя его благоприятные эффекты на постперфузионную легочную функции были непостоянны (Gu Y.J., de Vries A.J., Vos P., Boonstra P.W., van Oeveren W. Leukocyte depletion during cardiac operation: a new approach through the venous bypass circuit // Ann. Thorac. Surg. - 1999. - Vol. 67. - P. 604-609). В некоторых исследованиях лейкоцитарное обеднение во время ИК незначимо улучшало послеоперационные уровни Рао2 и легочную гемодинамику (Mihaljevic Т., М., von Segesser L.K. The influence of leukocyte filtration during cardiopulmonary bypass on post-operative lung function: a clinical study // J. Thorac. Cardiovasc. Surg. - 1995. - Vol. 109. - P. 1138-1145).
3. Модификация контура для перфузии
Применение покрытых гепарином контуров ИК связано с уменьшенной активацией лейкоцитов и выбросом цитокинов, приводящих к менее выраженной воспалительной реакции после перфузии (Те Velthuis Н., Baufreton С., Jansen P.G. Heparin coating of extracorporeal circuits inhibits contact activation during cardiac operations // J. Thorac. Cardiovasc. Surg. - 1997. - Vol. 114. - P. 117). По сравнению с обычными контурами контуры с гепариновым покрытием могут улучшить легочный комплайнс, легочное сосудистое сопротивление и могут уменьшить внутрилегочное шунтирование (Ranucci М., Cirri S., Conti D. Beneficial effects of Duraflo II heparin-coated circuits on postperfusion lung dysfunction // Ann. Thorac. Surg. - 1996. - Vol. 61. - P. 76-81). Однако такие преимущества не были клинически значимыми (Watanabe Н., Miyamura Н., Hayashi J. The influence of a heparin-coated oxygenator during cardiopulmonary bypass on postoperative lung oxygenation capacity in pediatric patients with congenital heart anomalies // J. Card. Surg. - 1996. - Vol. 11. - P. 396-401).
4. Продленная гемофильтрация
Высокообъемная продленная гемофильтрация, удаляя потенциально деструктивные и воспалительные субстанции из циркуляции во время ИК, может значительно снизить системный отек и легочную гипертензию, тем самым улучшить функцию легких. Комбинированное использование сбалансированной и модифицированной ультрафильтрации может эффективно сконцентрировать кровь, изменить увеличение некоторых вредных воспалительных медиаторов, предупредить развитие отека легких и воспалительного повреждения легких и смягчить ухудшение легочной функции (Nagashima М., Shin'oka Т., Nollert G., Shum-Tim D., Rader С.М., Mayer J.E. Jr. High-volume continuous hemofiltration during cardiopulmonary bypass attenuates pulmonary dysfunction in neonatal lambs after deep hypothermic circulatory arrest // Circulation. - 1998. - Vol. 98 (suppl 2). - P. 378-384).
За прототип предлагаемого изобретения выбран известный способ защиты легких при операциях на сердце с искусственным кровообращением (ИК), включающем интубацию трахеи, проведение искусственной вентиляции легких (ИВЛ) и проведение ультрагемофильтрации во время ИК (Nagashima М., Shin'oka Т., Nollert G., Shum-Tim D., Rader С.М., Mayer J.E. Jr. High-volume continuous hemofiltration during cardiopulmonary bypass attenuates pulmonary dysfunction in neonatal lambs after deep hypothermic circulatory arrest // Circulation. - 1998. - Vol. 98 (suppl 2). - P. 378-384).
Известный способ осуществляют следующим образом.
После вводного наркоза пациенту выполняют интубацию трахеи и он переводится на искусственную вентиляцию легких (ИВЛ). После выполнения срединной стернотомии производят канюляцию аорты и полых вен, после чего переходят на ИК, отключают механическую вентиляцию легких. Во время ИК ультрагемофильтрацию с удалением избытка жидкости (1000-2000 мл с поддержанием гематокрита не менее 25%). Пережимают аорту и проводят фармакохолодовую кардиоплегию путем введения в корень аорты кристаллоидного кардиоплегического раствора (Кустодиол). После наступления полной электромеханической остановки сердца выполняют основной этап операции. После открытия аорты возобновляют механическую вентиляцию легких. Восстанавливают сердечную деятельность, проводят перевод больного на самостоятельное кровообращение, отключают аппарат искусственного кровообращения. Затем послойно ушивают операционную рану.
Основным существенным недостатком известного способа является отсутствие кровотока в легочной артерии и вентиляции легких, что приводит к развитию ишемических и реперфузионных повреждений легочной ткани. Результатом является развитие послеоперационной легочной дисфункции и в ряде случаев - острой дыхательной недостаточности.
Задачей предлагаемого способа является создание способа защиты легких при операциях на сердце с ИК, который лишен недостатков прототипа.
Технический эффект при использовании способа заключается в повышении эффективности защиты легких за счет предупреждения увеличения альвеолярно-артериального кислородного градиента (ААКГ), снижения индекса оксигенации и легочного комплайнса, а также увеличения внутрилегочного шунтирования после искусственного кровообращения.
Технический результат достигается тем, что в известном способе защиты легких при операциях на сердце с искусственным кровообращением (ИК), включающем интубацию трахеи, проведение искусственной вентиляции легких (ИВЛ) и проведение ультрагемофильтрации во время ИК, после начала ИВЛ и катетеризации центральной вены осуществляют инфузию алпростадила в дозе 0,002-0,005 мкг/кг/мин в течение проведения всей операции до перевода больного в реанимацию, проводят перфузию легочной артерии через дополнительную канюлю, которую устанавливают выше клапана легочной артерии, подключенную к дополнительному перфузионному насосу через дополнительную трассу с оксигенированной кровью, в которую продолжают инфузию алпростадила в дозе 0,002-0,005 мкг/кг/мин, при этом легочную перфузию выполняют с объемной скоростью 250-300 мл/мин, искусственную вентиляцию легких продолжают сниженными дыхательными объемами (дыхательный объем 5 мл/кг; частота дыхания 5-6 в минуту) во время искусственного кровообращения.
Предлагаемый способ отвечает критериям изобретения «новизна» и «изобретательский уровень», так как при проведении патентно-информационных исследований не обнаружено источников научно-медицинской и патентной документации, которые порочат новизну предлагаемого способа, равно как и технических решений с существенными признаками предлагаемого технического решения.
Известен препарат Алпростадил - синтетический аналог естественного простагландина E1 (ПГЕ1).
Фармакологическое действие - сосудорасширяющее, антиагрегантное.
Алпростадил обладает широким спектром фармакологического действия. Среди наиболее значимых его эффектов - вазодилатация, подавление агрегации тромбоцитов, стимулирующее влияние на гладкую мускулатуру кишечника, матки и других гладкомышечных органов. Улучшает микроциркуляцию, повышает периферический кровоток, оказывает вазопротективное действие. При системном введении вызывает расслабление гладкомышечных волокон сосудистой стенки, оказывает сосудорасширяющее действие, уменьшает ОПСС, понижает АД. При этом отмечается рефлекторное увеличение сердечного выброса и ЧСС. Способствует повышению эластичности эритроцитов, уменьшает агрегацию тромбоцитов и активность нейтрофилов, повышает фибринолитическую активность крови.
Гладкомышечные клетки артериального протока обладают высокой чувствительностью к действию алпростадила, что позволяет применять его у новорожденных детей с врожденными ductus-зависимыми пороками сердца, в т.ч. при митральной атрезии, атрезии легочной артерии, трехстворчатого клапана, тетраде Фалло. Алпростадил применяют для паллиативного лечения до проведения хирургической операции. Использование алпростадила позволяет поддерживать артериальный проток в открытом состоянии, что улучшает кровообращение и оксигенацию. Лечение алпростадилом в этом случае является в основном кратковременной мерой, но иногда (при необходимости отложить оперативное вмешательство) может потребоваться длительная терапия (до нескольких месяцев).
Алпростадил быстро метаболизируется, Т1/2 около 10 сек. При в/в введении примерно 80% (у здорового взрослого человека при одном прохождении - до 70-90%) циркулирующего алпростадила метаболизируется при «первом прохождении» через легкие, главным образом путем бета- и омега-окисления. В результате ферментативного окисления образуется несколько метаболитов, в т.ч. 15-кето-ПГЕ1; 13,14-дигидро-ПГЕ1 и 13,14-дигидро, 15-оксо-ПГЕ1. Кето-метаболиты обладают более низким по сравнению с алпростадилом биологическим эффектом. Метаболиты алпростадила выводятся преимущественно почками (около 90% введенной дозы в течение 24 ч), остальное - с фекалиями. Не отмечалось появления неметаболизированного алпростадила в моче, также отсутствуют данные о задержке алпростадила или его метаболитов в тканях.
Концентрат/диофилизат для приготовления раствора для инфузий применяют:
- хронические облитерирующие заболевания периферических артерий III-IV: облитерирующий эндартериит с тяжелой перемежающейся хромотой (если не показано хирургическое вмешательство), атеросклероз артерий конечностей, диабетическая ангиопатия, облитерирующий тромбангиит (болезнь Бюргера), синдром Рейно с трофическими нарушениями, васкулит, системная склеродермия, судороги икроножных мышц, нарушения периферического кровообращения в результате повреждающего воздействия физических факторов, особенно сверхпредельной вибрации. Врожденные ductus-зависимые пороки сердца у новорожденных (для временного поддержания функционирования артериального протока до проведения реконструктивной кардиохирургической операции), в т.ч. митральная атрезия, атрезия легочной артерии, трехстворчатого клапана, тетрада Фалло.
Авторами предлагаемого способа не выявлено сведений о применении препарата в качестве средства защиты легких при операциях на сердце с искусственным кровообращением.
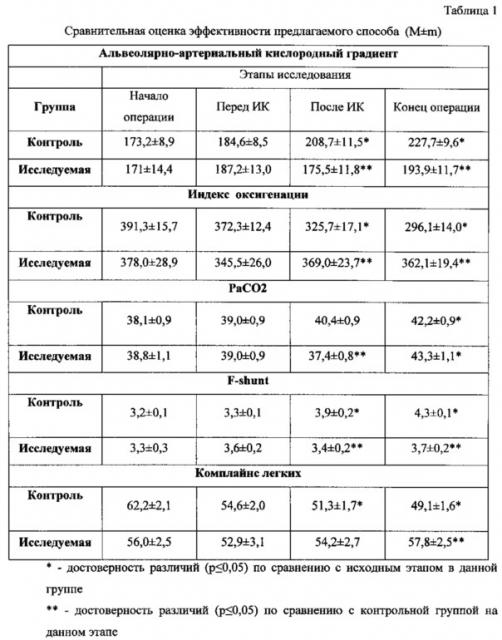
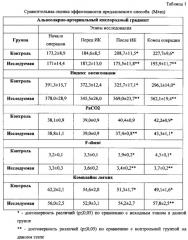
Технический результат при использовании предлагаемого способа заключается в обеспечении надежной и эффективной защиты легких при операциях с ИК за счет достижения более высоких значений индекса оксигенации и комплайнса легких, достоверно более низких значений альвеолярно-артериального кислородного градиента, внутрилегочного шунтирования (показатель F-shunt) на этапах после искусственного кровообращения,
На базе ГБУЗ НО «Специализированная кардиохирургическая клиническая больница» г. Нижнего Новгорода. С применением способа-прототипа было прооперировано 27 пациентов (контрольная группа), и с применением предлагаемого способа - 12 больных (исследуемая группа). В качестве сравнительных критериев эффективности защиты легких были использованы следующие показатели: альвеолярно-артериальный кислородный градиент; индекс оксигенации; РаСО2; показатель внутрилегочного шунтирования (F-shunt) и комплайнс легких. Результаты приведены в табл. 1.
Предлагаемый способ осуществляют следующим образом.
После вводного наркоза пациенту выполняют интубацию трахеи и переводят на искусственную вентиляцию легких (ИВЛ). Катетеризируют внутреннюю яремную вену или подключичную вену и лучевую артерию. Начинают инфузию алпростадила в/в в дозировке 0,002-0,005 мкг/кг/мин. После выполнения срединной стернотомии производят канюляцю аорты и полых вен, начинают искусственное кровообращение (ИК). Во время ИК проводят ультрагемофильтрацию с удалением избытка жидкости (1000-2000 мл с поддержанием гематокрита не менее 25%). Для обеспечения защиты легких во время основного этапа операции осуществляют перфузию легочной артерии и искусственную вентиляцию легких. Канюлю в легочную артерию устанавливают выше клапана легочной артерии, для проведения перфузии используют дополнительный насос аппарата искусственного кровообращения и дополнительную трассу с оксигенированной кровью, в которую вводят алпростадил в дозировке 0,002-0,005 мкг/кг/мин в течение всего времени перфузии легочной артерии, при этом легочную перфузию выполняют с объемной скоростью 250-300 мл/мин. Одновременно с этим изменяют параметры ИВЛ, уменьшая дыхательный объем до 50% от исходного, но не более 5 мл/кг, и снижая частоту дыхания до 5-6 раз в минуту. Пережимают аорту и проводят фармакохолодовую кардиоплегию путем введения в корень аорты кристаллоидного кардиоплегического раствора (Кустодиол). Когда происходит полная электромеханическая остановка сердца, выполняют основной этап операции, по окончании которого восстанавливают сердечную деятельность, проводят перевод больного на самостоятельное кровообращение. В этот момент переходят на исходные показатели механической вентиляции легких, прекращают перфузию легочной артерии. При стабилизации сердечной деятельности заканчивают искусственное кровообращение. Продолжают в/в введение алпростадила в дозировке 0,002-0,005 мкг/кг/мин до окончания операции. Затем послойно ушивают операционную рану и переводят пациента в отделение реанимации.
Пример конкретного применения предлагаемого способа дан в виде выписки из истории болезни.
Пациент Ф., 56 лет, поступил в ГБУЗ НО «СККБ» с диагнозом комбинированный митральный порок, комбинированный аортальный порок, недостаточность трикуспидального клапана. Диагноз подтвержден, выявлено высокое давление в главном стволе легочной артерии которое составило 62 мм рт.ст. Больному до операции была проведена предоперационная подготовка, пациент был взят в операционную. После вводного наркоза пациенту выполнена интубация трахеи и он переведен на искусственную вентиляцию легких. Частота дыхания составляла 10 раз в минуту, дыхательный объем 600 мл, FiO2=0,5. Катетеризирована правая внутренняя яремная вена и левая лучевая артерия. Исходный показатель комплайнса легких составил 50 мл/смН2О, индекс оксигенации 394, альвеолярно-артериальный кислородный градиент 247; РаСО2 составляло 46 мм рт.ст., показатель F-shunt составлял 3.1%. Больному начата в/в инфузия алпростадила в дозе 0,002 мкг/кг/мин. После выполнения срединной стернотомии была произведена канюляция аорты и полых вен. Перед началом искусственного кровообращения: комплайнс легких составил 62 мл/смН2, индекс оксигенации 406, альвеолярно-артериальный кислородный градиент 163, РаСО2 было 45 мм рт.ст., F-shunt составлял 3%. После начала искусственного кровообращения выполнена канюляция легочной артерии выше ее клапана и начата перфузия легочной артерии через отдельный насос аппарата и отдельную трассу оксигенированной кровью, куда вводился алпростадил в дозе 0,005 мкг/кг/мин в течение всего времени легочной перфузии. Легочную перфузию выполняют с объемной скоростью 250-300 мл/мин. Одновременно с этим изменили параметры искусственной вентиляции легких, уменьшив дыхательный объем до 300 мл (50% от исходного), и снизили частоту дыхания до 5 раз в минуту. После пережатия аорты и проведения комбинированной анте- и ретроградной фармакохолодовой кардиоплегии раствора Кустодиолом (2000 мл) начата ультрагемофильтрация, удалено 1000 мл избыточной жидкости. Выполнен основной этап операции: протезирование митрального клапана механическим протезом, протезирование аортального клапана механическим протезом, пластическая коррекция трехстворчатого клапана. Длительность пережатия аорты составила 98 мин. После открытия аорты параметры искусственной вентиляции легких были возвращены к исходным (дыхательный объем 600 мл, частота дыхания 10 раз в минуту, FiO2=0,5). Была прекращена перфузия легочной артерии. Продолжительность перфузии легочной артерии составила 110 мин. Восстановление сердечной деятельности самостоятельное. После стабилизации показателей гемодинамики и сократительной функции миокарда окончено искусственное кровообращение. Продолжительность его составила 126 мин, режим - нормотермический. После прекращения искусственного кровообращения: комплайнс составил 57 мл/смН2О, индекс оксигенации - 500, альвеолярно-артериальный кислородный градиент - 110 мм рт.ст., РаСО2 - 41 мм рт.ст., F-shunt составлял 2,16%. В постперфузионном периоде было продолжено в/в введение алпротадила в дозировке 0,002 мкг/кг/мин до момента окончания операции. Послойно ушита операционная рана. В конце операции: комплайнс легких составил 55 мл/смН2, индекс оксигенации - 380, альвеолярно-артериальный кислородный градиенту 170 мм рт.ст., РаСО2 - 46 мм рт.ст., F-shunt - 3.3%. Больной переведен в ОРИТ. ИВЛ в течение 7 часов. Пребывание в отделении реанимации 2 суток. Переведен в отделение в стабильном состоянии.
Способ защиты легких при операциях на сердце с искусственным кровообращением (ИК), включающий интубацию трахеи, проведение искусственной вентиляции легких (ИВЛ) и проведение ультрагемофильтрации во время ИК, отличающийся тем, что после начала ИВЛ и катетеризации центральной вены в нее осуществляют инфузию алпростадила в дозе 0,002- 0,005 мкг/кг/мин в течение проведения всей операции до перевода больного в реанимацию, проводят перфузию легочной артерии через дополнительную канюлю, установленную выше клапана легочной артерии, подключают ее к дополнительному перфузионному насосу через дополнительную трассу с оксигенированной кровью, в которую вводят алпростадил в дозе 0,002-0,005 мкг/кг/мин в течение всего времени перфузии легочной артерии, которую выполняют с объемной скоростью 250-300 мл/мин; во время искусственного кровообращения продолжают ИВЛ, уменьшая дыхательный объем до 50% от исходного, но не более 5 мл/кг, снижая частоту дыхания до 5-6 раз в минуту.