Липидный преконцентрат анионных фармакологически активных веществ с замедленным высвобождением и содержащая его фармацевтическая композиция
Иллюстрации
Показать всеНастоящая группа изобретений относится к области медицины, а именно к фармакологии, и раскрывает липидный преконцентрат с замедленным высвобождением анионного фармакологически активного вещества, а также фармацевтическую композицию для замедленного высвобождения анионного фармакологически активного вещества, которая содержит липидный преконцентрат. Липидный преконцентрат характеризуется тем, что содержит: a) по меньшей мере один формирователь жидких кристаллов; b) по меньшей мере один фосфолипид; c) по меньшей мере один отвердитель жидких кристаллов и d) по меньшей мере одну соль двух- или многовалентного металла, где преконцентрат с замедленным высвобождением существует в виде липидной жидкой фазы в отсутствие водной текучей среды и образует жидкие кристаллы под воздействием водной текучей среды. Изобретения обеспечивают фармацевтическую композицию с высоким уровнем безопасности и способностью к биодеградации. 2 н. и 11 з.п. ф-лы, 32 пр., 6 табл., 5 ил.
Реферат
Область техники
[1] Настоящее изобретение относится к липидному преконцентрату анионных фармакологически активных веществ с замедленным высвобождением и содержащей его фармацевтической композиции.
Уровень техники
[2] Возникнув в качестве многообещающих дозированных форм для снижения либо побочных эффектов, обусловленных множеством доз фармакологически активных веществ, которые необходимы для того, чтобы поддерживать эффективную концентрацию в плазме вещества в кровотоке в течение конкретного периода времени, либо частоты введения, составы с замедленным высвобождением экстенсивно исследованы. Состав с замедленным высвобождением представляет систему доставки лекарственного средства (DDS), разработанную для высвобождения однократной дозы фармакологически активного вещества в эффективной концентрации в течение определенного периода времени.
[3] PLGA [поли(молочная-когликолевая кислота)] представляет используемые в настоящее время биоразлагаемые материалы, которые одобрены Управлением по контролю за пищевыми продуктами и лекарственными средствами (FDA) для использования при замедленном высвобождении. PLGA представляет собой сополимер определенного типа, в котором молочную кислоту или лактид и гликолевую кислоту или гликолид сополимеризуют в различных соотношениях и который описан в патенте США № 5480656, для обеспечения возможности замедленного высвобождения фармакологически активных веществ посредством разложения PLGA на молочную кислоту и гликолевую кислоту в течение конкретного периода времени in vivo. Однако кислые продукты разложения PLGA вызывают воспаление, снижая клеточный рост (K. Athanasiou, G. G. Niederauer and C. M. Agrawal, Biomaterials, 17, 93 (1996)). Для замедленного высвобождения следует инъецировать твердые частицы PLGA 10-100 микрометров в диаметре, которые содержат лекарственное средство. Инъекцию твердых частиц PLGA сопровождают боль или воспаление. Следовательно, существует необходимость в новом составе с замедленным высвобождением, который обеспечивает эффективную концентрацию в плазме фармакологически активного вещества в кровотоке в течение пролонгированного периода времени при лучшем соблюдении пациентом схемы лечения.
[4] Ранее авторы настоящего изобретения представили преконцентрат с замедленным высвобождением, который содержит: a) по меньшей мере один формирователь жидких кристаллов; b) по меньшей мере один фосфолипид; и c) по меньшей мере один отвердитель жидких кристаллов, который существует в виде липидной жидкой фазы в отсутствие водной текучей среды и превращается в жидкий кристалл под воздействием водной текучей среды.
[5] Обнаружено, что преконцентрат, представленный авторами настоящего изобретения, когда к нему применяли нейтральные или жирорастворимые фармакологически активные вещества, высвобождал фармакологически активные вещества при замедленном высвобождении, с поддержанием эффективной концентрации в плазме в течение длительного периода времени. Однако для анионных лекарственных средств или лекарственных средств с суммарным зарядом (-) преконцентрат демонстрирует высокую начальную скорость высвобождения и короткое время поддержания эффективной концентрации в плазме, по сравнению с нейтральными или жирорастворимыми лекарственными средствами.
[6] Следовательно, требуется способ замедленного высвобождения без начального всплеска, посредством которого анионные лекарственные средства можно поддерживать в эффективной концентрации in vivo в течение пролонгированного периода времени.
[7] В завершение настоящего изобретения, интенсивные и тщательные исследования состава с замедленным высвобождением авторами настоящего изобретения привели к обнаружению того, что липидный преконцентрат с замедленным высвобождением, который содержит a) по меньшей мере один формирователь жидких кристаллов, b) по меньшей мере один фосфолипид, c) по меньшей мере один отвердитель жидких кристаллов и d) по меньшей мере одну соль двух- или многовалентного металла, существует в виде липидной жидкой фазы в отсутствие водной текучей среды и формирует жидкие кристаллы в водном текучем веществе, с высокой безопасностью и биологической разрушаемостью in vivo, и что когда объединен с e) по меньшей мере одним анионным фармакологически активным веществом, преконцентрат может высвобождать активное вещество в эффективной концентрации в течение длительного периода времени.
[8] Далее дана ссылка на известный уровень техники, релевантный настоящему изобретению.
[9] В публикации международного патента № WO 2005/117830 описан пресостав, который содержит нежидкокристаллическую смесь с низкой вязкостью из: по меньшей мере одного нейтрального диацильного липида и/или по меньшей мере одного токоферола, по меньшей мере одного фосфолипида и по меньшей мере одного биологически совместимого кислородсодержащего органического растворителя с низкой вязкостью. В публикации международного патента № WO 2006/075124 раскрыты пресоставы смеси с низкой вязкостью, содержащей по меньшей мере один диацилглицерин, по меньшей мере один фосфатидилхолин, по меньшей мере один кислородсодержащий органический растворитель и по меньшей мере один аналог соматостатина. Все эти пресоставы высвобождают фармакологически активные вещества in vivo в течение двух недель или дольше, но обнаружено, что используемые органические растворители снижают активность некоторых лекарственных средств (H. Ljusberg-Wahre, F. S. Nielse, 298, 328-332 (2005); H. Sah, Y. Bahl, Journal of Controlled Release 106, 51-61(2005)). Другое отличие от настоящего изобретения состоит в том, что соли двух- или многовалентных металлов не являются неотъемлемыми компонентами.
[10] В патенте США № 7731947 раскрыта композиция, которая содержит состав частиц, содержащий интерферон, сахарозу, метионин и цитратный буфер, и суспендирующий наполнитель, который содержит растворитель, такой как бензилбензоат, где состав частиц диспергируют в суспендирующем наполнителе. В одном из примеров описано, что фосфатидилхолин растворяют вместе с витамином E (токоферол) в органическом растворителе и используют для того, чтобы диспергировать в нем состав частиц. Однако эта композиция отличается от прозрачного и фильтруемого состава раствора по настоящему изобретению тем, что композицию используют для того, чтобы диспергировать твердые частицы и не допускать формирования жидких кристаллов.
[11] В патенте США № 7871642 раскрыт способ получения дисперсий для доставки фармакологически активного вещества, который включает диспергирование гомогенной смеси фосфолипида, полиоксиэтиленового соэмульсификатора, триглицерида и этанола в воде, где полиоксиэтиленовый соэмульсификатор выбран из сложных полиэтоксилированных сорбитановых эфиров жирных кислот (полисорбат) и полиэтоксилированных производных витамина E. Однако сложные полиэтоксилированные сорбитановые эфиры жирных кислот и полиэтоксилированные производные витамина E, полученные посредством сопряжения гидрофильного полимера полиоксиэтилена со сложным сорбитановым эфиром жирной кислоты и витамина E, соответственно, достаточно отличаются по структуре от сложного сорбитанового эфира жирной кислоты и витамина E. Их обычно используют в качестве гидрофильных поверхностно-активных веществ, используя свойство полиоксиэтилена, который отличается от компонента по настоящему изобретению.
[12] В патенте США № 5888533 раскрыта текучая композиция для формирования твердого биоразлагаемого импланта in situ внутри организма, который содержит неполимерный водонерастворимый биоразлагаемый материал; и биологически совместимый органический растворитель, который по меньшей мере частично делает растворимым материал и который можно смешивать или диспергировать в воде или текучих средах организма и который способен диффундировать или вымываться из композиции в текучую среду организма после размещения внутри организма, после чего неполимерный материал коагулирует или осаждается для формирования твердого импланта. В этой композиции стеролы, сложные холестериловые эфиры, жирные кислоты, глицериды жирных кислот, сложные эфиры сахарозы и жирных кислот, сложные сорбитановые эфиры жирных кислот, жирные спирты, сложные эфиры жирных спиртов и жирных кислот, ангидриды жирных кислот, фосфолипиды, ланолин, ланолиновые спирты и их смеси описаны в качестве неполимерного материала, а этанол используют в качестве растворителя. Однако отличия от настоящего изобретения заключаются в том, что данная композиция не может формировать жидкие кристаллы и предназначена для формирования твердых имплантов посредством простой коагуляции или осаждения водонерастворимых материалов, и что необходимо использовать много органического растворителя.
[13] В публикации международного патента № WO 2010/139278 раскрыт способ получения эмульсии «масло-в-воде», нагруженной лекарственным средством, которая содержит фосфатидилхолин в качестве поверхностно-активного вещества и α-токоферолацетат в качестве антиоксиданта. Однако эта композиция не образует жидкие кристаллы в водном текучем веществе и, кроме того, отличается от настоящего изобретения в отношении использования фосфатидилхолина в качестве поверхностно-активного вещества, отвечающего за растворение в масляной фазе или диспергирование в водной фазе, и α-токоферолацетата в качестве антиоксиданта.
[14] В публикации корейского патента № 10-2011-0056042 раскрыта нацеленная на опухоль фармацевтическая композиция в нанодисперсии, которая содержит лекарственное средство против злокачественной опухоли в качестве фармакологически активного вещества, двух- или трехвалентный ион переходного металла или ион щелочноземельного металла, масло и гиалуроновую кислоту или ее соль. Кроме того, описано, что масло может представлять собой α-токоферол или его соль, тогда как поверхностно-активное вещество представляет собой сорбитан моноолеат. Поскольку композиция имеет конечную форму наночастиц, которые получают посредством преципитации нанодисперсии, она отличается от композиции по настоящему изобретению, которая формирует жидкие кристаллы. Кроме того, двух- или трехвалентные ионы переходных металлов или ионы щелочноземельных металлов способствуют связыванию гиалуроновой кислоты или ее соли на поверхности наночастиц.
[15] В публикации международного патента № WO 2005/048930 описана инъецируемая композиция, которая содержит поверхностно-активное вещество, растворитель и полезное средство, где при воздействии гидрофильной среды из поверхностно-активного вещества и растворителя формируют вязкий гель, а полезное средство диспергируют или растворяют в геле. В качестве поверхностно-активного вещества, которое формирует вязкий гель в гидрофильной среде, используют фосфолипиды или пегилированные фосфолипиды, тогда как этанол или токоферол служат в качестве гидрофобного растворителя. Таким образом, эта композиция, которая образует вязкий гель в гидрофильной среде, отличается от композиции по настоящему изобретению, которая становится жидкими кристаллами при воздействии водной текучей среды.
[16] В публикации международного патента № WO 2010/108934 раскрыта везикулярная система доставки лекарственного средства, которая содержит по меньшей мере один липидный бислой, окружающий по меньшей мере одну водную полость; по меньшей мере одну молекулу малой интерферирующей рибонуклеиновой кислоты (миРНК), содержащуюся внутри водной полости; и по меньшей мере одно гидрофобное вещество лекарственного средства, встроенное в липидный бислой, и необязательно фармацевтически приемлемый эксципиент, выбранный из холестерина, полиэтиленгликоля (PEG) и токоферола. Однако фосфатидилхолин и эксципиент токоферол не могут формировать жидкие кристаллы при воздействии водной текучей среды, что составляет отличие от настоящего изобретения.
[17] В публикации международного патента № WO 2005/049069 инъецируемая гелевая композиция пролонгированного действия содержит гелевый наполнитель, который содержит биоразлагаемый биологически совместимый полимер и растворитель, несмешиваемый с водой, и в ней используют эксципиент для того, чтобы модулировать профили высвобождения и стабилизировать полезное средство. Среди эксципиентов модификаторы pH, включая неорганические соли, органические соли и их комбинации, и антиоксидант, в том числе d-α-токоферолацетат и d1-α-токоферолацетат. Однако, биоразлагаемую биологически совместимую PLGA, которая является неотъемлемым веществом в композиции, не находят в данном изобретении. Другое отличие от настоящего изобретения основано на использовании соли металла в качестве модификатора pH и токоферол ацетата в качестве антиоксиданта.
[18] В публикации международного патента № WO 2005/110360 описана липидная композиция, которая содержит по меньшей мере одно биологически активное соединение, мембранный липид, содержащий фосфатидилхолин, с температурой фазового перехода жидких кристаллов ниже 40°C, по меньшей мере один смешиваемый с водой фармацевтически приемлемый органический растворитель, фармацевтически приемлемый жидкий носитель и другие добавки, подходящие для инъекцирования. Под воздействием водной среды эта композиция превращается в вязкую липидную матрицу в жидкокристаллическом состоянии, таким образом делая возможным постепенное высвобождение биологически активного соединения. Однако, веществом, которое играет важную роль в композиции, является мембранный липид, который отличается от формирователя жидких кристаллов по настоящему изобретению.
[19] В публикации международного патента № WO 2008/139804 представлены наночастицы, содержащие низкомолекулярное лекарственное средство, которые имеют отрицательно заряженную группу, которую получают посредством гидрофобизации низкомолекулярного лекарственного средства, имеющего отрицательно заряженную группу, с ионом металла, и реакции гидрофобизированного продукта с PLGA. Однако отличие от настоящего изобретения состоит в использовании избытка органического растворителя при получении PLGA наночастиц и ионов металла при гидрофобизации лекарственных средств. Кроме того, эта композиция имеет ограниченное применение только к низкомолекулярным отрицательно заряженным лекарственным средствам, и отсутствуют упоминания о характеристиках высвобождения лекарственного средства in vivo.
[20]
Описание изобретения
Техническая проблема
[21] Следовательно задача настоящего изобретения состоит в том, чтобы предоставить липидный преконцентрат с замедленным высвобождением, основанный на фазовом переходе из липидной жидкой фазы в жидкие кристаллы, чтобы обеспечить возможность замедленного высвобождения анионных фармакологически активных веществ, с увеличением замедленного высвобождения посредством ионного взаимодействия между солями двух- или многовалентных металлов и анионными фармакологически активными веществами.
[22] Другая задача настоящего изобретения состоит в том, чтобы предоставить липидный преконцентрат с замедленным высвобождением, который сохраняет стабильность и биологическую разрушаемость, несмотря на присутствие солей двух- или многовалентных металлов.
[23]
Решение проблемы
[24] В соответствии с его аспектом, настоящее изобретение предусматривает липидный преконцентрат с замедленным высвобождением, который содержит: a) по меньшей мере один формирователь жидких кристаллов; b) по меньшей мере один фосфолипид; c) по меньшей мере один отвердитель жидких кристаллов и d) по меньшей мере одну соль двух- или многовалентного металла, который существует в виде липидной жидкой фазы в отсутствие водной текучей среды и формирует жидкие кристаллы под воздействием водной текучей среды.
[25] В соответствии с другим его аспектом, настоящее изобретение предусматривает фармацевтическую композицию, которая содержит e) по меньшей мере одно анионное фармакологически активное вещество плюс липидный преконцентрат с замедленным высвобождением, в котором анионное фармакологически активное вещество демонстрирует улучшенное замедленное высвобождение как результат ионного взаимодействия с солью двух- или многовалентного металла липидного преконцентрата с замедленным высвобождением.
[26] Далее приведено подробное описание каждого компонента.
[27]
[28] a) Формирователь жидких кристаллов
[29] Формирователь жидких кристаллов, используемый в настоящем изобретении, отвечает за формирование неслоистых жидких кристаллов и может быть выбран из группы, состоящей из сложного сорбитанового эфира ненасыщенной жирной кислоты, моноацилглицерина, диацилглицерина и их комбинации.
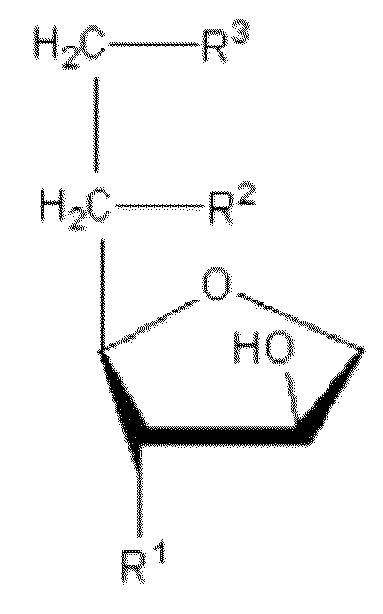
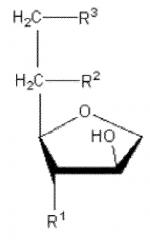
[30] Для применения в качестве формирователя жидких кристаллов в настоящем изобретении, сложный сорбитановый эфир ненасыщенной жирной кислоты предпочтительно имеет две или более –OH (гидроксильных) группы в полярной головке. Этот сложный сорбитановый эфир ненасыщенной жирной кислоты может быть представлен следующей химической формулой 1. Соединение химической формулы 1 представляет собой сложный сорбитановый моноэфир, где R1=R2=OH, R3=R, и сложный сорбитановый диэфир, где R1=OH, R2=R3=R, R представляет собой алкиловую сложноэфирную группу с 4-30 атомов углерода с по меньшей мере одной ненасыщенной связью.
[31] [Химическая формула 1]
[32]
[33] В деталях, сложный сорбитановый эфир ненасыщенной жирной кислоты по настоящему изобретению можно получать из китового жира и рыбьего жира, а также растительных масел и животных жиров и масел. Предпочтительные примеры растительных масел включают масло какао, масло бурачника, масло неполированного риса, масло зеленого чая, соевое масло, конопляное масло, сезамовое масло, масло косточек вишни, рапсовое масло, маковое масло, масло семян тыквы, масло виноградных косточек, масло абрикосовых ядрышек, кокосовое масло, масло камелии, масло энотеры, масло семян подсолнечника, масло канолы, масло кедрового ореха, масло грецкого ореха, масло лесного ореха, масло авокадо, миндальное масло, арахисовое масло, масло жожоба, пальмовое масло, касторовое масло, оливковое масло, кукурузное масло, хлопковое масло, масло семян сафлора и масло первоцвета. Предпочтительные примеры животных жиров и масел включают молочный жир, талловый говяжий жир, масло млекопитающего, масло рептилии и масло птицы. Предпочтительно его можно выбирать из сложного сорбитанового моноэфира, сложного сорбитанового сесквиэфира, сложного сорбитанового диэфира, который содержит жирную кислоту, полученную из китового жира и рыбьего жира, и их комбинации.
[34] Сложный сорбитановый моноэфир представляет собой соединение, в котором одну группу жирной кислоты присоединяют к сорбитану через сложноэфирную связь, и его можно выбирать из сорбитанмоноолеата, сорбитанмонолинолеата, сорбитанмонопальмитолеата, сорбитанмономиристолеата и их комбинации.
[35] Сложный сорбитановый сесквиэфир представляет собой соединение, в котором в среднем 1,5 группы жирной кислоты присоединяют к сорбитану через сложноэфирную связь, и его можно выбирать из сорбитансесквиолеата, сорбитансесквилинолеата, сорбитансесквипальмитолеата, сорбитансесквимиристолеата и их комбинации.
[36] Сложный сорбитановый диэфир представляет собой соединение, в котором две группы жирной кислоты присоединяют к сорбитану через сложноэфирную связь, и его можно выбирать из сорбитандиолеата, сорбитандилинолеата, сорбитандипальмитолеата, сорбитандимиристолеата и их комбинации.
[37] Для использования в настоящем изобретении сложный сорбитановый эфир ненасыщенной жирной кислоты предпочтительно выбирают из сорбитанмоноолеата, сорбитанмонолинолеата, сорбитанмонопальмитолеата, сорбитанмономиристолеата, сорбитансесквиолеата и их комбинации.
[38] Моноацилгликоль, который можно использовать в качестве формирователя жидких кристаллов в настоящем изобретении, состоит из глицерина в качестве полярной головки и одной жирной кислоты в качестве хвоста, со связью между ними через сложноэфирную связь, тогда как диацил глицерин содержит глицерин в качестве полярной головки с одинаковыми или различными двумя хвостами из жирных кислот, прикрепленными к нему через сложноэфирные связи. Группы жирных кислот, которые прикреплены к моно- или диацил глицерину через сложноэфирные связи, используемые в настоящем изобретении, жирные кислоты могут содержать одинаковое или различное число углеродных атомов в диапазоне от 4 до 30, и независимо могут быть насыщенными или ненасыщенными. Жирную кислоту можно выбирать из группы, состоящей из пальмитиновой кислоты, пальмитолеиновой кислоты, лауриновой кислоты, масляной кислоты, валериановой кислоты, капроновой кислоты, энантовой кислоты, каприловой кислоты, пеларгоновой кислоты, каприновой кислоты, миристиновой кислоты, миристолеиновой кислоты, стеариновой кислоты, арахидиновой кислоты, бегеновой кислоты, лигноцериновой кислоты, церотовой кислоты, линоленовой кислоты, α-линоленовой кислоты (ALA), эйкозапентаеновой кислоты (EPA), докозагексаеновой кислоты (DHA), линолевой кислоты (LA), γ-линолевой кислоты (GLA), дигомо-γ-линолевой кислоты (DGLA), арахидоновой кислоты (AA), олеиновой кислоты, вакценовой кислоты, элаидиновой кислоты, эйкозановой кислоты, эруковой кислоты, нервоновой кислоты и их комбинации.
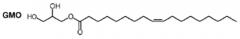
[39] В деталях, моноацилглицерин по настоящему изобретению можно выбирать из глицеринмонобутирата, глицеринмонобегената, глицеринмонокаприлата, глицеринмонолаурат, глицеринмонометакрилат, глицеринмонопальмитат, глицеринмоностеарата, глицеринмоноолеата, глицеринмонолинолеата, глицеринмоноарахидата, глицеринмоноарахидоната, глицеринмоноэруката и их комбинации. Предпочтительный пример моноацилглицерина представляет собой глицеринмоноолеат (GMO), представленный с помощью следующей химической формулы 2.
[40] [Химическая формула 2]
[41]
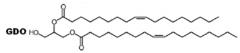
[42] Диацилглицерин по настоящему изобретению можно выбирать из глицериндибегената, гликольдилаурата, глицериндиметакрилата, глицериндипальмитата, глицериндистеарата, глицериндиолеата, глицериндилинолеата, глицериндиэруката, глицериндимиристата, глицериндирицинолеата, глицериндипальмитолеата и их комбинации. Предпочтительный пример диацилглицерина представляет собой глицериндиолеат (GDO, представлен следующей химической формулой 3.
[43] [Химическая формула 3]
[44]
[45]
[46] b) Фосфолипид
[47] Фосфолипиды необходимы для конструкции слоистых структур, таких как липосомы, в общепринятых способах, но не могут формировать неслоистую фазовую структуру, такую как жидкие кристаллы, самостоятельно. Однако фосфолипиды по настоящему изобретению участвуют в неслоистых фазовых структурах, формируемых с помощью формирователя жидких кристаллов, и вносят вклад в стабилизацию жидких кристаллов.
[48] Фосфолипид по настоящему изобретению получают из растений или животных, и он содержит насыщенную или ненасыщенную алкиловую сложноэфирную группу с 4-30 атомами углерода с полярной головкой. Фосфолипид можно выбирать из фосфатидилхолина, фосфатидилэтаноламина, фосфатидилсерина, фосфатидилглицерина, фосфатидилинозитола, фосфатидной кислоты, сфингомиелина и их комбинации в соответствии со структурой полярной головки. В фосфолипидах алкиловые сложноэфирные группы включают сложные эфиры насыщенных жирных кислот, такие как моно- и дипальмитоил, моно- и димиристоил, моно- и дилаурил и моно- и дистеарил, и цепи ненасыщенных жирных кислот, такие как моно- или дилинолеил, моно- и диолеил, моно- и дипальмитолеил и моно- и димиристолеил. Сложные эфиры насыщенных и ненасыщенных жирных кислот могут совместно существовать в фосфолипидах.
[49]
[50] c) Отвердитель жидких кристаллов
[51] Отвердитель жидких кристаллов по настоящему изобретению сам по себе не может формировать ни неслоистую структуру, в отличие от формирователя жидких кристаллов, ни слоистую структуру, такую как липосома, в отличие от фосфолипидов. Однако отвердитель жидких кристаллов участвует в неслоистых фазовых структурах и вносит вклад в увеличение упорядоченного сосуществования масла и воды посредством увеличения кривизны неслоистых структур. В интересах этой функции, отвердитель жидких кристаллов предпочтительно должен иметь очень ограниченный полярный фрагмент и большой неполярный фрагмент внутри своей молекулярной структуры.
[52] Однако на практике, биологически совместимые молекулы, которые можно инъецировать в организм, можно выбирать в качестве отвердителя жидких кристаллов по настоящему изобретению только через прямые и повторные эксперименты. Как результат, отвердители жидких кристаллов, подходящие для композиции по настоящему изобретению, имеют молекулярные структуры, которые отличаются друг от друга и, таким образом, не могут быть объяснены в качестве одной молекулярной структуры. Общий структурный признак, наблюдаемый при идентификации всех отвердителей жидких кристаллов, подходящих для композиции по настоящему изобретению, состоит в том, что они не содержат ионизируемые группы, такие как карбоксильные и аминогруппы, и имеют гидрофобные фрагменты, содержащие большую триацильную группу с от 15 до 40 углеродных атомов или структуру углеродного кольца.
[53] Отвердитель жидких кристаллов по настоящему изобретению может не содержать ионизируемые группы, такие как карбоксильные и аминогруппы, и имеет самое большее одну гидроксильную и сложноэфирную группу в качестве слабой полярной головки, с гидрофобными фрагментами, содержащими большую триацильную группу с от 20 до 40 углеродных атомов или структуру углеродного кольца. Предпочтительный пример отвердителя жидких кристаллов по настоящему изобретению можно выбирать из, но не ограничиваясь этим, триглицерида, ретинилпальмитата, токоферолацетата, холестерина, бензилбензоата, убихинона и их комбинации. Предпочтительно, отвердитель жидких кристаллов можно выбирать из токоферолацетата, холестерина и их комбинации.
[54]
[55] d) Соль двух- или многовалентного металла
[56] В структуре липосом или мицелл, содержащих фосфолипиды, ионы металла с положительными зарядами связываются с отрицательно заряженными фосфатными группами фосфолипидов (Journal of Lipid Research 8 (1967) 227-233). Кроме того, присутствие солей металлов ослабляет отталкивающую силу между отрицательными зарядами фосфатных групп, что увеличивает компактность липосомной или мицеллярной структуры (Chemistry and Physics of Lipids 151 (2008) 1-9).
[57] Частично или полностью формируя ионные связи с анионными фармакологически активными веществами, а также фосфатными группами фосфолипидов в жидкокристаллической структуре, соли двух- или многовалентных металлов по настоящему изобретению препятствуют тому, что анионные фармакологически активные вещества быстро покидали жидкокристаллическую структуру. Благодаря этому ионному взаимодействию, ионы металла могут значительно снижать начальный всплеск и улучшать замедленное высвобождение анионного фармакологически активного вещества. Со ссылкой на фиг. 1, схематически представлено ионное взаимодействие между анионными фармакологически активными веществами и солями двух- или многовалентных металлов внутри жидкокристаллической структуры.
[58] В солях двух- или многовалентных металлов по настоящему изобретению, пример фармацевтически приемлемых металлов включает соли алюминия, кальция, железа, магния, олова, титана и цинка, причем предпочтительны цинк, алюминий или кальций.
[59] В деталях, соль двух- или многовалентного металла можно выбирать из, но не ограничиваясь этим, карбоната алюминия, хлорида алюминия, гидроксида алюминия, оксида алюминия, фосфата алюминия, сульфата алюминия, бромида кальция, карбоната кальция, хлорида кальция, гидроксида кальция, нитрата кальция, оксида кальция, фосфата кальция, силиката кальция, сульфата кальция, ацетата кальция, хлорида железа (III), метагидроксида железа (III), оксида железа (III), сульфата железа (III), карбоната магния, хлорида магния, гидроксида магния, нитрата магния, оксида магния, фосфата магния, силиката магния, сульфата магния, хлорида олова, фторида олова, гидроксида олова, оксида олова (II), сульфата олова (II), диоксида титана, карбоната цинка, хлорида цинка, гидроксида цинка, нитрата цинка, оксида цинка, фосфата цинка, сульфата цинка, ацетата цинка и их комбинации.
[60] Предпочтительный пример соли двух- или многовалентного металла можно выбирать из хлорида алюминия, гидроксида алюминия, фосфата алюминия, бромида кальция, хлорида кальция, гидроксида кальция, оксида кальция, карбоната цинка, хлорида цинка, гидроксида цинка, ацетата цинка и их комбинации.
[61]
[62] e) Анионное фармакологически активное вещество
[63] Термин «анионное фармакологически активное вещество», как используют в настоящем документе, относится к фармакологически активному веществу, заряженному отрицательно или имеющему (-) суммарный заряд.
[64] Анионное фармакологически активное вещество по настоящему изобретению может быть в виде по меньшей мере одного, выбранного из карбоновой кислоты, сульфиновой кислоты, сульфоновой кислоты, фосфоновой кислоты, фосфорной кислоты, бороновой кислоты, бориновой кислоты, ароматического спирта, имида или галогенидных солей четвертичного аммония.
[65] Конкретные примеры анионного фармакологически активного вещества, которое можно использовать в настоящем изобретении, включают бортезомиб, метотрексат, олопатадин, тиотропий, ипратропий, гликопирроний, аклидиниум, умеклидиниум, троспиум, алендроновую кислоту, ибандроновую кислоту, инкадроновую кислоту, памидроновую кислоту, ризедроновую кислоту, золедроновую кислоту, этидроновую кислоту, клодроновую кислоту, тилудроновую кислоту, олпадроновую кислоту, неридроновую кислоту, диклофенак, левокабастин, индометацин, ибупрофен, флурбипрофен, фенопрофен, кетопрофен, напроксен, диклофенак, этодолак, сулиндак, толметин, салициловую кислоту, дифлунизал, оксапрозин, тиагабин, габапентин, ципрофлоксацин, левофлоксацин, фусидовую кислоту, аминолевулиновую кислоту, аминокапроновую кислоту, йодид изопропамида, хлорид тригексэтила, цефалексин, аспирин, индопрофен, леводопу, метилдопу, зомепирак, цефамандол, алклофенак, мефенамовую кислоту, флуфенамовую кислоту, лизиноприл, эналаприл, эналаприлат, каптоприл, рамиприл, фозиноприл, беназеприл, хинаприл, темокаприл, цилазаприл, валсартан, вальпроевую кислоту, кромоглициевую кислоту, траниласт, пантотеновую кислоту, метиазиновую кислоту, фентиазак, фенбуфен, пранопрофен, локсопрофен, дексибупрофен, алминопрофен, тиапрофеновую кислоту, ацеклофенак, налидиксовую кислоту, азелаиновую кислоту, микофеноловую кислоту, лейковорин, этакриновую кислоту, транексамовую кислоту, урсодезоксихолевую кислоту, фолиевую кислоту, меклофенамовую кислоту, карбенициллин, ребамипид, цетиризин, фексофенадин, летостеин, пробенецид, гопантеновую кислоту, баклофен, фуросемид, пиретанид, метилдопу, правастатин, лиотиронин, левотироксин, минодроновую кислоту, P-аминосалициловую кислоту, глюконовую кислоту, биотин, лираглутид, эксенатид, таспоглутид, албиглутид, ликсисенатид, интерферон альфа, интерферон бета, интерферон гамма, глюкагоноподобные пептиды, адренокортикотропный гормон, инсулин и инсулиноподобные факторы роста, паратиреоидный гормон и его фрагменты, дарбэпоэтин альфа, эпоэтин альфа, эпоэтин бета, эпоэтин дельта, инфликсимаб, инсулин, глюкагон, глюкагоноподобные пептиды, тиреотропный гормон, тиреостимулирующий гормон, паратиреоидный гормон, кальцитонин, адренокортикотропный гормон (ACTH), фолликулостимулирующий гормон, хорионический гонадотропин, гонадотропин-рилизинг гормон, соматотропин, GRF, липрессин, лютеинизирующий гормон, интерлейкин, гормон роста, простагландин, тромбоцитарные факторы роста (PDGF), факторы роста кератиноцитов (KGF), факторы роста фибробластов (FGF), эпидермальные факторы роста (EGF), трансформирующий фактор роста α (TGF-α), трансформирующий фактор роста β (TGF-β), эритропоэтин (EPO), инсулиноподобный фактор роста I (IGF-I), инсулиноподобный фактор роста II (IGF-II), фактор некроза опухоли α (TNF-α), фактор некроза опухоли β (TNF-β), колониестимулирующий фактор (CSF), фактор роста эндотелия сосудов (VEGF), тромбопоэтин (TPO), стромальные клеточные факторы (SDF), фактор роста плаценты (PIGF), фактор роста гепатоцитов (HGF), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), глиальный нейротрофический фактор (GDNF), гранулоцитарный колониестимулирующий фактор(G-CSF), цилиарный нейротрофический фактор (CNTF), фактор роста кости, морфогенетические белки кости (BMF), факторы свертывания крови, рилизинг-фактор гормонов поджелудочной железы, их аналоги и производные, их фармацевтически приемлемые соли и их комбинации.
[66] Предпочтительно, анионное фармакологически активное вещество можно выбирать из группы, состоящей из бортезомиба, метотрексата, олопатадина, лираглутида, эксенатида, таспоглутида, албиглутида, ликсисенатида, интерферона альфа, интерферона бета, интерферона гамма, тиотропия, ипратропия, гликопиррониума, аклидиниума, умеклидиниума, троспиума, алендроновой кислоты, ибандроновой кислоты, инкадроновой кислоты, памидроновой кислоты, ризедроновой кислоты, золедроновой кислоты, этидроновой кислоты, клодроновой кислоты, тилудроновой кислоты, олпадроновой кислоты, неридроновой кислоты, глюкагоноподобных пептидов, адренокортикотропного гормона, инсулина и инсулиноподобных факторов роста, паратиреоидного гормона и его фрагментов, дарбэпоэтина альфа, эпоэтина альфа, эпоэтина бета, эпоэтина дельта, диклофенака, левокабастина, индометацина, ибупрофена, флурбипрофена, фенопрофена, кетопрофена, напроксена, диклофенака, этодолака, сулиндака, толметина, салициловой кислоты, дифлунизала, оксапрозина, тиагабина, габапентина, ципрофлоксацина, левофлоксацина, фусидовой кислоты, аминолевулиновой кислоты, их фармацевтически приемлемых солей и их комбинации.
[67] Более предпочтительно, анионное фармакологически активное вещество можно выбирать из группы, состоящей из тиотропия, ипратропия, гликопиррониума, аклидиниума, умеклидиниума, троспиума, их фармацевтически приемлемых солей и их комбинации.
[68] Следует принимать во внимание, что анионное фармакологически активное вещество, применимое к липидному преконцентрату с замедленным высвобождением по настоящему изобретению не ограничено приведенными выше примерами лекарственных средств. При условии, что оно заряжено отрицательно, любое фармакологически активное вещество можно использовать в настоящем изобретении.
[69] В отношении pH композиции по настоящему изобретению, не существует каких-либо конкретных ограничений, если он попадает в типичный физиологически приемлемый диапазон. При необходимости, можно использовать модификатор pH. Его можно выбирать из, но не ограничиваясь этим, соляной кислоты, серной кислоты, борной кислоты, фосфорной кислоты, уксусной кислоты, гидроксида натрия, этаноламина, диэтаноламина и триэтаноламина.
[70] Как используют в настоящем документе, термин «водная текучая среда» предназначен для того, чтобы включать воду и текучие среды организма, такие как слизистый раствор, слезы, пот, слюна, желудочно-кишечная жидкость, внесосудистая жидкость, внеклеточная жидкость, интерстициальная жидкость и плазма. Под воздействием водной текучей среды композиция по настоящему изобретению подвергается переходу из липидной жидкой фазы в жидкокристаллическую фазу с полутвердыми свойствами. То есть, композиция по настоящему изобретению представляет собой преконцентрат, который существует в состоянии жидких липидов перед применением в организме человека и переходит в жидкокристаллическую фазу, обеспечивающую замедленное высвобождение внутри организма.
[71] Жидкие кристаллы, формируемые посредством композиции по настоящему изобретению, имеют неслоистую фазовую структуру, в которой масло и вода находятся в упорядоченной смеси и расположении без разграничения между внутренней и внешней фазами. Упорядоченное расположение