Фенилкарбаматные соединения для применения в предупреждении или лечении эпилепсии
Иллюстрации
Показать всеИзобретение относится к фармацевтической композиции для предупреждения или лечения эпилепсии, содержащей в качестве активного ингредиента фармацевтически эффективное количество фенилкарбаматного соединения, представленного химической формулой 1, его фармацевтически приемлемой соли, рацемата или энантиомера, где X представляет собой галоген; n означает целое число от 1 до 5; R1 представляет собой линейную или разветвленную алкильную группу С1-С4; А представляет собой карбамоильное производное, представленное формулой -С(О)NHR2, и В представляет собой Н; или А представляет собой Н и В представляет собой карбамоильное производное, представленное формулой –C(O)NHR3; и R2 и R3 могут быть одинаковыми или разными и независимо выбраны из группы, состоящей из водорода, линейной или разветвленной алкильной группы С1-С4, циклоалкильной группы С3-С8 и бензильной группы. Также изобретение относится к применению фенилкарбаматного соединения, представленного химической формулой 1, его фармацевтически приемлемой соли, рацемата или энантиомера в изготовлении лекарственного средства для лечения эпилепсии. Технический результат – применение фенилкарбаматного соединения в лечении эпилепсии. 2 н. и 2 з.п. ф-лы, 5 табл., 2 ил., 234 пр.
Химическая формула 1
Реферат
Область техники
Согласно настоящему изобретению предложены фенилкарбаматное соединение, фармацевтическая композиция для предупреждения и/или лечения эпилепсии, содержащая это фенилкарбаматное соединение в качестве активного ингредиента, и применение этого фенилкарбаматного соединения для предупреждения и/или лечения эпилепсии.
Предшествующий уровень техники
Эпилепсия является хроническим неврологическим расстройством, представляющим широкий спектр заболеваний, которое поражает приблизительно 50 миллионов людей по всему миру, что соответствует 1% от общего мирового показателя заболеваний, не уступая раку молочной железы у женщин и раку легкого у мужчин. Эпилепсия относится к клиническому феномену, а не к одной нозологической единице, поскольку существует множество форм и причин эпилепсии.
Важный шаг в диагностике и лечении пациента с припадком заключается в том, чтобы определить тип припадка, который возник. Основная характеристика, по которой проводят различие между разными категориями припадка, это является ли активность припадка парциальной или генерализованной.
По клиническим и энцефалографическим признакам различают четыре подтипа эпилепсии: большая эпилепсия (с подгруппами: генерализованная, фокальная, джексоновская), малая эпилепсия, психомоторная или височная эпилепсия (с подгруппами: психомоторная специфическая или тоническая с осевыми или торсионными движениями или жевательным признаком, автоматическая с амнезией или сенсорная с галлюцинациями или сумеречным помрачнением сознания) и автономная или диэнцефалическая эпилепсия (с приливом крови, бледностью, тахикардией, гипертензией, испариной или другими висцеральными симптомами).
Несмотря на испытания для разработки противоэпилептических лекарственных средств, эффективность лечения эпилепсии все еще не является удовлетворительной. Следовательно, существует потребность в улучшенных противоэпилептических лекарственных средствах.
Краткое изложение сущности изобретения
В одном воплощении предложено органическое соединение, т.е. фенилкарбаматное соединение. Более конкретно, это воплощение относится к фенилкарбаматному соединению приведенной ниже химической формулы 1, его рацемату, энантиомеру, диастереомеру, смеси энантиомеров или смеси диастереомеров или его фармацевтически приемлемой соли присоединения органической или неорганической кислоты, которые оказывают удивительно превосходный эффект в лечении эпилепсии, а также имеют очень низкую токсичность. Кроме того, соединения формулы I могут быть полезны в качестве лекарственного средства, в частности для лечения эпилепсии:
Химическая формула 1
где
Х представляет собой галоген, например хлор, фтор, йод или бром,
n, который означает количество заместителей X, означает целое число от 1 до 5, например 1 или 2,
R1 представляет собой линейную или разветвленную алкильную группу С1-С4, например метильную группу, этильную группу, изопропильную группу, или бутильную группу,
А представляет собой водород или карбамоильное производное, представленное формулой ,
В представляет собой водород, карбамоильное производное, представленное формулой , триалкилсилильные группы (например, группу триметилсилил (TMS), группу триэтилсилил (TES), группу триизопропилсилил (TIPS), группу трет-бутил-диметилсилил (TBDMS) и т.п.), триалкиларилсилильные группы (где суммарное количество алкильных и арильных групп равно трем; например, группу трет-бутил-дифенилсилил (TBDPS) и т.п.) или триалкилсилилэфирную группу, где каждая алкильная группа независимо может быть выбрана из группы, состоящей из линейных, разветвленных или циклических С1-С4 алкильных групп, и каждая арильная группа независимо может быть выбрана из группы, состоящей из С5-С8 арильных групп, предпочтительно фенильной группы,
А и В одновременно не являются карбамоильным производным, и
R2 и R3 могут быть одинаковыми или разными и независимо выбраны из группы, состоящей из водорода, линейной или разветвленной алкильной группы С1-С4, например С1-C3, циклоалкильной группы С3-С8, например С3-С7, и бензильной группы, и более конкретно R2 и R3 могут быть одинаковыми или разными и независимо выбраны из группы, состоящей из водорода, метильной группы, пропильной группы, изопропильной группы, циклопропильной группы, циклогексильной группы, бициклогептановой группы и бензильной группы.
В другом воплощении предложена фармацевтическая композиция для предупреждения и/или лечения эпилепсии, содержащая соединение химической формулы 1, его рацемат, энантиомер, диастереомер, смесь энантиомеров или смесь диастереомеров или его фармацевтически приемлемую соль в качестве активного ингредиента.
В другом воплощении предложен способ предупреждения и/или лечения эпилепсии, включающий введение терапевтически эффективного количества фенилкарбаматного соединения, представленного химической формулой 1, его рацемата, энантиомера, диастереомера, смеси энантиомеров или смеси диастереомеров или его фармацевтически приемлемой соли субъекту, нуждающемуся в предупреждении и/или лечении эпилепсии.
В другом воплощении предложено фенилкарбаматное соединение, представленное химической формулой 1, его рацемат, энантиомер, диастереомер, смесь энантиомеров или смесь диастереомеров или его фармацевтически приемлемая соль для применения в предупреждении и/или лечении эпилепсии или в изготовлении фармацевтической композиции для предупреждения и/или лечения эпилепсии.
ПОДРОБНОЕ ОПИСАНИЕ ВОПЛОЩЕНИЙ
Продолжая свою исследовательскую работу в области боли, авторы настоящего изобретения в результате исследований по разработке обезболивающих лекарственных средств обнаружили, что замещенные фенилкарбаматные соединения приведенной ниже химической формулы 1 проявляют удивительно превосходную противоэпилептическую активность в различных имитирующих моделях и одновременно имеют очень низкую токсичность.
Таким образом, в одном воплощении предложено органическое соединение, т.е. фенилкарбаматное производное, более конкретно фенилкарбаматное соединение, представленное приведенной ниже химической формулы 1, его рацемат, энантиомер, диастереомер, смесь энантиомеров или смесь диастереомеров или его фармацевтически приемлемая соль:
Химическая формула 1
где
Х представляет собой галоген, например хлор, фтор, йод или бром,
n, который означает количество заместителей X, означает целое число от 1 до 5, например 1 или 2,
R1 представляет собой линейную или разветвленную алкильную группу С1-С4, например метильную группу, этильную группу, изопропильную группу или бутильную группу,
А представляет собой водород или карбамоильное производное, представленное формулой ,
В представляет собой водород, карбамоильное производное, представленное формулой , триалкилсилильные группы (например, группу триметилсилил (TMS), группу триэтилсилил (TES), группу триизопропилсилил (TIPS), группу трет-бутил-диметилсилил (TBDMS), группу трет-бутил-дифенилсилил (TBDPS) и т.п.), триалкиларилсилильные группы (где общее количество алкильных и арильных групп равно трем, например группу трет-бутил-дифенил (TBDPS) и т.п.) или триалкилсилилэфирную группу, где каждая алкильная группа независимо может быть выбрана из группы, состоящей из линейных, разветвленных или циклических С1-С4 алкильных групп, и каждая арильная группа независимо может быть выбрана из группы, состоящей из С5-С8 арильных групп, предпочтительно фенильной группы,
А и В одновременно не являются карбамоильным производным, и
R2 и R3 могут быть одинаковыми или разными и независимо выбраны из группы, состоящей из водорода, линейной или разветвленной алкильной группы С1-С4, например С1-C3, циклоалкильной группы С3-С8, например С3-С7, и бензильной группы, и более конкретно R2 и R3 могут быть одинаковыми или разными и независимо выбраны из группы, состоящей из водорода, метильной группы, пропильной группы, изопропильной группы, циклопропильной группы, циклогексильной группы, бициклогептановой группы и бензильной группы.
В конкретном воплощении фенилкарбаматное соединение может быть выбрано из группы, состоящей из
1-(2-хлорфенил)-1-гидроксипропил-2-карбамата,
1-(2-хлорфенил)-1-гидроксибутил-2-карбамата,
1-(2-хлорфенил)-1-гидрокси-3-метил-бутил-2-карбамата,
1-(2-хлорфенил)-1-гидроксигексил-2-карбамата,
1-(2-хлорфенил)-1-гидроксипропил-2-N-метилкарбамата,
1-(2-хлорфенил)-1-гидроксипропил-2-N-пропилкарбамата,
1-(2-хлорфенил)-1-гидроксипропил-2-N-изопропилкарбамата,
1-(2-хлорфенил)-1-гидроксипропил-2-N-циклопропилкарбамата,
1-(2-хлорфенил)-1-гидроксипропил-2-N-циклогексилкарбамата,
1-(2-хлорфенил)-1-гидроксипропил-2-N-бензилкарбамата,
1-(2-хлорфенил)-1-гидроксипропил-2-N-бицикло[2,2,1]гептанкарбамата,
1-(2,4-дихлорфенил)-1-гидроксипропил-2-карбамата,
1-(2,6-дихлорфенил)-1-гидроксипропил-2-карбамата,
1-(2,4-дихлорфенил)-1-гидроксибутил-2-карбамата,
1-(2,6-дихлорфенил)-1-гидроксибутил-2-карбамата,
1-(2,4-дихлорфенил)-1-гидрокси-3-метил-бутил-2-карбамата,
1-(2,6-дихлорфенил)-1-гидрокси-3-метил-бутил-2-карбамата,
1-(2,4-дихлорфенил)-1-гидроксигексил-2-карбамата,
1-(2,6-дихлорфенил)-1-гидроксигексил-2-карбамата,
1-(2-хлорфенил)-2-гидроксипропил-1-карбамата,
1-(2-хлорфенил)-2-гидроксипропил-1-N-метилкарбамата,
1-(2-хлорфенил)-2-гидроксипропил-1-N-пропилкарбамата,
1-(2-хлорфенил)-2-гидроксипропил-1-N-изопропилкарбамата,
1-(2-хлорфенил)-2-гидроксипропил-1-N-циклопропилкарбамата,
1-(2-хлорфенил)-2-гидроксипропил-1-N-циклогексилкарбамата,
1-(2-хлорфенил)-2-гидроксипропил-1-N-бензилкарбамата,
1-(2,4-дихлорфенил)-2-гидроксипропил-1-карбамата,
1-(2,6-дихлорфенил)-2-гидроксипропил-1-карбамата,
1-(2,4-дихлорфенил)-2-гидроксибутил-1-карбамата,
1-(2,6-дихлорфенил)-2-гидроксибутил-1-карбамата,
1-(2,4-дихлорфенил)-2-гидрокси-3-метил-бутил-1-карбамата,
1-(2,6-дихлорфенил)-2-гидрокси-3-метил-бутил-1-карбамата,
1-(2,4-дихлорфенил)-2-гидроксигексил-1-карбамата,
1-(2,6-дихлорфенил)-2-гидроксигексил-1-карбамата,
1-(2-фторфенил)-1-гидроксипропил-2-карбамата,
1-(2-йодфенил)-1-гидроксипропил-2-карбамата,
1-(2-йодфенил)-1-гидроксибутил-2-карбамата,
1-(2,3-дихлорфенил)-1-гидроксипропил-2-карбамата и
1-(2,3-дихлорфенил)-2-гидроксипропил-1-карбамата.
В другом конкретном воплощении соединение может не включать 1-(2-хлорфенил)-1,2-пропандиол, 1-(2-хлорфенил)-1-гидроксибутил-2-карбамат и 1-(2,6-дихлорфенил)-1-гидроксибутил-2-карбамат.
В этом соединении имеется 2 хиральных атома углерода в положениях 1 и 2 фенильной группы, замещенной X, поэтому соединение может существовать в форме энантиомера, диастереомера, смеси энантиомеров или смеси диастереомеров, а также рацемата.
Альтернативно, соединение может находиться в форме фармацевтически приемлемой соли. Фармацевтически приемлемая соль может включать соль присоединения кислоты или основания и ее стереохимический изомер. Например, соединение может находиться в форме соли присоединения органической или неорганической кислоты. Соль не может быть конкретно ограничена и включает любые соли, которые сохраняют активность их родительских соединений при введении субъекту без нежелательных эффектов у субъекта. Такие соли могут включать неорганические и органические соли, такие как соли присоединения уксусной кислоты, азотной кислоты, аспарагиновой кислоты, сульфоновой кислоты, серной кислоты, малеиновой кислоты, глутаминовой кислоты, муравьиной кислоты, янтарной кислоты, фосфорной кислоты, фталевой кислоты, дубильной кислоты, винной кислоты, бромоводородной кислоты, пропионовой кислоты, бензолсульфоновой кислоты, бензойной кислоты, стеариновой кислоты, молочной кислоты, би-угольной кислоты, би-серной кислоты, би-винной кислоты, щавелевой кислоты, масляной кислоты, эдетат кальция, угольной кислоты, хлорбензойной кислоты, лимонной кислоты, этилендиаминтетрауксусной кислоты, толуолсульфоновой кислоты, фумаровой кислоты, глуцептиловой кислоты, эзиловой кислоты, памовой кислоты, глюконовой кислоты, метилазотной кислоты, малоновой кислоты, соляной кислоты, йодоводородной кислоты, гидроксинафтойной кислоты, изетионовой кислоты, лактобионовой кислоты, миндальной кислоты, слизевой кислоты, нафталиновой кислоты, муконовой кислоты, пара-нитрометансульфоновой кислоты, гексамовой кислоты, пантотеновой кислоты, моногидрофосфорной кислоты, дигидрофосфорной кислоты, салициловой кислоты, сульфаминовой кислоты, сульфаниловой кислоты, метансульфоновой кислоты и т.п. Соли присоединения основания могут включать соли щелочных металлов или щелочно-земельных металлов, такие как соли аммония, лития, натрия, калия, магния, кальция и т.п.; соли с органическим основанием, таким как бензатин, N-метил-D-глюкамин, гидрабамин и т.п.; и соли с аминокислотой, такой как аргинин, лизин и т.п. Кроме того, эти соли могут быть превращены в высвобождаемую форму путем обработки соответствующим основанием или кислотой.
Как продемонстрировано в приведенных ниже экспериментальных примерах, соединение химической формулы 1, его рацемат, энантиомер, диастереомер, смесь энантиомеров или смесь диастереомеров или его фармацевтически приемлемая соль оказывают превосходный эффект в предупреждении, улучшении и/или лечении эпилепсии. Таким образом, в еще одном воплощении предложена фармацевтическая композиция для предупреждения и/или лечения эпилепсии, содержащая фенилкарбаматное соединение, представленное химической формулой 1, его рацемат, энантиомер, диастереомер, смесь энантиомеров или смесь диастереомеров или его фармацевтически приемлемую соль в качестве активного ингредиента.
В другом воплощении предложен способ предупреждения и/или лечения эпилепсии, включающий введение фармацевтически эффективного количества фенилалкилкарбаматного соединения, представленного химической формулой 1, его рацемата, энантиомера, диастереомера, смеси энантиомеров или смеси диастереомеров или его фармацевтически приемлемой соли субъекту, нуждающемуся в предупреждении и/или лечении эпилепсии. Этот способ может дополнительно включать стадию идентификации субъекта, нуждающегося в предупреждении и/или лечении эпилепсии, перед стадией введения. В другом воплощении предложено фенилкарбаматное соединение, представленное химической формулой 1, его рацемат, энантиомер, диастереомер, смесь энантиомеров или смесь диастереомеров или его фармацевтически приемлемая соль для применения в предупреждении и/или лечении эпилепсии. В другом воплощении предложено применение фенилкарбаматного соединения, представленного химической формулой 1, его рацемата, энантиомера, диастереомера, смеси энантиомеров или смеси диастереомеров или его фармацевтически приемлемой соли для изготовления фармацевтической композиции для предупреждения и/или лечения эпилепсии.
В конкретном воплощении эпилепсия может включать эпилепсию, ассоциированную с нейродегенерацией (в головном мозге). В другом конкретном воплощении эпилепсия может не представлять собой эпилепсию, ассоциированную с мышечным спазмом.
Фармацевтическая композиция может быть приготовлена в различных формах для перорального или парентерального введения. Например, фармацевтическая композиция может быть приготовлена в форме для перорального введения, такой как таблетка, пилюля, мягкая или твердая капсула, жидкость, суспензия, эмульсия, сироп, гранулы, эликсиры и т.п. Помимо активного ингредиента форма для перорального введения может дополнительно содержать фармацевтически приемлемые и стандартные компоненты, например разбавитель, такой как лактоза, декстроза, сахароза, манит, сорбит, целлюлоза, глицин и т.п.; смазывающее вещество, такое как диоксид кремния, тальк, стеариновая кислота, ее магниевая или кальциевая соль, полиэтиленгликоль и т.п. В том случае, когда форма для перорального введения представляет собой таблетку, она может дополнительно содержать связывающее вещество, такое как алюмосиликат магния, крахмальная паста, желатин, трагакант, метилцеллюлоза, натрий-карбоксиметилцеллюлоза, поливинилпирролидин и т.п., и возможно может содержать одну или более добавок, выбранных из группы, состоящей из разрыхлителя, такого как крахмал, агар, альгинованая кислота или ее натриевая соль, адсорбента, красителя, корригента, подсластителя и т.п. Альтернативно, фармацевтическая композиция может быть также приготовлена в форме для парентерального введения, которую можно вводить подкожной инъекцией, внутривенной инъекцией, внутримышечной инъекцией, инъекцией в торакальную полость и т.п. Для того чтобы приготовить форму для парентерального введения, фармацевтическая композиция может быть приготовлена в виде раствора или суспензии, где активный ингредиент растворен в воде вместе со стабилизатором и/или буферным агентом, и такая форма раствора или суспензии может быть приготовлена в виде стандартной лекарственной формы в ампуле или аптечном пузырьке.
Фармацевтическая композиция может быть подвергнута стерилизации, и/или она может содержать дополнительные добавки, такие как консервант, стабилизатор, гидратирующий агент, ускоритель эмульгирования, соль и/или буферный агент для осморегуляции и т.п., и/или дополнительные терапевтически эффективные ингредиенты. Фармацевтическая композиция может быть приготовлена любым обычным способом смешивания, гранулирования, покрытия оболочкой и т.п.
Фармацевтическую композицию можно вводить млекопитающему, включая человека, в терапевтически эффективном количестве от 0,01 до 750 мг/кг (массы тела), предпочтительно от 0,1 до 500 мг/кг (массы тела) в сутки, в расчете на активный ингредиент. Фармацевтически эффективное количество может относиться к количеству, способному проявлять желаемый эффект, т.е. эффект лечения и/или предупреждения эпилепсии. Фармацевтически эффективное количество можно вводить пероральным или парентеральным путем (например, внутривенной инъекцией, внутримышечной инъекцией и т.д.) один или два или более раз в сутки.
Фармацевтически эффективное количество и путь введения фармацевтической композиции по настоящему изобретению могут быть надлежащим образом скорректированы специалистом в релевантной области с учетом состояния субъекта (пациента), желаемого эффекта и т.п. Субъектом может быть млекопитающее, включая человека, или клетки и/или ткани, извлеченные из него.
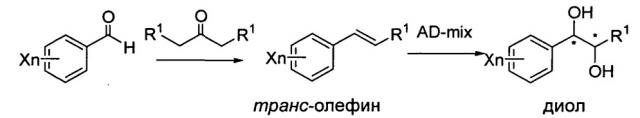
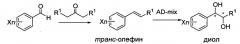
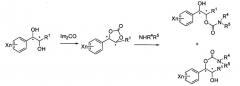
Карбаматное соединение по настоящему изобретению может быть получено согласно приведенной ниже реакционной схеме.
Реакционная схема I: Синтез диола-1
Диольное соединение, использованное в синтезе карбаматного соединения, может быть синтезировано путем дигидроксилирования транс-олефинового соединения. Диольное соединение, обладающее оптической активностью, может быть синтезировано с использованием катализатора асимметрического дигидроксилирования по Шарплессу.
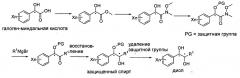
Реакционная схема II: Синтез диола-2
Как указано на Реакционной схеме II, оптически активное вещество диол может быть также синтезировано с использованием реагента-восстановителя после синтеза гидрокси-кетонного соединения с использованием галоген-миндальной кислоты. На Реакционной схеме II PG (защитная группа) может быть выбрана из группы, состоящей их триалкилсилильных групп (например, группы триметилсилил (TMS), группы триэтилсилил (TES), группы триизопропилсилил (TIPS), группы трет-бутил-диметилсилил (TBDMS) и т.п.), триалкиларилсилильных групп (где суммарное количество алкильных и арильных групп равно трем; например группы трет-бутил-дифенилсилил (TBDPS) и т.п.), сложноэфирной группы [Ас (ацетат), Bz (бензоат), Pv (пивалоат), Cbz (бензилкарбонат), ВОС (трет-бутилкарбонат), Fmoc (9-флуоренилметилоксикарбонил, Alloc (аллилкарбонат), Тroc (трихлорэтилкарбонат), пара-метоксибензоат, метилкарбонат и т.д.] и т.п., где каждая алкильная группа независимо может быть выбрана из группы, состоящей из линейных, разветвленных или циклических С1-С4 алкильных групп, и каждая арильная группа независимо может быть выбрана из группы, состоящей из С5-С8 арильных групп, предпочтительно фенильной группы.
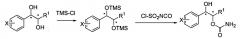
Реакционная схема III: Реакция карбамоилирования-1
Высокоселективная форма региоизомера монокарбамата диола, имеющего галогеновый заместитель на фенильном кольце (соединения Примеров 1-14 и 36-67 синтезированы по реакционной схеме III).
Реакционная схема IV: Реакция карбамоилирования-2
Два вещества в форме региоизомеров монокарбамата диола, имеющего галогеновый заместитель на фенильном кольце, могут быть разделены колоночной флэш-хроматографией с получением двух видов одного карбаматного соединения (соединения Примеров 15-35 и 68-115 синтезированы по реакционной схеме IV).
Реакционная схема V: Реакция введения защитных групп
На Реакционной схеме V PG (защитная группа) может быть выбрана из группы, состоящей их триалкилсилильных групп (например, группы триметилсилил (TMS), группы триэтилсилил (TES), группы триизопропилсилил (TIPS), группы трет-бутил-диметилсилил (TBDMS) и т.п.), триалкиларилсилильных групп (где суммарное количество алкильных и арильных групп равно трем; например, группы трет-бутил-дифенилсилил (TBDPS) и т.п.), сложноэфирной группы [Ас (ацетат), Bz (бензоат), Pv (пивалоат), Cbz (бензилкарбонат), ВОС (трет-бутил карбонат), Fmoc (9-флуоренилметилоксикарбонил, Alloc (аллилкарбонат), Troc (трихлорэтилкарбонат), пара-метоксибензоат, метилкарбонат и т.д.] и т.п., где каждая алкильная группа независимо может быть выбрана из группы, состоящей из линейных, разветвленных или циклических С1-С4 алкильных групп, и каждая арильная группа независимо может быть выбрана из группы, состоящей из С5-С8 арильных групп, предпочтительно фенильной группы.
На Реакционных схемах IV и V R4 и R5 могут быть одинаковыми или разными и независимо выбраны из группы, состоящей из водорода, линейной или разветвленной алкильной группы С1-С4, например С1-C3, циклоалкильной группы С3-С8, например С3-С7, и бензильной группы, и более конкретно R4 и R5 могут быть одинаковыми или разными и независимо выбраны из группы, состоящей из водорода, метильной группы, пропильной группы, изопропильной группы, циклопропильной группы, циклогексильной группы, бициклогептановой группы и бензильной группы.
Два вещества в форме региоизомеров монокарбамата диола, имеющего галогеновый заместитель на фенильном кольце, могут быть разделены колоночной флэш-хроматографией с получением двух видов одного карбаматного соединения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1 представляет собой график, показывающий значения ED50 в зависимости от времени, измеренные методом MES (максимальный электрошок).
Фиг. 2 представляет собой график, показывающий значения ED50 в зависимости от времени, измеренные методом scPTZ (подкожное введение пентилентетразола).
ПРИМЕРЫ
Настоящее изобретение далее разъясняется более подробно со ссылкой на приведенные ниже примеры. Эти примеры, однако, никоим образом не должны толковаться как ограничивающие объем настоящего изобретения.
Подготовительный пример 1: Синтез 1-(2-хлорфенил)-транс-1-пропена
48 мл 2-хлорбензолальдегида (0,42 моль) и 49,7 мл 3-пентанона (0,47 моль) растворяли в 600 мл гексана в колбе и затем перемешивали при растущей температуре. 53,6 мл эфирата трифторида бора (BF3OEt2, 0,42 моль) добавляли к полученной реакционной смеси в условиях дефлегмации. После завершения реакции добавляли воду. После разделения слоев полученный органический слой промывали дважды 1М раствором гидроксида натрия (1М NaOH), и затем органический слой отделяли и промывали водой. Отделенный органический слой дегидратировали безводным сульфатом магния (MgSO4) и концентрировали. Концентрированный остаток очищали колоночной хроматографией на силикагеле с получением указанного в заголовке соединения (38 г, выход 58%).
1H ЯМР (400 МГц, CDCl3) δ 1.94 (d, J=4.8 Гц, 3H), 6.24 (m, 1H), 6.78 (d, J=14 Гц, 1Н), 7.11-7.51 (m, 4H)
Подготовительный пример 2: Синтез 1-(2-хлорфенил)-транс-1-бутена
Осуществляли по существу такой же способ, как описано в Подготовительном примере 1, за исключением того, что 3-гептанон использовали вместо 3-пентанона, с получением указанного в заголовке соединения (2,9 г, выход 83%).
1H ЯМР (400 МГц, CDCl3) δ 1.14 (d, J=7.6 Гц, 3H), 2.29-2.33 (m, 2H), 6.28 (dt, J=16 Гц, 6.4 Гц, 1Н), 6.78 (d, J=15.6 Гц, 1H), 7.13-7.54 (m, 4H)
Подготовительный пример 3: Синтез 1-(2-хлорфенил)-3-метил-транс-1-бутена
Осуществляли по существу такой же способ, как описано в Подготовительном примере 1, за исключением того, что 2,6-диметил-гептан-4-он использовали вместо 3-пентанона, с получением указанного в заголовке соединения (8,0 г, выход 50-90%).
1H ЯМР (400 МГц, CDCl3) δ 1.14 (d, J=6.8 Гц, 6Н), 2.25-2.57 (m, 1H), 6.20 (dd, J=16 Гц, 7.2 Гц, 1H), 7.64 (d, J=16 Гц, 1H), 7.12-7.54 (m, 4H)
Подготовительный пример 4: Синтез 1-(2-хлорфенил)-транс-1-гексена
Осуществляли по существу такой же способ, как описано в Подготовительном примере 1, за исключением того, что 6-ундеканон использовали вместо 3-пентанона, с получением указанного в заголовке соединения (10 г, выход 85%).
1H ЯМР (400 МГц, CDCl3) δ 0.96 (t, J=7.2 Гц, 3H), 1.33-1.56 (m, 4H), 2.26-2.32 (m, 4H), 6.24 (dt, J=15.6 Гц, 7 Гц, 1H), 6.78 (d, J=16 Гц, 1H), 7.13-7.54 (m, 4H)
Подготовительный пример 5: Синтез 1-(2,4-дихлорфенил)-транс-1-пропена
Осуществляли по существу такой же способ, как описано в Подготовительном примере 1, за исключением того, что 2,4-дихлорбензолальдегид использовали вместо 2-хлорбензолальдегида, с получением указанного в заголовке соединения (2,4 г, выход 57%).
1H ЯМР (400 МГц, CDCl3) δ 1.95 (dd, J=6.8 Гц, 1.6 Гц, 3H), 6.24 (m, 1H), 6.72 (d, J=15.6 Гц, 1H), 7.18-7.44 (m, 3H)
Подготовительный пример 6: Синтез 1-(2,4-дихлорфенил)-транс-1-бутена
Осуществляли по существу такой же способ, как описано в Подготовительном примере 5, за исключением того, что 3-гептанон использовали вместо 3-пентанона, с получением указанного в заголовке соединения (2,1 г, выход 90%).
1H ЯМР (400 МГц, COCl3) δ 1.14 (d, J=7.6 Гц, 3H), 2.20-2.33 (m, 2H), 6.26 (dt, J=16 Гц, 6.8 Гц, 1H), 6.70 (d, J=15.6 Гц, 1H), 7.18-7.46 (m, 3H)
Подготовительный пример 7: Синтез 1-(2,6-дихлорфенил)-3-метил-тоанс-1-бутена
Осуществляли по существу такой же способ, как описано в Подготовительном примере 5, за исключением того, что 2,6-диметил-гептан-4-он использовали вместо 3-пентанона, с получением указанного в заголовке соединения (0,23 г, выход 10-40%).
1H ЯМР (400 МГц, CDCl3) δ 1.15 (d, J=6.8 Гц, 6Н), 2.53-2.58 (m, 1H), 6.19 (dd, J=16.4 Гц, 6.8 Гц, 1H), 6.31 (d, J=16.4 Гц, 1H), 7.18-7.46 (m, 3H)
Подготовительный пример 8: Синтез 1-(2,4-дихлорфенил)-транс-1-гексена
Осуществляли по существу такой же способ, как описано в Подготовительном примере 5, за исключением того, что 6-ундеканон использовали вместо 3-пентанона, с получением указанного в заголовке соединения (3,2 г, выход 40-80%).
1H ЯМР (400 МГц, CDCl3) δ 0.96 (t, J=7.2 Гц, 3H), 1.38-1.52 (m, 4H), 2.25-2.31 (m, 2H), 6.22 (dt, J=15.6 Гц, 6.8 Гц, 1Н), 6.70 (d, J=15.6 Гц, 1H), 7.18-7.46 (m, 3H)
Подготовительный пример 9: Синтез 1-(2,6-дихлорфенил)-транс-1-пропена
Осуществляли по существу такой же способ, как описано в Подготовительном примере 1, за исключением того, что 2,6-дихлорбензолальдегид использовали вместо 2-хлорбензолальдегида, с получением указанного в заголовке соединения (0,4 г, выход 10-40%).
1H ЯМР (400 МГц, CDCl3) δ 1.98 (d, J=8 Гц, 3H), 6.23-6.31 (m, 1H), 6.40 (d, J=16 Гц, 1H), 7.05-7.32 (m, 3H)
Подготовительный пример 10: Синтез 1-(2,6-дихлорфенил)-транс-1-бутена
Осуществляли по существу такой же способ, как описано в Подготовительном примере 9, за исключением того, что 3-гептанон использовали вместо 3-пентанона, с получением указанного в заголовке соединения (1,2 г, выход 10-40%).
1H ЯМР (400 МГц, CDCl3) δ 1.17 (t, J=7.6 Гц, 3H), 2.30-2.37 (m, 2H), 6.29 (dt, J=16.4 Гц, 6 Гц, 1H), 6.37 (d, J=16.4 Гц, 1H), 7.05-7.32 (m, 3H)
Подготовительный пример 11: Синтез 1-(2,6-дихлорфенил)-3-метил-транс-1-бутена
Осуществляли по существу такой же способ, как описано в Подготовительном примере 9, за исключением того, что 2,6-диметил-гептан-4-он использовали вместо 3-пентанона, с получением указанного в заголовке соединения (0,23 г, выход 10-40%).
1H ЯМР (400 МГц, CDCl3) δ 1.15 (d, J=6.8 Гц, 6Н), 2.53-2.58 (m, 1H), 6.19 (dd, J=16.4 Гц, 6.8 Гц, 1H), 6.31 (d, J=16.4 Гц, 1H), 7.05-7.32 (m, 3H)
Подготовительный пример 12: Синтез 1-(2,6-дихлорфенил)-транс-1-гексена
Осуществляли по существу такой же способ, как описано в Подготовительном примере 9, за исключением того, что 6-ундеканон использовали вместо 3-пентанона, с получением указанного в заголовке соединения (0,2 г, выход 10-40%).
1H ЯМР (400 МГц, CDCl3) δ 0.99 (t, J=7.2 Гц, 3H), 1.14-1.59 (m, 4H), 2.30-2.36 (m, 2H), 6.24 (dt, J=16 Гц, 6.6 Гц, 1H), 6.38 (d, J=16.4 Гц, 1H), 7.05-7.33 (m, 3H)
Подготовительный пример 13: Синтез 1-(2,3-дихлорфенил)-транс-1-пропена
Осуществляли по существу такой же способ, как описано в Подготовительном примере 1, за исключением того, что 2,3-дихлорбензолальдегид использовали вместо 2-хлорбензолальдегида, с получением указанного в заголовке соединения (0,2 г, выход 10-40%).
1H ЯМР (400 МГц, CDCl3) δ 1.94 (d, J=4.8 Гц, 3H), 6.24 (m, 1H), 6.78 (d, J=14 Гц, 1H), 7.11-7.51 (m, 3H)
Подготовительный пример 14: Синтез 1-(2-хлорфенил)-(S,S)-1,2-пропандиола
1-(2-Хлорфенил)-транс-1-пропен (1,5 г, Подготовительный пример 1) растворяли в 30 мл смеси t-BuOH/H2O (1:1 (об./об.)). При 0°C добавляли AD-mix-α (Aldrich, U.S.A.) (13,7 г) и метансульфонамид (CH3SO2NH2, 0,76 г, 0,0080 моль), и смесь перемешивали в течение ночи. После завершения реакции полученный продукт промывали водным раствором сульфита натрия (Na2SO3) и этилацетатом (ЕА). Затем органический слой дегидратировали безводным сульфатом магния (MgSO4), фильтровали и концентрировали при пониженном давлении. Концентрированный остаток очищали колоночной хроматографией на силикагеле с получением указанного в заголовке соединения (1,65 г, выход 90%).
1H ЯМР (400 МГц, CDCl3) δ 1.20 (d, J=6.4 Гц, 3H), 2.48 (d, J=4.0 Гц 1Н), 2.92 (d, J=4.4 Гц, 1Н), 3.93-3.97 (m, 1Н), 4.97 (t, J=4.8 Гц, 1Н), 7.22-7.51 (m, 4H)
13С ЯМР (100 МГц, CDCl3) δ 18.8, 71.5, 74.4, 127.1, 128.1, 128.9, 129.5, 132.6, 138.9
Подготовительный пример 15: Синтез 1-(2-хлорфенил)-(R,R)-1,2-пропандиола
1-(2-Хлорфенил)-транс-1-пропен (2,5 г, Подготовительный пример 1) растворяли в 50 мл смеси t-BuOH/H2O (1:1 (об./об.)). При 0°C добавляли AD-mix-α (Aldrich, U.S.A.) (23,5 г) и метансульфонамид (CH3SO2NH2, 1,27 г, 0,013 моль), и смесь перемешивали в течение ночи. После завершения реакции полученный продукт промывали водным раствором сульфита натрия (Na2SO3) и этилацетатом (ЕА). Затем органический слой дегидратировали безводным сульфатом магния (MgSO4), фильтровали и концентрировали при пониженном давлении. Концентрированный остаток очищали колоночной хроматографией на силикагеле с получением указанного в заголовке соединения (2,96 г, выход 90%).
1H ЯМР (400 МГц, CDCl3) δ 1.20 (d, J=6.4 Гц, 3H), 2.48 (d, J=4.0 Гц, 1Н), 2.92 (d, J=4.4 Гц, 1Н), 3.93-3.97 (m, 1Н), 4.97 (t, J=4.8 Гц, 1Н), 7.22-7.51 (m, 4H)
Подготовительный пример 16: Синтез смеси 1-(2-хлорфенил)-(S,S)-1,2-пропандиола и 1-(2-хлорфенил)-(R,R)-1,2-пропандиола
и
1-(2-Хлорфенил)-транс-1-пропен (6,53 г, Подготовительный пример 1) растворяли в 45 мл смеси ацетон/t-BuOH/H2O (5:1:1 об./об.). При комнатной температуре добавляли N-метилморфолин-N-оксид (7,51 г) и OsO4 (0,54 г), и смесь перемешивали в течение 2-3 часов. После завершения реакции полученный продукт промывали водой и метиленхлоридом (МС). Затем органический слой дегидратировали безводным сульфатом магния (MgSO4), фильтровали и концентрировали при пониженном давлении. Концентрированный остаток очищали колоночной хроматографией на силикагеле с получением указанного в заголовке соединения (6,42 г, выход 80%).
1H ЯМР (400 МГц, CDCl3) δ 1.20 (d, J=6.4 Гц, 3H), 2.48 (d, J=4.0 Гц, 1Н), 2.92 (d, J=4.4 Гц, 1Н), 3.93-3.97 (m, 1Н), 4.97 (t, J=4.8 Гц, 1Н), 7.22-7.51 (m, 4H)
Подготовительный пример 17: Синтез 1-(2-хлорфенил)-(S,S)-1,2-бутандиола
Осуществляли по существу такой же способ, как описано в Подготовительном примере 14, за исключением того, что 1-(2-хлорфенил)-транс-1-бутен (Подготовительный пример 2) использовали вместо 1-(2-хлорфенил)-транс-1-пропена (Подготовительный пример 1), с получением указанного в заголовке соединения (0,36 г, выход 95%).
1H ЯМР (400 МГц, CDCl3) δ 1.01 (t, J=7.4 Гц, 3H), 1.52-1.65 (m, 2H), 2.01 (d, J=4.4 Гц, 1Н), 2.74 (d, J=5.2 Гц, 1Н), 3.69-3.75 (m, 1Н), 5.05 (t, J=5.0 Гц, 1Н), 7.23-7.54 (m, 4H)
Подготовительный пример 18: Синтез 1-(2-хлорфенил)-(R,R)-1,2-бутандиола
Осуществляли по существу такой же способ, как описано в Подготовительном примере 15, за исключением того, что 1-(2-хлорфенил)-транс-1-бутен (Подготовительный пример 2) использовали вместо 1-(2-хлорфенил)-транс-1-пропена (Подготовительный пример 1), с получением указанного в заголовке соединения (0,84 г, выход 60-95%).
1H ЯМР (400 МГц, CDCl3) δ 1.01 (t, J=7.4 Гц, 3H), 1.52-1.65 (m, 2H), 2.01 (d, J=4.4 Гц, 1H), 2.74 (d, J=5.2 Гц, 1H), 3.69-3.75 (m, 1H), 5.05 (t, J=5.0 Гц, 1Н), 7.23-7.54 (m, 4H)
Подготовительный пример 19: Синтез смеси 1-(2-хлорфенил)-(S,S)-1,2-бутандиола и 1-(2-хлорфенил)-(R,R)-1,2-бутандиола
и
Осуществляли по существу такой же способ, как описано в Подготовительном примере 16, за исключением того, что 1-(2-хлорфенил)-транс-1-бутен (Подготовительный пример 2) использовали вместо 1-(2-хлорфенил)-транс-1-пропена (Подготовительный пример 1), с получением указанного в заголовке соединения (5,1 г, выход 60-90%).
1H ЯМР (400 МГц, CDCl3) δ 1.01 (t, J=7.4 Гц, 3H), 1.52-1.65 (m, 2H), 2.01 (d, J=4.4 Гц, 1H), 2.74 (d, J=5.2 Гц, 1H), 3.69-3.75 (m, 1H), 5.05 (t, J=5.0 Гц, 1H), 7.23-7.54 (m, 4H)
Подготовительный пример 20: Синтез 1-(2-хлорфенил)-3-метил-(S,S)-1,2-бутандиола
Осуществляли по существу такой же способ, как описано в Подготовительном примере 14, за исключением того, что 1-(2-хлорфенил)-3-метил-транс-1-бутен (Подготовительный пример 3) использовали вместо 1-(2-хлорфенил)-транс-1-пропена (Подготовительный пример 1), с получением указанного в заголовке соединения (0,96 г, выход 60-90%).
1H ЯМР (400 МГц, CDCl3) δ 1.07 (t, J=7.2 Гц, 6Н), 1.83-1.89 (m, 1H), 1.92 (d, J=5.6 Гц, 1H), 2.69 (d, J=6.4 Гц, 1H), 3.53-3.56 (m, 1H), 5.22-5.25 (m, 1H), 7.23-7.55 (m, 4H)
Подготовительный пример 21: Синтез 1-(2-хлорфенил)-3-метил-(R,R)-1,2-бутандиола
Осуществляли по существу такой же способ, как описано в Подготовительном примере 15, за исключением того, что 1-(2-хлорфенил)-3-метил-транс-1-бутен (Подготовительный пример 3) использовали вместо 1-(2-хлорфенил)-транс-1-пропена (Подготовительный пример 1), с получением указанного в заголовке соединения (4,2 г, выход 60-90%).
1H ЯМР (400 МГц, CDCl3) δ 1.07 (t, J=7.2 Гц, 6H), 1.82-1.90 (m, 1H), 1.93 (d, J=5.6 Гц, 1H), 2.79 (d, J=6 Гц, 1H), 3.53-3.57 (m, 1H), 5.23-5.25 (m, 1H), 7.23-7.54 (m, 4H)
Подготовительный пример 22: Синтез смеси 1-(2-хлорфенил)-3-метил-(S,S)-1,2-бутандиола и 1-(2-хлорфенил)-3-метил-(R,R)-1,2-бутандиола
и
Осуществляли по