Соединения для нацеленной доставки лекарственного средства и усиления активности siphk
Иллюстрации
Показать всеИзобретение относится к соединениям формулы I, которые могут найти применение для улучшения доставки терапевтических лекарственных средств и усиления их активности. В формуле I R1 и R2 независимо выбираются из группы, состоящей из С12-С18 алкильной, С12-С18 алкенильной и олеильной группы; R3 и R4 независимо выбираются из группы, состоящей из С1-С6 алкила и С2-С6 алканола; X выбирается из группы, состоящей из -СН2- и -S-, или отсутствует; Y выбирается из -(CH2)n и -S(CH2)n, где n=1-4; а=1-4; b=1-4; с=1-4 и Z является противоионом. Изобретение относится также к специфичному к звездчатым клеткам носителю для лекарственного средства, содержащему специфичное к звездчатым клеткам количество молекулы ретиноида и катионного липида, состоящего из соединения формулы I. 2 н. и 29 з.п. ф-лы, 16 ил., 14 табл., 43 пр.
Реферат
РОДСТВЕННЫЕ ЗАЯВКИ НА ПОЛУЧЕНИЕ ПАТЕНТА
Настоящая заявка испрашивает приоритет согласно предварительным заявкам на патент США №61/494840 и 61/494710, поданным 8 июня 2011 г., которые включены в настоящий документ в полном объеме посредством ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к применению катионных липидов и соединений жирорастворимых витаминов на нацеливания и усиления активности терапевтических молекул, включая siPHK.
УРОВЕНЬ ТЕХНИКИ
Фиброз печени может быть вызван звездчатыми клетками печени (HSC), приводящими к тому, что множество типов молекул коллагена и фибронектина осаждается на интерстициальной ткани. Это приводит к циррозу печени, печеночной недостаточности и/или гепатоцеллюлярной карциноме. Кроме того, хронический панкреатит развивается в результате панкреатического фиброза по тому же механизму, что и фиброз печени (Madro, et al., 2004; Med Sci Monit. 10: RA166-70; Jaster, 2004, Mol Cancer. 6:26). Кроме того, звездчатые клетки участвуют в нарушениях в голосовых связках и гортани, таких как рубцевание голосовых связок, фиброз слизистой оболочки голосовых связок и ларингеальный фиброз. Для профилактики или лечения фиброза в этих органах и в другом месте в организме необходимо разработать носитель для лекарственного средства и набор носителя для лекарственного средства.
[Звездчатые клетки являются одним из важных целевых кандидатов для лечения фиброза (Fallowfield et al., 2004, Expert Opin Ther Targets. 8:423-35; Pinzani, et al., 2004, Dig Liver Dis. 36: 231-42). В ходе фиброза звездчатые клетки активируются цитокинами из близлежащих клеток. Звездчатые клетки известны как клетки, несущие витамин A и принадлежащие к семейству миофибробластов, и они продуцируют множество факторов, которые вызывают фиброз печени.
С помощью терапевтических способов профилактики или лечения фиброза пытаются контролировать метаболизм коллагена, содействовать системе разрушения коллагена и ингибировать активацию звездчатых клеток. Однако во всех этих случаях низкая специфичность действия и/или низкая специфичность к органу вызывают проблемы, связанные с ограниченной эффективностью и нежелательными побочными эффектами.
Ингибирование синтеза белка коллагена не было установлено как терапевтический способ. Потенциал молекул, направленный на продуцирование коллагена, ограничен возможностью возникновения побочных эффектов. Непосредственное ингибирование продуцирования коллагена обеспечивает другой терапевтический способ профилактики или лечения фиброза. В таком способе требуется контролирование одного или более различных типов коллагена типов I-IV. Этот способ может осуществляться через белок теплового шока (HSP47), специфичный к коллагену молекулярный шаперон, который необходим для внутриклеточного транспорта и молекулярного созревания, необходимого для всех типов коллагена. Поэтому если функция HSP47 может специфически контролироваться в звездчатых клетках, существует возможность ингибирования фиброза печени.
Ряд методик доступен для доставки терапевтического агента, такого как siPHK в клетке, включая применение вирусных трансфекционных систем и невирусных трансфекционных систем. Невирусные трансфекционные системы могут включать, например, полимеры, липиды, липосомы, мицеллы, дендримеры и наноматериалы. Примеры полимеров, которые ранее были изучены для клеточной трансфекции включают катионные полимеры, такие как поли(L-лизин) (PLL), полиэтиленимин (PEI), хитозан и поли(2-диметиламино)этилметакрилат (pDMAEMA).
Система каждого типа имеет свои соответствующие преимущества и недостатки. Например, вирусные системы могут обеспечивать высокую эффективность трансфекции, но не могут быть такими безопасными, как некоторые невирусные системы. Кроме того, вирусные системы могут быть сложными и/или дорогостоящими для получения. Невирусные трансфекционные системы, такие как катионные полимеры, были предложены для трансфекции плазмидной ДНК в клетки. Однако некоторые недостатки катионные полимеров включают их токсичность по отношению к клетке и/или недостаток стабильности.
Таким образом, существует потребность в новых соединениях, композициях и способах применения катионных компонентов для улучшения доставки терапевтических лекарственных средств, включая нуклеиновые кислоты, в клетки, ткани и организмы.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Одним объектом настоящего изобретения являются соединения формулы I
где R1 и R2 независимо выбирается из группы, состоящей из C10-C18 алкильной, C12-C18 алкенильной и олеильной группы; где R3 и R4 независимо выбираются из группы, состоящей из C1-C6алкила и C2-C6алканола; где X выбирается из группы, состоящей из -CH2-, -S-, и -O-, или отсутствует; где Y выбирается из -(CH2)n, -S(CH2)n, -O(CH2)N-, тиофена, -SO2(CH2)n-, и сложного эфира, где n=1-4; где a=1-4; где b=1-4; где c=1-4; и где Z представляет собой противоион.
Одним объектом настоящего изобретения является соединение для облегчения доставки лекарственного средства в целевую клетку, состоящее из структуры (целевая молекула)т-линкер-(целевая молекула)n, где целевой молекулой является ретиноид, имеющий специфический рецептор или сайт активации/связывания на целевой клетке; где тип независимо равны 0, 1, 2 или 3; и где линкер содержит полиэтиленгликоль (ПЭГ) или ПЭГ-подобная молекула.
В одном варианте выполнения настоящего изобретения ретиноид выбирается из группы, состоящей из витамина A, ретиноевой кислоты, третиноина, адапалена, 4-гидрокси(фенил)ретинамида (4-HPR), ретинил пальмитата, ретиналя, насыщенной ретиноевой кислоты и насыщенной деметилированной ретиноевой кислоты.
В другом варианте выполнения настоящего изобретения линкер выбирается из группы, состоящей из бис-амидо-ПЭГ, трис-амидо-ПЭГ, тетра-амидо-ПЭГ, Lys-бис-амидо-ПЭГ Lys, Lys-трис-амидо-ПЭГ-Lys, Lys-тетр-амидо-ПЭГ-Lys, Lys-ПЭГ-Lys, ПЭГ2000, ПЭГ1250, ПЭГ1000, ПЭГ750, ПЭГ550, ПЭГ-Glu, Glu, C6, Gly3, и GluNH.
В другом варианте выполнения настоящего изобретения, соединение выбирается из группы, состоящей из ретиноид-ПЭГ-ретиноид, (ретиноид)2-ПЭГ-(ретиноид)2, VA-ПЭГ2000-VA, (ретиноид)2-бис-амидо-ПЭГ-(ретиноид)2, (ретиноид)2-Lys-бис-амидо-ПЭГ-Lys-(ретиноид)2.
В другом варианте выполнения настоящего изобретения ретиноид выбирается из группы, состоящей из витамина A, ретиноевой кислоты, третиноина, адапалена, 4-гидрокси(фенил)ретинамида (4-HPR), ретинил пальмитата, ретиналя, насыщенной ретиноевой кислоты и насыщенной деметилированной ретиноевой кислоты.
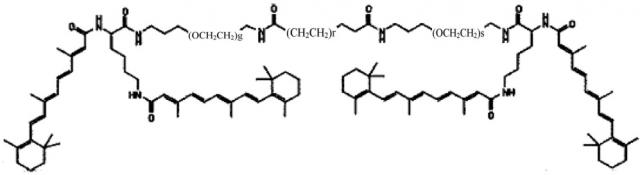
В другом варианте выполнения настоящего изобретения соединение представляет собой композицию формулы
где q, r и s каждый независимо равен 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10.
В другом варианте выполнения настоящего изобретения формула соединения содержит
Другим объектом настоящего изобретения является носитель для лекарственного средства специфичный для звездчатых клеток, содержащий специфичное для звездчатых клеток количество молекулы ретиноида, состоящей из структуры (ретиноид)m-линкер-(ретиноид)n; где m и n независимо равны 0, 1, 2 или 3; и где линкер содержит полиэтиленгликоль (ПЭГ) или ПЭГ-подобную молекулу.
В другом варианте выполнения настоящего изобретения настоящее изобретение обеспечивает композицию, содержащую липосомальную композицию. В других вариантах выполнения настоящего изобретения липосомальная композиция содержит липосому, содержащую бислой липидных молекул.
В определенных вариантах выполнения настоящего изобретения молекула ретиноида по меньшей мере частично выставлена на внешней поверхности носителя для лекарственного средства прежде чем носитель для лекарственного средства достигает звездчатой клетки.
В другом варианте выполнения настоящего изобретения ретиноид составляет от 0.1 мол.% до 20 мол.% липидных молекул.
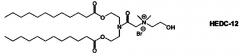
Настоящее изобретение также обеспечивает варианты выполнения настоящего изобретения, где липидные молекулы содержат один или более липидов, выбранных из группы, состоящей из HEDC, DODC, HEDODC, DSPE, DOPE и DC-6-14. В другом варианте выполнения настоящего изобретения липидные молекулы дополнительно содержат S104.
В определенных вариантах выполнения настоящего изобретения носитель для лекарственного средства содержит нуклеиновую кислоту.
В других вариантах выполнения настоящего изобретения нуклеиновой кислотой является siPHK, которая способна подавлять экспрессию hsp47 мРНК в звездчатой клетке.
Другим объектом настоящего изобретения является соединение для облегчения доставки лекарственного средства в целевую клетку, состоящее из структуры (липид)m-линкер-(целевая молекула)n, где целевой молекулой является ретиноид или жирорастворимый витамин, имеющий специфический рецептор или сайт активации/связывания на целевой клетке; где тип независимо равны 0, 1, 2 или 3; и где линкер содержит молекулу полиэтиленгликоля (ПЭГ).
В одном варианте выполнения настоящего изобретения липид выбирается из одного или более члена группы, состоящей из DODC, HEDODC, DSPE, DOPE и DC-6-14.
В другом варианте выполнения настоящего изобретения ретиноид выбирается из группы, состоящей из витамина A, ретиноевой кислоты, третиноина, адапалена, 4-гидрокси(фенил)ретинамида (4-HPR), ретинил пальмитата, ретиналя, насьпценной ретиноевой кислоты и насьпценной деметилированной ретиноевой кислоты.
В другом варианте выполнения настоящего изобретения жирорастворимым витамином является витамин D, витамин E или витамин K.
В другом варианте выполнения настоящего изобретения линкер выбирается из группы, состоящей из бис-амидо-ПЭГ, трис-амидо-ПЭГ, тетра-амидо-ПЭГ, Lys-бис-амидо-ПЭГ Lys, Lys-трис-амидо-ПЭГ-Lys, Lys-тетро-амидо-ПЭГ-Lys, Lys-ПЭГ-Lys, ПЭГ2000, ПЭГ1250, ПЭГ1000, ПЭГ750, ПЭГ550, ПЭГ-Glu, Glu, С6, Gly3 и GluNH.
В другом варианте выполнения настоящего изобретения настоящее изобретение выбирается из группы, состоящей из DSPE-II3r-VA, DSPE-iT3r2000-Glu-VA, DSPE-ror550-VA, DOPE-VA, DOPE-Glu-VA, DOPE-Glu-NH-VA, DOPE-Gly3-VA, DC-VA, DC-6-VA и AR-6-VA.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фиг. 1 показано подавление эффективности некоторых вариантов выполнения настоящего изобретения. Это включает HEDC липосомы по сравнению с DC-6-14 липоплекс контролями.
На Фиг. 2 показано in vitro сравнение подавления гена с применением катионных липидов.
На Фиг. 3 показана оценка генной экспрессии in vivo примерными HEDODC липосомальными композициями согласно настоящему изобретению (* показывает p<0.05).
На Фиг. 4 показана оценка генной экспрессии in vivo примерными HEDC липосомальными композициями согласно Примеру 15. Усы показывают среднеквадратическое отклонение (n=3). Сигмоидальная кривая доза-ответ показана на основе наилучшего соответствия. Значение EC50 было вычислено на основе кривой. Оно соответствует 11.8 нМ.
На Фиг. 5 показаны результаты измерений in vivo с применением крысиной модели DMNQ. После вычитания фоновых уровней gp46 мРНК, вычисленных на основе нативной группы, все значения тестовой группы были нормолизованы по отношению к gp46 мРНК группы со средой (выражается как процент от группы со средой). Средний уровень gp46 мРНК после обработки показал доза-зависимый ответ и кривую, соответствующую сигмоидальной кривой доза-ответ. Вычисленное значение ED50 равно 0.79 мг/кг.
На Фиг. 6 показаны результаты измерений in vivo с применением крысиной модели DMNC. После вычитания фоновых уровней gp46 мРНК, вычисленных на основе нативной группы, все значения тестовой группы были нормализованы по отношению к gp46 мРНК группы со средой (выражается как процент от группы со средой). Уровни мРНК MRPL19 были вычислены на основе анализа количественной ПЦР с обратной транскрипцией (TaqMan®). Уровни мРНК gp46 были нормализованы относительно уровней MRPL19. (*** показывает P<0.02.)
На Фиг. 7 показаны результаты измерений in vivo с применением крысиной модели легочного блеомицина. Столбиковая диаграмма суммирует размеры фиброза (T. Ashcroft) окрашенных азаном частей легкого для каждой группы. Статистический анализ провели с применением One way ANOVA, Bonferroni мульти-сравнительного теста с применением программного обеспечения Prism5.
Фиг. 8 Добавление VA-конъюгата через декорирование усиливает siPHK активность
Фиг. 9 Добавление VA-конъюгата через сосолюбилизацию усиливает siPHK активность
Фиг. 10 Добавление VA-конъюгата через сосолюбилизацию усиливает siPHK активность
Фиг. 11 Добавление VA-конъюгата к липоплексу через сосолюбилизацию усиливает siPHK активность
Фиг. 12 Добавление VA-конъюгата к липоплексу через сосолюбилизацию по сравнению с декорированием.
Фиг. 13 in vivo эффективность на мышах, CCl4 модель
Фиг. 14 in vivo эффективность декорированных по сравнению с солюбилизированными конъюгатами ретиноида
Фиг. 15 in vitro эффективность (pHSC), эффект конъюгатов ретиноида в липосомальных композициях.
На Фиг. 16 показана корреляция содержания конъюгата ретиноида (мол.%) с эффективностью in vivo (крыса DMNQ). Самцам крыс Sprague-Dawley внутривенно вводили либо композиции, содержащие 0, 0.25, 0.5, 1 и 2% DiVA в дозе 0.75 мг/кг siPHK или PBS (среда), один час после последней инъекции DMN.
ПОДРОБНОЕ ОПИСАНИЕ ИЛЛЮСТРАТИВНЫХ ВАРИАНТОВ ВЫПОЛНЕНИЯ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Согласно настоящему изобретению раскрываются соединения формулы I
где R1 и R2 независимо выбирается из группы, состоящей из C10-C18 алкильной, C12-C18 алкенильной и олеильной группы; где R3 и R4 независимо выбираются из группы, состоящей из C1-C6элкила и C2-C6алканола; где X выбирается из группы, состоящей из -CH2-, -S- и -O- или отсутствует; где Y выбирается из -(CH2)n, -S(CH2)n, -O(CH2)n-, тиофена, -SO2(CH2)n- и сложного эфира, где n=1-4; где a=1-4; где b=1-4; где c=1-4; и где Z является противоионом.
Соединения согласно настоящему изобретения также упоминаются в настоящей заявке как соединения входящие в класс соединений, известный как "катионные липиды." Катионными липидами являются соединения, которые включают по меньшей мере одну липидную составляющую и положительно заряженный атом азота, связанный с противоионом. "Липиды", как понимается в данной области техники состоят из гидрофобной алкильной или алкенильной составляющей и составляющей карбоновой кислоты или сложного эфира.
Поэтому было обнаружено, что составляющая амино-алкил-гидроксил (-N-алкил-OH) соединений формулы I придает свойства композициям согласно настоящему изобретению, ранее не обнаруженные с другими катионными липидами, ранее описанными. Композиции согласно настоящему изобретению, которые включают соединения формулы I, приводят к превосходному уменьшению экспрессии белка, по сравнению с композициями, которые не включают соединения формулы I. Особенно удивительной является способность композиций согласно настоящему изобретению, которые включают соединения формулы I, уменьшать экспрессию HSP47.
Предпочтительные соединения согласно настоящему изобретению включают те, в которых R1 и R2 каждый независимо представляет собой C10-C30алкил. В более предпочтительных вариантах выполнения настоящего изобретения R1 и R2 каждый независимо представляет собой C10-C20алкил. В еще более предпочтительных вариантах выполнения настоящего изобретения R1 и R2 каждый независимо представляет собой C12-C18алкил. Особенно предпочтительные варианты выполнения настоящего изобретения включают те соединения, в которых R1 и R2 каждый независимо представляет собой C13-C17алкил. Более предпочтительными являются те соединения, в которых R1 и R2 каждый представляет собой С13 алкил.
В других вариантах выполнения настоящего изобретения R1 и R2 каждый независимо представляет собой C10-C30алкенил. В более предпочтительных вариантах выполнения настоящего изобретения R1 и R2 каждый независимо представляет собой C10-C20алкенил. В еще более предпочтительных вариантах выполнения настоящего изобретения R1 и R2 каждый независимо представляет собой C12-C18алкенил. В еще более предпочтительных вариантах выполнения настоящего изобретения R1 и R2 каждый независимо представляет собой C13-C17алкенил. Наиболее предпочтительные соединения согласно настоящему изобретению включают те соединения, в которых R1 и R2 каждый представляет собой C12 алкенил.
Также для соединений формулы I, R3 и R4 независимо выбираются из группы, состоящей из C1-C6алкила. В предпочтительных вариантах выполнения настоящего изобретения R3 и R4 каждый независимо представляет собой C1-C3алкил. Наиболее предпочтительно R3 и R4 каждый представляет собой метил. В других вариантах выполнения настоящего изобретения по меньшей мере один из R3 и R4 представляют собой -CH2CH2OH.
Наиболее предпочтительными являются соединения формулы I, где a=b=c=1.
Z может представлять собой любой противоион азота, так что это термин понятен для специалиста в данной области техники. Предпочтительные противоионы азота включают галогены, причем хлорид и бромид являются особенно предпочтительными, и мезилат ( S O 3 C H 3 − ). В отличие от других ранее описанных катионных липидов, где эффект катионного липида зависит от противоиона, эффективность соединений формулы I, как было неожиданно обнаружено, оказалась не связанной с выбранным противоионом.
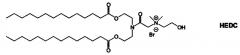
Примерные соединения формулы I включают:
В объем настоящего изобретения входит соединение для облегчения доставки лекарственного средства в целевую клетку, содержащее структуру (нацеливающая молекула)т-линкер-(нацеливающая молекула), где нацеливающая молекула являющаяся ретиноидом или жирорастворимым витамином, имеющим специфический рецептор или [сайт активации/связывания] на целевой клетке; и где тип независимо равны 0, 1, 2 или 3; и где линкер содержит полиэтилегликоль (ПЭГ) или ПЭГ-подобную молекулу и обозначается как "Формула A".
Настоящее изобретение также обеспечивает соединения для облегчения доставки лекарственного средства в целевую клетку, состоящие из структуры (липид)т-линкер-(нацеливающая молекула)n, где нацеливающей молекулой является ретиноид или жирорастворимый витамин, имеющий специфический рецептор на целевой клетке; где тип независимо равны 0, 1, 2 или 3; и где линкер содержит полиэтиленгликоль (ПЭГ) ПЭГ-подобную молекулу и обозначается как "Формула В".
Поэтому было обнаружено, что соединения формулы A или формулы B придают свойства композициям согласно настоящему изобретению, ранее не обнаруженные. Композиции согласно настоящему изобретению, которые включают соединение формулы A или формулы B, приводят к превосходному уменьшению генной экспрессии, по сравнению с композициями, которые не включат эти соединения. Особенно удивительным является способность композиций согласно настоящему изобретению, которые включают соединения Формулы A, уменьшать экспрессию HSP47.
В определенных предпочтительных вариантах выполнения настоящего изобретения ретиноид выбирается из группы, состоящей из витамина A, ретиноевой кислоты, третиноина, адапалена, 4-гидрокси(фенил)ретинамида (4-HPR), ретинил пальмитата, ретиналя, насыщенной ретиноевой кислоты и насыщенной деметилированной ретиноевой кислоты.
Предпочтительные варианты выполнения настоящего изобретения включают соединения, где линкер выбирается из группы, состоящей из бис-амидо-ПЭГ, трис-амидо-ПЭГ, тетра-амидо-ПЭГ, Lys-бис-амидо-ПЭГ Lys, Lys-трис-амидо-ПЭГ-Lys, Lys-TeTpa-aMHflO-ror-Lys, Lys-ror-Lys, ПЭГ2000, ПЭГ1250, ПЭГ1000, ПЭГ750, ПЭГ550, ПЭГ-Glu, Glu, С6, Gly3 и GluNH. В других вариантах выполнения настоящего изобретения ПЭГ представляет собой монодисперсию.
Другой вариант выполнения настоящего изобретения обеспечивает соединение, где формула A выбирается из группы, состоящей из ретиноид-ПЭГ-ретиноид, (ретиноид)2-ПЭГ-(ретиноид)2, VA-ПЭГ2000-УА, (ретиноид)2-бис-амидо-ПЭГ-(ретиноид)2, (ретиноид)2-Lys-бис-амидо-ПЭГ-Lys-(ретиноид)2.
Другим предпочтительным вариантов выполнения настоящего изобретения является соединение формулы
где q, r и s каждый независимо равны 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10.
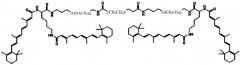
В других предпочтительных вариантах выполнения настоящего изобретения формула соединения содержит
Другие варианты выполнения настоящего изобретения включают структуры, показанные в Таблице 1
Композиции согласно настоящему изобретению, которые включают по меньшей мере одно соединение формул. В предпочтительных вариантах выполнения настоящего изобретения конъюгат ретиноида будет присутствовать в концентрации от около 0.3 до около 30 мас.%, на основе общей массы композиции или состава, что эквивалентно от около 0.1 до около 10 мол.%, что эквивалентно мольному отношению от около 0.1 до около 10. Предпочтительно конъюгатом ретиноида является молекула ретиноид-линкер-липид или молекула ретиноид-линкер-ретиноид.
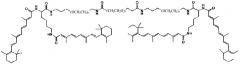
Примеры конъюгатов ретиноида включают соединения формулы II:
где q, r и s каждый независимо равны 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 и их энантиомеры и диастереомеры.
Предпочтительные соединения формулы II включают те, где q, r и s каждый независимо равны 1, 2, 3, 4, 5, 6 или 7. Более предпочтительными являются те соединения формулы II, где q, r и s каждый независимо равны 3, 4 или 5. Более предпочтительными являются те соединения формулы II, где q равно 3, r равно 5, и s равно 3. Одним примером соединения формулы II является
DiVA-ПЭГ-DiVA включают стереоцентры, и все энантиомеры и диастереомеры входят в объем настоящего изобретения.
Концентрация катионных липидов в композициях согласно настоящему изобретению, включающих катионные липиды формулы I, может составлять от 1 до около 80 мас.% от общей массы липидной композиции. Более предпочтительно концентрация составляет от 1 до около 75 мас.%. Даже более предпочтительно концентрация составляет от около 30 до около 75 мас.%. Концентрация от около 30 до около 75 мас.% соответствует до около 30-60 мол.% и мольному отношению около 30-60. Наиболее предпочтительными являются те композиции, которые имеют концентрацию катионных липидов около 50 мас.%. В композициях, которые содержат смесь ионизируемого катионного липида и катионного липида с четвертичным амином формулы I, предпочтительно мол.% составляет от 5% до 45 мол.%, и даже более предпочтительно смесь около 20 мол.% ионизируемого катионного липида и 20 мол.% катионного липида с четвертичным амином формулы I.
Такие композиции могут также включать водную среду. Катионные липиды, включая липиды формулы I, могут быть инкапсулированы внутри липосомы в таких вариантах выполнения настоящего изобретения и могут быть не доступны водной среде. Кроме того, катионные липиды, включая липиды формулы I, могут быть расположены на внешней поверхности липосомы и могут быть доступны водной среде.
Композиции согласно настоящему изобретению, которые включают по меньшей мере одно соединение формулы I и липосому и необязательно конъюгат ретиноида, как например соединение формулы II, может также включать siPHK. Также в объем настоящего изобретения входят композиции, содержащие по меньшей мере одно соединение Формулы A или B и siPHK.
Предполагается, что любая молекула siPHK может применяться в объеме настоящего изобретения. siPHK может включать антисмысловую последовательность к мРНК кодирующей последовательности для человеческого hsp47, примером чего является SEQ ID NO:1, которая показана далее.
Например,
Такие композиции могут также включать водную среду. Предпочтительно такие композиции состоят по существу из одного соединения формулы I в заряженном комплексе с siPHK. Такие композиции, включающие соединение формулы I и siPHK, могут дополнительно содержать жидкую среду. В одном варианте выполнения настоящего изобретения жидкая среда подходит для инъекции живому организму. Жидкие среды в объеме любого их вариантов выполнения настоящего изобретения могут быть водными, то есть полностью состоять из водного растворителя и включать соли, буферы и/или другие фармацевтические эксципиенты. В другом варианте выполнения настоящего изобретения жидкая среда может состоять из водного растворителя в комбинации с другим жидким растворителем, таким как, например, органический растворитель. Жидкие растворители в объеме любого из описанных вариантов выполнения настоящего изобретения могут также включать по меньшей мере один органический растворитель. Органические растворители по существу известны в данной области техники и включают C1-C4 спирты, диметилсульфоксид ("DMSO") и тому подобное. Те липидные среды, которые включают смесь воды и по меньшей мере одного органического растворителя, также входят в объем любого из описанных вариантов выполнения настоящего изобретена.
Также в объем настоящего изобретения входят композиции, которые содержат по меньшей мере одно соединений Формулы I и липосому. Такие варианты выполнения настоящего изобретения могут включать смеси соединений формулы I и липосому. Другие варианты выполнения настоящего изобретения могут включать липосому и одно или более соединений формулы I в дополнение к катионным липидам, которые не охватываются формулой I.
В некоторых вариантах выполнения настоящего изобретения siPHK будет инкапсулироваться липосомой, так что siPHK не доступна внешней среде. В других вариантах выполнения настоящего изобретения siPHK не будет инкапсулироваться липосомой. В таких вариантах выполнения настоящего изобретения siPHK может образовываться на внешней поверхности липосомы. В этих вариантах выполнения настоящего изобретения siPHK доступна водной среде.
Другие варианты выполнения настоящего изобретения включают специфичный к звездчатой клетке носитель для лекарственно средства, содержащий липосомальную композицию. Липосомальная композиция может содержать липосому, содержащую бислой липидных молекул. В определенных вариантах выполнения настоящего изобретения может быть предпочтительным, что молекула ретиноида является по меньшей мере частично выставленной на внешней поверхности носителя для лекарственного средства, прежде чем носитель для лекарственного средства достигает звездчатой клетки.
Определенные варианты выполнения настоящего изобретения обеспечивают липидные молекулы, которые содержат один или более липидов, выбранных из группы, состоящей из HEDC, DODC, HEDODC, DSPE, DOPE и DC-6-14. В других вариантах выполнения настоящего изобретения липидные молекулы могут дополнительно содержать S104.
В некоторых вариантах выполнения настоящего изобретения siPHK будет инкапсулироваться липосомой, так что siPHK является не доступной водной среде. В других вариантах выполнения настоящего изобретения siPHK не будет инкапсулироваться липосомой. В таких вариантах выполнения настоящего изобретения siPHK может образовываться на внешней поверхности липосомы. В этих вариантах выполнения настоящего изобретения siPHK является доступной водной среде.
Другие варианты выполнения настоящего изобретения носитель для лекарственного средства, специфичный к звездчатой клетке, содержащий липосомальную композицию. Липосомальная композиция может включать липосому, содержащую бислой липидных молекул. В других вариантах выполнения настоящего изобретения молекула ретиноида по меньшей мере частично выставлена на внешней поверхности носителя для лекарственного средства до того, как носитель для лекарственного средства достигает звездчатой клетки.
В определенных предпочтительных вариантах выполнения настоящего изобретения ретиноид составляет от 0.1 мол.% до 20 мол.% липидных молекул.
Вышеописанные композиции согласно настоящему изобретению могут также включать ПЭГ-конъюгированные липиды, которые по существу известны в данной области техники, включая ПЭГ-фсфолипиды и ПЭГ-церамиды, включая одну или более молекул, выбранных из следующих: ПЭГ2000-DSPE, ПЭГ2000-DPPE, ПЭГ2000-DMPE, ПЭГ2000-ЭОРЕ, ПЭГ1000-DSPE, ПЭГ1000-DPPE, ПЭГ1000-DMPE, ПЭГ1000-DOPE, ПЭГ550-DSPE, ПЭГ550-ОРРЕ, ПЭГ-550ОМРЕ, ПЭГ-1000DOPE, ПЭГ-холестерин, ПЭГ2000-церамид, ПЭГ1000-церамид, ПЭГ750-церамид и ПЭГ550-церамид.
Вышеописанные композиции согласно настоящему изобретению могут один или более фосфолипидов, таких как, например, 1,2-дистеароил-sn-глицеро-3-фосфолипид ("DSPC"), дипальмитоилфосфатидилхолин ("DPPC"), 1,2-дипальмитоил-sn-глицеро-3-фосфоэтаноламин ("DPPE") и 1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин ("DOPE"). Предпочтительным вспомогательным фосфолипидом является DOPE.
Например, липосомы в объеме настоящего изобретения, были получены с применением различных ПЭГ-липидов, включенных с применением способов солюбилизации, описанных в настоящем изобретении. Эти композиции содержали катионный липид : DOPE : холестерин : DIVA-ПЭГ-DIVA : ПЭГ-липид (50:10:38:5:2 мольное отношение), и каждую композицию протестировали в pHSC in vitro анализе, описанном в настоящей заявке, с применением HSP-47-C siPHK человека/крысы при концентрации 200 нМ. Результаты показаны в следующей таблице:
| ПЭГ-липид | подавление гена gp46 (%) | Std. Dev. |
| необработанный | 0 | 5.6 |
| RNAimax контроль | 50.0 | 7.9 |
| ПЭГ-BML | 95.5 | 1.7 |
| ПЭГ1000-DMPE | 93.2 | 0.8 |
| ПЭГ1000-DPPE | 92.8 | 1.3 |
| ПЭГ1000-DSPE | 93.5 | 0.8 |
| ПЭП1000-DOPE | 90.7 | 2.5 |
| ПЭГ2000-церамид | 91.8 | 1.0 |
| ПЭГ2000-ОМРЕ | 93.7 | 3.4 |
| ПЭГ2000-ОРРЕ | 91.1 | 1.4 |
| ПЭГ2000-DSPE | 89.4 | 1.7 |
Вышеописанные композиции согласно настоящему изобретению могут включать один или более фосфолипидов, таких как, например, 1,2-дистеароил- sn -глицеро-3-фосфолипид ("DSPC"), дипальмитоилфосфатидилхолин ("DPPC"), 1,2-дипальмитоил-sn-глицеро-3-фосфоэтаноламин ("DPPE") и 1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин ("DOPE"). Предпочтительным вспомогательным липидом является DOPE.
В дополнение к катионному липиду формулы I, другие липиды могут быть полезны. Они включают ионизируемые катионные липиды, включая S104, показанные ниже.
Композиции для доставки могут состоять из катионного липида Формулы I в комбинации с ионизируемым катионным липидом. Ионизируемый катионный липид может включать, например, S104. Ионизируемый катионный липид может присутствовать в концентрации от 0 до 45 мол.%, включая концентрацию, выбранную из 5, 10, 15, 20, 25, 30, 35,40 и 45 мол.%.
В объем настоящего изобретения также входят фармацевтические составы, которые включают любую из вышеупомянутых композиций в дополнение к фармацевтически приемлемому носителю или разбавителю. Фармацевтические составы согласно настоящему изобретению будут включать по меньшей мере один терапевтический агент. Предпочтительно терапевтическим агентом является siPHK. Предполагается, что любая молекула siPHK может применяться в объеме настоящего изобретения.
В объем настоящего изобретения также входят фармацевтические композиции, которые включают любое из вышеупомянутых соединений в дополнение к фармацевтически приемлемому носителю или разбавителю. Фармацевтические композиции согласно настоящему изобретению будут включать по меньшей мере один терапевтический агент. Предпочтительно терапевтическим агентом является siPHK. Предполагается, что любая молекула siPHK может применяться в объеме настоящего изобретения. Как описано ранее, siPHK включает последовательности, обозначенные как SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3 и SEQ ID NO: 4.
В предпочтительных композициях согласно настоящему изобретению, включающих siPHK, siPHK инкапсулирована липосомой. В других вариантах выполнения настоящего изобретения siPHK может находиться на внешней стороне липосомы. В этих вариантах выполнения настоящего изобретения siPHK может образовываться на внешней стороне липосомы.
Полезный интервал катионного липида: siPHK (фосфатное отношение азота липида к siPHK, "N:P") составляет от 0.2 до 5.0. Особенно предпочтительным интервалом N:P является 1.5-2.5 для композиций и составов согласно настоящему изобретению.
Предпочтительные композиции согласно настоящему изобретению включают композиции, содержащие HEDC : S104 : DOPE : Холестерин : ПЭГ-ОМРЕ : DIVA-ПЭГ-DiVA (20:20:30:25:5:2 мольное отношение) и HEDC : S104 : DOPE : Холестерин : ПЭГ-DMPE : DiVA-ПЭГ-DiVA (20:20:30:25:5:2 мольное отношение), где DiVA-ПЭГ-DiVA является солюбилизированным. DODC : DOPE : холестерин : ПЭГ-липид:DiVA-ПЭГ-DiVA (50:10:38:2:5 мольное отношение) и DODC : DOPE : холестерин : ПЭГ-липид : DiVA-ПЭГ-DiVA композиции, где DiVA-ПЭГ-DiVA является солюбилизированным.
Другие композиции согласно настоящему изобретению включают композиции, содержащие HEDODC : DOPE : олестерин-ПЭГ-липид : DiBA-ПЭГ-DiVA (50:10:38:2:5 мольное отношение) и HEDODC : DOPE : холестерин-ПЭГ-липид:DiVA-ПЭГ-DiVA композиции, где DiVA-ПЭГ-DiVA является солюбилизированным.
Другие предпочтительные композиции согласно настоящему изобретению включают композиции, содержащие DC-6-14 : DOPE : холестерин : DiVA-ПЭГ-DiVA (40:30:30:5, мольные отношения) и БС-6-14 : DOPE : холестерин : DiVA-TOT-DiVA, где DiVA-ПЭГ-DiVA является солюбилизированным.
Также настоящее изобретение охватывает способы доставки терапевтического агента в организм пациента. Эти способы содержит обеспечение фармацевтической композиции, включая любые вышеприведенные композиции и фармацевтически приемлемый носитель или разбавитель; и введение фармацевтической композиции в организм пациента.
Определения
Согласно настоящему изобретению термин «алкил» относится к полностью насыщенной (без двойных или тройных связей) углеводородной группе с линейной или разветвленной углеводородной цепью, например группе, имеющей общую формулу -CnH2n+1. Алкильная группа может содержать от 1 до 50 атомов углерода (во всех случаях, когда она появляется в настоящем описании, числовой диапазон, такой как «1-50» относится к каждому целому числу в данном диапазоне; например, термин «1-50 атомов углерода» означает, что алкильная группа может состоять из 1 атома углерода, 2 атомов углерода, 3 атомов углерода и т.д., до 50 атомов углерода включительно, несмотря на то что нас