Лечение папулопустулезной розацеа ивермектином
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности и представляет собой способ лечения папулопустулезной розацеа у нуждающегося в этом индивидуума, включающий местное нанесение один раз в сутки на область кожи, пораженную папулопустулезной розацеа, терапевтически эффективного количества фармацевтической композиции, содержащей ивермектин и фармацевтически приемлемый носитель, где лечение приводит к значительному снижению числа воспалительных очагов у индивидуума уже через 2 недели после первичного нанесения фармацевтической композиции. Изобретение обеспечивает значительное снижение числа воспалительных очагов уже через две недели после первичного применения без совместного использования другого активного агента, более эффективное лечение, а также более длительную ремиссию, уменьшение неблагоприятных кожных реакций. 2 н. и 14 з.п. ф-лы, 12 ил., 7 табл., 4 пр.
Реферат
[0001] ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0002] По настоящей заявке испрашивается приоритет на основании патентной заявки США с серийным № 14/209958, зарегистрированной 13 марта 2014 года, которая имеет право на приоритет в соответствии с 35 USC. § 119(e) предварительной патентной заявки США № 61/843540, зарегистрированной 8 июля 2013 года, предварительной патентной заявки США № 61/919208, зарегистрированной 20 декабря 2013 года, и предварительной патентной заявки США № 61/927717, зарегистрированной 15 января 2014 года, описание каждой из которых, таким образом, полностью включено в настоящее описание посредством ссылки.
УРОВЕНЬ ТЕХНИКИ, ПРЕДШЕСТВУЮЩИЙ ИЗОБРЕТЕНИЮ
[0003] Папулопустулезная розацеа (PPR) является хроническим воспалительным нарушением, характеризующимся папулами, пустулами и устойчивой эритемой лица.1 Она является очень распространенной и ассоциирована с отрицательным влиянием на качество жизни и депрессией.2 Этиология розацеа является многофакторной. В дополнение к нарушению нейроваскулярной регуляции, кожа лица пациентов с розацеа подвергается повышенным провоспалительным иммунным ответам.3 Основной активный пептид кателицидин (LL-37) содержится в высокой концентрации в коже, пораженной розацеа, и может способствовать острому воспалению.4 Кроме того, PPR характеризуется наличием воспалительных инфильтратов, которые сопровождают воспалительные гиперемии наряду с повышенным иммунным ответом, включая нейтрофильную инфильтрацию и повышенную экспрессию гена IL-8.5 В дополнение к экзогенным факторам (включая УФ излучение, тепло и спирт) ее могут вызывать клещи Demodex folliculorum.3 В некоторых исследованиях PPR наблюдали более высокую плотность клещей по сравнению с контролями.6-7 Таким образом, большое количество факторов могут активировать нейроваскулярные и/или иммунные ответы, и последующее воспаление, приводящее к формам воспалительной гиперемии розацеа.3
[0004] Воспалительные очаги розацеа, в частности от умеренной до тяжелой PPR, трудно поддаются лечению. В настоящее время существует только несколько терапевтических альтернатив лечения воспалительных очагов розацеа. В Соединенных Штатах Америки только три одобренных FDA видов лечения показаны для снижения воспалительных очагов розацеа, включая два местных вида лечения. В последнем обзоре Cochrane отмечал некоторые доказательства подтверждающие эффективность местного метронидазола и азелаиновой кислоты при лечении от умеренной до тяжелой розацеа,8 при этом, очевидно, что не все пациенты реагируют на эти лекарственные средства. В национальном исследовании потребителей существующих настоящее время лекарственных средств против розацеа 46% пациентов ранее меняли лекарственные средства, как правило, вследствие отсутствия улучшения.9
[0005] Ивермектин представляет собой противопаразитарное лекарственное средство производное семейства макроциклических лактонов, одобренных для использования для человека для лечения и химиопрофилактики онхоцеркоза и стронгилоидоза с 1996 г. в США и с 1988 г. во Франции. Кроме того, он был одобрен во Франции для лечения чесотки у человека. Пероральный ивермектин при демодекозе человека и животных являлся эффективным в отношении уменьшения Demodex folliculorum и улучшения состояния демодекоза. Кроме того, при введении перорально для ивермектина в комбинации с последующим еженедельным нанесением местного перметрина демонстрировали эффективность лечения у пациента, страдающего хроническим розацеаподобным демодекозом (14).
[0006] В патенте США № 5952372 описан способ лечения розацеа у людей, включающий пероральное введение или местное нанесение ивермектина. Однако в соответствии с патентом США № 5952372 вследствие барьерного эффекта кожи, при местном лечение ивермектином ожидают, что необходимо проводить нанесения один раз в сутки или два раза в сутки на протяжении четырех недель для получения достаточного проникновения в фолликулы и эффективного акарицидного действия. Кроме того описано, что после того, как ивермектин оказывает свое акарицидное действие на организмы Demodex folliculorum на коже, воспалительные ответы на них начинают уменьшаться, но остающиеся погибшие клещи все еще вызывают некоторую гиперемию и образование очагов до тех пор, пока процессы очищения организма не удалят их, процесс, который занимает от шести до восьми недель. Предлагают применять общепринятые лекарственные средства против розацеа, такие как пероральный тетрациклин и местный метронидазол, для подавления ранних обострений и для получения раненого клинического ответа во время начальной фазы введения ивермектина. В патенте США № 5952372 не содержится конкретного раскрытия местного лечения PPR.
[0007] В патенте США № 6133310 и патенте США № 8415311 также описан способ лечения красных угрей посредством местного нанесения ивермектина. Однако в них не содержится конкретного раскрытия лечения воспалительных очагов розацеа или PPR.
[0008] Таким образом, демонстрировали, что виды лечения обладают большей эффективностью лечения PPR, в частности PPR в форме от умеренной до тяжелой, чем существующие в настоящее время доступные композиции, такие как композиции метронидазола, все еще являются необходимыми для обеспечения большего, более продолжительного или более быстрого облегчения у индивидуумов, нуждающихся в лечении. Существует необходимость в улучшенном эффективном лечении PPR, в частности PPR в форме от умеренной до тяжелой. Настоящее изобретение решает такую необходимость.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0009] Ниже продемонстрировано, что местное нанесение ивермектина обеспечивало более быстрое облегчение папулопустулезной розацеа, а также в течение более длительного периода времени без рецидива по сравнению с доступными в настоящее время видами лечения, такими как местное лечение 0,75% по массе метронидазолом.
[0010] В одном из основных аспектов варианты осуществления настоящего изобретения относятся к способу лечения папулопустулезной розацеа у нуждающегося в этом индивидуума, включающему местное нанесение на область кожи, пораженную папулопустулезной розацеа, терапевтически эффективного количества фармацевтической композиции, содержащей ивермектин и фармацевтически приемлемый носитель.
[0011] Другой основной аспект настоящего изобретения относится к способу лечения воспалительных очагов папулопустулезной розацеа у нуждающегося в этом индивидуума, включающему местное нанесение на область кожи, пораженной воспалительными очагами папулопустулезной розацеа, фармацевтической композици, содержащей ивермектин и фармацевтически приемлемый носитель. В предпочтительном варианте осуществления настоящего изобретения фармацевтическая композиция содержит приблизительно от 0,5% до 1,5% по массе ивермектина.
[0012] В другом предпочтительном варианте осуществления настоящего изобретения индивидуум до лечения страдает папулопустулезная розацеа в форме от умеренной до тяжелой.
[0013] В еще одном другом предпочтительном варианте осуществления настоящего изобретения перед лечением индивидуум имеет по меньшей мере 10, предпочтительно по меньшей мере 12 и более предпочтительно по меньшей мере 15 воспалительных очагов папулопустулезной розацеа.
[0014] В соответствии с вариантами осуществления настоящего изобретения местное лечение один раз в сутки ивермектином является значительно лучше, чем местное лечение два раза сутки метронидазолом при лечении папулопустулезной розацеа.
[0015] Другие аспекты, признаки и преимущества изобретения будут понятны из следующего ниже описания, включающегося подробное описание изобретение и его предпочтительные варианты осуществления и прилагаемую формулу изобретения.
КРАТКОЕ ОПИСАНИЕ ФИГУР ЧЕРТЕЖЕЙ
[0016] Указанное выше описание сущности изобретения, а также следующее ниже подробное описание изобретения будут лучше понятны при чтении в сочетании с прилагаемыми чертежами. С целью иллюстрации изобретения на чертежах продемонстрированы варианты осуществления, которые являются предпочтительными по настоящему изобретению. Однако следует понимать, что изобретение не ограничено точными вариантами осуществления, продемонстрированы на чертежах.
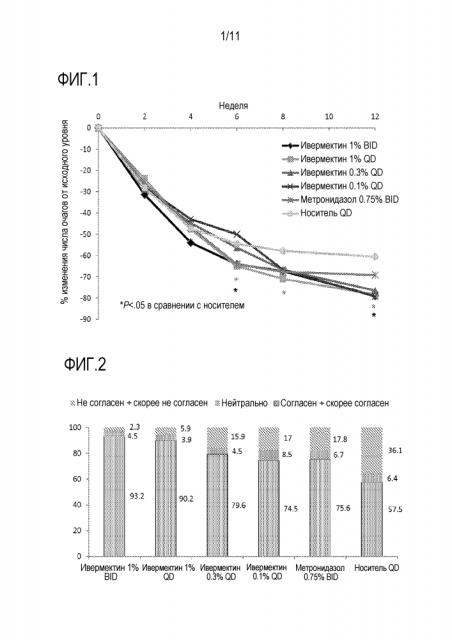
[0017] На фигуре 1 представлено средний процент изменения от исходного уровня числа очагов (популяция ITT-LOCF) в исследование диапазона доз после различных видах местного лечения.
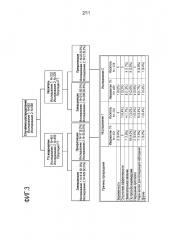
[0018] На фигуре 2 проиллюстрирован ответы индивидуумов на утверждение "продукт улучшает мое состояние розацеа" после различных видах местного лечения (наблюдаемая ITT).
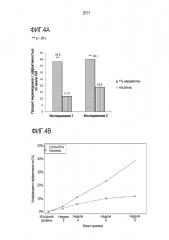
[0019] На фигуре 3 представлена предрасположенность индивидуумов в 2 клинических исследованиях безопасности и эффективности местного лечения ивермектинов.
[0020] На фигуре 4 проиллюстрированы проценты индивидуумов, у которых выявляли эффективность по шкале IGA ("чистая" или "практически чистая"): (A) на 12 неделе в исследованиях 1 и 2; (B) на 2, 4, 8 и 12 неделях в исследовании 1 и (C) на 2, 4, 8 и 12 неделях в исследовании 2, где SOOLANTRA представляет собой 1% крем ивермектина.
[0021] На фигуре 5 представлено изменение от исходного уровня числа воспалительных очагов (ITT-LOCF): (A) среднее абсолютное изменение (±стандартная ошибка) в исследовании 1; (B) среднее абсолютное изменение (±стандартная ошибка) в исследовании 2; (C) медианный процент изменений в исследовании 1 и (D) медианный процент изменений в исследовании 2, где SOOLANTRA представляет собой 1% крем ивермектина.
[0022] На фигуре 6 продемонстрирована оценка улучшения состояния розацеа индивидуумов в (A) исследовании 1 и (B) исследовании 2 на 12 неделе.
[0023] Фигура 7 представляет собой фотографии пациента на исходном уровне и на 12 недели (обычное освещение).
[0024] На фигуре 8 представлено распределение индивидуумов в клиническом исследовании, в котором сравнивают местные виды лечения ивермектином и метронидазолом.
[0025] На фигуре 9 проиллюстрирован средний процент изменения от исходного уровня числа воспалительных очагов (ITT-LOCF) после местных видов лечения ивермектином и метронидазолом, *p<0,05, **p<0,001.
[0026] На фигуре 10 представлен показатель эффективности на основании шкалы IGA "чистая" или "практически чистая" после местных видов лечения ивермектином и метронидазолом, *p<0,05, **p<0,001.
[0027] На фигуре 11 представлена оценка улучшения состояния розацеа индивидуумов после местных видов лечения ивермектином и метронидазолом, и
[0028] На фигуре 12 представлено время первого рецидив, определяемого как первое повторение IGA≥2 после успешных лечений ивермектином (CD5024) и метронидазолом.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0029] Различные публикации, статьи и патенты цитируются или описаны в предшествующем уровне техники и на всем протяжении описания; каждая из таких ссылок полностью включена в настоящее описание посредством ссылки. Обсуждение документов, актов, материалов, устройств, статей или т.п., которые включены в настоящем описании, приведено с целью обеспечения контекста для настоящего изобретения. Такое обсуждение не является признанием того, что любой или все эти объекты являются частью известного уровня техники в отношении любого изобретения, описываемого или заявляемого.
[0030] Если не определено иное, все технические и научные термины, используемые в настоящем описании, имеют такое же значение, как общепринято понимает специалист в данной области, к которой принадлежит это изобретение. В иных случаях определенные термины, используемые в настоящем описании, имеют значения, как указано в описании. Все патенты, опубликованные патентные заявки и публикации, цитируемые в настоящем описании, включены посредством ссылки, как если бы были полностью описаны в настоящем описании. Следует отметить, как используют в настоящем описании и в прилагаемой формуле изобретения, формы единственного числа включают формы множественного числа, если из контекста явно не следует иное.
[0031] Ивермектин является представителем класса авермектинов, для которых в иммунофармакологических исследованиях было продемонстрировано, что они оказывают противовоспалительное действие путем ингибирования индуцируемой липополисахаридами продукции воспалительных цитокинов, таких как фактор некроза опухоли альфа и интерлейкин (IL)-1b, при этом повышая экспрессию противовоспалительного цитокина IL-1010. Он представляет собой полусинтетическое производное, выделяемое при ферментации Streptomyces avermitilis, который принадлежит к семейству авермектинов макроциклических лактонов. Ивермектин представляет собой смесь, содержащую 5-O-деметил-22,23-дигидроавермектин A1a плюс 5-O-деметил-25-де(1-метилпропил)-25-(1-метилэтил)-22,23-дигидроавермектин A1a, как правило, обозначаемый как 22,23-дигидроавермектин B1a и B1b или H2B1a и H2B1b, соответственно. Соответствующие эмпирические формулы H2B1a и H2B1b представляют собой C48H74O14 и C47H72O14 с молекулярными массами 875,10 и 861,07 соответственно.
[0032] Ивермектин представляет собой производное макроциклического лактона, полагают, что его терапевтический эффект в значительной степени обусловлен его противовоспалительными свойствами, аналогичными свойствам других макролидов.11-12 Опубликовано, что авермектин оказывает противовоспалительное действие путем ингибирования индуцируемой липополисахаридами продукции воспалительных цитокинов. В дополнение к своему противовоспалительную механизму действия ивермектин обладает противопаразитарными свойствами. Его предшественник, авермектин, является противопаразитарным средством сельскохозяйственного значения, первые выделенным в 1974 году.13 Несколько исследований подтверждают роль ивермектина при эффективном пероральном лечении кожного демодекоза (в комбинации с местным кремом перметрина) и чесотки, а также местном лечении головных вшей.14-16 Ивермектин вызывает гибель паразитов преимущественно путем избирательного и высокоаффинного связывания с глутамат-зависимыми хлоридными каналами, которые встречаются в нервных и мышечных клетках беспозвоночных. Это приводит к прекращению нервных импульсов, вызывая паралич и гибель паразитических организмов. Известно, что ивермектин действует на клещей Demodex при локализованном и генерализованном демодекозе у животных и у людей.
[0033] В настоящем изобретении проводили исследования для оценки эффективности и безопасности ивермектина при лечении папулопустулезной розацеа (PPR). Сделали открытие, что уже через 2 недели после первичного местного введения фармацевтической композиции, содержащей от 0,5 до 1,5% (масс./масс.) ивермектина индивидууму наблюдали значительное снижение числа воспалительных очагов.
Как используют в настоящем описании, "значительное снижение" относится к снижению, которое является статистически значимым, не только случайным образом, значение p которого составляет 0,05 или менее. Значение p "значительного снижения" может составлять менее 0,05, 0,04, 0,03, 0,01, 0,005, 0,001 и т.д. Как используют в настоящем описании, "число воспалительных очагов" относится к количеству воспалительных очагов, связанных с розацеа или PPR. Воспалительные очаги могут представлять собой папулы и/или пустулы. Папула представляет собой небольшое, твердое возвышение диаметром менее одного сантиметра, и пустула представляет собой небольшое, ограниченное возвышение кожи, которое содержит желто-белые экссудаты.
[0034] Очаги могут представлять собой, например, папулы и/или пустулы любых размеров (небольших или больших). Например, через две недели после первичного лечения наблюдали приблизительно 30% (p<0,001) и 27,3% (p<0,01) медианное снижение числа воспалительных очагов у пациентов, лечение которых проводили ивермектином в двух различных клинических исследованиях способами по настоящему изобретению. Эти снижения являются статистически значимыми, т.к. они имеют значения p менее 0,01 или даже менее 0,001.
[0035] Такое раннее начало проявления достоверной эффективности является неожиданным и удивительным по сравнению с общепринятыми видами лечения. Например, существенные различия лечения наблюдали только через 4 недели или 8 недель в двух исследованиях III фазы для местного лечения умеренной PPR с использованием 15% азелаиновой кислоты два раза в сутки (Thiboutot et al., 2003, J. Am Acad Dermatol, 48 (6): 836-845), при этом не наблюдали статистически значимого отличия в отношении медианного числа воспалительных очагов или медианного процента изменений числа воспалительных очагов в любой оцениваемый момент времени во время исследования (P≥0,29) местного лечения PPR в форме от умеренной до тяжелой с использованием 0,75% или 1,0% метронидазола один раз в сутки (Dahl et al., 2001, J. Am Acad Dermatol, 45 (5): 723-730).
[0036] Такое раннее начало проявления достоверной эффективности также является неожиданным и удивительным, принимая во внимание указания предшествующего уровня техники, что можно ожидать, что при местном лечение ивермектином необходимо проводить нанесения один или два раза в сутки в течение четырех недель для получения достаточного проникновения в фолликулы и эффективного акарицидного действия, и что после того, как ивермектин оказывает свое акарицидное действие на организмы Demodex folliculorum на коже, оставшиеся погибшие клещи все еще вызывают некоторое покраснение и образование очагов до тех пор, пока процессы очищения организма не удалят их, процесс, который занимает от шести до восьми недель, и что предлагают использовать общепринятые лекарственные средства против розацеа, такие как пероральный тетрациклин и местный метронидазол для подавления ранних обострений и для получения раннего клинического ответа во время начальной фазы введения ивермектина (см., например, патент США № 5952372).
[0037] Прямые клинические исследования в настоящем изобретении также демонстрировали, что способы по вариантам осуществления настоящего изобретения приводят к более эффективному лечению PPR, а также более длительному периоду времени, необходимому для возникновения рецидив PPR по сравнению с общепринятым местным лечением, таким как лечение метронидазолом. Кроме того, способы по вариантам осуществления настоящего изобретения также приводят к более редким неблагоприятным реакциям кожи по сравнению с общепринятыми видами местного лечения.
[0038] Не желая быть связанными теорией, полагают, что механизм действия ивермектина при лечении папулопустулезной розацеа может быть связан с противовоспалительными эффектами ивермектина, а также с гибелью клещей Demodex, которые, как описано, являются фактором воспаления кожи. Вследствие того, что ивермектин обладает противовоспалительным и противопаразитарным видами действия, лечение PPR ивермектином представляет собой инновационную терапию, устраняющую эти соответствующие патогенные факторы при PPR, таким образом, новое дополнение к существующему в настоящее время набору лекарственных средств.
[0039] По одному из вариантов осуществления настоящего изобретения способ лечения папулопустулезной розацеа у нуждающегося в этом индивидуума включает местное нанесение на область кожи, пораженную папулопустулезной розацеа, фармацевтической композиции, содержащей ивермектин и фармацевтически приемлемый носитель.
[0040] Как используют в настоящем описании, "фармацевтически приемлемый носитель" относится к фармацевтически приемлемому носителю или разбавителю, содержащему эксципиенты и вспомогательные средства, которые облегчают обработку активных соединений до препаратов, которые можно использовать фармацевтически.
[0041] Фармацевтические композиции по изобретению являются пригодными для обработки кожи. Они могут находиться в жидкой, пастообразной или твердой форме и более конкретно в форме мазей, кремов, молочка, помад, порошков, пропитанных подушечек, синтетических моющих средств, влажных салфеток, растворов, гелей, спреев, пен, суспензий, лосьонов, карандашей, шампуней или моющих основ. Они также могут находиться в форме суспензий микросфер или наносфер, или липидных или полимерных везикул, или полимерных пластырей и гидрогелей для контролируемого высвобождения. Такие композиции для местного применения могут находиться в безводной форме, в водной форме или в форме эмульсии.
[0042] В одном из вариантов осуществления настоящего изобретения фармацевтическая композиция, формулируемая в виде эмульсии, местная фармацевтическая эмульсия содержит ивермектин и один или более других ингредиентов, выбранных из группы, состоящей из: масляной фазы, содержащей диметикон, циклометикон, изопропилпальмитат и/или изопропилмиристат, масляной фазы, дополнительно содержащей жировые вещества, выбранные из группы, состоящей из цетилового спирта, цетостеарилового спирта, стеарилового спирта, пальмитостеариновой кислоты, стеариновой кислоты и самоэмульгируемого воска; по меньшей мере одно поверхностно-активный эмульгатор, выбранный из группы, состоящей из глицерил/PEG100 стеарата, моностеарата сорбитана, пальмитата сорбитана, стеарет-20, стеарет-2, стеарет-21 и цетеарет-20; смеси растворителей и/или усилителей проникновения, выбранных из группы, состоящей из пропиленгликоля, олеилового спирта, феноксиэтанола и глицерилтриацетата; одного или более гелеобразующих средств, выбранных из группы, состоящей из карбомеров, гелеобразующих средств на основе целлюлозы, ксантановых камедей, алюмосиликатов магния, за исключением алюмосиликата магния/диоксида титана/диоксида кремния, гуаровых камедей, полиакриламидов и модифицированных крахмалов, и воду.
[0043] В предпочтительном варианте осуществления настоящего изобретения фармацевтическая композиция содержит 0,5-1,5% (масс./масс.) ивермектина, более предпочтительно приблизительно 1% (масс./масс.) ивермектина и фармацевтически приемлемый носитель.
[0044] В другом предпочтительном варианте осуществления настоящего изобретения фармацевтическая композиция содержит приблизительно 1% (масс./масс.) ивермектина и один или более неактивных ингредиентов, выбранных из группы, состоящей из карбомера, такого как карбомеровый сополимер типа B; цетилового спирта; моногидрата лимонной кислоты; диметикона 20 сСт; эдетата динатрия; глицерина; изопропилпальмитата; метилпарабена; олеилового спирта; феноксиэтанола; полиоксил-20-цетостеарилого эфира; пропиленгликоль; пропилпарабена; очищенной воды; гидроксида натрия; моностеарата сорбитана и стеарилового спирта.
[0045] Как используют в настоящем описании, термин "индивидуум" означает любое животное, предпочтительно млекопитающее, наиболее предпочтительно человека, которому будут вводить или вводили соединения или местные составы по вариантам осуществления изобретения. Предпочтительно индивидуум нуждается или являлся объектом наблюдения или эксперимента, лечения или профилактики папулопустулезной розацеа.
[0046] Как известно специалистам в данной области, "популяция пациентов с назначенным лечением" или "популяция ITT" относится ко всем индивидуумам, которых распределяли случайным образом в клиническом исследовании и которым вводят исследуемое лекарственное средство. "ITT-LOCF" относится к популяции ITT, для которой используют способ переноса вперед данных последнего наблюдения (LOCF), стандартный способ обработки отсутствующих данных, которым замещают или заполняют значения на основании существующих данных. "ITT-MI" относится к популяции ITT, для которой используют способ множественного восстановления (MI) на основании всех данных, доступных в модели, другой способ обработки данных, известный специалистам в данной области. "Популяция по протоколу" или "популяция PP" относится к индивидуумам популяции ITT в клиническом исследовании, которые не имеют значительных отклонений от протокола исследования.
[0047] В одном из вариантов осуществления "лечение" или "лечащий" относится к улучшению состояния, профилактике или купированию заболевания или нарушения, или по меньшей мере одного его выраженного симптома. В другом варианте осуществления "лечение" или "лечащий" относится к улучшению состояния, профилактике или купированию по меньшей мере одного измеряемого физического параметра, связанного с заболеванием или нарушением, подлежащим лечению, необязательно различимого у млекопитающего или млекопитающим. В еще одном варианте осуществления "лечение" или "лечащий" относится к ингибированию или замедлению прогрессирования заболевания или нарушения физически, например, стабилизации выраженного симптома, физиологически, например, стабилизации физического параметра, или обоих. В еще одном варианте осуществления "лечение" или "лечащий" относится к отсрочиванию начала заболевания или нарушения.
[0048] Эффективность лечения PPR можно измерять известными в данной области способами, такими как по снижению числа воспалительных очагов по сравнению с исходных уровнем перед лечением, по улучшению по сравнению с исходных уровнем по баллу шкалы общей оценке исследователя (IGA), или как по снижению числа воспалительных очагов, так и по оценке IGA.
[0049] Балл по шкале IGA определяют по оценке состояния кожи пациента, проводимой обученным медицинским специалистом с использованием общей оценки исследователем состояние кожи. Как правило, такие общие оценки определяют величину степени розацеа, проявляемой на коже. В дополнение к оценке, проводимой медицинским специалистом, информация от пациентов и их наблюдения состояния своей кожи и ответы на различные опросы (например, ощущения острой боли или жжения) также играют роль в определении балла по шкале IGA, которое проводят. Например, балл по шкале IGA для розацеа (таблица 1) может находиться в диапазоне, например, от 0 (чистая) до 1 (практически чистая) до 2 (легкая), до 3 (умеренная), до 4 (тяжелая), включая значения между этими числовыми категориями, такие как 1,5, 2,6, 3,4 и т.д. (например, интервалы 0,1).
[0050]
| Таблица 1Общая оценка исследователя тяжести розацеа | ||
| Степень | Балл | Клиническое описание |
| Чистая | 0 | Отсутствуют воспалительные очаги, эритема отсутствует |
| Практически чистая | 1 | Незначительное число папул/пустул, присутствует очень легкая эритема |
| Легкая | 2 | Несколько небольших папул/пустул, умеренная эритема |
| Умеренная | 3 | Несколько небольших или больших папул/пустул, умеренная эритема |
| Тяжелая | 4 | Многочисленные небольшие и/или большие папулы/пустулы, тяжелая эритема |
[0051] В свете настоящего изобретения область кожи, которая поражена папулопустулезной розацеа, можно идентифицировать с использованием любых диагностических признаков или средств, известных в данной области, и можно лечить способами по вариантам осуществления настоящего изобретения. Пациенты могут страдать папулопустулезной розацеа на различных стадиях от легкой до тяжелой.
[0052] В предпочтительном варианте осуществления пациент страдает папулопустулезной розацеа в форме от умеренной до тяжелой. Как используют в настоящем описании, пациент, страдающей "папулопустулезной розацеа в форме от умеренной до тяжелой", страдает по меньшей мере умеренной эритемой лица и по меньшей мере 10 папулопустулезными очагами до лечения. Например, пациент может иметь балл IGA розацеа 3 или 4, и по меньшей мере 10, 15, 20, 25 или более папулопустулезных очагов до лечения.
[0053] По вариантам осуществления настоящего изобретения папулопустулезную розацеа обрабатывают местным нанесением на область кожи, пораженную папулопустулезной розацеа, фармацевтической композиции, содержащей ивермектин и фармацевтически приемлемый носитель, и лечение приводит к снижению числа воспалительных очагов по сравнению с количеством очагов PPR исходного уровня (до лечения) на по меньшей мере от 1 до 100 очагов или более, так как по меньшей мере на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 50, 60, 70, 80, 90 или 100 очагов или более. По вариантам осуществления настоящего изобретения после лечения наблюдают снижение по меньшей мере приблизительно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100% числа воспалительных очагов. В зависимости от количества воспалительных очагов и других факторов, таких как состояние пациента, лечение может продолжаться при условии, что оно является необходимым, так как от 4 до 12 недель.
[0054] По другим вариантам осуществления настоящего изобретения лечение снижает балл IGA у получавшего лечение индивидуума. Как используют в настоящем описании, "показатель эффективности" в клиническом исследовании относится к проценту индивидуумов в исследовании, имеющих IGA 0 ("чистая") или 1 ("практически чистая") после лечения.
[0055] По вариантам осуществления настоящего изобретения фармацевтическая композиция можно наносить местно один или два раза в сутки, предпочтительно один раз в сутки.
[0056] По вариантам осуществления настоящего изобретения после начального эффективного лечения ивермектином, т.е. до IGA 0 или 1, проходит длительный период времени до появления рецидива, т.е. до IGA 2 или выше по сравнению с общепринятыми видами лечения, таким как местное лечение 0,75% по массе метронидазола. Например, лечение ивермектином (1%) один раз в сутки (QD) приводило к статистически значимой длительной ремиссии (например, задержка во времени до первого рецидива и увеличение числа суток без лечения) розацеа по сравнению с метронидазолом 0,75% два раза в сутки у индивидуумов, которые получали успешное лечение (IGA 0 или 1) в течение 16 недель. Также наблюдали численную тенденцию в пользу ивермектина 1% один раз в сутки в отношении частоты рецидивов.
[0057] Как используют в настоящем описании, "период времи до первого рецидива" определяют как задержку во времени от первичного эффективного лечения до IGA розацеа 0 или 1 до первого повторного появления IGA 2 или более у индивидуума. По вариантам осуществления настоящего изобретения медианный период времени до первого рецидива составляет приблизительно 110, 115, 120, 125, 130, 135, 140, 145 или 150 суток или более у индивидуумов, получавших лечение ивермектином, со значением p 0,05 или менее.
[0058] Другой аспект настоящего изобретения относится к способу лечения воспалительных очагов папулопустулезной розацеа у нуждающегося в этом индивидуума, включающему местное нанесение на область кожи, пораженной воспалительными очагами папулопустулезной розацеа, фармацевтической композиции, содержащей ивермектин и фармацевтически приемлемый носитель.
[0059] Предпочтительно индивидуум страдает PPR в форме от умеренной до тяжелой до начала лечения. Более предпочтительно индивидуум имеет по меньшей мере 15 воспалительных очагов PPR до лечения.
[0060] В другом предпочтительном варианте осуществления через две недели после первичного лечения наблюдают приблизительно 27% или более медианного снижения числа воспалительных очагов у индивидуумов, получавших лечение ивермектином, со значением p 0,01 или менее.
[0061] Предпочтительно фармацевтическая композиция содержит от 0,5% до 1,5% по массе ивермектина, более предпочтительно приблизительно 1% по массе ивермект
[0062] В одном из вариантов осуществления настоящего изобретения уже через 2 недели после первого введения фармацевтической композиции индивидууму наблюдают значительно снижение числа воспалительных очагов у индивидуума. В других вариантах осуществления настоящего изобретения способ приводит к большему снижению числа воспалительных очагов и более длительному периоду времени без рецидива воспалительных очагов розацеа у индивидуума по сравнению с результатом, получаемым путем местного нанесения индивидууму второй фармацевтической композиции, содержащей 0,75% по массе метронидазола.
[0063] Настоящее изобретение будет лучше понятно путем ссылке на неограничивающие примеры, которые следуют ниже, но специалистам в данной области вполне очевидно, что примеры являются только иллюстрирующими изобретение, и формулу изобретения, которая следует ниже в настоящем описании.
[0064] Если не указано иное, все процентные содержания ингредиентов в настоящей заявке являются массовыми процентами (масс./масс.).
[0065] Пример 1: Местные композиции ивермектина
[0066] Примеры фармацевтических композиций, которые можно использовать в настоящем изобретении, описаны в патенте США № 8415311 и патенте США № 8470788, которые включены в настоящее описание посредством ссылки. Композиции, пригодные в настоящем изобретении, включают, но не ограничиваются ими, такие, как указано ниже.
[0067] Композиция 1
| % по массе относительно общей массы композиции | |
| Ингредиенты | |
| Ивермектин | 1,00 |
| Глицерин | 4,0 |
| Алюмосиликат магния | 1,0 |
| Метил-пара-гидроксибензоат | 0,2 |
| EDTA динатрия | 0,05 |
| Моногидрат лимонной кислоты | 0,05 |
| Изопропилпальмитат | 4,0 |
| Глицерил/PEG 100 стеарат | 3,0 |
| Самоэмульгируемый воск | 2,0 |
| Пальмитостеариновая кислота | 2,5 |
| Стеарет-20 | 3,0 |
| Стеарат сорбитана | 2,0 |
| Диметикон 20 | 0,5 |
| Пропил-пара-гидроксибензоат | 0,1 |
| Пропиленгликоль | 4,0 |
| Глицерилтриацетат | 1,0 |
| Феноксиэтанол | 0,5 |
| 10% гидроксид натрия | в количестве, достаточном для pH |
| Вода | в количестве, достаточном для 100 |
[0068] Композиция 2
| % по массе относительно общей массы композиции | |
| Ингредиенты | |
| Ивермектин | 1,00 |
| Глицерин | 4,0 |
| Акрилат C10-30-алкилакрилат | 0,15 |
| Кроссполимер | |
| Метил-пара-гидроксибензоат | 0,2 |
| EDTA динатрия | 0,05 |
| Моногидрат лимонной кислоты | 0,05 |
| Изопропилмиристат | 4,0 |
| Цетиловый спирт | 3,0 |
| Стеариловый спирт | 2,0 |