Способ определения свободного связывающего партнера мультиспецифичного связующего
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к иммунологии, и может быть использована для определения свободного антигена мультиспецифического антитела в образце. Способ определения in vitro наличия и/или концентрации связывающего партнера мультиспецифического связующего, в котором связывающий партнер может быть специфически связан с первой областью связывания мультиспецифического связующего, включающий этапы: инкубацию образца, содержащего связывающий партнер и мультиспецифическое связующее, с моноспецифическим связующим, которое специфически связывается со второй областью связывания мультиспецифического связующего, отличной от первой области связывания. Элиминацию из образца комплекса моноспецифическое связующее - мультиспецифическое связующее перед определением наличия или концентрации свободного связывающего партнера. И определение концентрации связывающего партнера в образце, из которого элиминировано мультиспецифическое связующее. Группа изобретений относится также к применению антиидиотипического антитела, которое специфически связывается со второй областью связывания мультиспецифического антитела в вышеуказанном способе. Использование данной группы изобретений позволяет перед определением наличия или концентрации свободного связывающего партнера элиминировать из образца связывающий партнер, который специфически связан с мультиспецифическим связующим, т.е. комплекс связывающий партнер - мультиспецифическое связующее. 3 н. и 32 з.п. ф-лы, 7 ил.
Реферат
Данное изобретение относится к способу определения свободного, т.е. не входящего в состав комплекса, связывающего партнера, который может быть специфически связан в образце с мультиспецифическим связующим, при этом перед детекцией свободного связывающего партнера из образца элиминируют связывающий партнер, связанный с мультиспецифическим связующим.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Стандартный твердофазный иммуноферментный анализ с использованием антител подразумевает образование комплекса между антителом, адсорбированным/иммобилизованным на твердой фазе (захватывающим антителом), антигеном и антителом, распознающим другой эпитоп антигена, конъюгированным с ферментом или детектируемой меткой (меченым антителом). В ходе определения происходит образование «сэндвича»: твердая фаза/захватывающее антитело/антиген/меченое антитело. В реакции, катализируемой в анализе сэндвич-типа, активность фермента, конъюгированного с антителом, пропорциональна концентрации антигена в инкубационной среде. Исследования с использованием антиидиотипических антител упоминаются, например, в патентах US 5,219,730; WO 87/002778; ЕР 0139389 и ЕР 0170302. Wadhwa, М., et al. (J. Immunol. Methods 278 (2003) 1-17) предложили способ определения, измерения и характеризации нежелательных антител, образование которых вызывают терапевтически активные биопрепараты. Способ получения антиидиотипических антител описан в ЕР 1917854.
Chen, Y.-P., et al. (Clin. Vac. Immunol. 14 (2007) 720-725) предложили способ быстрого определения поверхностного антигена вируса гепатита В методом агглютинации, опосредованной биспецифическим диателом, направленным против человеческих эритроцитов и поверхностного антигена вируса гепатита В. Bruynck, A., et al. описали гуманизированное биспецифическое моноклональное антитело для лечения рака (J. Cancer 67 (1993) 436-440). В WO 2006/096697 предложены способы определения бивалентных терапевтически активных белков и антител.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В данной заявке предложен способ обнаружения и/или определения концентрации свободного, т.е. не входящего в состав комплекса связывающего партнера, который может быть специфически связан по меньшей мере с одной областью связывания мультиспецифического связующего. Было обнаружено, что перед определением наличия или концентрации свободного связывающего партнера предпочтительно элиминировать из образца связывающий партнер, который специфически связан с мультиспецифическим связующим, т.е. комплекс связывающий партнер-мультиспецифическое связующее. Согласно способам, предложенным в данной заявке, элиминацию мультиспецифического связующего осуществляют путем инкубации образца с моноспецифическим связующим, которое специфически связывается с одной областью связывания мультиспецифического связующего, при этом моноспецифическое связующее специфически связывается с областью связывания мультиспецифического связующего, которая не связывается со связывающим партнером, подлежащим определению (см. Фиг. 2).
Один аспект данного описания относится к способу определения in vitro наличия и/или концентрации связывающего партнера (антигена, мишени, аналита), который может быть специфически связан с первой областью связывания мультиспецифического связующего, причем связывающий партнер, связанный с мультиспецифическим связующим, элиминируют перед определением связывающего партнера путем инкубации образца с моноспецифическим связующим, специфически связывающимся со второй областью связывания мультиспецифического связующего.
В одном воплощении связывающий партнер, подлежащий определению, является связывающим партнером, не входящим в состав комплекса, или свободным связывающим партнером.
Таким образом, один аспект данного описания представляет собой способ определения in vitro наличия и/или концентрации связывающего партнера мультиспецифического связующего, причем связывающий партнер может быть специфически связан с первой областью связывания мультиспецифического связующего, включающий этап:
- инкубации образца, содержащего связывающий партнер и мультиспецифическое связующее, с моноспецифическим связующим, которое специфически связывается со второй областью связывания мультиспецифического связующего, отличной от первой области связывания.
В одном воплощении способ включает этапы:
- инкубации образца, содержащего связывающий партнер и мультиспецифическое связующее, с моноспецифическим связующим, которое специфически связывается со второй областью связывания мультиспецифического связующего, отличной от первой области связывания, и
- определения концентрации связывающего партнера в образце, из которого элиминировано мультиспецифическое связующее.
В одном воплощении способ включает этапы:
- инкубации образца, содержащего связывающий партнер и мультиспецифическое связующее, с моноспецифическим связующим, которое специфически связывается со второй областью связывания мультиспецифического связующего, отличной от первой области связывания,
- элиминации из образца комплекса моноспецифическое связующее-мультиспецифическое связующее перед определением наличия или концентрации свободного связывающего партнера, и
- определения концентрации связывающего партнера в образце, из которого элиминировано мультиспецифическое связующее.
При инкубации с моноспецифическим связующим, которое специфически связывается со второй областью связывания мультиспецифического связующего, из образца элиминируют мультиспецифическое связующее. Одновременно из образца также удаляют комплексы связывающий партнер-мультиспецифическое связующее.
В одном воплощении мультиспецифическое связующее выбрано из антитела, химерного полипептида, содержащего антитело или фрагмент антитела и полипептид, не являющийся антителом, химерного полипептида, содержащего антитело или фрагмент антитела и растворимый рецептор, или химерного полипептида, содержащего антитело или фрагмент антитела и пептидную связывающую молекулу.
В одном воплощении мультиспецифическое связующее представляет собой антитело. В одном воплощении антитело представляет собой биспецифическое антитело или триспецифическое антитело, или тетраспецифическое антитело, или пентаспецифическое антитело, или гексаспецифическое антитело. В одном воплощении антитело представляет собой биспецифическое антитело.
В одном воплощении моноспецифическое связующее представляет собой антиидиотипическое антитело.
В одном воплощении область связывания представляет собой сайт связывания или пару вариабельных доменов тяжелой цепи антитела и легкой цепи антитела.
В одном воплощении антиидиотипическое антитело связано с твердой фазой.
В одном воплощении антиидиотипическое антитело биотинилировано, а поверхность твердой фазы покрыта стрептавидином. В одном воплощении твердая фаза представляет собой покрытые стрептавидином парамагнитные гранулы или покрытые стрептавидином гранулы сефарозы.
Один аспект данного описания представляет собой способ иммунологического определения наличия и/или концентрации связывающего партнера мультиспецифического связующего в образце с помощью иммунологического анализа, в котором мультиспецифическое связующее элиминируют из образца перед определением связывающего партнера.
В одном воплощении всех аспектов данного описания связывающий партнер представляет собой свободный связывающий партнер, т.е. связывающий партнер, который не связан или не находится в комплексе с мультиспецифическим связующим.
В одном воплощении антиидиотипическое антитело представляет собой биотинилированное антиидиотипическое антитело, направленное против мультиспецифического связующего и конъюгированное с твердой фазой при помощи стрептавидина.
В одном воплощении способов данного описания антиидиотипическое антитело представляет собой смесь, содержащую по меньшей мере два антиидиотипических антитела с различными сайтами, по которым они конъюгированы с твердой фазой.
В одном воплощении конъюгацию антитела с его партнером по конъюгации осуществляют путем химического связывания по N-концевым и/или ε-аминогруппам (лизина), ε-аминогруппам различных лизинов, карбоксильным, сульфгидрильным, гидроксильным и/или фенольным функциональным группам аминокислотного скелета терапевтически активного антитела и/или спиртовым группам углеводных компонентов терапевтически активного антитела.
В одном воплощении смесь антиидиотипических антител содержит антиидиотипическое антитело, конъюгированное с твердой фазой по меньшей мере через две различные аминогруппы. Такое присоединение через различные аминогруппы может осуществляться путем ацилирования на первом этапе части ε-аминогрупп при помощи химических защитных агентов, например, путем введения цитраконильных групп. На втором этапе конъюгирование осуществляют через оставшиеся аминогруппы. Впоследствии цитраконильные группы удаляют, а антитело конъюгируют с твердой фазой через оставшиеся свободные аминогруппы, т.е. полученное антитело конъюгируют с твердой фазой через аминогруппы, которые не были защищены цитраконильными группами. Подходящие химические защитные агенты образуют связи с незащищенными аминогруппами боковых цепей, которые являются менее стабильными и отличаются от N-концевых связей. Известно множество химических защитных агентов (см., например, ЕР 0651761). В одном воплощении химические защитные агенты включают циклические ангидриды дикарбоновых кислот, такие как ангидрид малеиновой или цитраконовой кислот.
В одном воплощении антиидиотипическое антитело конъюгируют с твердой фазой при помощи пассивной адсорбции. Пассивная адсорбция описана, например Butler, J.E., "Solid Phases in Immunoassay" (1996) 205-225 и Diamandis, E.P., and Christopoulos, T.K. (Editors), "Immunoassays" (1996) Academic Press (San Diego).
В одном воплощении антиидиотипическое антитело конъюгировано (иммобилизовано) при помощи специфически связывающейся пары. В одном воплощении такая связывающаяся пара (первый компонент/второй компонент) выбрана из стрептавидина или авидина/биотина, антитела/антигена (см., например, Hermanson, G.T., et al., Bioconjugate Techniques, Academic Press (1996)), лектина/полисахарида, стероида/стероид-связывающего белка, гормона/рецептора гормона, фермента/субстрата, IgG/белка А и/или G и т.д. В одном воплощении антиидиотипическое антитело конъюгировано с биотином, а иммобилизация осуществляется через иммобилизованный авидин или стрептавидин.
Один аспект данного описания представляет собой способ определения in vitro наличия и/или концентрации антигена мультиспецифического антитела в образце, в котором антиген, подлежащий определению, может быть специфически связан с первой областью связывания мультиспецифического антитела, включающий этап:
- инкубации образца, содержащего мультиспецифическое антитело, антиген, связанный с мультиспецифическим антителом, и свободный антиген, с антиидиотипическим антителом, которое специфически связывается со второй областью связывания мультиспецифического антитела, отличной от первой области связывания.
В одном воплощении способ включает этапы:
- инкубации образца, содержащего антиген и мультиспецифическое антитело, с антиидиотипическим антителом, которое специфически связывается со второй областью связывания мультиспецифического антитела, отличной от первой области связывания, и
- определения концентрации антигена в образце, из которого элиминировано мультиспецифическое антитело.
В одном воплощении способ включает этапы:
- инкубации образца, содержащего антиген и мультиспецифическое антитело, с антиидиотипическим антителом, которое специфически связывается со второй областью связывания мультиспецифического антитела, отличной от первой области связывания,
- элиминации комплекса антиидиотипическое антитело-мультиспецифическое антитело из образца перед определением наличия или концентрации свободного антигена, и
- определения концентрации антигена в образце, из которого элиминировано мультиспецифическое антитело.
При инкубации с антиидиотипическим антителом, которое специфически связывается со второй областью связывания мультиспецифического антитела, мультиспецифическое антитело удаляют из образца. Одновременно из образца также удаляют комплексы антиген-мультиспецифическое антитело.
В одном воплощении образец содержит мультиспецифическое антитело, свободный антиген и комплексы мультиспецифическое антитело-антиген, и определяют свободный антиген мультиспецифического антитела.
В одном воплощении антиидиотипическое антитело конъюгировано с парамагнитной гранулой.
В одном воплощении антиидиотипическое антитело конъюгировано с твердой фазой.
В одном воплощении антиидиотипическое антитело биотинилировано, а поверхность твердой фазы покрыта стрептавидином. В одном воплощении твердая фаза представляет собой покрытые стрептавидином парамагнитные гранулы или покрытые стрептавидином гранулы сефарозы.
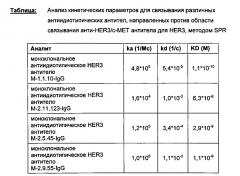
В одном воплощении константа ассоциации ka, характеризующая связывание антиидиотипического антитела со второй областью связывания мультиспецифического антитела, равна 105 л/моль*с или более.
В одном воплощении связывание антиидиотипического антитела со второй областью связывания мультиспецифического антитела характеризуется значением KD, равным 5*10-8 моль/л или менее.
В одном воплощении область связывания представляет собой сайт связывания. В одном воплощении сайт связывания представляет собой пару вариабельных доменов тяжелой цепи антитела и легкой цепи антитела.
В одном воплощении инкубация антиидиотипического антитела составляет приблизительно от 10 мин до приблизительно 36 часов.
В одном воплощении концентрацию мультиспецифического антитела в образце доводят до значений приблизительно от 2 мкг/мл приблизительно до 15 м кг/мл.
В одном воплощении общую концентрацию антигена в образце доводят до значений приблизительно от 1 нг/мл до приблизительно 250 нг/мл.
В одном воплощении способ включает следующие этапы:
- инкубацию образца, содержащего мультиспецифическое антитело, связанный с мультиспецифическим антителом антиген и свободный антиген, с антиидиотипическим антителом, которое специфически связывается со второй областью связывания мультиспецифического антитела, отличной от первой области связывания, для образования комплекса антиидиотипическое антитело - мультиспецифическое антитело, и
- удаление из образца комплекса антиидиотипическое антитело-мультиспецифическое антитело.
В одном воплощении комплекс антиидиотипическое антитело-мультиспецифическое антитело представляет собой смесь комплекса антиидиотипическое антитело-мультиспецифическое антитело и комплекса антиидиотипическое антитело-мультиспецифическое антитело-антиген.
В одном воплощении способ включает следующие этапы:
- инкубацию образца, содержащего антиген и мультиспецифическое антитело, с антиидиотипическим антителом, которое специфически связывается со второй областью связывания мультиспецифического антитела, отличной от первой области связывания, для образования комплекса антиидиотипическое антитело-мультиспецифическое антитело,
- удаление из образца комплекса антиидиотипическое антитело-мультиспецифическое антитело, и
- определение концентрации антигена в образце, из которого элиминировано мультиспецифическое-антитело.
В одном воплощении определение концентрации антигена включает следующие этапы:
- инкубацию образца, из которого элиминировано мультиспецифическое антитело, с захватывающим антителом, которое специфически связывается с антигеном, для образования комплекса захватывающее антитело-антиген, и
- установление зависимости между образованием комплекса захватывающее антитело-антиген и концентрацией в образце антигена.
В одном воплощении определение концентрации антигена включает следующие этапы:
- инкубацию образца, из которого элиминировано мультиспецифическое антитело, с захватывающим антителом, которое специфически связывается с антигеном, для образования комплекса захватывающее антитело- антиген,
- инкубацию комплекса захватывающее антитело-антиген с меченым антителом, в ходе которой захватывающее антитело и меченое антитело связываются с неперекрывающимися эпитопами антигена, и
- установление зависимости между образованием комплекса захватывающее антитело-антиген-меченое антитело и концентрацией в образце антигена.
В одном воплощении определение концентрации антигена включает следующие этапы:
- инкубацию образца, из которого элиминировано мультиспецифическое антитело, с захватывающим антителом, которое специфически связывается с антигеном, для образования комплекса захватывающее антитело- антиген,
- инкубацию комплекса захватывающее антитело-антиген с меченым антителом, в ходе которой захватывающее антитело и меченое антитело связываются с неперекрывающимися эпитопами антигена,
- инкубацию комплекса захватывающее антитело-антиген-меченое антитело с детектирующим антителом, содержащим детектируемую метку, в ходе которой детектирующее антитело специфически связывается с эпитопом меченого антитела, находящимся за пределами вариабельных доменов меченого антитела, и
- установление зависимости между образованием комплекса захватывающее антитело-антиген-меченое антитело и концентрацией в образце антигена.
В одном воплощении мультиспецифическое антитело представляет собой биспецифическое антитело, которое имеет первую область связывания, которая специфически связывается с первым антигеном или первым эпитопом антигена, и которое имеет вторую область связывания, которая специфически связывается со вторым антигеном или вторым эпитопом антигена.
Один аспект данного описания представляет собой применение антиидиотипического антитела, которое специфически связывается с первой областью связывания мультиспецифического антитела, для элиминации из образца антигена, связанного со второй областью связывания мультиспецифического антитела.
СВЕДЕНИЯ, ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ
ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
В данном документе описан способ предварительной обработки образца in vitro для детекции "свободного связывающего партнера" мультиспецифических связующих, таких как биспецифические антитела/лекарственные средства, в образцах для доклинических и клинических исследований.
Было обнаружено, что перед детекцией свободного связывающего партнера необходимо элиминировать из образца мультиспецифическое связующее.
В данном документе описано применение антиидиотипических антител, которые специфически связываются с областью связывания терапевтически активного мультиспецифического антитела для определения уровня антигена, который может быть но не является связанным со второй отличной областью связывания терапевтически активного мультиспецифического антитела. Антиидиотипическое антитело применяют для элиминации из образца мультиспецифического антитела и комплексов мультиспецифическое антитело-антиген, подлежащий определению.
Таким образом, в данном документе описан способ детекции in vitro свободного связывающего партнера (антигена, мишени, аналита) мультиспецифического связующего, который может быть специфически связан с первой областью связывания мультиспецифического связующего, где мультиспецифическое связующее элиминируют из образца перед определением свободного связывающего партнера путем инкубации образца с моноспецифическим связующим, которое специфически связывается со второй областью связывания мультиспецифического связующего, отличной от первой области связывания, и таким образом элиминации из образца мультиспецифического связующего и комплексов мультиспецифическое связующее-связывающий партнер.
Определение общего антигена, связанного с биспецифическим антителом антигена и свободного антигена может быть полезным при мониторинге лечения с применением терапевтически активных антител. Общий антиген представляет сумму свободного антигена и связанного с биспецифическим антителом антигена.
Ниже способ по данному описанию проиллюстрирован на примере мультиспецифического антитела, специфически связывающегося с множеством антигенов или эпитопов одного и того же антигена, как воплощения мультиспецифического связующего, и антигена, который специфически связывается с одной областью связывания мультиспецифического антитела, как воплощения связывающего партнера.
Термин "антитело" в данном документе используется в широком смысле и охватывает антитела с различной структурой, включая моноклональные антитела, поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела) и фрагменты антител, при условии, что они проявляют желаемую антигенсвязывающую активность, но не ограничивается ими.
В некоторых воплощениях антитело представляет собой мультиспецифическое антитело, например, биспецифическое антитело. Мультиспецифические антитела представляют собой моноклональные антитела, имеющие области связывания по меньшей мере для двух различных сайтов. В некоторых воплощениях одна из областей связывания предназначена для первого антигена, а другая - для отличающегося второго антигена. В некоторых воплощениях биспецифические антитела могут связывать два различных эпитопа одного и того же антигена. Биспецифические антитела могут быть созданы в виде полноразмерных антител или фрагментов антител. В одном воплощении антитело представляет собой биспецифическое антитело, которое специфически связывается с первым и вторым антигеном. В одном воплощении биспецифическое антитело имеет i) первую область связывания, которая специфически связывается с первым антигеном или первым эпитопом антигена, и ii) вторую область связывания, которая специфически связывается со вторым антигеном или вторым эпитопом того же самого антигена. В одном воплощении второй эпитоп того же самого антигена представляет собой неперекрывающийся эпитоп.
Мультиспецифические антитела описаны в WO 2009/080251, WO 2009/080252, WO 2009/080253, WO 2009/080254, WO 2010/112193, WO 2010/115589, WO 2010/136172, WO 2010/145792 или WO 2010/145793.
"Фрагмент антитела" обозначает молекулу, отличную от интактного антитела, содержащую часть интактного антитела, которая связывается с антигеном, связывающимся с интактным антителом. Примеры фрагментов антител включают Fv, Fab, Fab', Fab'-SH, F(ab')2, диатела, линейные антитела, молекулы одноцепочечных антител (например, scFv) и мультиспецифические антитела, образованные из фрагментов антител, но не ограничиваются ими.
"Класс" антитела обозначает тип константного домена или константного участка его тяжелой цепи. Существует пять основных классов антител: IgA, IgD, IgE, IgG и IgM, и некоторые из них можно подразделить на подклассы (изотипы), например, IgG1, lgG2, lgG3, IgG4, IgA1 и lgA2. Константные домены тяжелых цепей, соответствующие различным классам иммуноглобулинов, обозначаются α, δ, ε, γ и μ, соответственно.
Термин "свободный антиген" обозначает антиген, который может быть специфически связан с областью связывания антитела, но в данный момент не связан с данной областью связывания. В одном воплощении свободный антиген представляет собой антиген, не связанный с антителом, или антиген, не находящийся в комплексе с антителом.
Термин "Fc-фрагмент" в данном документе используется для обозначения С-концевого участка тяжелой цепи иммуноглобулина, содержащего по меньшей мере часть константного участка. Термин включает Fc-фрагменты с нативной последовательностью и варианты Fc-фрагментов. В одном воплощении Fc-фрагмент тяжелой цепи IgG человека простирается от Cys226 или от Pro230 до карбокси-конца тяжелой цепи. При этом, С-концевой лизин (Lys447) Fc фрагмента может присутствовать или отсутствовать. Если не указано иначе, нумерация аминокислотных остатков Fc-фрагмента или константного участка соответствует системе нумерации EU, также носящей название «EU index», согласно описанию Kabat, et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991), NIH Publication 91-3242.
"Каркасные участки" или "FR" обозначают остатки вариабельного домена, отличные от остатков гипервариабельного участка (HVR). FR вариабельного домена, как правило, состоит из 4 FR доменов: FR1, FR2, FR3 и FR4. Соответственно, последовательности HVR и FR в составе VH (или VL), как правило, располагаются в следующем порядке: FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
"Человеческое антитело" представляет собой антитело, аминокислотная последовательность которого соответствует последовательности антитела, продуцируемого в организме или в клетках человека или полученного из источника, не относящегося к человеку, но задействующего репертуар антител человека или иные последовательности, кодирующие антитела человека. Данное определение человеческого антитела, в частности, исключает гуманизированные антитела, содержащие антиген-связывающие остатки, не являющиеся человеческими.
"Гуманизированное" антитело обозначает химерное антитело, содержащее аминокислотные остатки гипервариабельных участков, не являющиеся человеческими, и аминокислотные остатки каркасных участков человека. В определенных воплощениях гуманизированное антитело содержит по существу все из по меньшей мере одного, а обычно двух вариабельных доменов, в которых все или по существу все гипервариабельные участки (например, CDR) соответствуют участкам антитела, не являющегося человеческим, и все или по существу все каркасные участки соответствуют участкам человеческого антитела. Гуманизированное антитело может содержать по меньшей мере часть константного участка антитела, полученного из человеческого антитела. "Гуманизированная форма" антитела, например, антитела не являющегося человеческим, обозначает антитело, прошедшее гуманизацию.
Термин "гипервариабельный участок" или "HVR" в данном документе обозначает каждый из участков вариабельного домена антитела, имеющих гипервариабельную последовательность и/или формирующих петли определенной структуры ("гипервариабельные петли"). Как правило, нативные состоящие из четырех цепей антитела имеют 6 HVR; три в VH (Н1, Н2, Н3) и три в VL (L1, L2, L3). Как правило, HVR содержат аминокислотные остатки гипервариабельных петель и/или "участков, определяющих комплементарность" (CDR), последние характеризуются наибольшей вариабельностью последовательности и/или задействованы в распознавании антигена. Приведенные в качестве примера гипервариабельные петли находятся между аминокислотными остатками 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (Н1), 53-55 (Н2) и 96-101 (Н3) (Chothia, С. and Lesk, A.M., J. Mol. Biol. 196 (1987) 901-917). Приведенные в качестве примера CDR (CDR-L1, CDR-L2, CDR-L3, CDR-H1, CDR-H2 и CDR-H3) находятся между аминокислотными остатками 24-34 в L1, 50-56 в L2, 89-97 в L3, 31-35 В в Н1, 50-65 в Н2 и 95-102 в Н3 (Kabat, Е.А. et al., Sequences of Proteins of Immunological Interest, 5th ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991), NIH Publication 91-3242). Как правило, CDR содержат аминокислотные остатки, образующие гипервариабельные петли, за исключением CDR1 в составе VH. CDR также включают "остатки, определяющие специфичность", или "SDR," которые представляют собой остатки, контактирующие с антигеном. SDR находятся в составе участков CDR, обозначаемых «укороченными CDR», или a-CDR (от англ. abbreviated-CDRs). Приведенные в качестве примера a-CDR (a-CDR-L1, a-CDR-L2, a-CDR-L3, a-CDR-H1, a-CDR-H2 и a-CDR-H3) образованы аминокислотными остатками в положениях 31-34 в L1, 50-55 в L2, 89-96 в L3, 31-35 В в Н1, 50-58 в Н2 и 95-102 в Н3 (Almagro, J.С. and Fransson, J., Front. Biosci. 13 (2008) 1619-1633). Если не указано иначе, гипервариабельные остатки и иные остатки вариабельного домена (например, остатки FR) в данном документе пронумерованы в соответствии с Kabat et al., см. выше.
Термин "моноклональное антитело" в данном документе используется для обозначения антитела, полученного из популяции по существу гомогенных антител, т.е. отдельные антитела, составляющие популяцию, идентичны и/или связываются с одним и тем же эпитопом, за исключением возможных вариантов антител, например, содержащих мутации, возникающие естественным путем или в ходе получения препарата моноклонального антитела, при этом подобные варианты, как правило, присутствуют в минорном количестве. В противоположность препаратам поликлональных антител, обычно содержащим различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело в препарате моноклональных антител направлено против единственной детерминанты антигена. Таким образом, определение "моноклональное" указывает на характер антитела, полученного из по существу гомогенной популяции антител, и не должно рассматриваться как необходимость получения антитела определенным способом. Например, моноклональные антитела, предназначенные для применения согласно настоящему изобретению, могут быть произведены с помощью различных технологий, включая гибридомную технологию, технологию рекомбинантной ДНК, технологию фагового дисплея и технологии с использованием трансгенных животных, имеющих все локусы человеческих иммуноглобулинов или их часть, но не ограничиваясь ими; данные способы и другие приведенные в качестве примера способы производства моноклональных антител описаны в данном документе.
Термин "вариабельный участок" или "вариабельный домен" обозначает домен легкой или тяжелой цепи антитела, задействованный в связывании антитела с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL, соответственно) нативного антитела, как правило, имеют одинаковую структуру, при этом каждый домен содержит четыре консервативных каркасных участка (FR) и три гипервариабельных участка (HVR) (см., например, Kindt, T.J. et al. Kuby Immunology, 6th ed., W.H. Freeman and Co., N.Y. (2007), page 91). Единственного VH или VL домена может быть достаточно для обеспечения специфичности связывания антигена. Более того, антитела, связывающие конкретный антиген, могут быть выделены при помощи VH или VL домена антитела, связывающего этот же антиген, при скрининге библиотеки на комплементарные VL или VH домены, соответственно. См., например, Portolano, S. et al., J. Immunol. 150 (1993) 880-887; Clackson, T. et al., Nature 352 (1991) 624-628).
Термин "антиидиотипическое антитело" обозначает антитело, которое специфически связывается с областью связывания, такой как сайт связывания родительского антитела, т.е. направленное, например, против антигенсвязывающего сайта родительского антитела. В одном воплощении антиидиотипическое антитело специфически связывается с одним или несколькими CDR родительского антитела. В одном воплощении родительское антитело представляет собой терапевтически активное антитело. В одном воплощении родительское антитело представляет собой мультиспецифическое антитело. В одном воплощении родительское антитело представляет собой биспецифическое антитело.
Два эпитопа являются перекрывающимися, если при использовании иммобилизованного антитела и растворимого антигена, или наоборот, при концентрации указанного эпитопа 20-50 нМ и концентрации антитела, с эпитопом которого определяется перекрывание, 100 нМ, методом поверхностного плазмонного резонанса (SPR, от англ. surface plasmon resonance) детектируется уменьшение сигнала на 50% или более, в одном воплощении на 75% или более. В альтернативном случае, можно применять способ, в котором перекрывание эпитопов двух антител, связывающихся с тем же антигеном, определяется при помощи конкурентного анализа. С этой целью, например, при помощи иммуноферментного анализа (ИФА) с использованием клеток, экспрессирующих эпитопы рекомбинантного антигена, определяют, конкурирует ли антитело, с эпитопом которого определяется перекрывание, с другим антителом за связывание с иммобилизованным антигеном. Для этой цели иммобилизованный антиген инкубируют с меченой формой антитела и избытком антитела, с эпитопом которого определяют перекрывание. Перекрывание эпитопов можно легко установить, определяя связанную метку. Если регистрируется снижение сигнала более чем на 70%, в одном воплощении более чем на 80% при той же концентрации, или вытеснение более чем на 80%, в одном воплощении более чем на 90% при более высоких концентрациях, в одном случае при 105-кратном избытке антитела, у которого определяют перекрывание эпитопов с известным антителом, то эпитопы являются идентичными или перекрывающимися, а оба антитела связываются с тем же самым или с перекрывающимися эпитопами того же самого антигена.
Принцип различных видов иммунологического анализа описан, например, Hage, D.S. (Anal. Chem. 71 (1999) 294R-304R). Lu, В., et al. (Analyst 121 (1996) 29R-32R) предложили применять в иммунологических анализах ориентированную иммобилизацию антител. Иммунологические анализы с использованием авидина-биотина описаны, например, Wilchek, М., and Bayer, Е.А., in Methods Enzymol. 184 (1990) 467-469.
Моноклональные антитела и их константные домены, имея белковую природу, содержат ряд реакционноспособных боковых цепей для присоединения связывающего партнера, такого как поверхность, белок, полимер (например, ПЭГ, целлюлоза или полистирол), фермент или член связывающейся пары. Реакционноспособными химическими группами антител являются, например, аминогруппы (лизины, альфа-аминогруппы), тиоловые группы (цистины, цистеины и метионины), карбоксильные группы (аспарагиновые кислоты, глутаминовые кислоты) и спиртовые группы. Такие способы описаны, например, Aslam М., and Dent, A., in "Bioconjugation", MacMillan Ref. Ltd. 1999, pp. 50-100.
Одной из наиболее распространенных реакционноспособных групп белков является алифатическая ε-аминогруппа аминокислоты лизина. Как правило, практически все антитела богаты лизином. Аминогруппы лизина являются достаточно хорошими нуклеофилами при pH выше 8,0 (pKa=9,18) и таким образом, легко и полностью реагируют с различными реагентами с образованием стабильных связей. Реагенты, вступающие в реакцию с аминогруппами, в первую очередь реагируют с лизинами и α-аминогруппами белков. Реакционноспособные сложные эфиры, в частности N-гидрокси-сукцинимидные (NHS) эфиры, относятся к наиболее широко употребляемым реагентам для модификации аминогрупп. Оптимальные значения pH для протекания реакции в водной среде составляют от pH 8,0 до 9,0. Изотиоцианаты являются реагентами, модифицирующими аминогруппы, и образуют с белками тиомочевинные соединения. Они вступают в реакцию с аминогруппами белков в водном растворе (оптимальные значения pH 9,0-9,5). Альдегиды вступают в реакцию в мягких условиях в водной среде с алифатическими и ароматическими аминами, гидразинами и гидразидами с образованием промежуточного имина (основания Шиффа). Основание Шиффа может быть селективно восстановлено при помощи слабых или сильных восстанавливающих агентов (таких как борогидрид натрия или цианоборогидрид натрия) с образованием стабильных алкиламинных связей. Другими реагентами, которые применяют для модификации аминогрупп, являются ангидриды кислот. Например, ангидрид диэтилентриаминпентауксусной кислоты (DTPA) является бифункциональным хелатирующим агентом, содержащим две ангидридные группы, вступающие в реакцию с аминогруппами. Он может вступать в реакцию с N-концевыми и ε-аминогруппами белков с образованием амидных связей. Ангидридные циклы размыкаются с образованием мультивалентных хелатирующих ионы металлов «клешней», способных прочно связываться с ионами металлов с образованием координационного комплекса.
Другой распространенной реакционноспособной группой антител является тиоловый остаток серосодержащей аминокислоты цистина и продукта его восстановления цистеина (или полуцистина). Цистеин содержит свободную тиоловую группу, которая обладает более выраженными нуклеофильными свойствами, чем аминогруппы и как правило представляет собой наиболее реакционноспособную функциональную группу в составе белка. Тиоловые группы, как правило, являются реакционноспособными при нейтральных значениях pH, и таким образом могут селективно связываться с другими молекулами в присутствии аминогрупп. Поскольку свободные сульфгидрильные группы являются относительно реакционноспособными, белки, содержащие эти группы, часто содержат их в окисленной форме в виде дисульфидных групп или дисульфидных связей. В таких белках для образования реакционноспособной свободной тиоловой группы необходимо восстановление дисульфидных связ