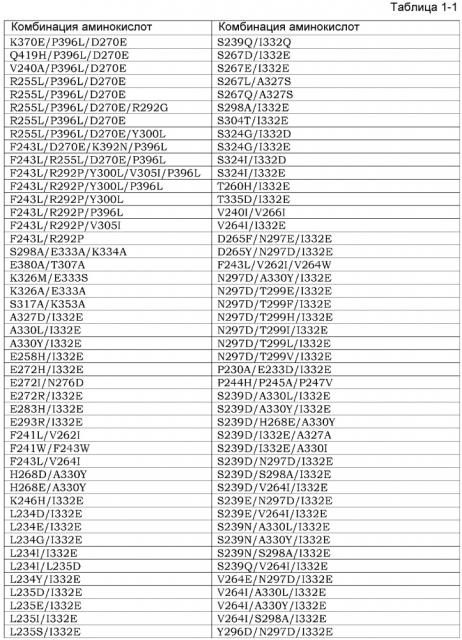
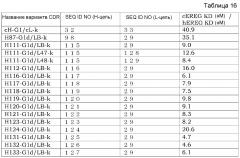
Гуманизированное анти-эпирегулин-антитело и противораковый терапевтический агент, содержащий указанное антитело, в качестве активного ингредиента
Иллюстрации
Показать всеИзобретение относится к медицине. Изобретение представляет собой антитело к Эпирегулину, которое содержит вариабельную область тяжелой цепи, включающую CDR1 тяжелой цепи последовательности SEQ ID NO: 9, CDR2 тяжелой цепи SEQ ID NO: 160 и CDR3 тяжелой цепи SEQ ID NO: 158; и вариабельную область легкой цепи, включающую CDR1 легкой цепи SEQ ID NO: 163, CDR2 легкой цепи SEQ ID NO: 13 и CDR3 легкой цепи SEQ ID NO: 164, которое содержит вариабельную область тяжелой цепи, соответствующую вариабельной области тяжелой цепи в SEQ ID NO: 150, и вариабельную область легкой цепи, соответствующую вариабельной области в SEQ ID NO: 141. константную область тяжелой цепи SEQ ID NO: 30, которое содержит константную область легкой цепи SEQ ID NO: 27, обладает нейтрализующей активностью, цитотоксичностью, где цитотоксичность представляет собой CDC и/или ADCC. Изобретение ингибирует рост раковых клеток проявлением цитотоксической активности и нейтрализующей активности против Эпирегулин-экспрессирующих раковых клеток. 6 з.п. ф-лы, 23 табл., 21 ил., 19 пр.
Реферат
Область техники, к которой относится данное изобретение
Данное изобретение относится к способам лечения рака, агентам для ингибирования пролиферации раковых клеток и противораковым агентам.
Уровень техники
Рак является главной причиной смертности в индустриальных странах. Многие химиотерапевтические агенты были разработаны на протяжении последних 50 лет с целью лечения рака. Большинство химиотерапевтических агентов могут быть классифицированы как алкилирующие агенты, антиметаболиты, антрациклины, алкалоиды растений, ингибиторы топоизомеразы и противоопухолевые агенты. Все из этих фармацевтических агентов воздействуют на деление клеток или синтез ДНК и вызывают терапевтические эффекты посредством механизма, который функционирует некоторым определенным образом.
Эффективность конкретного химиотерапевтического агента является разной среди раков или пациентов или является разной в зависимости от временного хода в индивидуальных пациентах. Раковые клетки, подвергнутые химиотерапевтическим агентам, развивают устойчивость к этим химиотерапевтическим агентам и также часто развивают перекрестную устойчивость к множеству других противораковых агентов. Кроме того, для контроля побочных эффектов, происходящих из повреждения клеток этими химиотерапевтическими агентами на нормальных клетках посредством вышеупомянутого механизма этих агентов, доза или применение этих агентов часто являются ограниченными.
Вместо общепринятых химиотерапевтических агентов, недавно были разработаны молекулярно-нацеленные лекарственные средства, которые экспрессируются специфически на раковых клетках. С появлением этих молекулярно-нацеленных лекарственных средств побочные эффекты, присущие общепринятым химиотерапевтическим агентам, могли избегаться, и лечение рака, которое способствует QOL раковых пациентов, становится осуществимым. Такие молекулярно-нацеленные лекарственные средства включают в себя фармацевтические агенты с малыми молекулами, а также высокомолекулярные фармацевтические агенты, такие как антитела. Терапевтические антитела являются молекулами, которые врожденно присутствуют в организме и имеют преимущество низкой токсичности в отношении живых организмов, а также преимущество проявления терапевтических эффектов, специфически разрушающих клетки-мишени посредством механизма действия, другого, чем механизм фармацевтических агентов с малой молекулой, такого как цитотоксическая активность, опосредуемая эффекторными функциями. Таким образом, многие терапевтические антитела недавно были представлены на рынок.
Нацеливающий на терапевтические антитела эпирегулин, который высоко экспрессируется в раке ободочной кишки, аденокарциноме легкого, панкреатическом раке, раке желудка и раке почки, был описан в качестве антител, которые специфически повреждают клетки-мишени посредством механизма действия, другого, чем механизм действия низкомолекулярных агентов, такой как цитотоксическая активность, опосредуемая такими эффекторными функциями (Патентный Документ 1). Конкретно, измерение активности комплементзависимой цитотоксичности (CDC) и активности антителозависимой клеточноопосредованной цитотоксичности (ADCC) выявило, что анти-Эпирегулин-антитела имеют CDC-активность и ADCC-активность на Эпирегулин-экспрессирующих клетках. Кроме того, было обнаружено, что анти-Эпирегулин-антитела оказывают ингибирующее пролиферацию действия на линиях раковых клеток посредством нейтрализующего действия. Кроме того, из вышеупомянутых открытий было выявлено, что анти-Эпирегулин-антитела являются эффективными для диагностики, предотвращения и лечения различных первичных и метастатических раков.
Любой новый кандидатный фармацевтический агент, включающий в себя противораковые агенты, такие как описанные выше, должен проходить строгие испытания, чтобы стать коммерчески доступным. Например, эти испытания классифицируются как преклинические испытания и клинические испытания. Обычно последние классифицируются в испытаниях фазы I, фазы II и фазы III и выполняются на человеке, тогда как первые испытания выполняются с использованием животных. Обычно целью преклинических исследований является демонстрация того, что кандидатное лекарственное средство является сильным, а также эффективным и безопасным. Конкретно, целями этих исследований на животных является демонстрация того, что этот фармацевтический агент не является канцерогенным, мутагенным или тератогенным, а также понимание фармакокинетики этого фармацевтического агента. Клинические исследования с использованием введения тестируемого фармацевтического агента разрешаются только тогда, когда безопасность и эффективность тестируемого фармацевтического агента в отношении животных установлены в преклинических испытаниях.
Во многих случаях действие низкомолекулярного тестируемого фармацевтического агента (например, нового противоракового агента, произведенного из антрациклина) в животных может становиться индикатором для ожидаемых действий этого фармацевтического агента при введении человеку. Таким образом, обычно данные, полученные из таких преклинических испытаний, могут быть высокопредсказуемыми из действий, которые могут иметь место при введении людям. Однако такая предсказуемость не получается в любом типе тестируемого фармацевтического агента; и предсказуемость на основе результатов преклинических исследований, и вероятность того, что эти кандидатные фармацевтические агенты будут одобрены в клинических исследованиях, значительно уменьшается.
Обычно антитела могут функционировать посредством высокоспецифического узнавания молекул-мишеней, которые являются обычно белковыми. В большинстве случаев тестируемые фармацевтические агенты в виде антител являются моноклональными антителами и узнают только единственный сайт или единственный эпитоп на молекуле-мишени. Поскольку моноклональные антитела обычно имеют высокую мишень-идентифицирующую функцию, антитела становятся представляющими большой интерес кандидатами для развития фармацевтических агентов, но, с другой стороны, эта идентифицирующая функция в некоторых случаях делает преклинические исследования трудными. Это бывает потому, что имеются видоспецифические вариации в последовательностях молекул-мишеней, связанных этими антителами. Например, моноклональное антитело, которое специфически узнает молекулу Y via эпитоп Х в людях и связывается с этой молекулой, будет тестироваться на соответствующий эпитоп X' в соответствующей молекуле-мишени (ортологе) Y' в видах животных, используемых для преклинических исследований, но X' может отличаться от X, присутствующего в соответствующей молекуле-мишени в людях. Таким образом, часто это моноклональное антитело не может специфически узнавать ортолог Y' и связываться с этой молекулой. Даже среди групп моноклональных антител, которые имеют реактивность в отношении антигенов человека и приматов, имеется много примеров антител, которые реагируют только с гомологами антигена человека и шимпанзе. Например, такие случаи наблюдали для моноклональных анти-CD3-антител. Одним из наиболее широко используемых CD3-комплекс-специфических моноклональных антител, которые имеют большинство определяемых свойств, является OKT-3. OKT-3 реагирует с CD3 шимпанзе, но не реагирует с гомологами CD3 других приматов, таких как макак-резус или CD3 собаки (Непатентный Документ 2). С другой стороны, имеются примеры моноклональных антител, которые узнают антигены резуса, но не их ортологи человека. Одним примером в этой группе является FN-18, который является моноклональным антителом против полученного из макака-резус CD3 (Непатентный Документ 2).
Несколько стратегий были заимствованы для противостояния проблемам с преклиническими исследованиями на животных, вызываемыми высокой специфичностью таких моноклональных антител.
Первым известным подходом является выполнение преклинических исследований на тестируемых содержащих антитела фармацевтических препаратах с использованием модели шимпанзе. Шимпанзе являются ближайшим генетическим родственником людей, и поскольку их геном имеет 99% идентичность относительно генома человека, вариации молекулы-мишени, специфически связанные тестируемым содержащим антитело фармацевтическим препаратом в шимпанзе, являются с высокой вероятностью идентичными вариациям этой молекулы в людях. Действительно, Schereth et al. обнаружили, что эти вариации в CD3 являются общими между людьми и шимпанзе (Непатентный Документ 3). Таким образом, считается, что риск того, что эта молекула не будет распознаваться тестируемым содержащим антитело фармацевтическим препаратом в шимпанзе, является низким. Однако исследования с использованием шимпанзе являются очень дорогостоящими и также имеют этические проблемы. Кроме того, поскольку шимпанзе являются животными с риском вымирания, и количество животных, которые могут быть использованы в экспериментах, является в сильной степени ограниченным, такие преклинические исследования на шимпанзе исключены из развития большинства тестируемых содержащих антитела фармацевтических препаратов.
Вторым подходом является подход адаптирования молекулы, используемой в преклинических исследованиях к животному, используемому в этих исследованиях. В этом подходе информацию незаменимой безопасности получают в преклинических исследованиях конструированием так называемого ʺсуррогатногоʺ антитела для введения тест-животным. Обычно таким суррогатным антителом является антитело, которое специфически распознает ортолог тест-животного из молекулы-мишени, связанной несуррогатным антителом (подлинным тестируемым содержащим антитело фармацевтическим препаратом для человека), и является антителом, которое было модифицировано для связывания этого ортолога. Таким образом, в этом подходе с использованием такого ʺсуррогатногоʺ антитела, можно индивидуально сконструировать две разные молекулы: клинический тестируемый фармацевтический агент и преклинический тестируемый фармацевтический агент для использования в преклинических исследованиях на виде животного, которое имеет специфичность-мишень, соответствующую этому клиническому фармацевтическому агенту, и безопасность которого, как такового, должна быть испытана. Большим недостатком такого суррогатного подхода является то, что этим суррогатным антителом для преклинических исследований является модифицированный продукт этого клинического тестируемого содержащего антитело фармацевтического препарата. Таким образом, данные, полученные в преклинических исследованиях с использованием суррогатного антитела, часто не могут быть применимы непосредственно к людям. Таким образом, предсказуемость результатов клинического исследования, основанная на результатах преклинического исследования с использованием этих подходов, может уменьшаться.
Вышеупомянутый подход адаптирует тестируемый фармацевтический агент таким образом, что он является подходящим для животного, используемого в преклинических исследованиях. С другой стороны, другие известные подходы адаптируют животных, используемых в преклинических исследованиях, к кандидатному фармацевтическому агенту, подлежащему введению в людей.
Примером адаптации тест-животного к содержащему тест-антитело фармацевтическому препарату, предназначенному для введения людям, является продуцирование трансгенного животного, которое экспрессирует молекулу человека, с которой этот тестируемый содержащий антитело фармацевтический препарат специфически связывается, вместо молекулы не-человека, присущей этому виду тест-животного. Ожидается, что в этом способе, этот тестируемый содержащий антитело фармацевтический препарат связывается с антигеном человека в этом трансгенном тест-животном. Например, в исследовании, проведенном Bugelski et al., оценивание преклинической безопасности выполняли на моноклональном антителе keliximab с использованием CD4-трансгенных мышей человека для предсказания долгосрочного лечения ревматоидного артрита в пациентах-людях. Keliximab является моноклональным антителом, которое имеет специфичность в отношении CD4 человека и шимпанзе. Bugelski et al. делают вывод, что использование экспрессирующей белок человека трансгенной мыши обеспечивает полезный альтернативный способ для исследований, проводимых в шимпанзе, с использованием биологических фармацевтических препаратов, которые имеют ограниченную межвидовую специфичность. Однако получение трансгенных животных для тест-целей является трудоемким и дорогостоящим, так как оно требует большой работы.
Документы известного уровня техники
Патентные Документы
Патентный Документ 1 WO2008/047723.
Непатентные Документы]
Непатентный Документ 1 J. Med. Primatol. (1986 15, 441-451.
Непатентный Документ 2 J. Med. Primatol. (2001) 40, 141-147.
Непатентный Документ 3 Cancer Immunol. Immunother. Май 2006; 55 (5), 503-514.
Непатентный Документ 4 Hum. Exp. Toxicol. (2000) 19, 230-243.
Сущность изобретения
Проблемы, подлежащие решению этим изобретением
Данное изобретение относится к анти-Эпирегулин-антителам, обнаруживающим перекрестную межвидовую реактивность между животными, не являющимися человеком, и людьми. Дополнительно данное изобретение относится к анти-Эпирегулин-антителам с ослабленной химической деградацией. Данное изобретение относится также к анти-Эпирегулин-антителам с уменьшенной изоэлектрической точкой. Кроме того, данное изобретение относится к анти-Эпирегулин-антителам с уменьшенным количеством агрегата. Кроме того, данное изобретение относится к фармацевтическим композициям или терапевтическим агентам для рака, содержащим вышеупомянутые анти-антитела. Данное изобретение относится также к способам получения вышеупомянутых анти-Эпирегулин-антител.
Средства для решения этих проблем
Авторы этого изобретения обнаружили, что отношение активности связывания с Эпирегулином, выделенным из собакоподобной обезьяны, к активности связывания с Эпирегулином человека увеличивается заменой аминокислотного остатка в последовательности вариабельного района гуманизированного антитела EP27, которое ингибирует рост раковых клеток проявлением цитотоксической активности и нейтрализующей активности против раковых клеток, которые экспрессируют Эпирегулин, остатком аргинина. Более конкретно, авторы данного изобретения сконструировали анти-Эпирегулин-антитела, обнаруживающие перекрестную межвидовую реактивность между людьми и собакоподобными обезьянами, которые являются животными, не являющимися человеком. Кроме того, конструировали анти-Эпирегулин-антитела с уменьшенной химической деградацией заменой подходящим образом аминокислотных остатков в последовательности вариабельного района гуманизированного антитела EP27. Кроме того, конструировали анти-Эпирегулин-антитела с уменьшенной изоэлектрической точкой заменой подходящим образом аминокислотных остатков в последовательности вариабельного района гуманизированного антитела EP27. Конструировали анти-Эпирегулин-антитела с уменьшенным количеством агрегата заменой подходящим образом аминокислотных остатков в последовательности вариабельного района гуманизированного антитела EP27. Авторы данного изобретения выявили, что анти-Эпирегулин-антитела, имеющие эти свойства, обнаруживают эффекты ингибирования роста посредством нейтрализующей активности и цитотоксической активности на линиях раковых клеток. Кроме того, из вышеупомянутых открытий, авторы данного изобретения обнаружили, что анти-Эпирегулин-антитела являются эффективными для лечения различных первичных и метастатических раков, и тем самым завершили данное изобретение.
Более конкретно, данное изобретение относится к следующему:
[1] анти-Эпирегулин-антителу, которое является антителом, которое связывается с эпитопом, связанным анти-Эпирегулин-антителом, содержащим CDR вариабельного района тяжелой цепи SEQ ID NO: 9, 10 и 11 и CDR вариабельного района легкой цепи SEQ ID NO: 12, 13 и 14, где это антитело характеризуется наличием меньшего отношения величины KD для анти-Эпирегулин-антитела обезьяны SEQ ID NO: 170 (cEREG KD) к величине KD для Эпирегулина человека SEQ ID NO: 34 (hEREG KD) (cEREG KD/hEREG KD), чем это отношение (cEREG KD)/hEREG KD) анти-Эпирегулин-антитела, содержащего CDR вариабельного района тяжелой цепи SEQ ID NO: 9, 10 и 11 и CDR вариабельного района легкой цепи SEQ ID NO: 12, 13 и 14:
[2] антителу [1], где cEREG KD/hEREG KD меньше чем 40;
[3] антителу [1], где cEREG KD/hEREG KD меньше чем 10;
[4] антителу [1], где cEREG KD/hEREG KD меньше чем 6;
[5] антителу [1], где cEREG KD/hEREG KD меньше чем 4;
[6] антителу по любому [1]-[5], которое содержит вариабельный район тяжелой цепи, содержащий CDR1 тяжелой цепи SEQ ID NO: 9, CDR2 тяжелой цепи, выбранный из группы, состоящей из SEQ ID NO: 161, 160, 159, 157, 156, 155, 153, 108, 107, 106, 105, 104, 103, 102, 101 и 100, и CDR3 тяжелой цепи, выбранный из группы, состоящей из SEQ ID NO: 158, 154, 152, 151, 112, 111, 110 и 11; и вариабельный район легкой цепи, содержащий CDR1 легкой цепи, выбранный из группы, состоящей из SEQ ID NO: 163, 68, 67 и 12, CDR2 легкой цепи, выбранный из группы, состоящей из SEQ ID NO: 71, 69 и 13, и CDR3 легкой цепи, выбранный из группы, состоящей из SEQ ID NO: 164, 48, 47 и 14;
[7] антителу по любому из [1]-[5], которое содержит вариабельный район тяжелой цепи, выбранный из группы, состоящей из SEQ ID NO: 150, 149, 148, 147, 146, 145, 144, 143, 142, 140, 139, 138, 137, 135, 134, 133, 132, 131, 127, 126, 125, 124, 123, 122, 121, 120, 119, 118, 117, 116 и 115, и вариабельный район легкой цепи, выбранный из группы, состоящей из SEQ ID NO: 141, 136, 130, 129, 128, 99, 85, 84, 83, 82, 81, 80, 58, 57 и 29;
[8] анти-Эпирегулин-антителу, выбранному из любого ниже:
(1) анти-Эпирегулин-антитела, содержащего вариабельный район тяжелой цепи, выбранный из группы, состоящей из SEQ ID NO: 150, 149, 148, 147, 146, 145, 144, 143, 142, 140, 139, 138, 137, 135, 134, 133, 132, 131, 127, 126, 125, 124, 123, 122, 121, 120, 119, 118, 117, 116, 115, 98, 97, 96, 95, 94, 93, 92, 79, 78, 77, 76, 75, 74, 73, 72, 56, 55, 54, 53, 52, 51, 50, 49 и 38;
(2) анти-Эпирегулин-антитела, содержащего вариабельный район легкой цепи, выбранный из группы, состоящей из SEQ ID NO: 141, 136, 130, 129, 128, 99, 85, 84, 83, 82, 81, 80, 58, 57 и 29; и
(3) анти-Эпирегулин-антитела, содержащего вариабельный район тяжелой цепи, выбранный из группы, состоящей из SEQ ID NO: 150, 149, 148, 147, 146, 145, 144, 143, 142, 140, 139, 138, 137, 135, 134, 133, 132, 131, 127, 126, 125, 124, 123, 122, 121, 120, 119, 118, 117, 116, 115, 98, 97, 96, 95, 94, 93, 92, 79, 78, 77, 76, 75, 74, 73, 72, 56, 55, 54, 53, 52, 51, 50, 49 и 38; и вариабельный район легкой цепи, выбранный из группы, состоящей из SEQ ID NO: 141, 136, 130, 129, 128, 99, 85, 84, 83, 82, 81, 80, 58, 57 и 29;
[9] антителу по любому из [6]-[8], которое содержит константный район тяжелой цепи SEQ ID NO: 26;
[10] антителу по любому из [6]-[9], которое содержит константный район легкой цепи SEQ ID NO: 27;
[11] антителу по любому из [1]-[10], которое имеет нейтрализующую активность;
[12] антителу по любому из [1]-[11], которое имеет цитотоксичность;
[13] антителу по [12], где этой цитотоксичностью является CDC и/или ADCC;
[14] антителу по любому из [1]-[12], где ингибитор роста или цитотоксическое вещество связаны с этим антителом;
[15] антителу по [14], где это антитело является низкомолекулярным антителом;
[16] антителу по любому из [12]-[15], где константный район тяжелой цепи SEQ ID NO: 26 содержит по меньшей мере одну замену аминокислоты в положении, выбранном из группы, состоящей из 230, 240, 244, 245, 247, 262, 263, 266, 273, 275, 299, 302, 313, 323, 325, 328 и 332, как показано EU-нумерацией;
[17] вектору, содержащему полинуклеотид, кодирующий вариабельный район тяжелой цепи, который содержит CDR1 тяжелой цепи SEQ ID NO: 9, CDR2 тяжелой цепи, выбранный из группы, состоящей из SEQ ID NO: 161, 160, 159, 157, 156, 155, 153, 108, 107, 106, 105, 104, 103, 102, 101 и 100, и CDR3 тяжелой цепи, выбранный из группы, состоящей из SEQ ID NO: 158, 154, 152, 151, 112, 111, 110 и 11;
[18] вектору по [17], который содержит полинуклеотид, кодирующий константный район тяжелой цепи SEQ ID NO: 26;
[19] вектору, содержащему полинуклеотид, кодирующий вариабельный район легкой цепи, который содержит CDR1 легкой цепи, выбранный из группы, состоящей из SEQ ID NO: 163, 68, 67 и 12, CDR2 легкой цепи, выбранный из группы, состоящей из SEQ ID NO: 71, 69 и 13, и CDR3 легкой цепи, выбранный из группы, состоящей из SEQ ID NO: 164, 48, 47 и 14;
[20] вектору по [19], который содержит полинуклеотид, кодирующий константный район легкой цепи SEQ ID NO: 27;
[21] вектору, содержащему:
(1) полинуклеотид, кодирующий вариабельный район тяжелой цепи, содержащий CDR1 тяжелой цепи SEQ ID NO: 9, CDR2 тяжелой цепи, выбранный из группы, состоящей из SEQ ID NO: 161, 160, 159, 157, 156, 155, 153, 108, 107, 106, 105, 104, 103, 102, 101 и 100, и CDR3 тяжелой цепи, выбранный из группы, состоящей из SEQ ID NO: 158, 154, 152, 151, 112, 111, 110 и 11; и
(2) полинуклеотид, кодирующий вариабельный район легкой цепи, который содержит CDR1 легкой цепи, выбранный из группы, состоящей из SEQ ID NO: 163, 68, 67 и 12, CDR2 легкой цепи, выбранный из группы, состоящей из SEQ ID NO: 71, 69 и 13, и CDR3 легкой цепи, выбранный из группы, состоящей из SEQ ID NO: 164, 48, 47 и 14;
[22] вектору, содержащему;
(1) полинуклеотид, кодирующий вариабельный район тяжелой цепи, содержащий CDR1 тяжелой цепи SEQ ID NO: 9, CDR2 тяжелой цепи, выбранный из группы, состоящей из SEQ ID NO: 161, 160, 159, 157, 156, 155, 153, 108, 107, 106, 105, 104, 103, 102, 101 и 100, и CDR3 тяжелой цепи, выбранный из группы, состоящей из SEQ ID NO: 158, 154, 152, 151, 112, 111, 110 и 11; и полинуклеотид, кодирующий константный район легкой цепи SEQ ID NO: 26;
(2) полинуклеотид, кодирующий вариабельный район легкой цепи, содержащий CDR1 легкой цепи, выбранный из группы, состоящей из SEQ ID NO: 163, 68, 67 и 12, CDR2 легкой цепи, выбранный из группы, состоящей из SEQ ID NO: 71, 69 и 13, и CDR3 легкой цепи, выбранный из группы, состоящей из SEQ ID NO: 164, 48, 47 и 14; и полинуклеотид, кодирующий константный район легкой цепи SEQ ID NO: 27;
[23] вектору, содержащему полинуклеотид [18] или [22], который содержит мутированный нуклеотид, кодирующий константный район тяжелой цепи по меньшей мере с одной заменой аминокислоты в положении, выбранном из группы, состоящей из 221, 222, 223, 224, 225, 227, 228, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 243, 244, 245, 246, 247, 249, 250, 251, 254, 255, 256, 258, 260, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 278, 279, 280, 281, 282, 283, 284, 285, 286, 288, 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 311, 313, 315, 317, 318, 320, 322, 323, 324, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 339, 376, 377, 378, 379, 380, 382, 385, 392, 396, 421, 427, 428, 429, 434, 436 и 440, как показано EU-нумерацией в константном районе тяжелой цепи SEQ ID NO: 26;
[24] клетке-хозяину, содержащей векторы [17] и [19], векторы [18] и [20] или вектор [21] или [22].
[25] клетке-хозяину, содержащей вектор [23];
[26] клетке-хозяину по [25], где способность добавления фукозы к сахарной цепи в клетке-хозяине является низкой;
[27] клетке-хозяину по [26], где эта клетка-хозяин с низкой способностью добавления фукозы к сахарной цепи является клеткой-хозяином с недостаточностью в одном или нескольких функциональных белках, выбранных из группы, состоящей из фукозилтрансферазы, транспортера фукозы, GMD (GDP-маннозо-4,6-дегидратазы), Fx(GDP-кето-6-дезоксиманнозо-3,5-эпимеразы, 4-редуктазы) и GFPP (GDP-β-L-фукозопирофосфорилазы);
[28] клетке-хозяину [25], где эта клетка-хозяин способна образовывать двурассеченную структуру N-ацетилглюкозамина на сахарной цепи;
[29] клетке-хозяину [28], где эта клетка-хозяин, имеющая способность образовывать двурассеченную структуру N-ацетилглюкозамина на сахарной цепи, является клеткой-хозяином, которая имеет β(1,4)-галактозилтрансферазную активность и содержит вектор, содержащий полинуклеотид, кодирующий функциональный домен локализации Гольджи обитающего в аппарате
Гольджи полипептида;
[30] клетке-хозяину [29], содержащей вектор, который содержит полинуклеотид, кодирующий функциональный домен локализации Гольджи, выбранный из группы, состоящей из домена локализации маннозидазы II, домена локализации β(1,2)-N-ацетилглюкозаминилтрансферазы I, домена локализации β(1,2)-N-ацетилглюкозаминилтрансферазы II, домена локализации маннозидазы I и домена локализации α1-6-кора-фукозилтрансферазы; и полинуклеотид, кодирующий слитый полипептид, содержащий каталитический домен β(1,4)-галактозилтрансферазы;
[31] клетке-хозяину по любому из [24]-[30], где эта клетка-хозяин выбрана из группы, состоящей из СНО-клетки, ВНК-клетки, NS0-клетки, SP2/0-клетки, миеломной YO-клетки, P3X63-клетки мышиной миеломы, PER-клетки, PER.С6-клетки, HEK293-клетки и клетки гибридомы;
[32] способу получения антитела по любому из [1]-[16], который включает сбор клеток-хозяев по любому из [24]-[31] из культурального раствора;
[33] антителу, полученному по способу [32];
[34] антителу по [33], где агент ингибирования роста или цитотоксическое вещество связаны с этим антителом;
[35] фармацевтической композиции, содержащей антитело по любому из [1]-[16] или [33] или [34] в качестве активного ингредиента;
[36] терапевтическому агенту для рака или агенту для ослабления рецидива или метастазирования рака, который содержит антитело по любому из [1]-[16] или [33] или [34] в качестве активного ингредиента;
[37] терапевтическому агенту для рака или агенту для ослабления рецидива или метастазирования рака по [36], где этот рак является любым раком, выбранным из группы, состоящей из рака ободочной кишки, аденокарциномы легкого, рака поджелудочной железы, рака желудка и рака почки;
[38] терапевтическому агенту для рака или агенту для ослабления рецидива или метастазирования рака по [37], где этим раком является слабо дифференцированный рак ободочной кишки, умеренно дифференцированный рак ободочной кишки или хорошо дифференцированный рак ободочной кишки; и
[39] терапевтическому агенту для рака или агенту для ослабления рецидива или метастазирования рака по [36]-[38], где субъект, которому вводят этот терапевтический агент для рака, является субъектом, несущим экспрессирующие белок Эпирегулин раковые клетки, детектированные в выделенной пробе ткани.
Данное изобретение относится также к способам ослабления пролиферации клеток, способам предотвращения рака и способам ослабления рецидива или метастазирования рака, которые включают стадию введения этому субъекту антитела по данному изобретению или антитела, полученного способом получения по данному изобретению. Кроме того, данное изобретение относится к применениям антитела по данному изобретению или антитела, полученного способом получения по данному изобретению, в получении агентов для ингибирования пролиферации клеток, агентов для предотвращения или лечения рака или агентов для ослабления рецидива или метастазирования рака. Данное изобретение относится также к антителам по данному изобретению или антителам, полученным способом получения по данному изобретению, для применения в ослаблении пролиферации клеток, предотвращении или лечении рака или ослабления рецидива или метастазировании рака. Кроме того, данное изобретение относится к способам получения агентов для ингибирования пролиферации клеток, агентов для предотвращения или лечения рака или агентов для ослабления рецидива или метастазирования рака, которые включают стадию применения антитела по данному изобретению или антитела, полученного способом получения по данному изобретению.
Краткое описание фигур
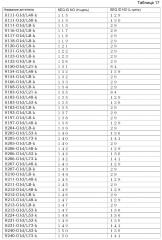
Фиг. 1 изображает диаграмму, показывающую отношение аффинности каждого из этих антител к Эпирегулину человека (величина KD каждого антитела/величина KD химерного антитела EP27). Хотя изображение (нотация) названия антитела описывается названием только вариабельного района, эта фигура изображает тест-результаты антител, содержащих константные районы тяжелой цепи G1d и легкой цепи каппа.
Фиг. 2 изображает диаграмму, показывающую отношение аффинности каждого из этих антител (величина KD для Эпирегулина обезьяны/величина KD для Эпирегулина человека). Хотя изображение (нотация) названия антитела описывается названием только вариабельного района, эта фигура изображает тест-результаты антител, содержащих константные районы тяжелой цепи G1d и легкой цепи каппа.
Фиг. 3 изображает диаграмму, показывающую отношение аффинности каждого из этих антител к Эпирегулину человека (величина KD каждого антитела/величина KD химерного антитела EP27).
Фиг. 4 изображает диаграмму, показывающую отношение аффинности каждого из этих антител к Эпирегулину человека (величина KD для Эпирегулина обезьяны/величина KD для Эпирегулина человека).
Фиг. 5 изображает график, показывающий активность ADCC каждого из этих антител (специфическая скорость выделения кальцеина АМ).
Фиг 6 изображает график, показывающий нейтрализующую активность каждого из этих антител в виде степени ингибирования зависимой от Эпирегулина пролиферации клеток человека BAF_EGFR.
Фиг. 7 изображает график, показывающий нейтрализующую активность каждого из этих антител в виде степени ингибирования зависимой от Эпирегулина пролиферации клеток обезьяны BAF_EGFR.
Фиг. 8 изображает активность каждого из этих антител в отношении ослабления in vivo роста опухоли человека в виде противоопухолевой активности в мышиных моделях, трансплантированных раковыми клеток человека.
Фиг. 9 является изображением, показывающим электрофоретические картины Эпирегулина человека (hsEREG-His) и Эпирегулина обезьяны (cysEREG-His).
Фиг. 10 показывает результаты флуоресцентного окрашивания клеток, каждые из которых экспрессировали различные количества белка Эпирегулина, и иммуногистологического окрашивания мышей, трансплантированных этими клетками.
Фиг. 11 изображает графики, показывающие активность ADCC против клеток, каждые из которых экспрессировали различные количества белка Эпирегулина.
Фиг. 12 изображает графики, показывающие in vivo активность ингибирования роста опухоли человека в виде противоопухолевой активности в мышиных моделях, трансплантированных клетками, каждые из которых экспрессировали различные количества белка Эпирегулина.
Фиг. 13 представляет фотографии, показывающие экспрессию Эпирегулина в клинических случаях слабо дифференцированного рака ободочной кишки.
Фиг. 14 является диаграммой, показывающей лекарственную эффективность гуманизированного EP27 антитела Glycomab против онкогенеза стволовых клеток PLR123 рака ободочной кишки, которые обнаруживают лекарственную эффективность против метастазирования рака ободочной кишки.
Фиг. 15 показывает лекарственную эффективность гуманизированного EP27 антитела Glycomab против легочного метастазирования стволовых клеток PLR123 рака ободочной кишки, которые обнаруживают лекарственную эффективность против метастазирования рака ободочной кишки.
Фиг. 16 является графиком, показывающим лекарственную эффективность гуманизированного EP27 антитела Glycomab против модели слабо дифференцированного рака ободочной кишки.
Фиг. 17 является графиком, показывающим лекарственную эффективность гуманизированного EP27 антитела Glycomab против умеренно дифференцированного рака ободочной кишки с использованием модели PLR379 умеренно дифференцированного рака ободочной кишки.
Фиг. 18 предоставляет фотографии, показывающие экспрессию Эпирегулина в клинических случаях аденокарциномы легкого.
Фиг. 19 является графиком, показывающим ADCC-активность (степень выделения специфического кальцеина АМ) гуманизированного EP27 антитела Glycomab против линии клеток Calu-3 аденокарциномы легких человека.
Фиг. 20 является графиком, показывающим лекарственную эффективность гуманизированного EP27 антитела Glycomab против аденокарциномы легких с использованием модели Calu-3 аденокарциномы легких.
Фиг. 21 показывает, что конъюгат антитело-лекарственное средство, содержащий гуманизированное EP27 антитело Glycomab, становится интернализованным в линии клеток DLD-1, которые экспрессируют Эпирегулин, и вызывают повреждение клеток против линии клеток DLD-1.
Способ проведения этого изобретения
Данное изобретение относится к анти-Эпирегулин-антителам, обнаруживающим перекрестную межвидовую реактивность между животными, не являющимися человеком, и людьми. Данное изобретение дополнительно относится к анти-Эпирегулин-антителам с ослабленной химической деградацией. Данное изобретение относится также к анти-Эпирегулин-антителам с уменьшенной изоэлектрической точкой. Кроме того, данное изобретение относится к анти-Эпирегулин-антителам с уменьшенным количеством агрегата. Кроме того, данное изобретение относится к фармацевтическим композициям или терапевтическим агентам для рака, содержащего вышеупомянутые анти-Эпирегулин-антитела. Данное изобретение относится также к способам получения вышеупомянутых анти-Эпирегулин-антител.
Определения и подробное описание ниже обеспечены для содействия пониманию данного изобретения, иллюстрированного здесь.
Определения
Аминокислоты
Здесь описаны аминокислоты в одно- или трехбуквенных кодах или обоих, например, Ala/A, Leu/L, Arg/R, Lys/K, Asn/N, Met/M, Asp/D, Phe/F, Cys/C, Pro/P, Gln/Q, Ser/S, Glu/E, Thr/T, Gly/G, Trp/W, His/H, Tyr/Y, Ile/I или Val/V. Аминокислоты, содержащиеся в аминокислотных последовательностях по данному изобретению, могут быть посттрансляционно модифицированы (например, модификация N-терминального глутамина в пироглутаминовую кислоту хорошо известна квалифицированным в данной области специалистам). Разумеется, такие посттрансляционно модифицированные аминокислоты включены в аминокислотные последовательности в данном изобретении.
Антигены
Антитела, обеспеченные данным изобретением, связываются с анти-Эпирегулином в качестве антигена. Эпирегулин является мембраносвязанным белком эпидермального фактора роста. Его аминокислотная последовательность описана в GenBank Acession Number NP_001423 (SEQ ID NO: 167). В данном изобретении определение Эпирегулин включает в себя как полноразмерный белок, так и его фрагменты. Термин ʺфрагментыʺ относится к полипептидам, содержащим любой район Эпирегулина, и они могут не иметь функции нативного Эпирегулина. Один пример этих фрагментов включает в себя фрагмент, содержащий внеклеточный район Эпирегулина. Положения 30-118 в аминокислотной последовательности SEQ ID NO: 167 соответствуют внеклеточному району Эпирегулина. Положения 119-140 в аминокислотной последовательности 167 соответствуют трансмембранному району. Здесь Эпирегулин может называться как EREG, и эти термины используют синонимически.
ʺЭпитопʺ обозначает антигенную детерминанту в антигене и относится к сайту антигена, с которым связывается антигенсвязывающий домен анти-Эпирегулин-антитела, описанного здесь. Так, например, этот эпитоп может быть определен в соответствии с его структурой. Альтернативно, этот эпитоп может быть определен в соответствии с антигенсвязывающей активностью анти-Эпирегулин-антитела, которое распознает этот эпитоп. Когда этот антиген является пептидом или полинуклеотидом, этот эпитоп может быть установлен по аминокислотным остатком, образующим этот эпитоп. Альтернативно, когда этот эпитоп является сахарной цепью, этот эпитоп может быть установлен по его специфической структуре сахарной цепи.
Линейным эпитопом является эпитоп, первичная аминокислотная последовательность которого распознается как эпитоп, состоящий из ряда последовательных аминокислот в этой первичной аминокислотной последовательности. Такой линейный эпитоп обычно содержит по меньшей мере три и наиболее часто по меньшей мере пять, например, приблизительно 8-10 или 6-20 аминокислот в этой специфической последовательности.
В противоположность линейному эпитопу, ʺконформационным эпитопомʺ является эпитоп, в котором первичная аминокислотная последовательность, содержащая этот эпитоп, не является единственной детерминантой этого распознаваемого эпитопа (например, первичная аминокислотная последовательность конформационного эпитопа необязательно распознается эпитоп-определяющим антителом). Конформационные эпитопы могут содержать большее количество аминокислот в сравнении с линейными эпитопами. Конформационный эпитоп-узнающее антитело распознает трехмерную структуру пептида или белка. Например, когда молекула белка складывается и образует трехмерную структуру, аминокислоты и/или основные цепи полипептида, которые образуют конформационный эпитоп, сопоставляются, и эпитоп становится распознаваемым этим антителом. Способы для определения конформаций эпитопа включают, например, рентгеновскую кристаллографию, двухмерный ядерный магнитный резонанс, сайт-специфическое спиновое мечение и электронный парамагнитный (спиновый) резонанс, но не ограничиваются ими. См., например, Epitope Mapping Protocols in Methods in Molecular Biology (1996), Vol. 66, Morris (ed.).
Связывающая активность
Примеры способа для подтверждении связывания антитела с Эпирегулином или, более конкретно, эпитопом, присутствующим в молекуле Эпирегулина, показаны ниже, но этот способ не ограничивается следующими способами, и квалифицированный в данной области специалист может подходящим образом использовать известн