Средство для лечения фиброза почек
Иллюстрации
Показать всеНастоящее изобретение относится к носителю для доставки вещества в продуцирующие внеклеточный матрикс клетки в почке, причем носитель состоит из липидной структуры, содержащей ретиноид в качестве нацеливающего агента, где носитель имеет форму липосомы. Настоящее изобретение также относится к фармацевтической композиции для лечения фиброза почек, в которой применяется указанный носитель, способу и набору для ее получения. 4 н. и 4 з.п. ф-лы, 3 пр., 2 ил.
Реферат
Область техники
Настоящее изобретение относится к носителю для доставки вещества в продуцирующие внеклеточный матрикс клетки в почке и к композиции для лечения фиброза почек, и к способу лечения фиброза почек, в котором применяется вышеуказанный носитель.
Уровень техники
В последние годы, из-за больших изменений в образе жизни, главным образом касающихся предпочтений в еде, увеличилось распространение связанных с образом жизни болезней, таких как повышенное кровяное давление и диабет, и сопровождающий эти явления риск заболевания почек и, следовательно, почечной недостаточности увеличивался.
Почка является важным органом для поддержания гомеостаза внутренней среды посредством экскреции продуктов жизнедеятельности или регуляции жидкостей тела/электролитов/кислотно-основного баланса и т.д. Почка контролирует концентрации различных соединений в крови, таких как водород, натрий, калий и кремний и выделяет продукты жизнедеятельности в виде мочи. Любое ухудшение почечной функции формирует возможность вмешательства в способность организма в достаточном объеме удалять метаболиты из крови и также возможность нарушения баланса электролита тела. В наиболее тяжелой форме ухудшение или отказ функции почек могут быть фатальными.
Кроме того, помимо вышеупомянутых функций почка обладает такими функциями как опосредованный клетками иммунитет, эндокринная секреция и метаболизм. Почка в качестве эндокринного органа производит эритропоэтин, который регулирует продукцию эритроцитов, или 1,25-дигидроксивитамин D3, который является активной формой витамина D3, секрецию ренина и эритропоэтина, которые являются факторами регуляции кровяного давления, и секрецию кинина, калликреина, простагландина и т.д.
Хроническая почечная недостаточность означает состояние, при котором вышеупомянутые почечные функции постепенно ухудшаются необратимо, и гомеостаз живого организма не может поддерживаться. Известно, что хроническая почечная недостаточность вызывается диабетической нефропатией, хроническим гломерулонефритом, злокачественным нефросклерозом, поликистозным заболеванием почек и т.д. Все почечные заболевания сопровождаются фиброзом почки и, в конечном счете, приводят к неизлечимой почечной недостаточности. В частности, так как хроническое ухудшение почечной функции зависит в большой степени от прогрессирования фиброза почки, считается, что ингибирование прогрессирования фиброза может привести к подавлению прогрессирования хронической почечной недостаточности.
Как правило, фиброз почек сопровождается воспалительным ответом вследствие дисфункции эндотелиальных клеток и внеклеточного матрикса, который, в конечном счете, продуцируется в избытке, являются причиной фиброза. Например, при громелуросклерозе из-за клубочковой дисфункции эндотелиальных клеток секретируется цитокин, такой как хемокин или фактор роста, и моноциты или макрофаги мигрируют для того, чтобы воспалительный ответ развивался. Впоследствии происходят активация, пролиферация и трансформация мезангиальных клеток, продуцируется избыточное количество внеклеточного матрикса из продуцирующих внеклеточный матрикс клеток, таких как мезангиальные клетки, появляется фиброз, и это приводит к громелуросклерозу.
В частности диабетическая нефропатия является самым важным фактором, приводящим к хронической почечной недостаточности, и одному из осложнений диабета. Диабетическая нефропатия характеризуется гиперплазией и расширением гломерулярного мезангия, и это происходит главным образом из-за увеличения накопления белка ЕСМ, такого как коллаген I типа или IV типа, фибронектина или ламинина.
Как только достигается опасная степень хронической почечной недостаточности, восстановление становится невозможным, и случается уремия, если не будет осуществлено лечение, такое как диализ. В качестве терапии хронической почечной недостаточности применяется диета, такая как низкобелковая диета или диета с ограничением соли, введение гипотензивного препарата, чтобы облегчить нагрузку на клубочки и т.д.
Кроме того, для хронической почечной недостаточности, по мере необходимости, проводится лечение для компенсации 1,25-дигидроксивитамина D3 или эритропоэтина, которые секретируются почкой, или лечение для поддержания надлежащей регуляции кровяного давления, что является важной функцией почки.
В качестве химиотерапии, чтобы подавить прогрессирование почечной недостаточности, используются ингибитор ангиотензин-превращающего фермента или антагонист рецептора ангиотензина II. Предполагается, что они имеют защитный эффект по отношению к почкам сами по себе в дополнение к подавлению прогрессирования почечной недостаточности посредством уменьшения кровяного давления в клубочках. Однако необходимо соблюдать осторожность при введении, так как, когда клубочковое кровяное давление уменьшается слишком резко, интенсивность клубочкового кровотока на самом деле уменьшается, и случается преренальная почечная недостаточность.
В качестве ингибитора ангиотензин-превращающего фермента известны: каптоприл, эналаприл, делаприл, имидаприл, квинаприл, темокаприл, периндоприла эрбумин, лизиноприл и т.д., а в качестве антагонистов рецептора ангиотензина II известны: лозартан, валсартан, кандесартан цилексетил, телмисартан, олмесартана медоксомил, ирбесартан и т.д.
Кроме вышеупомянутого, для того чтобы нормализовать симптомы уремии и задержать немного начало диализа, используется Kremezin в качестве адсорбирующего угля, который адсорбирует вредные вещества в кишечнике. Кроме того, чтобы предотвратить одышку, онемение в конечностях, аритмию и т.д. вследствие увеличения калия в крови, используется полистиролсульфонат кальция в качестве ионообменной смолы, которая адсорбирует калий в кишечнике и выводит в виде экскрементов.
Когда концентрация в сыворотке креатинина, который является метаболитом, образующимся в скелетных мышцах, превышает 5-7 мг/дл, следует рассматривать искусственную диализную терапию, такую как перитонеальный диализ, гемофильтрацию или диализ крови или пересадку почек. Однако диализ крови оказывается очень обременительным для человека из-за необходимости посещать больницу три раза в неделю и быть заключенным там в течение 4-5 часов для лечения, и относительно пересадки почек: так как доноров почек немного, среди пациентов, которые желают пересадки, только очень небольшое число может получить трансплантат почки. Кроме того, ожидаемая средняя продолжительность жизни больных почечной недостаточностью после начала диализа приблизительно вдвое меньше, чем продолжительность жизни у нормальной популяции.
При этих обстоятельствах большая научно-исследовательская работа была проведена для разработки средства для лечения фиброза почек. В результате было сообщено, что имеют определенную степень успеха на животной модели с фиброзом почек или в клинических испытаниях (непатентный документ 1) например, лекарственное средство, действующее на систему ренин-ангиотензин-альдостерон, такие как ингибитор ангиотензин-превращающего фермента, антагонист рецептора ангиотензина II AT1, антагонист альдостерона или ингибитора ренина, лекарственное средство, действующее на систему окиси азота, такой как антагонист эндотелиннового рецептора, α-блокатор, β-блокатор, иммуносупрессор, ингибитор метаболизма внеклеточного матрикса, ингибитор системы комплемента, ингибитор хемокина или ингибитор фосфодиэстеразы 5 и лекарственное средство, такое как ингибитор NFκB, ингибитор Rho, ингибитор р38 МАРК, ингибитор PI3Kγ, ингибитор сосудистого эндотелиального фактора роста (VEGF), калликреин, релаксин, антагонист рецептора интерлейкина 1, костный морфогенетический фактор 7 (ВМР-7), антитело против фактора некроза опухоли-α (антитело Anti-TNFα), или антитело против тромбоцитарного фактора роста D (Антитело Anti-PDGF-D).
Кроме того, было много заявок на патент и, например, патенты, касающиеся ингибитора ангиотензин-превращающего фермента (патентный документ 1), антагонистов рецептора ангиотензина II (патентный документ 2), ингибитор трансформирующего фактора роста-β (TGF-β) (патентный документ 3), ингибитор продуцирования ингибитора активатора плазминогена 1 (PAI-1) (патентный документ 4), селективный агонист простагландинового рецептора 4 (патентный документ 5), ингибитор синтеза коллагена типа I (патентный документ 6), ингибитор сульфотрансферазы протеогликана хондроитинсульфата (патентный документ 7), ингибитор эпоксидредуктазы витамина К (патентный документ 8), ингибитор образования конечного продукта гликирования (патентный документ 9), 2A агонист аденозинового рецептора A2A (патентный документ 10), антагонист рецептора эндотелина (патентный документ 11), ингибитор VEGF (патентный документ 12) и т.д., которые применялись в качестве лекарственных средств против фиброза почек. Однако ни одно из этих лекарственных средств не является удовлетворительным, и необходимо дальнейшее развитие препаратов для лечения фиброза почек.
Документы, использованные при экспертизе заявки
Патентные документы
Патентный документ 1 патент США. №5238924
Патентный документ 2 JP, А, 07-002667
Патентный документ 3 JP, А, 2004-043459
Патентный документ 4 JP, А, 2009-007258
Патентный документ 5 JP, А, 2001-233792
Патентный документ 6 JP, (РСТ) 2004-534760
Патентный документ 7 JP, А, 2009-292725
Патентный документ 8 JP, А, 2010-077101
Патентный документ 9 JP, А, 2009-029750
Патентный документ 10 JP, (РСТ) 2007-536241
Патентный документ 11 JP, (РСТ) 2006-519817
Патентный документ 12 JP, А, 2007-099641
Патентный документ 13 международная заявка на патент WO 2006/068232
Патентный документ 14 JP, А, 2009-221164
Патентный документ 15 JP, А, 2010-59124
Непатентные Документы
Непатентный документ 1 Nephrology, dialysis, transplantation 2007; 22 (12): 3391-407
Сущность изобретения
Проблемы, решаемые настоящим изобретением
Целью настоящего изобретения является обеспечение носителя, который может специфически доставлять вещество, такое как лекарственное средство, к клеткам, продуцирующим внеклеточный матрикс в почке, и средства для лечения фиброза почек, и способа лечения фиброза почек, в котором применяется указанный носитель.
Средства для решения проблем
Авторы настоящего изобретения обнаружили во время исследования нового средства для лечения фиброза почек, что фиброз почек можно эффективно лечить посредством введения композиции, в которой ингибитор продуцирования внеклеточного матрикса переносится носителем, который включает ретиноид в качестве нацеливающего агента, таким образом, осуществляя настоящее изобретение.
Известно, что носитель, который включает витамин А, может доставлять лекарственное средство к звездчатым клеткам, которые хранят витамин А (патентный документ 13), и что композиция, в которой миРНК для HSP47 зафиксирована на вышеупомянутом носителе, может нормализовать печеночный фиброз (патентный документ 13), легочный фиброз (патентный документ 14), и миелофиброз (патентный документ 15), но никакая взаимосвязь между почечным фиброзом, интерстициальной ткани почек или мезангии до сих пор совершенно неизвестна.
Таким образом, настоящее изобретение касается следующего:
(1) Носитель для доставки вещества к продуцирующим внеклеточный матрикс клеткам в почке, включающий ретиноид в качестве агента, нацеливающего на продуцирующие внеклеточный матрикс клетки.
(2) Носитель по п.(1), приведенному выше, в котором ретиноид включает ретинол.
(3) Носитель в соответствии с пп.(1) или (2), указанных выше, в котором носитель имеет форму липосомы, и мольное отношение ретиноида и липида, содержащегося в липосоме, составляет от 8:1 до 1:4.
(4) Фармацевтическая композиция для лечения фиброза почек, включающая носитель по любому из пп.(1) - (3), приведенных выше, и лекарственное средство для контроля активности или роста продуцирующих внеклеточный матрикс клеток в почке.
(5) Фармацевтическая композиция по п.(4), приведенному выше, в которой лекарственное средство для контроля активности или роста продуцирующих внеклеточный матрикс клеток в почке, выбирается из группы, состоящей из ингибитора активности или продуцирования PAI-1, ингибитора клеточной активности, ингибитора роста, индуктора апоптоза и молекулы РНКи, рибозима, антисмысловой нуклеиновой кислоты или химерного полинуклеотида ДНК/РНК, которые нацелены по меньшей мере на одно из молекул, составляющих внеклеточный матрикс, или молекул, вовлеченных в продуцирование или секрецию молекул, составляющих внеклеточный матрикс, или вектора, экспрессирующего их.
(6) Фармацевтическая композиция по п.(4), приведенному выше, в которой лекарственное средство для контроля активности или роста продуцирующих внеклеточный матрикс клеток, представляет собой ингибитор HSP47.
(7) Фармацевтическая композиция по любому из пп.(4) - (6), приведенных выше, в которой лекарственное средство и носитель смешиваются в месте лечения или поблизости от него.
(8) Набор для получения фармацевтической композиции по любому из пп.(4) - (7), описанных выше, включающий один или более контейнеров, которые содержат либо по отдельности, либо в комбинации лекарственное средство для контроля активности или роста продуцирующих внеклеточный матрикс клеток в почке, ретиноид и при необходимости составляющее носитель вещество, отличное от ретиноида.
(9) Способ получения носителя для доставки вещества к продуцирующим внеклеточный матрикс клеткам в почке, включающий стадию введения ретиноида в качестве агента, нацеливающего на продуцирующие внеклеточный матрикс клетки в почке.
(10) Способ получения фармацевтической композиции для лечения фиброза почек, включающий стадию введения ретиноида в качестве агента, нацеливающего на продуцирующие внеклеточный матрикс клетки в почке, и лекарственное средство для контроля активности или роста продуцирующих внеклеточный матрикс клеток в почке, в качестве активного ингредиента.
Эффекты изобретения
Хотя точный способ действия композиции для лечения фиброза почек в соответствии с настоящим изобретением еще не был полностью выяснен, считается, что ретиноид функционирует в качестве агента, который нацеливает на продуцирующие внеклеточный матрикс клетки в почке, такие как фибробласты или миофибробласты, и доставляет активный ингредиент, такой как лекарственное средство, которое контролирует активность или рост продуцирующих внеклеточный матрикс клеток в почке, к таким клеткам, таким образом демонстрируя эффект против фиброза почек.
Поэтому, так как активный ингредиент может быть эффективно доставлен к месту действия, и затем к клеткам-мишеням при помощи носителя в соответствии с настоящим изобретением, лечение, подавление прогрессирования и предотвращение наступления фиброза почек и т.д., в особенности диабетического нефрита, чье лечение было трудным до настоящего времени, стало возможным, и настоящий носитель таким образом вносит значительный вклад в медицину человека и ветеринарию.
Кроме того носитель в соответствии с настоящим изобретением может быть объединен с любым лекарственным средством (например, существующим лекарственным средством для лечения фиброза почек), чтобы увеличить эффективность его действия; поэтому это также является выгодным для всего широкого спектра применения с точки зрения технологии приготовления лекарственного средства, что облегчает производство эффективных лекарственных средств.
Краткое описание чертежей
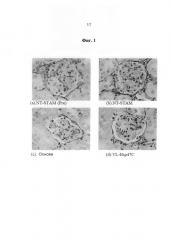
Фиг.1 представляет собой микроскопическое изображение клубочка при окрашивании с помощью красителя сириус красный среза коркового вещества почки мыши каждой группы. Изображения получали при увеличении 800× с использованием масляно-иммерсионной линзы.
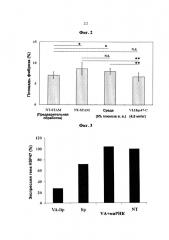
Фиг.2 представляет собой график, показывающий долю фиброзной области коркового вещества почки, количественно определенной с помощью окрашивания красителем сириус красный. 20 полей зрения были случайным образом выбраны в области коркового вещества почки для каждой мыши и были вычислены доли фиброзной области (Площадь фиброза (%)) (*Р<0,05, **Р<0,01).
Фиг.3 представляет собой график, показывающий нокдаун гена посредством липосомы, VA-связывающей, содержащей миРНК, в мышиных почечные клетках, продуцирующих внеклеточный матрикс. Уровень экспрессии гена HSP47 в клетках, продуцирующих внеклеточный матрикс, собранных из почки мыши, был скорректирован с уровнем экспрессии GAPDH, который является геном внутреннего контроля, и была построена доля экспрессии гена HSP47 (экспрессия гена HSP47 (%)), определяя «Никакого лечения» (нелеченные) как 100%. VA-lip обозначает VA-липосома-миРНК Hsp47C, lip обозначает липосома-миРНК Hsp47C, VA + миРНК обозначает VA + миРНК Hsp47C, и NT обозначает отсутствие лечения.
Варианты выполнения настоящего изобретения
В настоящем изобретении продуцирующие внеклеточный матрикс клетки в почке, не являются особенно ограниченными, до тех пор пока они являются клетками, существующими в почке, обладающие способностью продуцировать внеклеточный матрикс, и примеры этого, присутствующие в почке, включают мезангиальные клетки, тубулоинтерстициальные клетки, перициты, фибробласты, фиброциты, которые являются клетками предшественниками фибробластов и миофибробластов. Клетки, продуцирующие матрикс, существующие в почке, могут включать не только клетки, полученные из клеток, существующих в почке, но также и клетки, полученные из фиброцитов в циркулирующей крови и клеток, трансформированных из эндотелиальных клеток путем эндотелиально-мезенхимальной трансдифференцировки. Миофибробласты характеризуются экспрессией α-SMA (альфа-актина гладких мышц). Миофибробласты в настоящем изобретении являются миофибробластами, идентифицированными, например, с помощью иммуноокрашивания с использованием детектируемо-меченных анти α-SMA антител. Кроме того, так как фибробласты экспрессируют виментин, который характерен для мезенхимальных клеток, но не экспрессируют αSMA, они могут быть идентифицированы двойным окрашиванием виментина и αSMA и т.д. Кроме того продуцирующие внеклеточный матрикс клетки в почке, могут быть получены обработкой почечной ткани коллагеназой и протеазой и затем осуществлением выделения посредством центрифугирования в градиенте плотности (например, в Nycodenz®, имеющем конечную концентрацию 8%).
Ретиноид в соответствии с настоящим изобретением функционирует в качестве нацеливающего агента (нацеливающий агент) к продуцирующим внеклеточный матрикс клеткам в почке, и способствует специфической доставке вещества к этим клеткам. Механизм способствования доставке вещества посредством ретиноида еще не полностью ясен; однако, например, считается, что ретиноид, которой специфически связывается с ретинол-связывающим белком (RBP), поглощается клетками, продуцирующими внеклеточный матрикс в почке, через определенный рецептор, представленный на поверхности указанной клетки.
Ретиноид является членом класса соединений, имеющих скелет, в котором четыре изопреноидные единицы соединены голова-к-хвосту (см. G. P. Moss, «Biochemical Nomenclature and Related Documents)), 2nd Ed. Portland Press, pp.247-251 (1992)). Термин витамин А является родовым названием для ретиноида, которое качественно указывает биологическую активность ретинола. Ретиноид, который может использоваться в настоящем изобретении in vitro, не особенно ограничивается, и примеры его включают ретинол (включая all-транс-ретинол), ретиналь, ретиноевую кислоту (включая третиноин), ретиноидные производные, такие как сложный эфир ретинола и жирной кислоты, сложный эфир алифатического спирта и ретиноевой кислоты, этретинат, изотретиноин, адапален, ацитретин, тазаротен и ретинил пальмитат и аналоги витамина А, такие как (4-HPR) фенретидин и бексаротен.
Из них ретинол, ретиналь, ретиноевая кислота, сложный эфир ретинола и жирной кислоты (такой как ретинил ацетат, ретинил пальмитат, ретинил стеарат и ретинил лаурат) и сложный эфир алифатического спирта и ретиноевой кислоты (такой как этил ретиноат) предпочтительны с точки зрения эффективности специфической доставки вещества к продуцирующим внеклеточный матрикс клеткам в почке.
Все изомеры ретиноида, включая цис-транс изомеры, включены в объем настоящего изобретения. Ретиноид может быть замещенным одним или более заместителями. Ретиноид в настоящем изобретении включает ретиноид как в чистом виде, так и в форме раствора или смеси со средой, которая может растворять или сохранять ретиноид.
Носитель в соответствии с настоящим изобретением может состоять только из ретиноида или может быть создан путем связывания ретиноида с составной частью компонента носителя, отличного от ретиноида, или путем включения его туда. Поэтому, носитель в соответствии с настоящим изобретением может включать компонент составной части носителя, отличного от ретиноида. Такой компонент in vitro не особенно ограничивается, и любой компонент, известный в лекарственной и фармацевтической областях, может использоваться, но те из них, которые могут включать ретиноид или могут связаться с ретиноидом, предпочтительны.
Примеры такого компонента включают липид, например, фосфолипид, такой как глицерофосфолипид, сфинголипид, такой как сфингомиелин, стерол, такой как холестерин, растительное масло, такое как соевое масло или маковое масло, минеральное масло, лецитин, такой как лецитин яичного желтка, и полимер, но примеры не ограничены вышеперечисленным. Среди них те, которые могут образовывать липосому, например, природный фосфолипид, такой как лецитин, полусинтетический фосфолипид, такой как димиристоилфосфатидилхолин (DMPC), дипальмитоилфосфатидилхолин (DPPC), или дистеароилфосфатидилхолин (DSPC), диолеоилфосфатидилэтаноламин (DOPE), дилауроилфосфатидилхолин (DLPC), холестерин и т.д., предпочтительны.
Особенно предпочтительным компонентом является компонент, который может избежать захвата ретикулоэндотелиальной системой, примеры этого включают катионные липиды, такие как N-(α-триметиламмониоацетил)-дидоде-цил-D-глутамат хлорид (TMAG), N,N’,N’’,N’’’-тетраметил-N,N’,N’’,N’’’-тетрапальми-тилспермин (TMTPS), 2,3-диолеилокси-N-[2-(сперминкарбоксами-до)этил]-N,N-диметил-1-пропанаминиум трифторацетат (DOSPA), N-[1-(2,3-диолеилокси)пропил]-N,N,N-триметиламмониум хлорид (DOTMA), диоктадецилдиметиламмониум хлорид (DODAC), дидодециламмониум бромид (DDAB), 1,2-диолеилокси-3-триметиламмониопропан (DOTAP), 3β-[N-(N’,N’’-диметиламиноэтан)карбамоил]холестерин (DC-Chol), 1,2 димиристо-илоксипропил-3-диметилгидроксиэтиламмониум (DMRIE) и O,O’-дитетра-деканоил-N-(α-триметиламмониоацетил)диэтаноламин хлорид (DC-6-14).
Носитель в настоящем изобретении может иметь специфическую пространственную структуру. Такая структура не имеет ограничений, и примеры этому включают неразветвленную или разветвленную линейную структуру, слоистую структуру и сферическую структуру. Поэтому, носитель может иметь без ограничения любую трехмерную структуру, такую как мицелла, липосома, эмульсия, микросфера или наносфера.
Связывание ретиноида с носителем в соответствии с настоящим изобретением или его включение в носитель также делается возможным путем связывания ретиноида с или включением его в компоненты носителя, отличные от ретиноида, химическим и/или физическим методом. Альтернативно, ретиноид может быть связан с или включен в носитель в соответствии с настоящим изобретением посредством смешения ретиноида и компонентами носителя, отличного от ретиноида, в процессе получения носителя. Количество ретиноида в носителе в соответствии с настоящим изобретением может быть, например, 0,01 к 1000 нмоль/мкл и предпочтительно 0,1 к 100 нмоль/мкл. Ретиноид может быть связан с или включен в носитель прежде, чем лекарственное средство будет загружено на носитель; или носитель, ретиноид и лекарственное средство могут быть смешаны одновременно; или ретиноид может быть смешан с носителем, уже содержащим лекарственное средство и т.д. Поэтому настоящее изобретение также касается способа получения состава, специфичного к продуцирующим внеклеточный матрикс клеткам в почках, включающий стадию связывания ретиноида с любым существующим носителем, связывающим лекарственное средство, или носителем, способным к инкапсуляции лекарственного средства, например, липосомальной композицией, таким как DaunoXome®, Doxil, Caelyx® или Myocet®.
Носитель в соответствии с настоящим изобретением может быть в любой форме пока требуемое вещество или предмет может быть транспортирован к продуцирующим внеклеточный матрикс клеткам в почках, и примеры этого включают, но не ограничиваются этим: полимерная мицелла, липосома, эмульсия, микросферы и наносферы. В настоящем изобретении липосомальная форма является предпочтительной перед остальными с точки зрения высокой эффективности доставки, широкого выбора веществ, которые могут быть доставлены, и простоты технологии получения и т.д., и катионная липосома, содержащая катионный липид, особенно предпочтительна. В случае, когда носитель находится в форме липосомы, мольное отношение ретиноида к другим компонентам липосомы предпочтительно составляет от 8:1 до 1:4, и более предпочтительно от 4:1 до 1:2, с точки зрения эффективности связывания ретиноида с носителем или инкапсулирования в него.
Носитель в соответствии с настоящим изобретением может содержать вещество, для транспортировки в своем внутреннем объеме, он может присоединять к внешней поверхности вещество, которое должно транспортироваться, или он может быть смешан с веществом, которое должно транспортироваться, необходимо лишь, чтобы он содержал ретиноид в такой форме, чтобы ретиноид был в состоянии функционировать в качестве нацеливающего агента. «Функционирует в качестве нацеливающего агента» в настоящем изобретении означает, что носитель, который включает ретиноид, достигает и/или поглощается клетками-мишенями, то есть клетками, производящими внеклеточный матрикс в почке, быстрее и/или в большем количестве, чем с носителем, не включающим ретиноид, и это может легко быть подтверждено, например, добавлением меченого носителя или носителя, содержащего метку, к культуре клеток-мишеней, и анализируя распределение метки после предварительно определенного промежутка времени. Структурно это требование может быть удовлетворено, например, если ретиноид, по меньшей мере частично экспонируется на внешней поверхности лекарственной формы, содержащей носитель, самое позднее к тому времени, когда он достигает клеток-мишеней. «Лекарственная форма», упомянутая в настоящем изобретении, является понятием, которое включает композицию в соответствии с настоящим изобретением, которая описывается ниже, и которая дополнительно имеет форму. Будет ли или не будет ретиноид экспонироваться на внешней поверхности лекарственной формы, может быть оценено посредством контактирования лекарственной формы с веществом, которое специфически связывается с ретиноидом, таким как, например ретинол-связывающий белок (RBP), и исследуя его связывание с лекарственной формой.
Экспозиция ретиноида по меньшей мере частично на поверхности лекарственной формы не позже того времени, когда она достигнет клеток-мишеней, может быть достигнута, например, посредством регуляции отношения ретиноида и компонентов, составляющих носитель, отличных от ретиноида. Кроме того, когда носитель имеет форму липидной структуры, такую как липосома, например, когда например, образование комплекса из ретиноида и компонента, составляющего носитель, отличного от ретиноида, может использоваться способ, в котором сначала липидную структуру, сформированную из компонента, составляющего носитель, отличного от ретиноида, разбавляют в водном растворе, и затем она приводится в контакт и смешивается с ретиноидом и т.п. В этом случае ретиноид может быть в состоянии, в котором растворяется в растворителе, например, органическом растворителе, таком как ДМСО. Липидная структура, упоминаемая в настоящем изобретении, означает структуру, содержащую липид как составной компонент и имеющую любую пространственную структуру, например, форму, такую как линейная форма, форма пленки или сферическая форма, и примеры этого включают, но не ограничиваются этим: липосома, мицелла, липидная микросфера, липидная наносфера и липидная эмульсия. Применение других носителей лекарственного средства для того же самого нацеливающего агента, который используется с липосомой для нацеливания описано например в Zhao and Lee, Adv Drug Deliv Rev. 2004; 56(8): 1193-204, Temming et al., Drug Resist Updat. 2005; 8(6): 381-402 и т.д.
Липидная структура может быть стабилизирована, например, с посредством регулирования осмотического давления при помощи регулирующего осмотическое давление вещества, такого как соль, сахарид, такой как сахароза, глюкоза или мальтоза или многоатомный спирт, такой как глицерин или пропиленгликоль, и предпочтительно сахароза или глюкоза. Кроме того, pH может быть отрегулирован, прибавлением соответствующего количества корректирующего вещества, такого как соль или буферный раствор. Поэтому возможно осуществить продуцирование, хранение и т.д. липидной структуры в среде, содержащей вышеупомянутые вещества. В этом случае концентрация регулирующего осмотическое давление агента предпочтительно такова, чтобы стать изотонической с кровью. Например, в случае сахарозы концентрация ее в среде составляет, хотя не ограничена этим: 3-15 мас.%, предпочтительно 5-12 мас.%, более предпочтительно 8-10 мас.% и особенно 9 мас.%, а в случае глюкозы концентрация ее в среде составляет, хотя не ограничена этим: 1 - 10 мас.%, предпочтительно 3-8 мас.%, более предпочтительно 4-6 мас.% и особенно 5 мас.%.
Настоящее изобретение также касается способа получения носителя для доставки вещества к продуцирующим внеклеточный матрикс клеткам в почке, включающий стадию введения ретиноида в качестве агента, нацеливающего на продуцирующие внеклеточный матрикс клетки в почке. Способ введения ретиноида не ограничивается до тех пор, пока в носителе, в котором он введен, ретиноид может функционировать в качестве агента, нацеливающий на продуцирующие внеклеточный матрикс клетки в почках, и например, могут использоваться различные способы, описанные в настоящем описании. Поэтому, введение ретиноида может быть осуществлена посредством, связывания ретиноида с или включением его в другой компонент, составляющий носитель, химическим и/или физическим способом или смешением ретиноида с другим компонентом, составляющим носитель, при приготовлении носителя. Количество введенного ретиноида и др. представлено, как описано выше, относительно носителя в соответствии с настоящим изобретением.
Вещество или предмет, который доставляется настоящим носителем, не ограничивается до тех пор, пока и он предпочтительно имеет размер такой, что он может физически перемещаться в внутри тела организма от места введения к месту повреждения, где присутствуют клетки-мишени. Поэтому носитель в соответствии с настоящим изобретением может транспортировать не только субстанцию, такое как атом, молекула, соединение, белок или нуклеиновая кислота, но также и объект, такой как вектор, вирусная частица, клетка, система для высвобождения лекарственного средства, которая включает один или больше элементов или микромашину. Вещество или предмет предпочтительно обладают свойством иметь некоторый эффект на клетки-мишени, и примеры включают такие, которые метят клетки-мишени или контролируют (например, увеличивают или подавляют) активность или рост клеток-мишеней.
Поэтому, в одном варианте осуществления настоящего изобретения, он является «лекарственным средством для контроля активности или роста продуцирующих внеклеточный матрикс клеток в почке», который доставляется носителем. Активность продуцирующих внеклеточный матрикс клеток в почке, в настоящем изобретении относится к различным активностям, таким как секреция, поглощение или миграция, демонстрируемое клетками, продуцирующими внеклеточный матрикс в почках, и в настоящем изобретении, в частности среди тех, которые, как правило, означает активность, вовлеченную в начало, прогрессию и/или рецидив фиброза почек. Примеры такой активности включают, но не ограничиваются этим: продуцирование/секреция биологически активного вещества, такого как PAI-1, и внеклеточного матриксного компонента, такого как коллаген, протеогликан, тенасцин, фибронектин, тромбоспондин, остеопонтин, остеонектин или эластин и подавление активности разложения этих внеклеточных матриксных компонентов.
Поэтому, лекарственное средство для контроля активности или роста продуцирующих внеклеточный матрикс клеток в почке, упоминаемый в настоящем описании, может быть любым лекарственным средством, которое прямо или косвенно подавляет физические, химические и/или физиологические и др. действия указанных клеток, связанных с началом, прогрессией и/или рецидивом фиброза почек, и примеры вышеперечисленного включают, но не ограничиваются этим: лекарственное средство, которое ингибирует активность или продуцирование биологически активных веществ, перечисленных выше, антитела и фрагменты антител, которые нейтрализуют биологически активных веществ, перечисленных выше, вещество, которое подавляет экспрессию биологически активных веществ, перечисленных выше, таких как молекула РНКи (например, миРНК, кшРНК (короткая шпилечная РНК), ddRNA, микроРНК, piRNA, rasiRNA и т.д.) рибозим, антисмысловая нуклеиновая кислота (включая РНК, ДНК, ПНК или композицию вышеперечисленного) или вещество, имеющее доминантный негативный эффект, такой как доминантный негативный мутант или вектор, экспрессирующий их, или лекарственное средство, которое ингибирует продуцирование и секрецию внеклеточного матриксного компонента, упомянутого выше, например, вещество, которое подавляет экспрессию внеклеточного матриксного компонента, такого как молекула РНКи (например, миРНК, кшРНК, ddRNA, микроРНК, piRNA, rasiRNA и т.д.) рибозим, антисмысловая нуклеиновая кислота (включая РНК, ДНК, ПНК или композицию вышеперечисленного) или вещество, имеющее доминантный негативный эффект, такой как доминантный негативный мутант или вектор, экспрессирующий их ингибитор клеточной активности, такой как блокатор натриевого канала, ингибитор роста клеток, такой как алкилирующий агент (такой как ифосфамид, нимустин, циклофосфамид, дакарбазин, мелфалан или ранимустин), противоопухолевый антибиотик (такой как идарубицин, эпирубицин, даунорубицин, доксорубицин, пирарубицин, блеомицин, пепломицин, митоксантрон или митомицин C), антиметаболит (такой как гемцитарабин, эноцитабин, цитарабин, тегафур/урацил, смесь тегафур/гимерацил/отерацил калия, доксифлуридин, гидроксикарбамид, фтороурацил, метотрексат или меркаптопурин), алкалоид, такой как этопозид, иринотекан, винорелбин, доцетаксел, паклитаксел, винкристин, виндезин, или винбластин и платиновый комплекс, такой как карбоплатин, цисплатин, или недаплатин, так же как индуктор апоптоза, такой как циклоспорин.
Примеры лекарственного средства для ингибирования продуцирования/секреции внеклеточного матриксного компонента включают, но не ограничиваются этим: HSP47, который является специфичным для коллагена молекулярным шапероном, важным для внутриклеточного транспорта и созревания молекулы, которые характерны для синтетических процессов различных типов коллагена.
Кроме того, «лекарственное средство для контроля активности или роста продуцирующих внеклеточный матрикс клеток в почке» в настоящем изобретении может быть любым лекарственным средством, которое прямо или косвенно способствует физическим, химическим и/или физиологическим действиям продуцирующих внеклеточный матрикс клеток в почке, прямо или косвенно связанный с подавлением начала, прогрессии и/или рецидива фиброза почек, например, продуцирования/секрецией ММР (включая ММР1, MMP2, и т.д.), активатор плазминогена (РА) и т.д. Примеры такого средства включают, но не ограничиваются этим: активатор или энхансер экспрессии для этих веществ. Носитель в соответствии с настоящим изобретением может доставлять один или более типов вышеупомянутых лекарственных средств.
миРНК (малая интерферирующая РНК), которая может использоваться в настоящем изобретении, включает, в дополнение к миРНК в строгом значении, двухцепочечные РНК и их модифицированные формы, такие как миRNA (микро РНК), кшRNA (короткая шпилечн