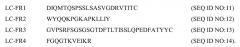Антитела к pd-l1 и их применение для усиления функции т-клеток
Иллюстрации
Показать всеНастоящее изобретение относится к иммунологии. Предложено выделенное антитело к PD-L1 и его антигенсвязывающий фрагмент, охарактеризованные аминокислотными последовательностями гипервариабельных участков (HVR) в составе вариабельных областей тяжелой цепи и легкой цепи. Кроме того, описана выделенная нуклеиновая кислота, кодирующая антитело; экспрессионный вектор; клетка-хозяин и способ получения антитела или его антигенсвязывающего фрагмента. Также рассмотрена композиция, содержащая эффективное количество антитела к PD-L1 или антигенсвязывающего фрагмента; изделие производства, содержащее емкость с терапевтически эффективным количеством композиции; и способы лечения злокачественной опухоли и инфекции. Данное изобретение может найти дальнейшее применение в терапии. 11 н. и 49 з.п. ф-лы, 11 ил., 4 табл., 11 пр.
Реферат
Родственные заявки
Настоящая заявка притязает на приоритет согласно 35 USC 119(e) на основании предварительной заявки на выдачу патента № 61/121092, поданной 9 декабря 2008, описание которой включено в настоящее описание путем ссылки в полном объеме.
Область техники, к которой относится изобретение
Настоящее изобретение, в общем, относится к иммунной функции и к усилению функции T-клеток, включая повышенную регуляцию опосредованных клетками иммунных ответов, и к лечению T-клеточных дисфункциональных расстройств.
Уровень техники
Костимуляция или предоставление двух отдельных сигналов T-клеткам является широко распространенной моделью активации покоящихся T-лимфоцитов антигенпрезентирующими клетками (APC, АПК). Lafferty et al., Aust. J. Exp. Biol. Med. Sci. 53: 27-42 (1975). Такая модель дополнительно предусматривает способность отличать свое от чужого и иммунную толерантность. Bretscher et al., Science 169: 1042-1049 (1970); Bretscher, P.A., P.N.A.S. USA 96: 185-190 (1999); Jenkins et al., J. Exp. Med. 165: 302-319 (1987). Трансдукция первого сигнала или специфичного для антигена сигнала осуществляется через T-клеточный рецептор (TCR) после распознавания чужеродного антигенного пептида, презентируемого в контексте главного комплекса гистосовместимости (MHC). Второй или костимулирующий сигнал доставляется к T-клеткам костимулирующими молекулами, экспрессируемыми на антигенпрезентирующих клетках (АПК), и индуцирует T-клетки, стимулируя клональную экспансию, секрецию цитокинов и эффекторную функцию. Lenschow et al., Ann. Rev. Immunol. 14: 233 (1996). В отсутствие костимуляции T-клетки могут становиться невосприимчивыми к антигенной стимуляции, не обеспечивают формирование эффективного иммунного ответа и, кроме того, могут приводить к истощению или толерантности к чужеродным антигенам.
Простая основанная на двух сигналах модель может быть чрезмерным упрощением, поскольку интенсивность сигнала TCR в действительности оказывает количественное влияние на активацию и дифференцировку T-клеток. Viola et al., Science 273: 104-106 (1996); Sloan-Lancaster, Nature 363: 156-159 (1993). Кроме того, активация T-клеток может происходить даже в отсутствие костимулирующего сигнала, если интенсивность сигнала TCR высока. Более важно то, что T-клетки получают как позитивные, так и негативные вторичные костимулирующие сигналы. Регулирование таких позитивных и негативных сигналов является важным для максимизации защитных иммунных ответов хозяина при сохранении иммунной толерантности и недопущении аутоиммунитета. Негативные вторичные сигналы, по-видимому, необходимы для индукции T-клеточной толерантности, тогда как позитивные сигналы стимулируют активацию T-клеток. Хотя простая основанная на двух сигналах модель все же дает правильное объяснение в случае «необученных» лимфоцитов, иммунный ответ хозяина является динамическим процессом, и подвергаемые воздействию антигена T-клетки также могут получать костимулирующие сигналы.
Механизм костимуляции представляет терапевтический интерес, так как показано, что управление костимулирующими сигналами обеспечивает средство либо для усиления, либо для прекращения основанного на клетках иммунного ответа. Недавно было обнаружено, что нарушение функции T-клеток или анергия возникает одновременно с индуцированной и длительной экспрессией ингибирующего рецептора, полипептида запрограммированной гибели 1 (PD-1). В результате целенаправленное терапевтическое воздействие, направленное на PD-1 и другие молекулы, которые передают сигнал посредством взаимодействий с PD-1, такие как лиганд пептида запрограммированной гибели 1 (PD-L1) и лиганд пептида запрограммированной гибели 2 (PD-L2), относится к области повышенного интереса. Ингибирование передачи сигнала PD-L1 было предложено в качестве средства усиления T-клеточного иммунитета для лечения злокачественной опухоли (например, опухолевого иммунитета) и инфекции, включая как острую, так и хроническую (например, персистирующую) инфекцию. Однако поскольку оптимальное терапевтическое средство, направленное к мишени в таком пути, должно быть все-таки поставлено на коммерческую основу, в области медицины существует значительная неудовлетворенная потребность в таких средствах.
Сущность изобретения
Настоящее изобретение относится к антителам к PD-L1, включая кодирующую их нуклеиновую кислоту и композиции, содержащие такие антитела, и к их применению с целью усиления функции T-клеток для осуществления повышающей регуляции опосредованных клетками иммунных ответов, и для лечения T-клеточных дисфункциональных расстройств, включая инфекцию (например, острую и хроническую) и опухолевый иммунитет.
В одном варианте изобретение относится к выделенному полипептиду вариабельной области тяжелой цепи, содержащему последовательность HVR-H1, HVR-H2 и HVR-H3, где:
(a) последовательность HVR-H1 представляет собой последовательность GFTFSX1SWIH (SEQ ID NO:1);
(b) последовательность HVR-H2 представляет собой последовательность AWIX2PYGGSX3YYADSVKG (SEQ ID NO:2);
(c) последовательность HVR-H3 представляет собой последовательность RHWPGGFDY (SEQ ID NO:3);
и где: X1 означает D или G; X2 означает S или L; X3 означает T или S.
В одном конкретном аспекте X1 означает D; X2 означает S, и X3 означает T. В другом аспекте полипептид дополнительно содержит последовательности каркаса вариабельной области тяжелой цепи, расположенные между HVR согласно формуле: (HC-FR1)-(HVR-H1)-(HC-FR2)-(HVR-H2)-(HC-FR3)-(HVR-H3)-(HC-FR4). В еще одном аспекте каркасные последовательности получены из консенсусных каркасных последовательностей человека. В следующем аспекте каркасные последовательности представляют собой консенсусный каркас VH подгруппы III. В еще одном аспекте, по меньшей мере, одна из каркасных последовательностей представляет собой следующую последовательность:
HC-FR1 представляет собой EVQLVESGGGLVQPGGSLRLSCAAS (SEQ ID NO:4)
HC-FR2 представляет собой WVRQAPGKGLEWV (SEQ ID NO:5)
HC-FR3 представляет собой RFTISADTSKNTAYLQMNSLRAEDTAVYYCAR (SEQ ID NO:6)
HC-FR4 представляет собой WGQGTLVTVSA (SEQ ID NO:7).
В еще одном аспекте полипептид тяжелой цепи дополнительно объединен с вариабельной областью легкой цепи, содержащей HVR-L1, HVR-L2 и HVR-L3, где:
(a) последовательность HVR-L1 представляет собой RASQX4X5X6TX7X8A (SEQ ID NO:8);
(b) последовательность HVR-L2 представляет собой SASX9LX10S, (SEQ ID NO:9);
(c) последовательность HVR-L3 представляет собой QQX11X12X13X14PX15T (SEQ ID NO:10);
и где: X4 означает D или V; X5 означает V или I; X6 означает S или N; X7 означает A или F; X8 означает V или L; X9 означает F или T; X10 означает Y или A; X11 означает Y, G, F или S; X12 означает L, Y, F или W; X13 означает Y, N, A, T, G, F или I; X14 означает H, V, P, T или I; X15 означает A, W, R, P или T.
В еще одном аспекте X4 означает D; X5 означает V; X6 означает S; X7 означает A; X8 означает V; X9 означает F; X10 означает Y; X11 означает Y; X12 означает L; X13 означает Y; X14 означает H; X15 означает A. В еще одном аспекте легкая цепь дополнительно содержит каркасные последовательности вариабельной области легкой цепи, расположенные между HVR согласно формуле: (LC-FR1)-(HVR-L1)-(LC-FR2)-(HVR-L2)-(LC-FR3)-(HVR-L3)-(LC-FR4). В еще одном аспекте каркасные последовательности получены из консенсусных каркасных последовательностей человека. В еще одном аспекте каркасные последовательности представляют собой консенсусный каркас VL каппа I. В еще одном аспекте, по меньшей мере, одна из каркасных последовательностей представляет собой следующую последовательность:
LC-FR1 представляет собой DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO:11)
LC-FR2 представляет собой WYQQKPGKAPKLLIY (SEQ ID NO:12)
LC-FR3 представляет собой GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC (SEQ ID NO:13)
LC-FR4 представляет собой FGQGTKVEIKR (SEQ ID NO:14).
В другом варианте изобретение относится к выделенному антителу к PD-L1 или антигенсвязывающему фрагменту, содержащему последовательность вариабельной области тяжелой цепи и легкой цепи, где:
(a) тяжелая цепь содержит HVR-H1, HVR-H2 и HVR-H3, и где:
(i) последовательность HVR-H1 представляет собой GFTFSX1SWIH; (SEQ ID NO:1)
(ii) последовательность HVR-H2 представляет собой AWIX2PYGGSX3YYADSVKG (SEQ ID NO:2)
(iii) последовательность HVR-H3 представляет собой RHWPGGFDY и (SEQ ID NO:3),
(b) легкая цепь содержит HVR-L1, HVR-L2 и HVR-L3, и где:
(i) последовательность HVR-L1 представляет собой RASQX4X5X6TX7X8A (SEQ ID NO:8)
(ii) последовательность HVR-L2 представляет собой SASX9LX10S; и (SEQ ID NO:9)
(iii) последовательность HVR-L3 представляет собой QQX11X12X13X14PX15T; (SEQ ID NO:10)
и где: X1 означает D или G; X2 означает S или L; X3 означает T или S; X4 означает D или V; X5 означает V или I; X6 означает S или N; X7 означает A или F; X8 означает V или L; X9 означает F или T; X10 означает Y или A; X11 означает Y, G, F или S; X12 означает L, Y, F или W; X13 означает Y, N, A, T, G, F или I; X14 означает H, V, P, T или I; X15 означает A, W, R, P или T.
В конкретном аспекте X1 означает D; X2 означает S и X3 означает T. В другом аспекте X4 означает D; X5 означает V; X6 означает S; X7 означает A; X8 означает V; X9 означает F; X10 означает Y; X11 означает Y; X12 означает L; X13 означает Y; X14 означает H; X15 означает A. В еще одном аспекте X1 означает D; X2 означает S и X3 означает T, X4 означает D; X5 означает V; X6 означает S; X7 означает A; X8 означает V; X9 означает F; X10 означает Y; X11 означает Y; X12 означает L; X13 означает Y; X14 означает H и X15 означает A.
В следующем аспекте вариабельная область тяжелой цепи содержит одну или более каркасных последовательностей, расположенных между HVR следующим образом: (HC-FR1)-(HVR-H1)-(HC-FR2)-(HVR-H2)-(HC-FR3)-(HVR-H3)-(HC-FR4), и вариабельная область легкой цепи содержит одну или более каркасных последовательностей, расположенных между HVR следующим образом: (LC-FR1)-(HVR-L1)-(LC-FR2)-(HVR-L2)-(LC-FR3)-(HVR-L3)-(LC-FR4). В еще одном аспекте каркасные последовательности получены из консенсусных каркасных последовательностей человека. В еще одном аспекте каркасные последовательности тяжелой цепи получены из последовательности подгруппы I, II или III по Кабату. В еще одном аспекте каркасная последовательность тяжелой цепи представляет собой консенсусный каркас подгруппы III VH. В еще одном аспекте одна или более каркасных последовательностей тяжелой цепи представляют собой следующие последовательности:
В еще одном аспекте каркасные последовательности легкой цепи получены из последовательности подгруппы каппа I, II, II или IV по Кабату. В еще одном аспекте каркасные последовательности легкой цепи представляют собой консенсусный каркас VL каппа I. В еще одном аспекте одна или более каркасных последовательностей легкой цепи представляют собой следующие последовательности:
В еще одном конкретном аспекте антитело дополнительно содержит константную область человека или мыши. В еще одном аспекте константная область человека выбрана из группы, состоящей из IgG1, IgG2, IgG2, IgG3, IgG4. В еще одном конкретном аспекте константная область человека получена из IgG1. В еще одном аспекте константная область мыши выбрана из группы, состоящей из IgG1, IgG2A, IgG2B, IgG3. В еще одном аспекте константная область мыши получена из IgG2A. В еще одном дополнительном конкретном аспекте антитело обладает пониженной или минимальной эффекторной функцией. В еще одном конкретном аспекте минимальная эффекторная функция является результатом «Fc-мутации с утратой эффекторной функции» или отсутствия гликозилирования. В еще одном варианте изобретения Fc-мутация с утратой эффекторной функции представляет собой замену N297A или D265A/N297A в константной области.
В еще одном варианте изобретения предлагается антитело к PD-L1, содержащее последовательность вариабельной области тяжелой цепи и легкой цепи, где:
(a) тяжелая цепь дополнительно содержит последовательность HVR-H1, HVR-H2 и HVR-H3, имеющую, по меньшей мере, 85% идентичность последовательности с последовательностью GFTFSDSWIH (SEQ ID NO:15), AWISPYGGSTYYADSVKG (SEQ ID NO:16) и RHWPGGFDY (SEQ ID NO:3), соответственно, или
(b) легкая цепь дополнительно содержит последовательность HVR-L1, HVR-L2 и HVR-L3, имеющую, по меньшей мере, 85% идентичность последовательности с последовательностью RASQDVSTAVA (SEQ ID NO:17), SASFLYS (SEQ ID NO:18) и QQYLYHPAT (SEQ ID NO:19), соответственно.
В конкретном аспекте идентичность последовательности составляет 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%. В другом аспекте вариабельная область тяжелой цепи содержит одну или более каркасных последовательностей, расположенных между HVR следующим образом: (HC-FR1)-(HVR-H1)-(HC-FR2)-(HVR-H2)-(HC-FR3)-(HVR-H3)-(HC-FR4), и вариабельные области легкой цепи содержат одну или более каркасных последовательностей, расположенных между HVR следующим образом: (LC-FR1)-(HVR-L1)-(LC-FR2)-(HVR-L2)-(LC-FR3)-(HVR-L3)-(LC-FR4). В еще одном аспекте каркасные последовательности получены из консенсусных каркасных последовательностей человека. В еще одном аспекте каркасные последовательности тяжелой цепи получены из последовательности подгруппы I, II или III по Кабату. В еще одном аспекте каркасная последовательность тяжелой цепи представляет собой консенсусный каркас VH подгруппы III. В еще одном аспекте одна или более каркасных последовательностей тяжелой цепи представляют собой следующие последовательности:
В еще одном аспекте каркасные последовательности легкой цепи получены из последовательности каппа подгруппы I, II, II или IV по Кабату. В еще одном аспекте каркасные последовательности легкой цепи представляют собой консенсусный каркас VL каппа I. В еще одном аспекте одна или более каркасных последовательностей легкой цепи представляют собой следующие последовательности:
В еще одном конкретном аспекте антитело дополнительно содержит константную область человека или мыши. В еще одном аспекте константная область человека выбрана из группы, состоящей из IgG1, IgG2, IgG2, IgG3, IgG4. В еще одном конкретном аспекте константная область человека получена из IgG1. В еще одном аспекте константная область мыши выбрана из группы, состоящей из IgG1, IgG2A, IgG2B, IgG3. В еще одном аспекте константная область мыши получена из IgG2A. В еще одном дополнительном конкретном аспекте антитело обладает пониженной или минимальной эффекторной функцией. В еще одном конкретном аспекте минимальная эффекторная функция является результатом «Fc-мутации с утратой эффекторной функции» или отсутствия гликозилирования. В еще одном варианте изобретения Fc-мутация с утратой эффекторной функции представляет собой замену N297A или D265A/N297A в константной области.
В еще одном варианте изобретения предлагается выделенное антитело к PD-L1, содержащее последовательность вариабельной области тяжелой цепи и легкой цепи, где:
(a) последовательность тяжелой цепи имеет, по меньшей мере, 85% идентичность последовательности с последовательностью тяжелой цепи:
или
(b) последовательность легкой цепи имеет, по меньшей мере, 85% идентичность последовательности с последовательностью легкой цепи:
В конкретном аспекте идентичность последовательности составляет 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%. В другом аспекте вариабельная область тяжелой цепи содержит одну или более каркасных последовательностей, расположенных между HVR следующим образом: (HC-FR1)-(HVR-H1)-(HC-FR2)-(HVR-H2)-(HC-FR3)-(HVR-H3)-(HC-FR4), и вариабельные области легкой цепи содержат одну или более каркасных последовательностей, расположенных между HVR следующим образом: (LC-FR1)-(HVR-L1)-(LC-FR2)-(HVR-L2)-(LC-FR3)-(HVR-L3)-(LC-FR4). В еще одном аспекте каркасные последовательности получены из консенсусных каркасных последовательностей человека. В следующем аспекте каркасные последовательности тяжелой цепи получены из последовательности подгруппы I, II или III по Кабату. В еще одном аспекте каркасная последовательность тяжелой цепи представляет собой консенсусный каркас VH подгруппы III. В еще одном аспекте одна или более каркасных последовательностей тяжелой цепи представляют собой следующие последовательности:
В еще одном аспекте каркасные последовательности легкой цепи получены из последовательности каппа подгруппы I, II, II или IV по Кабату. В еще одном аспекте каркасные последовательности легкой цепи представляют собой консенсусный каркас VL каппа I. В еще одном аспекте одна или более каркасных последовательностей легкой цепи представляют собой следующие последовательности:
В еще одном конкретном аспекте антитело дополнительно содержит константную область человека или мыши. В еще одном аспекте константная область человека выбрана из группы, состоящей из IgG1, IgG2, IgG2, IgG3, IgG4. В еще одном конкретном аспекте константная область человека получена из IgG1. В еще одном аспекте константная область мыши выбрана из группы, состоящей из IgG1, IgG2A, IgG2B, IgG3. В еще одном аспекте константная область мыши получена из IgG2A. В еще одном дополнительном конкретном аспекте антитело обладает пониженной или минимальной эффекторной функцией. В еще одном конкретном аспекте минимальная эффекторная функция является результатом продуцирования в прокариотических клетках. В еще одном конкретном аспекте минимальная эффекторная функция является результатом «Fc-мутации с утратой эффекторной функции» или отсутствия гликозилирования. В еще одном варианте изобретения Fc-мутация с утратой эффекторной функции представляет собой замену N297A или D265A/N297A в константной области.
В еще одном варианте изобретение относится к композициям, содержащим любое из описанных выше антител к PD-L1 в сочетании, по меньшей мере, с одним фармацевтически приемлемым носителем.
В еще одном варианте изобретение относится к выделенной нуклеиновой кислоте, кодирующей последовательность вариабельной области легкой цепи или тяжелой цепи антитела к PD-L1, где:
(a) тяжелая цепь дополнительно содержит последовательность HVR-H1, HVR-H2 и HVR-H3, имеющую, по меньшей мере, 85% идентичность последовательности с последовательностью GFTFSDSWIH (SEQ ID NO:15), AWISPYGGSTYYADSVKG (SEQ ID NO:16) и RHWPGGFDY (SEQ ID NO:3), соответственно, и
(b) легкая цепь дополнительно содержит последовательность HVR-L1, HVR-L2 и HVR-L3, имеющую, по меньшей мере, 85% идентичность последовательности с последовательностью RASQDVSTAVA (SEQ ID NO:17), SASFLYS (SEQ ID NO:18) и QQYLYHPAT (SEQ ID NO:19), соответственно.
В конкретном аспекте идентичность последовательности составляет 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%. В одном аспекте вариабельная область тяжелой цепи содержит одну или более каркасных последовательностей, расположенных между HVR следующим образом: (HC-FR1)-(HVR-H1)-(HC-FR2)-(HVR-H2)-(HC-FR3)-(HVR-H3)-(HC-FR4), и вариабельные области легкой цепи содержат одну или более каркасных последовательностей, расположенных между HVR следующим образом: (LC-FR1)-(HVR-L1)-(LC-FR2)-(HVR-L2)-(LC-FR3)-(HVR-L3)-(LC-FR4). В еще одном аспекте каркасные последовательности получены из консенсусных каркасных последовательностей человека. В следующем аспекте каркасные последовательности тяжелой цепи получены из последовательности подгруппы I, II или III по Кабату. В еще одном аспекте каркасная последовательность тяжелой цепи представляет собой консенсусный каркас VH подгруппы III. В еще одном аспекте одна или более каркасных последовательностей тяжелой цепи представляют собой следующие последовательности:
В еще одном аспекте каркасные последовательности легкой цепи получены из последовательности каппа подгруппы I, II, II или IV по Кабату. В еще одном аспекте каркасные последовательности легкой цепи представляют собой консенсусный каркас VL каппа I. В еще одном аспекте одна или более каркасных последовательностей легкой цепи представляют собой следующие последовательности:
В еще одном конкретном аспекте антитело дополнительно содержит константную область человека или мыши. В еще одном аспекте константная область человека выбрана из группы, состоящей из IgG1, IgG2, IgG2, IgG3, IgG4. В еще одном конкретном аспекте константная область человека получена из IgG1. В еще одном аспекте константная область мыши выбрана из группы, состоящей из IgG1, IgG2A, IgG2B, IgG3. В еще одном аспекте константная область мыши получена из IgG2A. В еще одном дополнительном конкретном аспекте антитело обладает пониженной или минимальной эффекторной функцией. В еще одном конкретном аспекте минимальная эффекторная функция является результатом продуцирования в прокариотических клетках. В еще одном конкретном аспекте минимальная эффекторная функция является результатом «Fc-мутации с утратой эффекторной функции» или отсутствия гликозилирования. В еще одном варианте Fc-мутация с утратой эффекторной функции представляет собой замену N297A или D265A/N297A в константной области.
В еще одном аспекте нуклеиновая кислота дополнительно содержится в векторе, подходящем для экспрессии нуклеиновой кислоты, кодирующей любое из ранее описанных антител к PD-L1. В еще одном конкретном аспекте вектор дополнительно содержится в клетке-хозяине, подходящей для экспрессии нуклеиновой кислоты. В еще одном конкретном аспекте клеткой-хозяином является эукариотическая клетка или прокариотическая клетка. В еще одном конкретном аспекте эукариотической клеткой является клетка млекопитающего, такая как клетка яичника китайского хомячка (CHO).
В еще одном варианте изобретение относится к способу получения антитела к PD-L1 или его антигенсвязывающего фрагмента, включающему культивирование клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую ранее описанные антитела к PD-L1 или антигенсвязывающий фрагмент, в форме, подходящей для экспрессии, в условиях, подходящих для продуцирования такого антитела или фрагмента, и извлечение антитела или фрагмента.
В еще одном варианте изобретение относится к композиции, содержащей антитело к PD-L1 или его антигенсвязывающий фрагмент, предлагаемые в изобретении, и, по меньшей мере, один фармацевтически приемлемый носитель.
В еще одном варианте изобретение относится к изделию производства, включающему емкость, содержащую терапевтически эффективное количество композиции, описанной в настоящей публикации, и вкладыш в упаковку, в котором указано применение для лечения T-клеточного дисфункционального расстройства.
В еще одном варианте изобретение относится к изделию производства, содержащему любую из описанных выше композиций анти-PD-L1 в сочетании, по меньшей мере, с одной молекулой BNCA. В одном аспекте молекулы BNCA представляют собой антитело, антигенсвязывающий фрагмент антитела, олигопептид BNCA, РНК-и BNCA или малую молекулу BNCA. В другом аспекте негативная костимулирующая молекула B7 выбрана из группы, состоящей из: CTLA-4, PD-1, PD-L1, PD-L2, B7.1, B7-H3 и B7-H4.
В еще одном варианте изделие производства содержит любую из описанных выше анти-PD-L1-композиций в сочетании с химиотерапевтическим средством. В одном аспекте химиотерапевтическим средством является гемцитабин.
В еще одном варианте изобретения предлагается изделие производства, содержащее любое из описанных выше антител к PD-L1 в сочетании с одним или более агонистами позитивной костимулирующей молекулы. В одном аспекте позитивная костимулирующая молекула представляет собой костимулирующую молекулу семейства B7. В другом аспекте позитивная костимулирующая молекула выбрана из группы, состоящей из: CD28, CD80, CD86, ICOS/ICOSL. В еще одном аспекте позитивная костимулирующая молекула представляет собой костимулирующую молекулу семейства TNFR. В следующем аспекте костимулирующая молекула TNFR выбрана из группы, состоящей из: OX40/OX40L, 4-1BB/4-1BBL, CD27/CD27L, CD30/CD30L и HVEM/LIGHT, и их растворимых фрагментов, конструкций и агонистических антител.
В еще одном варианте изобретения предлагается изделие производства, содержащее любое из описанных выше антител к PD-L1 в сочетании с одним или более антибиотиками. В одном аспекте антибиотик выбран из группы, состоящей из противовирусного средства, антибактериального средства, противогрибкового средства, противопротозойного средства.
В другом аспекте противовирусное средство выбрано из группы, состоящей из ингибиторов обратной транскриптазы, ингибиторов протеазы, ингибиторов интегразы, ингибиторов проникновения или слияния, ингибиторов созревания, ингибиторов высвобождения вирусов, усилителей иммунного ответа, противовирусных синергетических усилителей, вакцин, печеночных агонистов и терапевтических средств из растительного сырья. В еще одном аспекте сочетание включает одну или более категорий противовирусных средств.
В еще одном варианте изобретения предлагается изделие производства, содержащее любое из описанных выше антител к PD-L1 в сочетании с одной или более вакцинами.
В еще одном варианте изобретение относится к способу усиления T-клеточной функции, включающему введение эффективного количества любого из описанных выше антител к PD-L1 или композиций. В одном аспекте антитело к PD-L1 или композиция делает дисфункциональные T-клетки недисфункциональными.
В еще одном варианте изобретение относится к способу лечения T-клеточного дисфункционального расстройства, включающему введение терапевтически эффективного количества любого из описанных выше антител к PD-L1 или композиций. В одном конкретном аспекте T-клеточным дисфункциональным расстройством является инфекция или опухолевый иммунитет. В другом аспекте инфекция является острой или хронической. В другом аспекте хроническая инфекция является персистирующей, латентной или медленно текущей. В еще одном аспекте хроническая инфекция является результатом действия патогена, выбранного из группы, состоящей из бактерий, вирусов, грибов и простейших. В следующем аспекте уровень патогена в организме хозяина снижают. В еще одном аспекте способ дополнительно включает лечение вакциной. В еще одном аспекте способ дополнительно включает лечение антибиотиком. В еще одном аспекте патогеном являются бактерии, и способ дополнительно включает введение антибактериального средства. В еще одном аспекте бактерии выбраны из группы, состоящей из: Mycobacterium spp., Salmonella spp., Listeria spp., Streptococcus spp., Haemophilus spp., Neisseria spp., Klebsiella spp., Borrelia spp., Bacterioides fragillis, Treponema spp. и Helicobacter pylori. В еще одном аспекте патогеном является вирус, и способ дополнительно включает введение противовирусного средства. В еще одном аспекте вирус выбран из группы, состоящей из: вируса гепатита-B, -C, вируса простого герпеса-I, -II, вируса иммунодефицита человека -I, -II, цитомегаловируса, вируса Эпштейн-Барр, вируса папилломы человека, T-клеточных лимфотрофических вирусов человека -I, -II, вируса ветряной оспы. В еще одном аспекте патогеном является гриб, и способ дополнительно включает введение противогрибкового средства. В еще одном аспекте расстройство выбрано из группы, состоящей из: аспергиллеза, бластомикоза, кандидоза (Candida albicans), кокцидиоидомикоза (Coccidioides immitis), гистоплазмоза, паракокцидиоидомикоза, микроспоридиоза. В еще одном аспекте патогеном является простейшее, и способ дополнительно включает введение противопротозойного средства. В еще одном аспекте расстройство выбрано из группы, состоящей из: лейшманиоза, плазмодиоза (т.е. малярии), криптоспоридиоза, токсоплазмоза, трипаносомоза и гельминтовых инфекций, включая инфекции, вызванные трематодами (например, шистосомоз), ленточными червями (например, эхинококкоз) и нематодами (например, трихиноз, аскаридоз, филариоз и стронгилоидоз).
В еще одном аспекте T-клеточным дисфункциональным расстройством является опухолевый иммунитет. В еще одном аспекте антитело к PD-L1 или композицию сочетают в схеме лечения, дополнительно включающей традиционную терапию, выбранную из группы, состоящей из: лучевой терапии, химиотерапии, целенаправленной терапии, иммунотерапии, гормональной терапии, ингибирования ангиогенеза и паллиативного лечения. В еще одном конкретном аспекте химиотерапевтическое лечение выбрано из группы, состоящей из: гемцитабина, циклофосфамида, доксорубицина, паклитаксела, цисплатина. В еще одном конкретном аспекте опухолевый иммунитет возникает в результате наличия злокачественной опухоли, выбранной из группы, состоящей из: рака молочной железы, легкого, ободочной кишки, яичника, меланомы, рака мочевого пузыря, почки, печени, слюнных желез, желудка, глиом, рака щитовидной железы, вилочковой железы, эпителиального рака, рака головы и шеи, рака ЖКТ и поджелудочной железы.
Краткое описание чертежей
Фигура 1 является графической иллюстрацией, изображающей костимуляцию T-клеток молекулами клеточной поверхности семейства B7.
Фигура 2 является схематичным изображением дизайна эксперимента для анализа стимуляции T-клеток PMEL/B16.
Фигура 3 представляет собой гистограмму, показывающую влияние антитела к PD-L1 на антиген-специфичную функцию T-клеток на основании повышенной продукции IFN-γ в T-клетках CD8+ PMEL в ответ на пептид меланоцитов gp100. Как процентное содержание IFN-γ-продуцирующих T-клеток CD8+, так и уровни продукции ими IFN-γ повышены при стимуляции в присутствии антитела к PD-L1.
Фигура 4 представляет собой гистограмму, показывающую влияние антитела к PD-L1 на антиген-специфичную функцию T-клеток на основании повышения пролиферации овальбумин-специфичных T-клеток CD4+ антителом к PD-L1 YW243.55.S1 при вторичной стимуляции с использованием импульсно обработанных овальбумином B-клеток A20/АПК mPD-L1.
Фигура 5 представляет собой серию графиков FACS, показывающих усиление пролиферации T-клеток CD8 человека антителом к PD-L1 YW243.55S1 в реакции смешанных лимфоцитов. Также указан процент пролиферирующих клеток, измеренный при разбавлении в единицах интенсивности CFSE.
Фигура 6 является схемой дизайна эксперимента по лечению хронической инфекции LCMV химерной формой антитела к PD-L1 YW243.55S70. Стрелками обозначены временные точки для 6 доз анти-PD-L1, начиная с 14 дня после инфекции с использованием 2×106 БОЕ LCMV клона 13.
Фигуры 7A и 7B представляют собой графики, показывающие усиленную эффекторную функцию CD8 в клетках ex vivo после лечения in vivo хронической инфекции LCMV антителом к PD-L1 YW243.55.S70. Блокада PD-L1 антителом YW243.55.S70 увеличивала дегрануляцию T-клеток CD8+ (которую измеряли по увеличению поверхностного CD107A) (фиг.7A) и увеличивала % IFN-гамма-продуцирующих клеток в ответ на пептид gp33 LCMV (фиг.7B). Частоту встречаемости gp33-специфичных клеток выявляли окрашиванием H2-Db-gp33-пентамерами.
На фигурах 8A и 8B показано снижение титров LCMV в крови и ткани при хронической инфекции LCMV после лечения in vivo антителом к PD-L1. На фигуре 8A: титр вирусов в различных указанных тканях анализировали на 21 и 28 день, через одну и две недели после лечения антителом, соответственно. На фигуре 8B: титры вирусов в сыворотке анализировали в дни 0, 7, 14, 21 и 28, при этом инокуляцию LCMV осуществляли в 0 день и лечение начинали на 14 день.
На фигуре 9A показано значимое снижение роста опухоли карциномы ободочной кишки MC38.Ova в результате применения антитела к PD-L1 после терапевтического лечения верифицированных опухолей (лечение начинали на 14 день, когда опухоль имела размер 250 мм3). Фигура 9B представляет собой гистограмму, показывающую поверхностные уровни экспрессии PD-L1 на клетках MC38.Ova в культуре ткани, которые измеряли проточной цитометрией. PD-L2 не экспрессируется клетками MC38.Ova.
Фигура 10 является графиком, показывающим влияние лечения, блокирующего PD-L1, отдельно и в сочетании либо с анти-VEGF, либо с гемцитабином, на рост опухолей MC38.Ova у мышей C57BL/6.
На фигурах 11A-B показаны последовательности вариабельных областей тяжелой и легкой цепи, соответственно, 11 антител к PD-L1, идентифицированных с помощью фагового дисплея. Заштрихованные столбики показывают CDR с разными определениями, тогда как заключенные в прямоугольники области показывают протяженность HVR.
Подробное описание предпочтительных вариантов осуществления
Все публикации, указанные в настоящем описании, специально включены путем ссылки.
Общие способы
При практическом осуществлении настоящего изобретения, если не оговорено особо, будут использованы обычные методики молекулярной биологии (включая методику рекомбинантов), микробиологии, клеточной биологии, биохимии и иммунологии, которые известны специалистам в данной области. Такие методики полностью объяснены в литературе, например, Molecular Cloning: A Laboratory Manual, second edition (Sambrook et al., 1989); Oligonecleotide Synthesis (M.J. Gait, ed., 1984); Animal Cell Culture (R.I. Freshney, ed., 1987); Methods in Enzymology (Academic Press, Inc.); Current Protocols in Molecular Biology (F.M. Ausubel et al., eds 1987, and periodic updates), PCR: The Polymerase Chain Reaction, (Mullis et al., ed., 1994); A Practical Guide to Molecular Cloning (Perbal Bernard V., 1988); Phage Display: A Laboratory Manual (Barbas et al., 2001).
I. Иммунитет хозяина
A. Развитие и активация лимфоцитов
У человека два основных типа лимфоцитов: T (происходящие из тимуса) и B (происходящие из костного мозга). Такие клетки происходят из гематопоэтических стволовых клеток в костном мозге и печени плода, которые были коммитированы к лимфоидному пути развития. Потомство таких стволовых клеток следует по дивергентным путям, созревая либо до B-, либо до T-лимфоцитов. Развитие B-лимфоцитов человека происходит полностью в костном мозге. С другой стороны, T-клетки развиваются из незрелых предшественников, которые покидают костный мозг и перемещаются по кровяному руслу в тимус, где они пролиферируют и дифференцируются в зрелые T-лимфоциты.
Зрелые лимфоциты, которые происходят из тимуса или костного мозга, находятся в молчащем или «покоящемся» состоянии, т.е. они являются митотически неактивными. При распределении в кровообращении такие «нативные» или «необученные» лимфоциты перемещаются в различные вторичные или периферические лимфоидные органы, такие как селезенка, лимфатические узлы или миндалины. Большинство необученных лимфоцитов по своей природе имеют короткую продолжительность жизни и погибают в течение нескольких дней после того, как они покидают костный мозг или тимус. Однако если такая клетка получает сигналы, которые свидетельствуют о присутствии антигена, они могут активироваться и подвергаться последовательным раундам клеточного деления. Затем некоторые из образовавшихся клеток потомства возвращаются к покоящемуся состоянию, становясь лимфоцитами памяти - B- и T-клетками, которые по существу примированы для следующей встречи со стимулирующим аллергеном. Другим потомством активированных необученных лимфоцитов являются эффекторные клетки, которые живут только в течение нескольких дней, но осуществляют специфичные защитные активности.
Активация лимфоцитов относится к серии упорядоченных событий, которые проходит покоящийся лимфоцит, когда он стимулирован к делению и образованию клеток-потомков, некоторые из которых становятся эффекторными клетками. Полный ответ включает как индукцию клеточной пролиферации (митогенез), так и экспрессию иммунологических функций. Лимфоциты становятся активированными, когда специфичные лиганды связываются с рецепторами на их поверхности. Лиганды для T-клеток и B-клеток отличаются, но итоговые внутриклеточные физиологические механизмы сходны.
Некоторые чужеродные антигены могут индуцировать активацию лимфоцитов сами по себе, особенно крупные полимерные антигены, которые поперечно сшивают поверхностные иммуноглобулины на B-клетках или другие гликопротеины на T-клетках. Однако большинство антигенов не являются полимерами, и даже прямое связывание с B-клетками больших количеств не может привести к активации. Такие более распространенные антигены активируют B-клетки в случае костимуляции соседними активированными хелперными T-лимфоцитами. Такая стимуляция может осуществляться лимфокинами, секретируемыми T-клеткой, но наиболее эффективно может происходить при прямом контакте B-клетки с поверхностными белками T-клетки, которые взаимодействуют с некоторыми рецепторами на поверхности B-клеток, генерируя вторичный сигнал.
B. T-клетки
T-лимфоциты не эк