Молекула, содержащая spr0096 и spr2021
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к носителям для вакцин, и может быть использовано в медицине для индукции иммунного ответа против бактериального капсульного сахарида. Предложен конъюгат, содержащий бактериальный капсульный сахарид, например капсульный сахарид из N. meningitidis серогруппы А, С, W135 или Y, ковалентно связанный с молекулой носителя, где молекула носителя содержит единую полипептидную цепь, состоящую из одного антигена spr0096 и одного антигена spr2021. Изобретение обеспечивает усиление иммунного ответа на сахарид по сравнению с белком-носителем CRM197. 5 н. и 10 з.п. ф-лы, 18 ил., 5 табл.
Реферат
По настоящей заявке испрашивается приоритет временной заявки США № 61/556456, поданной 7 ноября 2011 года; и временной заявки США № 61/566407, поданной 2 декабря 2011 года. Идеи указанных выше заявок включены в настоящее описание в качестве ссылок в полном объеме.
ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к конъюгатам антигенов и молекул носителей, и вакцинам, содержащим эти конъюгаты. Антигенами, главным образом, являются сахариды.
УРОВЕНЬ ТЕХНИКИ, К КОТОРОМУ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Использование конъюгации с белками-носителями для повышения иммуногенности сахаридных антигенов хорошо известно [например, рассмотрено в ссылках 1-9 и т.д.] и ее применяют, в частности, для детских вакцин [10]. Тремя широко используемыми белками-носителями в современных вакцинах являются столбнячный токсоид (TT), дифтерийный токсоид (DT) и вариант дифтерийного токсоида CRM197. Эти белки используют в качестве носителей для различных сахаридов, в частности, менингококковых капсулярных сахаридов (см., например, использование TT в качестве носителя для сахаридов, происходящих из серогрупп N.meningitidis A, C, W135 и Y в ссылке 11; и DT и CRM197 в качестве носителей для тех же сахаридов в ссылках 12 и 13 соответственно). Появилась обеспокоенность в отношении чрезмерного использования этих белков-носителей в вакцинах [см., например, ссылку 14], и были предложены различные альтернативные носители (например, белок D из H.influenzae в ссылке 15). Однако многие альтернативные белки-носители не являются настолько же эффективными, как и TT, DT и/или CRM197. Таким образом, остается потребность в поиске альтернативных и/или лучших белков-носителей.
Таким образом, задачей изобретения является предоставление дополнительных или лучших белков-носителей, в частности, белков-носителей для менингококковых капсулярных сахаридов. Белки-носители можно использовать в конъюгатах для индукции защитных и/или терапевтических иммунных ответов против инфекций или лекарственных средств.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Авторы изобретения открыли, что белки, содержащие два конкретных антигена Streptococcus pneumoniae, антиген spr0096 и антиген spr2021, являются эффективными носителями. Эти носители являются универсальными и могут быть конъюгированы с различными антигенами, в частности, сахаридами, например, из патогенных организмов. Полученные конъюгаты могут быть более иммуногенными, чем конъюгаты на основе используемых в настоящее время белков-носителей, например, CRM197. Более того, они могут обеспечить более высокие уровни защитного иммунитета против патогенов, из которых происходят сахариды.
Таким образом, изобретение относится к конъюгату, содержащему антиген и молекулу носителя, где молекула носителя содержит антиген spr0096 и антиген spr2021. Молекула носителя, как правило, содержит антиген spr0096 и антиген spr2021 в качестве одной полипептидной цепи (ʺгибридныйʺ полипептид). Как правило, антиген представляет собой сахарид. Сахарид может представлять собой любой сахарид, в частности, сахарид из патогенного организма. Например, сахарид может представлять собой капсулярный сахарид из N.meningitidis, глюкан или капсулярный сахарид из S.pneumoniae. Когда сахарид представляет собой капсулярный сахарид из N.meningitidis, он, как правило, происходит из одной из следующих серогрупп менингококков: A, C, W135 и Y. Когда сахарид представляет собой глюкан, он, как правило, представляет собой ламинарин. Когда сахарид представляет собой капсулярный сахарид из S.pneumoniae, он, как правило, происходит из одного из следующих серотипов пневмококков: 1, 2, 3, 4, 5, 6A, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F и 33F. Однако в некоторых вариантах осуществления сахарид не является капсулярным сахаридом из S.pneumoniae.
Настоящее изобретение также относится к фармацевтическим композициям, содержащим конъюгат по изобретению в комбинации с фармацевтически приемлемым носителем.
Кроме того, настоящее изобретение относится к способам индукции иммунного ответа у млекопитающего, включающим введение конъюгата или фармацевтической композиции по изобретению млекопитающему.
Кроме того, настоящее изобретение относится к молекулам носителей, которые модифицированы так, чтобы они включали неприродные аминокислоты.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1 представлены повторяющиеся элементы репрезентативных бактериальных сахаридов для применения в рамках изобретения.
На фиг. 2 сравнивается иммуногенность ламинарина, конъюгированного с различными пневмококковыми белками, и эталонного носителя CRM197.
На фиг. 3 сравнивается иммуногенность конъюгата ламинарина по изобретению и эталонного конъюгата CRM197.
На фиг. 4 сравнивается иммуногенность различных конъюгатов пневмококковых и менингококковых сахаридов по изобретению и эталонных конъюгатов CRM197.
На фиг. 5 сравнивается иммуногенность пневмококкового конъюгата по изобретению с эталонным конъюгатом CRM197.
На фиг. 6 сравниваются эффекты пневмококкового конъюгата по изобретению и эталонного конъюгата CRM197 в модели защитного иммунитета против пневмококковой инфекции серотипа 5.
На фиг. 7 сравниваются эффекты пневмококкового конъюгата по изобретению, эталонного конъюгата CRM197, и пневмококкового сахарида и носителя отдельно и вместе, в модели защитного иммунитета против пневмококковой инфекции серотипа 5.
На фиг. 8-10 сравнивается иммуногенность менингококкового конъюгата серогруппы A по изобретению и эталонного конъюгата CRM197, отдельно и в комбинации с другими менингококковыми конъюгатами. На фиг. 9 и 10 над каждым столбцом приведены титры SBA.
На фиг. 11 сравнивается иммуногенность менингококкового конъюгата серогруппы C по изобретению и эталонного конъюгата CRM197, отдельно и в комбинации с другими менингококковыми конъюгатами.
На фиг. 12 сравнивается иммуногенность менингококкового конъюгата серогруппы W135 по изобретению и эталонного конъюгата CRM197, отдельно и в комбинации с другими менингококковыми конъюгатами.
На фиг. 13 сравнивается иммуногенность менингококкового конъюгата серогруппы Y по изобретению и эталонного конъюгата CRM197, отдельно и в комбинации с другими менингококковыми конъюгатами.
На фиг. 14 сравнивается иммуногенность менингококкового конъюгата серогруппы C по изобретению и эталонного конъюгата CRM197 и конъюгата spr1416.
На фиг. 15 сравнивается T-клеточный ответ на менингококковый конъюгат серогруппы C по изобретению и эталонный конъюгат CRM197 и конъюгат spr1416.
На фиг. 16 представлена кривая масс-спектрометрии для носителя по изобретению, экспрессированного в клетке-хозяине так, чтобы остатки 1-гомоаллилглицина были включены в белок в положениях, обычно содержащих метионин (SEQ ID NO: 20 против SEQ ID NO: 9).
На фиг. 17 сравнивается иммуногенность менингококкового конъюгата серогруппы A по изобретению и эталонных конъюгатов CRM197, отдельно и в комбинации с другими менингококковыми конъюгатами.
На фиг. 18 сравнивается иммуногенность других менингококковых конъюгатов в исследовании согласно фиг. 17.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение относится к конъюгату, содержащему антиген и молекулу носителя, где молекула носителя содержит антиген spr0096 и антиген spr2021. Признаки этого конъюгата подробно описаны ниже.
Изобретение также относится к молекулам носителей, которые модифицированы так, чтобы они включали неприродные аминокислоты. Иллюстративные модификации и белки носителей также подробно описаны ниже.
Молекула носителя
Молекула носителя содержит антиген spr0096 и антиген spr2021. Как правило, молекула носителя содержит антиген spr0096 и антиген spr2021 в качестве единой полипептидной цепи (ʺгибридныйʺ полипептид).
Антиген spr0096
Исходная последовательность полипептида ʺspr0096ʺ описана в ссылке 16 в качестве ʺгипотетического белкаʺ (см. GI:15902140). Для информации, аминокислотная последовательность полноразмерного spr0096, встречающегося в штамме R6, приведена в настоящем описании в качестве SEQ ID NO: 1.
Антиген spr0096 по изобретению содержит по меньшей мере один CD4+ T-клеточный эпитоп. CD4+ T-клетки помогают B-лимфоцитам продуцировать антитела против антигенов [17]. T-клеточные эпитопы можно идентифицировать эмпирически (например, с использованием PEPSCAN [18, 19] или сходных способов), или их можно предсказывать (например, с использованием антигенного индекса Jameson-Wolf [20], подходов на основе матрицы [21], TEPITOPE [22], нейронных сетей [23], OptiMer & EpiMer [24,25], ADEPT [26], Tsites [27], гидрофильности [28], антигенного индекса [29] или способов, описанных в ссылке 30, и т.д.).
Предпочтительные антигены spr0096 для применения в рамках настоящего изобретения включают аминокислотную последовательность: (a) имеющую 50% или более идентичность (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 1; и/или (b) содержащую фрагмент по меньшей мере ʺnʺ последовательно расположенных аминокислот SEQ ID NO: 1, где ʺnʺ равно 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Эти полипептиды spr0096 включают варианты SEQ ID NO: 1 (например, SEQ ID NO: 2; см. ниже). Предпочтительные фрагменты (b) содержат по меньшей мере один CD4+ T-клеточный эпитоп из SEQ ID NO: 1. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) на C-конце и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) на N-конце SEQ ID NO: 1 при сохранении по меньшей мере одного CD4+ T-клеточного эпитопа SEQ ID NO: 1. В других фрагментах отсутствуют один или несколько белковых доменов. Одним пригодным фрагментом является SEQ ID NO: 14, в котором отсутствует последовательность природного лидерного пептида. Антиген spr0096 может состоять из одного CD4+ T-клеточного эпитопа из SEQ ID NO: 1.
Форма варианта spr0096 с вставкой вблизи его C-конца относительно SEQ ID NO: 1 в настоящем описании представлена как SEQ ID NO: 2. Использование этого варианта для иммунизации описано в ссылке 31 (SEQ ID NO: 150 в указанном документе), где она описана как домен белка LysM. Таким образом, антиген spr0096 для применения в рамках настоящего изобретения может содержать аминокислотную последовательность: (a) имеющую 50% или более идентичность (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 2; и/или (b) содержащую фрагмент из по меньшей мере ʺnʺ последовательно расположенных аминокислот SEQ ID NO: 2, где ʺnʺ равно 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Эти полипептиды включают варианты SEQ ID NO: 2. Предпочтительные фрагменты (b) включают по меньшей мере один CD4+ T-клеточный эпитоп из SEQ ID NO: 2. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) на C-конце и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) на N-конце SEQ ID NO: 2 при сохранении по меньшей мере одного CD4+ T-клеточного эпитопа SEQ ID NO: 2. В других фрагментах отсутствуют один или несколько белковых доменов. Одним подходящим фрагментом является SEQ ID NO: 15, в котором отсутствует последовательность природного лидерного пептида. Иммуногенные фрагменты SEQ ID NO: 2 идентифицированы в таблице 1 ссылки 31. Антиген spr0096 может состоять из одного CD4+ T-клеточного эпитопа из SEQ ID NO: 2.
Антиген spr0096 можно использовать в форме димера, например, гомодимера.
Антиген spr2021
Исходная полипептидная последовательность ʺspr2021ʺ описана в ссылке 16 в качестве ʺобщего стрессорного белка GSP-781ʺ (см. GI:15904062). Для информации, аминокислотная последовательность полноразмерного spr2021, встречающегося в штамме R6, приведена в настоящем описании в качестве SEQ ID NO: 3.
Антиген spr2021 по изобретению содержит по меньшей мере один CD4+ T-клеточный эпитоп.
Предпочтительные антигены spr2021 для применения в рамках изобретения содержат аминокислотную последовательность: (a) имеющую 50% или более идентичность (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 3; и/или (b) содержащую фрагмент из по меньшей мере ʺnʺ последовательно расположенных аминокислот SEQ ID NO: 3, где ʺnʺ равно 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Эти полипептиды spr2021 включают варианты SEQ ID NO: 3. Предпочтительные фрагменты (b) содержат по меньшей мере один CD4+ T-клеточный эпитоп из SEQ ID NO: 3. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) на C-конце и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) на N-конце SEQ ID NO: 3 при сохранении по меньшей мере одного CD4+ T-клеточного эпитопа SEQ ID NO: 3. В других фрагментах отсутствуют один или несколько белковых доменов. Одним пригодным фрагментом является SEQ ID NO: 4, в которой отсутствует последовательность природного лидерного пептида. Антиген spr0096 может состоять из одного CD4+ T-клеточного эпитопа из SEQ ID NO: 3.
В ссылке 31 описан spr2021 в качестве секретируемого белка массой 45 кДа, имеющего гомологию с GbpB, и описано его применение в качестве иммуногена (SEQ ID NO: 243 в указанном документе; SP2216). Иммуногенные фрагменты spr2021 указаны в таблице 1 ссылки 31 (стр.73). Другой пригодный фрагмент spr2021 описан в качестве SEQ ID NO: 1 в ссылке 32 (аминокислоты 28-278 SEQ ID NO: 3 в настоящем описании).
Гибридный полипептид
Как правило, антиген spr0096 и антиген spr2021 экспрессируются в качестве одной полипептидной цепи (ʺгибридныйʺ полипептид). Гибридные полипептиды могут быть представлены формулой NH2-A-{-X-L-}n-B-COOH, где: A представляет собой необязательную N-концевую аминокислотную последовательность; B представляет собой необязательную C-концевую аминокислотную последовательность; n представляет собой целое число, равное 2 или более (например, 2, 3, 4, 5, 6 и т.д.); каждый X представляет собой аминокислотную последовательность антигена spr0096 или антигена spr2021 (как описано выше), где по меньшей мере один X представляет собой антиген spr0096 и по меньшей мере один X представляет собой антиген spr2021; и L представляет собой необязательную линкерную аминокислотную последовательность. Обычно n равно 2. Когда n равно 2, X1 обычно представляет собой антиген spr0096 и X2 обычно представляет собой антиген spr2021. Когда n составляет более 2, каждый антиген spr0096 (когда присутствует более одного антигена) может быть таким же или отличающимся и каждый антиген spr2021 (когда присутствует более одного антигена) может быть таким же или отличающимся.
Антиген spr0096 или антиген spr2021, который представляет собой аминокислотную последовательность каждого X, является таким, как определено выше. Когда эти антигены определены как (a) имеющие 50% или более идентичность (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с данной последовательностью; и/или (b) содержащие фрагмент из по меньшей мере ʺnʺ последовательно расположенных аминокислот данной последовательности, где ʺnʺ равно 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более), уровень идентичности в (a) и величина ʺnʺ в (b) могут быть одинаковыми для каждого X.
Лидерная пептидная последовательность в форме дикого типа каждой части -X- может быть включена или может отсутствовать в гибридном белке. В некоторых вариантах осуществления лидерные пептиды удалены, за исключением лидерных пептидов части -X-, расположенной на N-конце гибридного белка, т.е. лидерный пептид X1 сохранен, однако лидерные пептид X2 … Xn отсутствуют. Это эквивалентно удалению всех лидерных пептидов и использованию лидерного пептида X1 в качестве части -A-.
Для каждого из n случаев {-X-L-}, линкерная аминокислотная последовательность -L- может присутствовать или отсутствовать. Например, когда n=2, гибрид может представлять собой NH2-X1-L1-X2-L2-COOH, NH2-X1-X2-COOH, NH2-X1-L1-X2-COOH, NH2-X1-X2-L2-COOH и т.д. Линкерная аминокислотная последовательность(и) -L-, как правило, является короткой (например, 20 или меньше аминокислот, т.е. 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1). Примеры включают короткие пептидные последовательности, которые облегчают клонирование, полиглициновые линкеры (т.е. содержащие Glyn, где n=2, 3, 4, 5, 6, 7, 8, 9, 10 или более) и гистидиновые метки (т.е. Hisn, где n=3, 4, 5, 6, 7, 8, 9, 10 или более). Другие подходящие линкерные аминокислотные последовательности будут понятны специалистам в данной области. Пригодным линкером является GSGGGG (SEQ ID NO:5) или GSGSGGGG (SEQ ID NO:6), причем дипептид Gly-Ser образован участком рестрикции BamHI, таким образом, способствуя клонированию и манипулированию, и тетрапептид (Gly)4 является типичным полиглициновым линкером. Другие подходящие линкеры, в частности, для применения в качестве конечного Ln представляют собой дипептид Leu-Glu или SEQ ID NO: 7.
-A- представляет собой необязательную N-концевую аминокислотную последовательность. Она, как правило, является короткой (например, 40 или менее аминокислот, т.е. 40, 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1). Примеры включают лидерные последовательности для регуляции транспорта белка или короткие пептидные последовательности, которые облегчают клонирование и очистку (например, гистидиновые метки, т.е. Hisn, где n=3, 4, 5, 6, 7, 8, 9, 10 или более). Другие подходящие N-концевые аминокислотные последовательности будут понятны специалистам в данной области. Если X1 лишен его собственного N-концевого метионина, -A- предпочтительно представляет собой олигопептид (например, с 1, 2, 3, 4, 5, 6, 7 или 8 аминокислотами), который обеспечивает N-концевой метионин, например, Met-Ala-Ser, или единичный остаток Met.
-B- представляет собой необязательную C-концевую аминокислотную последовательность. Она, как правило, является короткой (например, 40 или менее аминокислот, т.е. 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1). Примеры включают последовательности для регуляции транспорта белка, короткие пептидные последовательности, которые облегчают клонирование или очистку (например, содержащие гистидиновые метки, т.е. Hisn, где n=3, 4, 5, 6, 7, 8, 9, 10 или более, такие как SEQ ID NO: 8), или последовательности, которые повышают стабильность белка. Другие подходящие C-концевые аминокислотные последовательности будут понятны специалистам в данной области.
Примеры гибридов включают полипептиды, которые содержат аминокислотную последовательность spr0096-spr2021 (например, SEQ ID NO: 9) или spr2021-spr0096 (например, SEQ ID NO: 10). Гибрид также может содержать аминокислотную последовательность, имеющую 50% или более идентичность (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 9 или 10. Как правило, гибрид содержит аминокислотную последовательность SEQ ID NO: 9. Гибрид также может содержать аминокислотную последовательность, имеющую 50% или более идентичность (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 9.
В конкретных вариантах осуществления молекула носителя содержит (a) один или несколько (например, 1, 2, 3, 4, 5 и т.д.) CD4+ T-клеточных эпитопов из SEQ ID NO: 2; и (b) один или несколько (например, 1, 2, 3, 4, 5 и т.д.) CD4+ T-клеточных эпитопов из SEQ ID NO: 3.
Молекулы носителей, модифицированные так, чтобы они включали неприродные аминокислоты
Также изобретение относится к молекулам носителей, модифицированным так, чтобы они включали неприродные аминокислоты. Неприродную аминокислоту можно использовать для конъюгации молекулы носителя с другой молекулой.
В некоторых альтернативах молекула носителя содержит одну или несколько (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 и т.д.) неприродных аминокислот. Неприродная аминокислота может иметь функциональную группу с реакционным профилем, который отличается от реакционного профиля функциональных групп, доступных для реакции в белках, состоящих из канонических аминокислот (например, аминогруппа лизина или сульфгидрильная группа цистеина). Это, в свою очередь, означает, что хемоселективные реакции позволяют проведение сайт-селективной конъюгации в заданных участках, где в белок включена неприродная аминокислота.
В конкретных вариантах осуществления молекула носителя содержит один или несколько остатков L-гомоаллилглицина (HAG). Как правило, остатки HAG замещают остатки метионина в последовательности. HAG, химически известная как L-2-амино-5-гексановая кислота, является аналогом метионина и содержит реакционноспособный алкеновый участок. HAG может заменять метионин на стадиях как инициации, так и элонгации, синтеза белка. HAG имеет олефиновую боковую цепь, которая имеет отличающийся реакционный профиль относительно функциональных групп, встречающихся в канонических аминокислотах, реагирующую через тиил-еновый механизм.
В других вариантах осуществления молекула носителя может быть модифицирована включением других неприродных аминокислот, которые позволяют проведение сайт-селективной конъюгации в заданных участках. Например, молекула носителя может быть модифицирована так, чтобы один или несколько (например, 1, 2, 3, 4, 5 и т.д.) остатков п-ацетилфенилаланина были включены в ее последовательность. Эта аминокислота имеет кето-функциональную группу, которая не присутствует ни в одной из канонических аминокислот, и, таким образом, аминокислота может специфически реагировать с гидразинами, алкоксиаминами и семикарбазидами в мягких водных условиях, образуя гидразоновые, оксимные и семикарбазоновые связи. Другие аминокислоты с кето-функциональными группами включают м-ацетилфенилаланин и п-бензоилфенилаланин и эти остатки можно использовать аналогичным образом.
В других вариантах осуществления молекула носителя может быть модифицирована так, чтобы она включала азидную группу (которая также не встречается в канонических аминокислотах), например путем включения одного или нескольких (например, 1, 2, 3, 4, 5 и т.д.) остатков п-азидофенилаланина. Азидная группа может реагировать с ацетиленовой группой на партнере по конъюгации в катализируемой медью (I) [2+3] реакции циклоприсоединения. Напротив, можно встроить способами инженерии в белок-носитель не встречающуюся в природе ацетиленовую группу путем включения одного или нескольких (например, 1, 2, 3, 4, 5 и т.д.) остатков п-пропаргилоксифенилаланина, которые затем можно подвергать реакции с помощью того же механизма с азидной группой на партнере по конъюгации.
В следующих вариантах осуществления молекула носителя может быть модифицирована так, чтобы она включала один или несколько (например, 1, 2, 3, 4, 5 и т.д.) остатков фенилселеноцистеина. Обработка этого остатка пероксидом водорода позволяет его конъюгацию с тиольными группами.
В иллюстративных модифицированных молекулах носителей по изобретению антиген spr0096 может содержать аминокислотную последовательность: (a) имеющую 50% или более идентичность (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 1; и/или (b) содержащую фрагмент по меньшей мере из ʺnʺ последовательно расположенных аминокислот SEQ ID NO: 1, где ʺnʺ равно 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более), где один или несколько остатков метионина в полипептиде заменен на HAG. Например, молекула носителя может иметь последовательность, указанную в SEQ ID NO: 16.
Форма варианта spr0096 с вставкой вблизи его C-конца относительно SEQ ID NO: 1, представлена как SEQ ID NO: 2 в настоящем описании. Таким образом, антиген spr0096 для применения в рамках изобретения может содержать аминокислотную последовательность: (a) имеющую 50% или более идентичность (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 2; и/или (b) содержащую фрагмент из по меньшей мере ʺnʺ последовательно расположенных аминокислот SEQ ID NO: 2, где ʺnʺ равно 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более), где один или несколько остатков метионина в полипептиде заменен на HAG. Например, молекула носителя может иметь последовательность, указанную в SEQ ID NO: 17. В другом или тех же примерах модифицированных молекул носителей по изобретению антиген spr2021 может содержать аминокислотную последовательность: (a) имеющую 50% или более идентичность (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 3; и/или (b) содержащую фрагмент из по меньшей мере ʺnʺ последовательно расположенных аминокислот SEQ ID NO: 3, где ʺnʺ равно 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более), где один или несколько из остатков метионина в полипептиде заменен на HAG. В некоторых вариантах осуществления два или более, три или более, или четыре или более из остатков метионина остатки в полипептиде заменены на HAG. Например, молекула носителя может иметь последовательность, указанную в SEQ ID NO: 18.
Форма варианта spr2021 представляет собой SEQ ID NO: 4, в которой отсутствует природная лидерная пептидная последовательность. Таким образом, антиген spr2021 для применения в рамках изобретения может содержать аминокислотную последовательность: (a) имеющую 50% или более идентичность (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 4; и/или (b) содержащую фрагмент из по меньшей мере ʺnʺ последовательно расположенных аминокислот SEQ ID NO: 4, где ʺnʺ равно 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более), где один или несколько из остатков метионина в полипептиде заменены на HAG. Например, молекула носителя может иметь последовательность, указанную в SEQ ID NO: 19.
Следующие примеры модифицированных молекул носителя включают гибридные полипептиды, как определено выше, где один или несколько из остатков метионина в полипептиде заменен на HAG. Например, гибридный полипептид может содержать аминокислотную последовательность spr0096-spr2021 (например, SEQ ID NO: 9) или spr2021-spr0096 (например, SEQ ID NO: 10), или аминокислотную последовательность, имеющую 50% или более идентичность (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 9 или 10, где один или несколько из остатков метионина в полипептиде заменен на HAG. В некоторых вариантах осуществления два или более, или три или более остатков метионина в полипептиде заменены на HAG. Например, молекула носителя может иметь последовательность, указанную в SEQ ID NO: 20 или 21. В конкретных вариантах осуществления молекула носителя содержит (a) один или несколько (например, 1, 2, 3, 4, 5 и т.д.) CD4+ T-клеточных эпитопов из SEQ ID NO: 2; и/или (b) один или несколько (например, 1, 2, 3, 4, 5 и т.д.) CD4+ T-клеточных эпитопов из SEQ ID NO: 3.
Эти способы также можно использовать для других известных неприродных аминокислот, и, кроме того, для других молекул носителей. Таким образом, в описанных выше вариантах осуществления молекула носителя может представлять собой любую из этих других молекул носителей. Предпочтительные молекулы носителей включают бактериальные токсины, такие как дифтерийные или столбнячные токсины или токсоиды, или их мутанты. Их часто используют в вакцинах на основе конъюгатов. Мутант дифтерийного токсина CRM197 является особенно предпочтительным [33]. Также можно использовать фрагмент C столбнячного токсоида [34]. Другие молекулы носителей включают антигены, такие как spr0096 или spr2021, как описано выше. Следующие пригодные молекулы носителей включают комплекс белков наружной мембраны N.meningitidis [35], синтетические пептиды [36, 37], белки теплового шока [38, 39], коклюшные белки [40, 41], цитокины [42], лимфокины [150], гормоны [150], факторы роста [150], искусственные белки, содержащие множество CD4+ T-клеточных эпитопов человека из различных происходящих из патогенов антигенов [43], таких как N19 [44], белок D из H.influenzae [45-47], пневмолизин [48] или его нетоксичные производные [49], пневмококковый поверхностный белок PspA [50], осуществляющие захват железа белки [51], токсин A или B из C.difficile [52], рекомбинантный экзобелок A Pseudomonas aeruginosa (rEPA) [53] и т.д.
Антиген
Антиген, как правило, представляет собой сахарид. Когда антиген представляет собой сахарид, сахарид может представлять собой любой сахарид, в частности, сахарид из патогенного организма. Иллюстративные сахариды для применения в рамках изобретения описаны ниже. В частности, сахарид может представлять собой бактериальный сахарид, например, бактериальный капсулярный сахарид. Репрезентативные бактериальные сахариды представлены на фиг.1.
Сахариды можно использовать в форме олигосахаридов. Их удобным образом получают путем фрагментации очищенного полисахарида (например, гидролизом), после которой обычно следует очистка фрагментов желаемого размера. Сахариды можно очищать из природных источников. В качестве альтернативы очистке сахариды можно получать посредством полного или частичного синтеза.
Когда антиген не является сахаридом, он может представлять собой любой другой антиген, т.е. любой иммуноген или гаптен. Конъюгаты по изобретению могут индуцировать иммунный ответ против гаптена, конъюгированного с молекулой носителя. Гаптен может представлять собой, например, лекарственное средство, вызывающее злоупотребление [54]. Примеры включают, но не ограничиваются ими, опиаты, марихуану, амфетамины, кокаин, барбитураты, глутетимид, метиприлон, хлоралгидрат, метаквалон, бензодиазепины, LSD, никотин, антихолинергические лекарственные средства, антипсихотические лекарственные средства, триптамин, другие психомиметические лекарственные средства, седативные средства, фенциклидин, псилоцибин, летучий нитрит и другие лекарственные средства, индуцирующие физическую и/или психологическую зависимость.
Капсулярные сахариды N.meningitidis
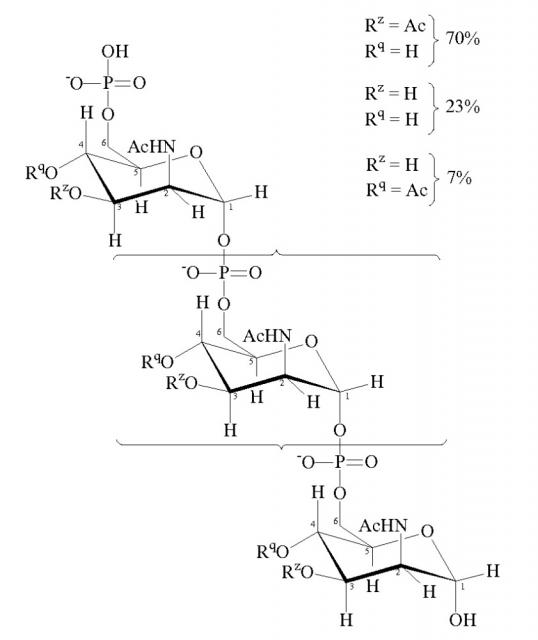
Сахарид может представлять собой бактериальный капсулярный сахарид. Иллюстративные бактериальные капсулярные сахариды включают сахариды из N.meningitidis. На основе капсулярного полисахарида организмов идентифицированы различные серогруппы N.meningitidis, включая A, B, C, H, I, K, L, 29E, W135, X, Y и Z. Сахарид в рамках изобретения может происходить из любой из этих серогрупп. Как правило, сахарид происходит из одной из следующих серогрупп менингококков: A, C, W135 и Y.
Капсулярные сахариды обычно используют в форме олигосахаридов. Их удобно получать фрагментацией очищенного капсулярного полисахарида (например, посредством гидролиза), после чего обычно следует очистка фрагментов желаемого размера.
Фрагментацию полисахаридов, как правило, проводят до конечной средней степени полимеризации (DP) в олигосахариде менее 30 (например, от 10 до 20, предпочтительно около 10 для серогруппы A; от 15 до 25 для серогрупп W135 и Y, предпочтительно около 15-20; от 12 до 22 для серогруппы C и т.д.). DP можно удобным образом измерять посредством ионообменной хроматографии или колориметрических анализов [55].
Если проводят гидролиз, гидролизат обычно разделяют по размеру для удаления коротких олигосахаридов [56]. Это можно осуществлять различными путями, такими как ультрафильтрация с последующей ионообменной хроматографией. Олигосахариды со степенью полимеризации, меньшей или равной приблизительно 6, предпочтительно удаляют в случае серогруппы A, и олисахариды со степенью полимеризации, меньшей чем приблизительно 4, предпочтительно удаляют в случае серогрупп W135 и Y.
Химический гидролиз сахаридов обычно вовлекает обработку либо кислотой, либо основанием, в условиях, которые являются стандартными в данной области. Условия для деполимеризации капсулярных сахаридов до составляющих их моносахаридов известны в данной области. Один из способов деполимеризации вовлекает использование пероксида водорода [57]. Пероксид водорода добавляют к сахариду (например, до конечной концентрации H2O2 1%), а затем смесь инкубируют (например, при приблизительно 55єC) до тех пор, пока не достигнут желаемого уменьшения длины цепи. Наблюдение за уменьшением с течением времени можно проводить путем извлечения образцов из смеси, а затем измерения (среднего) размера молекул сахарида в образце. Затем после достижения желаемой длины цепи деполимеризацию можно останавливать быстрым охлаждением.
Серогруппы C, W135 и Y
Способы получения капсулярных полисахаридов из менингококков известны уже много лет и, как правило, вовлекают процесс, включающий стадии преципитации полисахаридов (например, с использованием катионного детергента), фракционирование этанолом, экстракции холодным фенолом (для удаления белка) и ультрацентрифугирования (для удаления LPS) [например, см. ссылку 58].
Более предпочтительный способ [59] вовлекает преципитацию полисахаридов с последующей солюбилизацией преципитированного полисахарида с использованием низшего спирта. Преципитацию можно осуществлять с использованием катионного детергента, такого как тетрабутиламмоний и соли цитилтриметиламмония (например, бромидные соли), или бромид гексадиметрина и соли миристилтриметиламмония. Бромид цетилтриметиламмония (ʺCTABʺ) является особенно предпочтительным [60]. Солюбилизацию преципитированного материала можно осуществлять с использованием низшего спирта, такого как метанол, пропан-1-ол, пропан-2-ол, бутан-1-ол, бутан-2-ол, 2-метилпропан-1-ол, 2-метилпропан-2-ол, диолы и т.д., однако этанол является особенно пригодным для солюбилизации комплексов CTAB-полисахарид. Этанол можно добавлять к преципитированному полисахариду до конечной концентрации этанола (на основе общего содержания этанола и воды) от 50% до 95%.
После повторной солюбилизации полисахарид можно далее обрабатывать для удаления примесей. Это является особенно важным в ситуациях, когда даже незначительное загрязнение неприемлемо (например, для продуцирования вакцин для человека). Это, как правило, вовлекает одну или несколько стадий фильтрации, например, можно использовать глубинную фильтрацию, фильтрацию через активированный уголь, фильтрацию по размеру и/или ультрафильтрацию.
После фильтрации для удаления примесей полисахарид можно преципитировать для дальнейшей обработки и/или переработки. Это удобно осуществлять путем катионного обмена (например, путем добавления солей кальция или натрия).
После очистки капсулярные сахариды конъюгируют с белками-носителями, как описано ниже.
Следующие и альтернативные способы очистки и конъюгации менингококковых сахаридов описаны в ссылках 57 и 61.
В качестве альтернативы очистке капсулярные сахариды по настоящему изобретению можно получать посредством полного или частичного синтеза, например, синтез Hib описан в ссылке 62, и синтез MenA описан в ссылке 63.
Сахарид может быть химически модифицированным, например, он может быть O-ацетилированным или де-O-ацетилированным. Любое такое де-O-ацетилирование или гиперацетилирование может быть осуществлено в конкретных положениях в сахариде. Например, большинство штаммов серогруппы C имеют O-ацетильные группы в положении C-7 и/или C-8 остатков сиаловой кислоты, но приблизительно 15% клинических изолятов лишены этих O-ацетильных групп [64, 65]. Ацетилирование, по-видимому, не влияет на эффективность защиты (например, в отличие от продукта MenjugateTM, в продукте NeisVac-CTM используется де-O-ацетилированный сахарид, но обе вакцины являются эффективными). Сахарид серогруппы W135 представляет собой полимер дисахаридных элементов сиаловая кислота-галактоза. Сахарид серогруппы Y сходен с сахаридом серогруппы W135 за исключением того, что дисахаридный повторяющийся элемент включает глюкозу вместо галактозы. Подобно сахаридам серогруппы C, сахариды MenW135 и MenY имеют вариабельное O-ацетилирование, но в положениях сиаловой кислоты 7 и 9 [66]. Любые такие химические модификации предпочтительно осуществляют до конъюгации, однако альтернативно или дополнительно их осуществляют в процессе конъюгации.
Сахариды из различных серогрупп предпочтительно очищают по отдельности, а затем комбинируют, либо до, либо после конъюгации.
Серогруппа A
Конъюгаты по изобретению могут включать антиген капсулярного сахарида серогруппы A. Сахарид можно очищать и конъюгировать аналогично тому, как и для серогрупп C, W135 и Y (см. выше), хотя он структурно отличается – в то время как капсулы серогрупп C, W135 и Y основаны на сиаловой кислоте (N-ацетилнейраминовая кислота, NeuAc), капсула серогруппы A основана на N-ацетилманнозамине, который является природным предшественником сиаловой кислоты. Сахарид серогруппы A является особенно чувствительным к гидролизу и его нестабильность в водной среде означает, что (a) иммуногенность жидких вакцин в отношении серогруппы A снижается с течением времени, и (b) контроль качества является более трудным вследствие высвобождения продукта гидролиза сахарида в вакцину.
Нативный капсулярный сахарид MenA представляет собой гомополимер (α1→6)-связанного N-ацетил-D-маннозамин-1-фосфата с