Способ получения соединений тиенопиримидина
Иллюстрации
Показать всеИзобретение относится к способу получения (S)-1-(4-((2-(2-аминoпиpимидин-5-ил)-7-мeтил-4-мopфoлинoтиeнo[3,2-d]пиpимидин-6-ил)мeтил)пипepaзин-1-ил)-2-гидpoкcипpoпaн-1-она, имеющего структуру:
,
а также к новому промежуточному соединению оксалату (S)-2-гидрокси-1-(пиперазин-1-ил)пропан-1-она, имеющему следующую структуру:
Технический результат: разработан новый способ получения (S)-1-(4-((2-(2-аминoпиpимидин-5-ил)-7-мeтил-4-мopфoлинoтиeнo[3,2-d]пиpимидин-6-ил)мeтил)пипepaзин-1-ил)-2-гидpoкcипpoпaн-1-она, являющегося двойным ингибитором mTOR/PI3K GDC-0980. 2 н. и 14 з.п. ф-лы, 1 табл., 18 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ Данная заявка является не предварительной заявкой, которая подана в соответствии с 37 CFR §1.53 (b), и в соответствии с 35 USC §119(e) испрашивает приоритет предварительной заявки США номер 61/711900, поданной 10 октября 2012 года, которая включена в настоящий документ посредством ссылки в полном объеме.
ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к способам получения соединения GDC-0980, являющегося ингибитором PI3K.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Фосфоинозитид 3-киназы (PI3K) представляют собой киназы липидов, которые фосфорилируют липиды по 3-гидроксильному остатку кольца инозита (Whitman et al (1988) Nature, 332: 664). 3-фосфорилированные фосфолипиды (PIP3), образуемые PI3-киназами, действуют как вторичные посредники, привлекая киназы со связывающими липиды доменами (включая гомологичные плекстрину (РН) районы), такие как Akt и фосфоинозитид-зависимая киназа-1 (PDK1). Связывание Akt с мембранными PIP3 вызывает перемещение Akt на плазматическую мембрану, в результате чего Akt контактирует с PDK1, который отвечает за активацию Akt. Опухоль-супрессорная фосфатаза PTEN дефосфорилирует PIP3 и, следовательно, действует как негативный регулятор активации Akt. PI3-киназы Akt и PDK1 играют важную роль в регуляции многих клеточных процессов, включая регуляцию клеточного цикла, пролиферацию, выживание, апоптоз и подвижность клеток, и являются значимыми компонентами молекулярных механизмов таких заболеваний как рак, диабет и иммунное воспаление (Vivanco et al (2002) Nature Rev. Cancer 2: 489; Phillips et al (1998) Cancer 83: 41).
Наиболее важной изоформой PI3-киназ при раке является PI3-киназа класса I, р110α (альфа) (US 5824492; US 5846824; US 6274327). Другие изоформы вовлечены в сердечно-сосудистые и иммунно-воспалительные заболевания (Workman Р (2004) Biochem Soc Trans 32: 393-396; Patel et al (2004) Proceedings of the American Association of Cancer Research (Abstract LB-247) 95th Annual Meeting, March 27-31, Orlando, Florida, USA; Ahmadi K and Waterfield MD (2004) Encyclopedia of Biological Chemistry (Lennarz W J, Lane M D eds) Elsevier/Academic Press). Путь PI3 киназа/Akt/PTEN является привлекательной мишенью для разработки лекарств против рака, так как, как ожидается, такие модулирующие или ингибирующие агенты будут способны ингибировать пролиферацию, устранять устойчивость к апоптозу и преодолевать устойчивость к цитотоксическим агентам раковых клеток (Folkes et al (2008) J. Med. Chem. 51: 5522-5532; Yaguchi et al (2006) Jour, of the Nat. Cancer Inst. 98(8): 545-556). Регуляция сигнального пути PI3K-PTEN-AKT нарушена при самых разнообразных видах рака (Samuels Y, Wang Z, Bardellil A et al. High frequency of mutations of the PIK3CA gene in human cancers. (2004) Science; 304 (5670): 554; Carpten J, Faber AL, Horn C. "A transforming mutation in the pleckstrin homology domain of AKT1 in cancer" (2007) Nature; 448: 439-444).
GDC-0980 (Genentech, Inc., Roche, RG-7422) демонстрирует активность в широком спектре доклинических моделей ксенотрансплантатов рака, включая рак молочной железы, яичников, легких и предстательной железы, и в настоящее время ведутся исследования данного соединения в качестве потенциального перорального лекарственного средства для лечения рака, включая солидные опухоли и неходжкинскую лимфому (Wagner AJ; Burris III НА; de Bono JS et al AACR-NCI-EORTC International Congress (2009), 21st: November 17 (Abs B137) "Pharmacokinetics and Pharmacodynamic biomarkers for the dual PI3K/mTOR inhibitor GDC-0980: initial phase I evaluation"; US 7888352; US 2009/0098135; US 2010/0233164). В марте 2009 года было начато исследование I фазы на пациентах с солидными опухолями или NHL; в апреле 2009 года было начато второе исследование I фазы; эти исследования продолжались в апреле 2010 г. В декабре 2010 г. было начато исследование фазы 1b комбинированного лечения метастатического рака молочной железы. В июле 2010 года исследование II фазы лечения метастатического рака молочной железы было запланировано провести в первой половине 2011 года; пациенты должны были получать GDC-0980 в комбинации с гормональной терапией. Клинические результаты на сегодняшний день показывают, что GDC-0980 может принести пользу пациентам с солидными опухолями или гематологическими злокачественными новообразованиями (Sutherlin DP, Belvin М, Bao L et al, American Association for Cancer Research Annual Meeting, (2011) 102nd: April 04 (Abs 2787)).
GDC-0980 является мощным селективным пероральным ингибитором PI3K класса I и киназы mTOR, который характеризуется следующими значениями IC50 против изоформ PI3K класса I, измеренными биохимическими методами in vivo: р110а (альфа) - 4,8 нМ; р110β (бета) - 26,8 нМ; р110 (гамма) - 13,8 нм; p110d (дельта) - 6,7 нМ; Ki для mTOR - 17,3 нМ. GDC-0980 был селективным для PI3K по сравнению с большим набором киназ (>145), в том числе по сравнению с другими членами семейства фосфатидилинозит киназ. В клеточных линиях РСЗ и MCF7-neo/HER2 соединение продемонстрировало значения IC50, равные 307 и 320 нМ соответственно. GDC-0980 был стабилен в человеческих микросомах и гепатоцитах, проявлял низкую активность против hERG, IC50>100 μМ (мкМ) и не давал значительный ответ в анализе скрининга рецепторов (n=68; GDC-0980=10 мкМ). У грызунов и собак значения клиренса были от умеренных до высоких, 60 мл/мин/кг и 12 мл/мин/кг соответственно. Терминальный период полувыведения соединения составлял от 6 до 18 ч, значения AUC и Cmax пропорционально увеличивались с увеличением единичной пероральной дозы. GDC-0980 (от 25 до 150 мг/кг в день, перорально) был эффективен в нескольких моделях ксенотрансплантатов, в том числе в моделях ксенотрансплантатов РС3 PTEN-рака простаты и MCF7.1 E545K рака молочной железы на мышах. В модели ксенотрансплантата рака молочной железы MDA-IVIB-361.1 GDC-0980 давал значительное ингибирование роста при минимальной дозе 1,0 мг/кг в день.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к способам получения двойного ингибитора mTOR/PI3K GDC-0980, имеющего химическое название (S)-1-(4-((2-(2-аминопиримидин-5-ил)-7-метил-4-морфолинотиено[3,2-d]пиримидин-6-ил)метил)пиперазин-1-ил)-2-гидроксипропан-1-он, и имеющего структуру:
и его стереоизомеров, геометрических изомеров, таутомеров и фармацевтически приемлемых солей.
Другой аспект настоящего изобретения относится к способам получения интермедиата, 2-аминопиримидин-5-илбороновой кислоты III, который полезен для получения GDC-0980, имеющего структуру:
Другой аспект настоящего изобретения относится к новому интермедиату, оксалату (S)-2-гидрокси-1-(пиперазин-1-ил)пропан-1-она V, который полезен для получения GDC-0980, имеющему структуру:
ОПРЕДЕЛЕНИЯ
Термин "хиральный" относится к молекулам, которые обладают свойством неналожимости на свое зеркальное отображение, тогда как термин "ахиральный" относится к молекулам, которые являются наложимыми на их зеркальные отображения.
Термин "стереоизомеры" относится к соединениям, которые имеют одинаковый химический состав, но отличаются по расположению атомов или групп в пространстве.
"Диастереомер" относится к стереоизомеру с двумя или более центрами хиральности, чьи молекулы не являются зеркальным отображениями друг друга. Диастереомеры имеют различные физические свойства, например, точки плавления, точки кипения, спектральные свойства и реакционную способность. Смеси диастереомеров можно разделить с помощью аналитических процедур с высоким разрешением, таких как электрофорез и хроматография.
"Энантиомеры" относятся к двум стереоизомерам соединения, которые являются не наложимыми зеркальными отражениями друг друга.
Стереохимические определения и условные термины, используемые в настоящем документе, как правило, соответствуют S.P. Parker, Ed., McGraw-Hill Dictionary of Chemical Terms (1984) McGraw-Hill Book Company, New York; and Eliel, E. and Wilen, S., "Stereochemistry of Organic Compounds", John Wiley & Sons, Inc., New York, 1994. Соединения по изобретению могут содержать асимметричные или хиральные центры и поэтому могут существовать в различных стереоизомерных формах. Предполагается, что все стереоизомерные формы соединений по изобретению, включая, но не ограничиваясь ими, диастереомеры, энантиомеры и атропоизомеры, а также их смеси, такие как рацемические смеси, включены в настоящее изобретение. Многие органические соединения существуют в оптически активных формах, т.е. они обладают способностью вращать плоскость плоско-поляризованного света. При описании оптически активного соединения префиксы D и L или R и S используются для обозначения абсолютной конфигурации молекулы относительно ее хирального центра (центров). Префиксы d и I или (+) и (-) используются для обозначения знака вращения плоскости поляризованного света соединением, причем (-) или 1 означает, что соединение является левовращающим. Соединение с префиксом (+) или D является правовращающим. Для данной химической структуры эти стереоизомеры идентичны за исключением того, что они являются зеркальными отражениями друг друга. Конкретный стереоизомер может также называться энантиомером, и смесь таких изомеров часто называют энантиомерной смесью. Смесь энантиомеров в соотношении 50:50 называют рацемической смесью или рацематом, такая смесь может быть получена в том случае, когда в ходе химической реакции или процесса не было стереоизбирательности или стереоспецифичности. Термины "рацемическая смесь" и "рацемат" относятся к эквимолярной смеси двух энантиомеров, лишенной оптической активности.
Термин "таутомер" или "таутомерная форма" относится к структурным изомерам с различной энергией, которые являются взаимопревращаемыми за счет низкого энергетического барьера. Например, протонные таутомеры (также известные как прототропные таутомеры) осуществляют взаимопревращения за счет миграции протона, такой как процессы кето-енольной и имин-енаминной изомеризации. Валентные таутомеры включают взаимопревращения за счет реорганизации некоторых связывающих электронов.
Фраза "фармацевтически приемлемая соль" в настоящем документе относится к фармацевтически приемлемым органическим или неорганическим солям соединений настоящего изобретения. Примеры солей включают, но ими не ограничиваются ими, сульфат, цитрат, ацетат, оксалат, хлорид, бромид, иодид, нитрат, бисульфат, фосфат, кислый фосфат, изоникотинат, лактат, салицилат, кислый цитрат, тартрат, олеат, таннат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентисинат, фумарат, глюконат, глюкуронат, сахарат, формиат, бензоат, глутамат, метансульфонат "мезилат", этансульфонат, бензолсульфонат, пара-толуолсульфонат, памоат (то есть 1,1'-метилен-бис(2-гидрокси-3-нафтоат)). Фармацевтически приемлемая соль может содержать включения других молекул, таких как ионы ацетата, ионы сукцината или другие противоионы. Указанный противоион может быть любым органическим или неорганическим фрагментом, который стабилизирует заряд на исходном соединении. Кроме того, фармацевтически приемлемая соль может содержать более одного заряженного атома в своей структуре. В случаях, когда фармацевтически приемлемая соль включает несколько заряженных атомов, такая соль может иметь несколько противоионов. Следовательно, фармацевтически приемлемая соль может содержать один или более из заряженных атомов и/или один или более из противоионов.
Если соединение настоящего изобретения представляет собой основание, нужную фармацевтически приемлемую соль можно получить любым подходящим способом, известным специалистам в данной области, например обработкой свободного основания неорганической кислотой, такой как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, метансульфоновая кислота, фосфорная кислота и т.п., или органической кислотой, такой как уксусная кислота, малеиновая кислота, янтарная кислота, миндальная кислота, фумаровая кислота, гликолевая кислота, малоновая кислота, щавелевая кислота, пировиноградная кислота, салициловая кислота, пиранозидиловая кислота, такая как глюкуроновая кислота или галактуроновая кислота, альфа-гидроксикислота, такая как лимонная кислота или винная кислота, аминокислота, такая как аспарагиновая кислота или глутаминовая кислота, ароматическая кислота, такая как бензойная кислота или коричная кислота, сульфоновая кислота, такая как пара-толуолсульфоновая кислота или этансульфоновая кислота или т.п.
Если соединение настоящего изобретения представляет собой кислоту, нужную фармацевтически приемлемую соль можно получить любым подходящим способом, например, обрабатывая свободную кислоту неорганическим или органическим основанием, таким как амин (первичный, вторичный или третичный), гидроксидом щелочного металла или гидроксидом щелочноземельного металла или подобными веществами. Иллюстративные примеры подходящих солей включают, но не ограничиваются ими, органические соли, полученные из аминокислот, таких как глицин и аргинин, аммиака, первичных, вторичных и третичных аминов, циклических аминов, таких как пиперидин, морфолин и пиперазин, и неорганические соли, полученные с натрием, кальцием, калием, магнием, марганцем, железом, медью, цинком, алюминием и литием.
Термин "сольват" относится к ассоциации или комплексу молекул одного или более растворителей и соединения настоящего изобретения. Примеры растворителей, которые образуют сольваты, включают, но не ограничиваются ими, воду, изопропанол, этанол, метанол, ДМСО, этилацетат, уксусную кислоту и этаноламин. Термин "гидрат" относится к комплексу, в котором молекулой растворителя является вода.
ПОЛУЧЕНИЕ GDC-0980
Настоящее изобретение включает процессы, способы, реагенты и интермедиаты для синтеза GDC-0980, низкомолекулярного ингибитора PI3K и mTOR (CAS Reg. No. 1032754-93-0), который имеет структуру:
и может быть назван: (S)-1-(4-((2-(2-аминопиримидин-5-ил)-7-метил-4-морфолинотиено[3,2-d]пиримидин-6-ил)метил)пиперазин-1-ил)-2-гидроксипропан-1-он (US 7888352, US 2009/0098135, US 2010/0233164). В настоящем документе GDC-0980 включает все стереоизомеры, геометрические изомеры, таутомеры и их фармацевтически приемлемые соли.
Соединения по изобретению могут включать асимметричные или хиральные центры и поэтому могут существовать в различных стереоизомерных формах. Предполагается, что все стереоизомерные формы соединений по изобретению, включая, но не ограничиваясь ими, диастереомеры, энантиомеры и атропоизомеры, а также их смеси, такие как рацемические смеси, включены в настоящее изобретение. Кроме того, настоящее изобретение охватывает все геометрические изомеры и изомеры положения. Если в структурах, показанных в данном описании, не указана стереохимия любого конкретного хирального атома, то все их стереоизомеры рассматриваются и включены в качестве соединений по изобретению. Если стереохимия показана с помощью закрашенного клина или пунктирной линии, что указывает на конкретную конфигурацию, то определен и указан этот конкретный стереоизомер.
Соединения по настоящему изобретению могут существовать в несольватированных, а также в сольватированных формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и тому подобное, и предполагается, что настоящее изобретение охватывает как сольватированные, так и несольватированные формы.
Соединения по настоящему изобретению могут также существовать в различных таутомерных формах, и все такие формы охватываются объемом настоящего изобретения. Термины "таутомер" или "таутомерная форма" относятся к структурным изомерам с различной энергией, которые являются взаимопревращаемыми за счет низкого энергетического барьера. Например, протонные таутомеры (также известные под названием прототропные таутомеры) включают взаимопревращения посредством миграции протона, такие как кето-енольная и имин-енаминная изомеризация. Валентные таутомеры включают взаимопревращения путем реорганизации некоторых из связывающих электронов.
Соединения по изобретению также включают меченные изотопами соединения, которые идентичны соединениям, приведенным в настоящем документе, за исключением того, что один или более атомов замещены атомом, имеющим атомную массу или массовое число, отличающиеся от атомной массы или массового числа, встречающихся в природе. Все изотопы какого-либо конкретного атома или элемента, как указано в настоящем документе, включены в объем соединений данного изобретения и их применения. Примеры изотопов, которые могут быть включены в соединения изобретения, включают изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора, хлора и йода, такие как 2Н, 3Н, 11С, 13С, 14С, 13N, 15N, 15O, 17О, 18О, 32Р, 33P, 35S, 18F, 36Cl, 123I и 125I. Некоторые меченные изотопами соединения по настоящему изобретению (например, меченные 3Н или 14С), применимы в анализах распределения лекарственного вещества и/или субстрата в ткани. Меченные тритием (3Н) и углеродом-14 (14С) изотопы являются в особенности предпочтительными вследствие простоты их получения и обнаружения. Кроме того, замещение более тяжелыми изотопами, такими как дейтерий (т.е. 2Н), может дать определенные терапевтические преимущества вследствие большей метаболической стабильности (например, за счет увеличения периода полувыведения in vivo или уменьшения требуемых дозировок), и, следовательно, может быть предпочтительным при некоторых обстоятельствах. Излучающие позитроны изотопы, такие как 15О, 13N, 11С и 18F, полезны для исследований методом позитронно-эмиссионной томографии (ПЭТ) для изучения связывания рецептора субстратом. Меченые изотопами соединения данного изобретения могут быть обычно получены согласно процедурам, аналогичным тем, которые приведены в представленных ниже примерах, путем замещения не меченного изотопом реагента на реагент, меченный изотопом.
Исходные материалы и реагенты для получения GDC-0980, как правило, доступны из коммерческих источников, таких как Sigma-Aldrich Chemical (Милуоки, Висконсин), или могут быть легко получены с использованием способов, которые хорошо известны специалистам в данной области техники (например, получены способами, которые в общем описаны Louis F. Fieser and Mary Fieser, Reagenfs for Organic Synthesis, v. 1-19, Wiley, N.Y. (1967-1999 ed.), or Beilsteins handbuch der organischen Chemie, 4, Aufl. ed. Springer-Verlag, Berlin, включая дополнения к этим изданиям (также доступны через онлайн-базу данных Beilstein).
Следующие Схемы 1-8 иллюстрируют химические реакции, процессы, методики синтеза GDC-0980 формулы I, а также некоторые интермедиаты и реагенты. Понятно, что для достижения тех же превращений могут быть использованы другие реагенты, растворители и условия реакции, чем проиллюстрировано на Схемах 1-8.
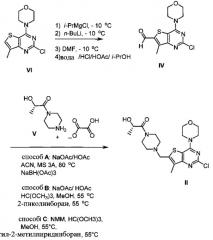
Схема 1:
Схема 1 показывает синтез интермедиата 4-(2-хлор-7-метилтиено[3,2-0]пиримидин-4-ил)морфолина VI из метил-3-амино-4-метилтиофен-2-карбоновой кислоты IX. Циклизация IX с цианатом калия в уксусной кислоте и воде давала 7-метилтиено[3,2-d]пиримидин-2,4(1Н,3Н)-дион VIII (Пример 1). Хлорирование VIII оксихлоридом фосфора в присутствии N,N-диметиланилина в ацетонитриле (ACN) давало 2,4-дихлор-7-метилтиено[3,2-d]пиримидин VII (Пример 2). Замещение 4-хлор группы VII морфолином в метаноле давало соединение VI (Пример 3).
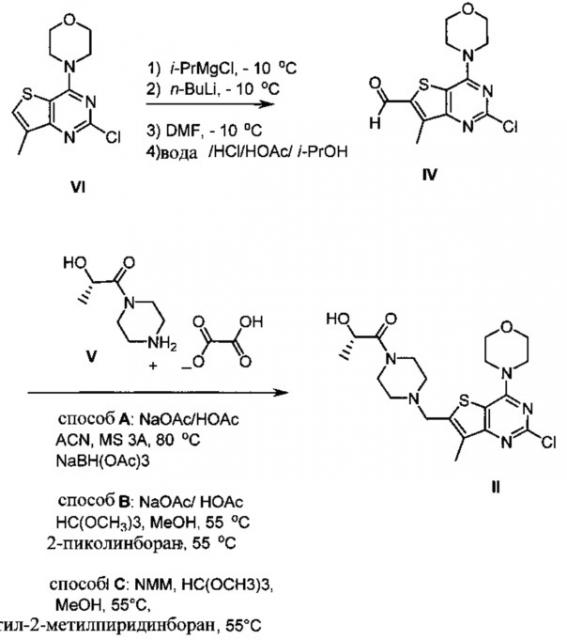
Схема 2:
Схема 2 показывает синтез интермедиата (S)-1-(4-((2-хлор-7-метил-4-морфолинотиено[3,2-d]пиримидин-6-ил)метил)пиперазин-1-ил)-2-гидроксипропан-1-она II из 4-(2-хлор-7-метилтиено[3,2-D]пиримидин-4-ил)морфолина VI. Обработка VI реактивом Гриньяра изопропилмагнийхлоридом, а затем н-бутиллитием при -10°C с последующим добавлением диметилформамида и быстрым разбавлением водным раствором кислоты давала формилированный интермедиат 2-хлор-7-метил-4-морфолинотиено[3,2-d]пиримидин-6-карбальдегид IV (Пример 4). Восстановительное аминирование IV проводили путем смешивания IV с оксалатом (S)-2-гидрокси-1-(пиперазин-1-ил)пропан-1-она V с последующей обработкой восстановительным агентом, таким как триацетоксиборгидрид натрия (способ А), 2-пиколин боран (способ В) или 5-этил-2-метилпиридин боран (Способ С) с получением II, который кристаллизуют в смеси толуол/гептан (Пример 5) или Ме-ТГФ/гептан.
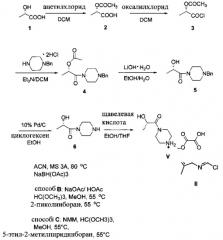
Схема 3:
Схема 3 показывает синтез интермедиата, оксалата (S)-2-гидрокси-1-(пиперазин-1-ил)пропан-1-она V, из (S)-2-гидроксипропановой кислоты (L-молочной кислоты) 1. ацетилирование 1 с получениеми (S)-2-ацетоксипропановой кислоты 2, с последующей обработкой хлорирующим реагентом, таким как оксалилхлорид, с получением хлорангидрида кислоты, (S)-1-хлор-1-оксопропан-2-ил ацетата 3 (Пример 6). Реакция 3 с дигидрохлоридом 1-бензилпиперазина в дихлорметане в присутствии триэтиламина давала (S)-1-(4-бензилпиперазин-1-ил)-1-оксопропан-2-ил ацетат 4 (Пример 7). С помощью гидролиза ацетата 4 гидроксидом лития получали (S)-1-(4-бензилпиперазин-1-ил)-2-гидроксипропан-1 5 (Пример 8), который затем гидрировали для удаления N-бензильной группы, чтобы получить (S)-2-гидрокси-1-(пиперазин-1-ил)пропан-1-он 6 (Пример 9). Оксалат получали из 6 с помощью обработки щавелевой кислотой в этаноле и тетрагидрофуране с получением V (Пример 9).
Схема 4:
Схема 4 показывает синтез интермедиата (S)-2-гидрокси-1-(пиперазин-1-ил)пропан-1-она V из (S)-этил 2-гидроксипропаноата 7. 1-бензилпиперазин и 7 подвергали взаимодействию в смеси метоксида натрия и метанола с получением (S)-1-(4-бензилпиперазин-1-ил)-2-гидроксипропан-1-она 8, который выделяли из смолы Amberlite® IRC-748 или щавелевой кислоты с последующей обработкой активированным углем (Пример 10). Восстановительное удаление бензильной группы из 8 осуществляли с помощью катализа палладием либо обработкой газообразным водородом (способ А), либо циклогексеном (способ В), что давало интермедиат (S)-2-гидрокси-1-(пиперазин-1-ил)пропан-1 6 (Пример 11). Оксалат получали из 6 с помощью обработки щавелевой кислотой в этаноле и тетрагидрофуране с получением V (Пример 11).
Схема 5:
Схема 5 показывает альтернативный одностадийный синтез интермедиата оксалата (S)-2-гидрокси-1-(пиперазин-1-ил)пропан-1-она V из (S)-этил 2-гидроксипропаноата 7. Незащищенный 7 и пиперазин реагируют с метилатом натрия в метаноле с образованием амида V, после чего проводят обработку щавелевой кислотой или смолой Amberlite® IRC-748 для удаления примесей, и получают соль щавелевой кислоты (Пример 12).
Схема 6:
Способ А
Схема 6 показывает синтез (S)-1-(4-((2-(2-аминопиримидин-5-ил)-7-метил-4-морфолинотиено[3,2-d]пиримидин-6-ил)метил)пиперазин-1-ил)-2-гидроксипропан-1-она, GDC-0980, Формула I, из интермедиата (S)-1-(4-((2-хлор-7-метил-4-морфолинотиено[3,2-d]пиримидин-6-ил)метил)пиперазин-1-ил)-2-гидроксипропан-1-она II. Сочетание II и 2-аминопиримидин-5-илбороновой кислоты III с палладиевым катализом по Сузуки-Мияура дает неочищенное соединение I (Пример 13). Для гашения реакционной смеси добавляли воду, после чего проводят рециркуляционную фильтрацию через активированный уголь, чтобы удалить палладий. Летучие вещества удаляли при пониженном давлении и I кристаллизовали из н-пропанола и воды, чтобы получить свободное основание, GDC-0980, формула I. В способе В реакцию проводят с использованием KHPO4 в качестве основания в смеси н-пропанол/вода в качестве растворителя.
В стадии сочетания по Сузуки-Мияура с образованием соединения I может быть использовано множество палладиевых катализаторов. Сочетание по Сузуки-Мияура представляет собой опосредованную палладием реакцию перекрестного сочетания арилгалогенида, такого как II, с бороновой кислотой, такой как III. Для получения I могут быть использованы низковалентные Pd (II) и Pd (0) катализаторы, в том числе PdCl2(PPh3)2, Pd(t-Bu)3, PdCl2 dppf CH2Cl2, Pd(PPh3)4, Pd(OAc)/PPh3, Cl2Rd[(Pet3)]2, Pd(DIPHOS)2, Cl2Pd(Bipy), [PdCl(Ph2PCH2PPh2)]2, Cl2Pd[P(o-tol)3]2, Pd2(dba)3/P(o-tol)3, Pd2(dba)/P(фурил)3, Cl2Pd[P(фурил)3]2, Cl2Pd(PMePh2)2, Cl2Pd[P(4-F-Ph)3]2, Cl2Rd[P(C6F6)3]2, Cl2Pd[P(2-COOH-Ph)(Ph)2]2, Cl2Pd[P(4-COOH-Ph)(Ph)2]2, а также инкапсулированные катализаторы Pd EnCat™ 30, Pd EnCat™ TPP30 и Pd(II)EnCat™ BINAP30 (US 2004/0254066).
Для удаления палладия после стадии сочетания по Сузуки-Мияура с образованием соединения I может быть использовано множество твердых адсорбентов поглотителей палладия. Примеры вариантов осуществления включают поглотители палладия FLORISIL®, SILIABOND® Thiol и SILIABOND® Thiourea. Другие поглотители палладия включают силикагель, стекло с контролируемым размером пор (TosoHaas) и дериватизированный слабосшитый полистирол QUADRAPURE™ АЕА, QUADRAPURE™ IMDAZ, QUADRAPURE™ МРА, QUADRAPURE™ TU (Reaxa Ltd., Sigma-Aldrich Chemical Co.).
Реакцию арилгалогенида, такого как II, и бороновой кислоты, такой как III, с образованием соединения I также можно проводить в условиях катализа палладием по Бухвальду с использованием предкатализатора палладацикла Бухвальда и реагентов-лигандов из таблицы 1, и как описано в ссылках: Biscoe et al (2008) J. Am. Chem. Soc. 130: 6686-6687; Kinzel et al (2010) J. Am. Chem. Soc. 132:14073-14075; Molander et al (2012) J. Am. Chem. Soc. 134: 11667-11673; Walker et al (2004) Angew. Chem. Int. Ed. 43: 1871; Billingsley et al (2007) Angew. Chem. Int. Ed. 46: 5359-5363; US 6946560; US 7026498; US 7247731; US 7560582; US 6307087; US 6395916; US 7223879; US 7858784, которые включены в настоящий документ посредством ссылки. Такие реагенты коммерчески доступны (Johnson Matthey Inc., Wayne, PA; Sigma Aldrich Fine Chemical, St. Louis, MO; Strem Chemicals, Inc., Newburyport, MA).
Схема 7:
Схема 7 показывает синтез 2-аминопиримидин-5-илбороновой кислоты III из 5-бромпиримидин-2-амина 9. Защиту 2-аминогруппы с помощью Вос-защитного реагента, такого как ди-трет-бутилдикарбонат (Boc2O), проводили через бис-Вос-защищенный интермедиат, бис-трет-бутил-5-бромпиридин-2-ил-дикарбамат 10 (Пример 14) с последующим основным гидролизом одной группы Воc с получением моно-Вос-защищенного трет-бутил 5-бромпиримидин-2-илкарбамата 11 (Пример 15). Основный гидролиз может быть проведен с использованием гидроксида щелочноземельного металла, такого как гидроксид калия, гидроксид натрия или гидроксид лития. Металлирование 11 алкиллитиевым реагентом, таким как н-бутиллитий, и борилирование триалкилборатным реагентом, таким как триизопропилборат, дает 2-(трет-бутоксикарбониламино)пиримидин-5-илбороновую кислоту 12 (Пример 16). Удаление защитной группы с помощью водного кислотного гидролиза и подщелачивания или нейтрализации дает III (Пример 17).
Схема 8:
Схема 8 иллюстрирует альтернативный синтез 2-аминопиримидин-5-илбороновой кислоты III из 5-бромпиримидин-2-амина 9. Металлирование брома в незащищенном 9 с использованием н-бутиллития и борилирование триизопропилборатом дает III (Пример 17).
Другой альтернативный синтез 2-аминопиримидин-5-илбороновой кислоты III может быть проведен с помощью реакции бис-трет-бутил-5-бромпиримидин-2-ил-дикарбамата 10 и 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолана), также известного как бис(пинаколато)дибор, B2Pin2, пинакол диборан, в соответствии с условиями катализа палладием по Бухвальду с использованием предкатализатора палладацикла Бухвальда и реагентов-лигандов из таблицы 1 (Пример 18) с получением бис-трет-бутил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил) пиримидин-2-илдикарбамата 13.
Кислотный гидролиз обеих групп Воc и пинаколиновой группы дает 2-аминопиримидин-5-илбороновую кислоту III.
Лекарственные формы
GDC-0980 может быть получен в виде лекарственных форм в соответствии со стандартной фармацевтической практикой для использования в терапевтических комбинациях для терапевтического лечения (включая профилактическое лечение) гиперпролиферативных заболеваний у млекопитающих, включая человека. Настоящее изобретение относится к фармацевтической композиции, содержащей GDC-0980 в сочетании с одним или более фармацевтически приемлемыми носителями, веществами, способствующими скольжению, разбавителями или эксципиентами.
Подходящие носители, разбавители, вещества, способствующие скольжению, и эксципиенты хорошо известны специалистам в данной области и включают такие материалы как углеводы, воски, растворимые в воде и/или набухающие в воде полимеры, гидрофильные или гидрофобные материалы, желатин, масла, растворители, воду и т.п.
Лекарственные формы могут быть получены с использованием обычных процедур растворения и смешивания. Соединениям по настоящему изобретению, как правило, придают вид фармацевтических дозированных форм, чтобы обеспечить легко контролируемое дозирование лекарства и обеспечить соблюдение пациентом предписанного режима.
Фармацевтическая композиция (или лекарственная форма) может быть упакована в различных формах в зависимости от способа, используемого для введения лекарственного средства. Как правило, изделие для продажи включает контейнер, содержащий фармацевтический препарат в соответствующей форме. Подходящие контейнеры хорошо известны специалистам в данной области техники и включают бутылки (из пластика и стекла), саше, ампулы, пластиковые мешки, металлические цилиндры и тому подобное. Контейнер может также включать приспособление для контроля первого вскрытия, чтобы предотвратить нежелательный доступ к содержимому упаковки. Кроме того, контейнер несет на себе этикетку, которая описывает содержимое контейнера. Этикетка может также включать соответствующие предупреждения.
Фармацевтические лекарственные формы соединений по настоящему изобретению могут быть получены для различных путей и типов введения с фармацевтически приемлемыми разбавителями, носителями, эксципиентами, глидантами или стабилизаторами (Remington's Pharmaceutical Sciences (1995) 18th edition, Mack Publ. Co., Easton, PA) в форме лиофилизированной лекарственной формы, размолотого порошка или водного раствора. Получение лекарственной формы может быть проведено при перемешивании при комнатной температуре при соответствующем рН и при желаемой степени чистоты с физиологически приемлемыми носителями, то есть с носителями, которые являются нетоксичными для реципиентов в используемых дозах и концентрациях. рН лекарственной формы зависит в основном от конкретного применения и концентрации соединения и может быть в диапазоне от около 3 до около 8.
Фармацевтическая лекарственная форма предпочтительно является стерильной. В частности, лекарственные формы, которые будут использоваться для введения in vivo, должны быть стерильными. Такую стерилизацию легко осуществить путем фильтрации через стерильные фильтрационные мембраны.
Фармацевтическую лекарственную форму обычно можно хранить в виде твердой композиции, таблетки, пилюли, капсулы, лиофилизированной лекарственной формы или в виде водного раствора.
Фармацевтические лекарственные формы по изобретению можно дозировать и вводить в соответствии с хорошей медицинской практикой, то есть их количества, концентрации, график введения, курс введения, носители и способ введения соответствуют хорошей медицинской практике. Факторы, подлежащие рассмотрению в данном контексте, включают конкретное расстройство, которое подвергают лечению, клиническое состояние конкретного пациента, причину расстройства, место доставки агента, способ введения, схему введения и другие факторы, известные практикующим врачам.
Приемлемые разбавители, носители, эксципиенты и стабилизаторы являются нетоксичными для реципиентов в используемых дозах и концентрациях и включают буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония, хлорид бензетония; фенол, бутиловый спирт, этанол или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцин; циклогексанол; 3-пентанол, а также м-крезол); низкомолекулярные (менее чем приблизительно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТА; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, Zn-протеиновые комплексы); и/или неионные поверхностно-активные вещества, такие как TWEEN™, в том числе Tween 80, PLURONIC™ или полиэтиленгликоль (PEG), в том числе PEG400. Активные фармацевтические ингредиенты могут быть также заключены в микрокапсулы, которые получены, например, способами коацервации или путем межфазной полимеризации, например, микрокапсулы из гидроксиметилцеллюлозы или желатина и микрокапсулы из поли(метилметакрилата) соответственно в коллоидные системах доставки лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие способы описаны в Remington's Pharmaceutical Sciences 18th edition, (1995) Mack Publ. Co., Easton, PA. Другие примеры лекарственных форм можно найти в Liberman, Н. A. and Lachman, L, Eds., Pharmaceutical Dosage Forms, Marcel Decker, Vol 3, 2nd Ed., New York, NY.
Фармацевтически приемлемые глиданты могут быть выбраны из диоксида кремния, порошкообразной целлюлозы, микрокристаллической целлюлозы, стеаратов металлов, алюмосиликата натрия, бензоата натрия, карбоната кальция, силиката кальция, кукурузного крахмала, карбоната магния, свободного от асбеста талька, Stearowet С, крахмала, крахмала 1500, лаурилсульфата магния, оксида магния и их комбинаций.
Фармацевтические лекарственные формы включают лекарственные формы, пригодные для путей введения, которые описаны в данном документе. Лекарственные формы могут быть удобно представлены в единичной дозированной форме и могут быть получены любым из способов, хорошо известных в области фармации. Соответствующие способы и лекарственные формы в целом описаны в Remington's Pharmaceutical Sciences 18th Ed. (1995) Mack Publishing Co., Easton, PA. Такие способы включают стадию ассоциации активного ингредиента с носителем, который состоит из одного или более вспомогательных ингредиентов. В общем, лекарственные формы получают путем однородного и тщательного смешивания активного ингредиента с жидкими носителями или тонко измельченными твердыми носителями, или с ними обоими с последующим формованием продукта, если это необходимо.
Фармацевтические композиции могут быть в форме стерильного инъецируемого препарата, например в виде стерильной инъекционной водной или масляной суспензии. Эти суспензии могут быть получены в соответствии с известным уровнем техники с использованием подходящих диспергирующих или смачивающих агентов и суспендирующих агентов, которые были указаны выше. Стерильный инъецируемый препарат может представлять собой раствор или суспензию в нетоксичном парентерально приемлемом разбавителе или растворителе, например, раствор в 1,3-бутандиоле, или может быть получен из лиофилизированного порошка. Приемлемые носители и растворители, которые могут быть использованы, включают воду, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды обычно могут быть использованы стерильные нелетучие масла. С этой целью могут быть использованы любые мягкие нелетучие масла, в том числе синтетические моно- или диглицериды. Кроме того, в инъецируемых препаратах аналогичным образом могут быть использованы жирные кислоты, такие как олеиновая кислота.
ПРИМЕРЫ
Пример 1. 7-метилтиено[3,2-d]пиримидин-2,4 (1Н,3Н)-дион VIII
Метиловый эфир 3-амино-4-метилтиофен-2-карбоновой кислоты IX (100 г, 0,584 моль) и уксусную кислоту (750 мл, 13,1 моль) перемешивали в течение 5 мин с получением прозрачного раствора. К раствору в течение 20 мин медленно добавляли раствор цианата калия (56,8 г, 0,70 моль) в воде (120 мл) и смесь перемешивали в течение 1,5 ч. Затем в течение 20 мин дополнительно медленно добавляли раствор цианата калия (56,8 г, 0,70 моль) в воде (120 мл) и смесь перемешивали в течение 2 ч. Добавляли воду (600 мл) и смесь охлаждали до 10°С и перемешива