Средство для лечения фиброза кишечника
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к носителю для лекарственного средства для лечения фиброза кишечника посредством доставки лекарственного средства для ингибирования активности или роста клеток, продуцирующих внеклеточный матрикс в кишечнике, что может быть использовано в медицине. Указанный носитель содержит ретиноид и липид, где ретиноид способствует доставке лекарственного средства в указанные клетки и лечению фиброза кишечника, что применяется в составе фармацевтической композиции для лечения фиброза кишечника и для регенерации нормальной ткани кишечника из фиброзной ткани кишечника, в наборе для получения указанных фармацевтических композиций, способе лечения фиброза кишечника, а также регенерации нормальной ткани кишечника из фиброзной ткани кишечника. Изобретение позволяет высокоэффективно доставлять ингибитор продукции внеклеточного матрикса к клетке, продуцирующей внеклеточный матрикс, и ингибировать экспрессию молекулы, участвующей в продуцировании внеклеточного матрикса. 6 н. и 9 з.п. ф-лы, 4 ил., 4 пр.
Реферат
Область изобретения
Настоящее изобретение относится к носителю для доставки вещества, нацеленного на клетки, продуцирующие внеклеточный матрикс в кишечнике, и композиции для лечения фиброза кишечника и способу лечения фиброза кишечника с использованием указанного носителя. Кроме того, настоящее изобретение также относится к полученной линии клеток фиброзного кишечника, продуцирующих внеклеточный матрикс, способу ее получения, способу с использованием линии клеток для скрининга лекарственного средства для лечения фиброза кишечника и набору, содержащему линию клеток, для скрининга лекарственного средства для лечения фиброза кишечника.
Уровень техники
Фиброз кишечника представляет собой патологическое состояние, характеризуемое избыточным отложением рубцовой ткани на стенке кишечника, и сопровождается хроническим воспалением кишечника, таким как, например, хроническая воспалительная болезнь кишечника (IBD) или повреждение ткани вследствие облучения (Непатентная литература 1). Воспалительные болезни кишечника включают болезнь Крона и язвенный колит; например, при болезни Крона фиброз кишечника происходит у приблизительно 25%-30% пациентов. Фиброз кишечника образует стриктуру кишечника, когда он прогрессирует, делает затруднительным прохождение пищи через него, и становится важной причиной нарушения QOL больного субъекта. Однако механизм фиброза кишечника еще не выяснен, и по этой причине в настоящее время не установлено определенной терапии.
Общепринятое лечение фиброза кишечника сфокусировано на лечении причинного воспаления; применяются разнообразные противовоспалительные средства, например лекарственное средство на основе аминосалициловой кислоты, такое как сульфосалазин, мезаламин, алсалазин или балсалазид, кортикостероидное лекарственное средство, такое как преднизолон или будесонид, иммуносупрессорное средство, такое как азатиоприн, меркаптопурин, циклоспорин или метотрексат, ингибитор TNFα, такой как инфликсимаб и, кроме того, антибиотик, такой как метронидазол или Ципроксан. Однако эти противовоспалительные средства не излечивают фиброз непосредственно, и при серьезном фиброзе кишечника становится необходимым хирургическим путем удалять фиброзную ткань, что возлагает огромную нагрузку на пациента.
В свете таких обстоятельств за последние годы было сделано несколько попыток непосредственно лечить фиброз кишечника. В результате сообщалось, что лекарственный препарат, такой как, например, вакцина TGFβ1 (Непатентная литература 2), пентоксифиллин или его метаболит (Непатентная литература 3), ингибитор фосфодиэстеразы 4 (Непатентная литература 4), ингибитор HMG-CoA редуктазы (Непатентная литература 5), дайкенчуто (Непатентная литература 6), правастатин (Непатентная литература 7), аналог липоксина A4 (Патентная литература 1) или ингибитор трансферазы сульфатной группы (Патентная литература 2) проявляли некоторую степень успеха при лечении фиброза кишечника у животной модели и т.д. Однако ни один из этих лекарственных препаратов не является удовлетворительным, и необходима дальнейшая разработка средств для лечения фиброза кишечника.
Список цитирования
Патентная литература
[Патентная литература 1] WO 2008/022807
[Патентная литература 2] WO 2009/084232
[Патентная литература 3] WO 2006/068232
[Патентная литература 4] WO 2009/036368
[Патентная литература 5] WO 2010/014117
[Патентная литература 6] WO 2009/116257
[Патентная литература 7] WO 2010/026766
Непатентная литература
[Непатентная литература 1] Rieder и Fiocchi, Nat Rev Gastroenterol Hepatol. 2009 Apr; 6(4):228-35
[Непатентная литература 2] Ma et al., Inflamm Bowel Dis. 2010 Jun; 16(6):1040-50
[Непатентная литература 3] Peterson et al., Eur J Pharmacol. 2011 Jul 15; 662(1-3):47-54
[Непатентная литература 4] Videla et al., J Pharmacol Exp Ther. 2006 Feb; 316(2):940-5
[Непатентная литература 5] http://www.ncbi.nlm.nih.gov/pubmed/21909991
[Непатентная литература 6] Inoue et al., Biol Pharm Bull. 2011; 34(11):1659-65
[Непатентная литература 7] Haydont et al., Clin Cancer Res. 2007 Sep 15; 13(18 Pt 1):5331-40
Краткое содержание сущности изобретения
Техническая задача
Задачей настоящего изобретения является обеспечение носителя, который может доставлять вещество, такое как лекарственное средство, конкретно к клеткам, продуцирующим внеклеточный матрикс в кишечнике, средство для лечения фиброза кишечника и способ лечения фиброза кишечника с использованием указанного носителя.
Решение задачи
Авторы настоящего изобретения достигли успеха при выделении клеток, продуцирующих внеклеточный матрикс из фиброзной ткани кишечника во время исследования нового средства для лечения фиброза кишечника и, кроме того, обнаружили, что носитель, который включает ретиноид в качестве нацеливающего средства, доставляет ингибитор продуцирования внеклеточного матрикса к указанным клеткам с высокой эффективностью и заметно ингибирует экспрессию молекулы, вовлеченной в продуцирование внеклеточного матрикса, и создание настоящего изобретения было, таким образом, завершено.
Известно, что носитель, который включает витамин А, может доставлять лекарственное средство к печеночным звездчатым клеткам (Патентная литература 3, Патентная литература 4) или линии печеночных звездчатых клеток (Патентная литература 3, Патентная литература 5), или клеткам, продуцирующим внеклеточный матрикс в легких (Патентная литература 6) и костном мозге (Патентная литература 7), и то, что композиция, в которой siPHK для HSP47 осуществляют на указанном выше носителе, может улучшить состояние печеночного фиброза (Патентная литература 3), фиброза легких (Патентная литература 6) и миелофиброза (Патентная литература 7), но любая взаимосвязь с клетками, продуцирующими внеклеточный матрикс в кишечнике, или фиброзом кишечника до сих пор полностью не известна.
То есть настоящее изобретение относится к следующему:
(1) Носителю для доставки вещества к клеткам, продуцирующим внеклеточный матрикс в кишечнике, содержащему ретиноид в качестве нацеливающего средства для клеток, продуцирующих внеклеточный матрикс в кишечнике.
(2) Носителю в соответствии с п. (1), указанным выше, где ретиноид включает ретинол.
(3) Носителю в соответствии с п. (1) или п. (2), указанными выше, где он включает ретиноид и компонент носителя, отличный от ретиноида, молярное отношение ретиноида к компоненту носителя, отличному от ретиноида, составляет 8:1-1:4.
(4) Фармацевтической композиции для лечения фиброза кишечника, содержащей носитель в соответствии с любым из пп. (1)-(3), указанных выше, и лекарственному средству для контроля активности или роста клеток, продуцирующих внеклеточный матрикс в кишечнике.
(5) Фармацевтической композиции для регенерации нормальной ткани кишечника из фиброзной ткани кишечника, композиции, содержащей носитель в соответствии с любым из пп. (1)-(3), указанных выше, и лекарственному средству для контроля активности или роста клеток, продуцирующих внеклеточный матрикс в кишечнике.
(6) Фармацевтической композиции в соответствии с п. (4) или п. (5), указанным выше, где лекарственное средство для контроля активности или роста клеток, продуцирующих внеклеточный матрикс в кишечнике, выбирают из группы, состоящей из вещества для ингибирования продуцирования и секреции компонента внеклеточного матрикса, ингибитора роста клеток, апоптоз-индуцирующего вещества, ингибитора ΉΜΡ и ингибитора α1-антитрипсина.
(7) Фармацевтической композиции в соответствии с п. (6), указанным выше, где вещество для ингибирования продуцирования и секреции компонента внеклеточного матрикса представляет собой ингибитор HSP47.
(8) Фармацевтической композиции в соответствии с любым из пп. (4)-(7), указанных выше, где она находится в форме, полученной в момент применения.
(9) Набору для получения фармацевтической композиции в соответствии с любым из пп. (4)-(8), указанных выше, набору, содержащему один или несколько контейнеров, которые содержат либо по отдельности, или в комбинации лекарственное средство для контроля активности или роста клеток, продуцирующих внеклеточный матрикс в кишечнике, ретиноид и, при необходимости, компонент носителя, отличный от ретиноида.
(10) Способу получения носителя для доставки вещества к клеткам, продуцирующим внеклеточный матрикс в кишечнике, включающему в себя стадию получения ретиноида в виде нацеливающего средства для клеток, продуцирующих внеклеточный матрикс в кишечнике.
(11) Способу получения фармацевтической композиции для лечения фиброза кишечника или фармацевтической композиции для регенерации нормальной ткани кишечника из фиброзной ткани кишечника, включающему в себя стадию получения ретиноида в виде нацеливающего средства для клеток, продуцирующих внеклеточный матрикс в кишечнике, и лекарственного средства для контроля активности или роста клеток, продуцирующих внеклеточный матрикс в кишечнике в качестве активного ингредиента.
(12) Линии клеток кишечника, продуцирующих внеклеточный матрикс, получаемой из фиброзной кишечной ткани, собранной от субъекта, страдающего от фиброза кишечника, и имеющей виментин-положительный, αSMA-отрицательный и GFAP-отрицательный фенотип.
(13) Способу выделения клеток, продуцирующих внеклеточный матрикс кишечника, включающему в себя
(i) стадию получения клеток из фиброзной кишечной ткани, собранной от субъекта, страдающего от фиброза кишечника, и
(ii) стадию селекции клеток, имеющих виментин-положительный, αSMA-отрицательный и GFAP-отрицательный фенотип из клеток, полученных на (i).
(14) Способу получения линии клеток кишечника, продуцирующих внеклеточный матрикс, включающему в себя
(i) стадию получения клеток из фиброзной кишечной ткани, собранной от субъекта, страдающего от фиброза кишечника, и
(ii) стадию селекции клеток, имеющих виментин-положительный, αSMA-отрицательный и GFAP-отрицательный фенотип из клеток, полученных на (i),
способу, также включающему в себя стадию иммортализации клеток после стадии (i) или (ii).
(15) Способу скрининга фактора для лечения фиброза кишечника, включающему в себя
(i) стадию получения клеточной линии в соответствии с п. (12), указанным выше, для сосуществования с тестируемым фактором, и
(ii) стадию обнаружения изменения клеточной линии вследствие сосуществования с тестируемым фактором.
(16) Набору для скрининга фактора для лечения фиброза кишечника, содержащему линию клеток в соответствии с п. (12), указанным выше.
Преимущественные эффекты изобретения
В то время как точный механизм действия композиции для лечения фиброза кишечника по настоящему изобретению еще полностью не выяснен, полагают, что ретиноид функционирует как средство, которое нацелено на клетки, продуцирующие внеклеточный матрикс в кишечнике, и доставляет активный ингредиент, такой как, например, лекарственное средство, которое контролирует активность или рост клеток, продуцирующих внеклеточный матрикс в кишечнике к таким клеткам, таким образом проявляя эффект против фиброза кишечника.
Следовательно, поскольку активный ингредиент может быть эффективно доставлен к месту действия и, дополнительно для нацеливания на клетки посредством использования носителя по настоящему изобретению, содержащего ретиноид в качестве нацеливающего средства, излечение, подавление развития и предотвращение появления фиброза кишечника, для которого до настоящего времени отсутствует определенный терапевтический способ, становятся возможными, и настоящий носитель, таким образом, существенно способствует медицине и ветеринарии.
Более того, носитель по настоящему изобретению может комбинироваться с любым лекарственным средством (например, существующим терапевтическим лекарственным средством для фиброза кишечника) для увеличения его эффективности действия; существует, следовательно, также преимущество в том, что существует широкий диапазон применения с точки зрения разработки рецептуры готовой формы, обеспечивающий упрощение производства эффективных терапевтических средств.
Кроме того, клеточная линия по настоящему изобретению может использоваться при скрининге лекарственного средства для лечения фиброза кишечника или при установлении механизма фиброза кишечника, и это обстоятельство способствует развитию новых средств лечения или способов лечения фиброза кишечника.
Краткое описание чертежей
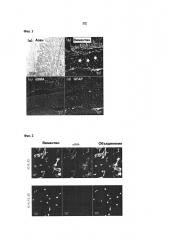
[Фиг. 1] Фиг. 1 представляет собой фотографическую диаграмму, показывающую локализацию подобных звездчатых мезенхимальных клеток на участке фиброза кишечника у мышей SAMP 1 Alt. Она показывает изображение окрашивания азаном (а) и изображения иммунофлюоресцентного окрашивания посредством антител против виментина (b), антител против αSMA (с) и антител против GFAP (d). Стрелки показывают локализацию подобных звездчатых мезенхимальных клеток. Шкала масштаба обозначает 100 мкм для (а) и 50 мкм для (b)-(d).
[Фиг. 2] Фиг. 2 представляет собой фотографическую диаграмму, показывающую экспрессию виментина и αSMA в мезенхимальной клеточной линии IC10_F2, выделенной из участка фиброза кишечника у мышей SAMPl/Yit (верхняя часть) и виментин-положительной, aSMA-отрицательной, GFAP-отрицательной клеточной линии IC10_F2_E9, полученной из нее (нижняя часть). Шкала масштаба обозначает 50 мкм.
[Фиг. 3] Фиг. 3 представляет собой график, показывающий относительную экспрессию виментина, αSMA, ADRP, LRAT и LXRJ3 в клетках IC10F2 и клетках IC10_F2_E9.
[Фиг. 4] Фиг. 4 представляет собой график, показывающий относительную экспрессию HSP47, когда siPHK, переносимую VA-связанными липосомами для HSP47, вводят в клетки IC10_F2_E9.
Описание вариантов выполнения изобретения
Один объект настоящего изобретения относится к носителю для доставки вещества к клеткам, продуцирующим внеклеточный матрикс в кишечнике, носителю, содержащему ретиноид в качестве нацеливающего средства для клеток, продуцирующих внеклеточный матрикс в кишечнике. Один вариант выполнения носителя по настоящему изобретению включает эффективное количество ретиноида для нацеливания на клетки, продуцирующие внеклеточный матрикс в кишечнике. Кроме того, один вариант выполнения носителя по настоящему изобретению относится к носителю, нацеленному на клетки, продуцирующие внеклеточный матрикс в кишечнике, посредством ретиноида.
В настоящем изобретении, клетки, продуцирующие внеклеточный матрикс в кишечнике, не являются особым образом ограниченными, поскольку они представляют собой клетки, которые присутствуют в кишечнике и обладают способностью продуцировать внеклеточный матрикс; их примеры включают звездчатые клетки, фибробласты, перициты, фиброциты и миофибробласты, которые присутствуют в кишечнике. Продуцирующие матрикс клетки, которые присутствуют в кишечнике, могут включать не только клетки, полученные из клеток, которые присутствуют в кишечнике, но также клетки, полученные из фиброцитов в циркулирующей крови, и клетки, трансформированные из эпителиальных клеток или эндотелиальных клеток посредством эндотелиальной-мезенхимальной трансдифференцировки (Непатентная литература 1).
Примеры звездчатых клеток включают клетки, имеющие виментан-положительный, αSMA (α-актин гладкой мускулатуры)-отрицательный и GFAP (глиальный фибриллярный кислотный белок)-отрицательный фенотип, которые идентифицированы в примерах ниже. Такие клетки идентифицируют посредством иммуноокрашивания с использованием антител против виментина, антител против αSMA, и антител против GFAP, которые метят с целью обнаружения. Клетки могут экспрессировать ген, относящийся к накоплению VA (витамина А), например, ADRP (белка, относящегося к адипозной дифференцировки, LRAT (лецитин-ретинолацилтрансферазы), и/или LXRβ (печеночного X рецептора β), и т.д. Печеночные звездчатые клетки активируются при культивировании in vitro и становятся αSMA-положительными и GFAP-положительными, но клетки, подобные звездчатым клеткам, не становятся αSMA- и GFAP-положительными даже при культивировании in vitro. Миофибробласты бактеризуются экспрессией виментина и αSMA; фибробласты экспрессируют виментин, характерный для мезенхимальных клеток, но не экспрессируют αSMA, и они могут быть идентифицированы двойным окрашиванием и т.д. виментина и αSMA. Клетки, продуцирующие внеклеточный матрикс в кишечнике, могут также быть получены посредством селекции из клеток, полученных из ткани кишечника, клеток, имеющих виментин-положительный, αSMA-отрицательный и GFAP-отрицательный фенотип.
Ретиноид по настоящему изобретению функционирует в качестве нацеливающего средства для клеток, продуцирующих внеклеточный матрикс в кишечнике, и стимулирует специфичную доставку вещества к этим клеткам. Механизм стимуляции доставки вещества посредством ретиноида полностью не выяснен; однако, например, полагают, что ретиноид, который был специфично связан ретинолсвязывающим белком (RBP) захватывается клетками, продуцирующими внеклеточный матрикс в кишечнике посредством определенного рецептора, присутствующего на поверхности этой клетки.
Ретиноид является членом класса соединений, имеющих скелет, в котором четыре изопреноидных единицы объединены по типу голова-к-хвосту (см. G.P. Moss, 'Biochemical Nomenclature and Related Documents', 2nd Ed. Portland Press, pp. 247-251 (1992)). Витамин А является родовым дескриптором для ретиноида, проявляющего качественно биологическую активность ретинола. Ретиноид, который может применяться в настоящем изобретении, не является особым образом ограниченным, и его примеры включают ретинол (включая all-транс-ретинол), ретиналь, ретиноевую кислоту (включая третиноин), производные ретиноидов, такие как сложный эфир ретинола и жирной кислоты, сложный эфир алифатического спирта и ретиноевой кислоты, этретинат, изотретиноин, адапален, ацитретин, тазаротен и ретинилпальмитат и аналоги витамина А, такие как фентретинид (4-HPR) и бексаротен.
Из перечисленных ретинол, ретиналь, ретиноевая кислота, сложный эфир ретинола и жирной кислоты (такой как, например, ретинилацетат, ретинилпальмитат, ретинилстеарат и ретиниллаурат) и сложный эфир алифатического спирта и ретиноевой кислоты (такой как, например, этилретиноат) являются предпочтительными с точки зрения эффективности специфической доставки вещества к клеткам, продуцирующим внеклеточный матрикс в кишечнике.
Все ретиноидные изомеры, включая цис-транс изомеры, включены в объем настоящего изобретения. Ретиноид может быть замещен одним или несколькими заместителями. Ретиноид в настоящем изобретении включает ретиноид в выделенной форме, а также в форме раствора или смеси со средой, которая может растворять или удерживать ретиноид.
Ретиноид в настоящем изобретении включает соединение, содержащее ретиноид в качестве его части (соединение, содержащее ретиноидный фрагмент). Такое соединение может содержать один или несколько ретиноидных фрагментов, например один, два, три, четыре, пять, шесть, семь, восемь, девять, десять или более фрагментов. В таком соединении, ретиноид может присутствовать в состоянии, в котором его RBP-связывающий участок (например, фрагмент циклогексенового кольца в случае ретинола) может связываться с RBP. Примеры такого соединения включают, но не ограничены лишь перечисленными, соединение, в котором один или несколько ретиноидов и ПЭГ или его производное являются связанными. В таком ретиноид-ПЭГ конъюгате, RBP-несвязывающий участок (например, фрагмент, отличный от фрагмента циклогесенового кольца в случае ретинола, например, ОН-группа и т.д.) ретиноида могут быть ковалентно связаны с ПЭГ или его производным. ПЭГ или его производное могут иметь от 1 до 50 повторяющихся единиц (СН2СН2О). ПЭГ или его производное могут иметь молекулярную массу от 200 до 4000 г/моль. ПЭГ или его производное могут быть линейными или разветвленными. Производное ПЭГ может иметь группу, пригодную для связывания с ретиноидом по концу, например аминогруппу и т.д. Производное ПЭГ может иметь одну или несколько амидных групп в цепи, например одну, две, три, четыре, пять, шесть, семь, восемь, девять, десять или более амидных групп.
Носитель по настоящему изобретению составлен из ретиноида самого или может быть составлен посредством связывания ретиноида с компонентом носителя, отличным от ретиноида или посредством включения его в носитель. Следовательно, носитель по настоящему изобретению может включать компонент носителя, отличный от ретиноида. Такой компонент не является особым образом ограниченным, и может применяться любой компонент, известный в медицинской и фармацевтической областях, но те компоненты, которые могут включать в себя ретиноид или могут связываться с ретиноидом, являются предпочтительными.
Примеры таких компонентов включают липид, например фосфолипид, такой как глицерофосфолипид, сфинголипид, такой как сфингомиелин, стерин, такой как холестерин, растительное масло, такое как соевое масло или маковое масло, минеральное масло или лецитин, такой как лецитин яичного желтка, и полимер, но примеры не ограничиваются лишь ими. Среди них липиды, которые могут образовывать липосому, например природный фосфолипид, такой как лецитин, полусинтетический фосфолипид, такой как димиристоилфосфатидилхолин (DMPC), дипальмитоилфосфатидилхолин (DPPC) или дистеароилфосфатидилхолин (DSPC), диолеилфосфатидилэтаноламин (DOPE), дилауроилфосфатидилхолин (DLPC), холестерин и т.д., являются предпочтительными.
Особенно предпочтительным компонентом является компонент, который может избежать захвата ретикулоэндотелиальной системой, его примеры включают катионные липиды, такие как хлорид
N-(α-триметиламмониоацетил)-дидодецил-D-глутамата (TMAG), Ν,Ν',Ν'',N'''-тетраметил-N,N',Ν'',Ν''' -тетрапальмитил спермин (TMTPS), трифторацетат 2,3-диолеилокси-N-[2-(сперминкарбоксамидо)этил]-N,N-диметил-1-пропанаминия трифторацетат (DOSPA), хлорид
N-[1-(2,3-диолеилокси)пропил]-N,N,N-триметиламмония (DOTMA), хлорид диоктадецилдиметиламмония (DODAC), бромид дидодециламмония (DDAB), 3β-[N-(N',N'-диметаламиноэтан)карбамоил]холестерина (DC-Chol), бромид 1,2-димиристоилоксипропил-3-диметилгидроксиэтиламмония (DMRIE),
и хлорид O,O'-дитетрадеканоил-N-(α-триметаламмониоацетил)диэтаноламина (DC-6-14).
Носитель в настоящем изобретении может иметь специфичную трехмерную структуру. Такая структура не является ограниченной и ее примеры включают прямоцепочечную или разветвленную линейную структуру, пленочную структуру и сферическую структуру. Следовательно, носитель может иметь, без ограничения, любую трехмерную форму, такую как дендример, дендрон, мицелла, липосома, эмульсия, микросфера или наносфера. Кроме того, один вариант выполнения носителя в настоящем изобретении представляет собой носитель, который обеспечивает активное нацеливание посредством нацеливающего средства (включающего нацеливающую молекулу, нацеливающий фрагмент и т.д.). Носитель, который имеет трехмерную конфигурацию, или носитель, который обеспечивает активное нацеливание, является хорошо известным в существующей области техники (ссылки, например, Marcucci and Lefoulon, Drug Discov Today. 2004 Mar 1; 9 (5):219-28, Torchilin, Eur J Pharm Sci. 2000 Oct; 11 Suppl 2: S81-91 и т.д.).
Связывание ретиноида с носителем по настоящему изобретению или включение его внутрь него также делается возможным посредством связывания ретиноида с компонентом носителя, отличным от ретиноида, или включения в носитель посредством химического и/или физического метода. Альтернативно, ретиноид может быть связан с носителем по настоящему изобретению или включен в него посредством смешивания ретиноида и компонента носителя, отличного от ретиноида, во время получения носителя. Количество ретиноида в носителе по настоящему изобретению может составлять, например, от 0,01 до 1000 нмоль/мкл, предпочтительно от 0,1 до 100 нмоль/мкл. Кроме того, в носителе по настоящему изобретению, содержащем ретиноид и компонент носителя, отличный от ретиноида, молярное отношение ретиноида к компоненту носителя, отличного от ретиноида, не является ограниченным и может составлять, например, от 8:1 до 1:4 или от 4:1 до 1:2. Ретиноид может быть связан с носителем или включен в него перед загрузкой вещества, подлежащего доставке, на носитель; или носитель, ретиноид, и вещество, подлежащее доставке, могут быть смешаны одновременно; или ретиноид может быть смешан с носителем, уже несущим вещество, подлежащее доставке, и т.д. Следовательно, настоящее изобретение также относится к способу получения готовой формы, специфичной к клеткам, продуцирующим внеклеточный матрикс в кишечнике, способу, включающему в себя стадию связывания ретиноида с любым существующим лекарственным средством, связанным с носителем, или лекарственным средством, инкапсулированным в носитель, например, липосомальную готовую форму, такую как DaimoXome®, Doxil, Caelyx®, или Myocet®.
Носитель по настоящему изобретению может находиться в любой форме, поскольку желательное вещество или объект могут транспортироваться к целевым клеткам, продуцирующим внеклеточный матрикс в кишечнике, и ее примеры включают, но не ограничены лишь перечисленными, полимер, дендример, дендрон, макромолекулярную мицеллу, липосому, эмульсию, микросферы и наносферы. В настоящем изобретении липосомальная форма является предпочтительной среди этих форм с точки зрения высокой эффективности доставки, широкого выбора веществ, подлежащих доставке, и простоте разработки рецептуры и т.д., и катионная липосома, содержащая катионный липид, является особенно предпочтительной. В случае, когда носитель находится в форме липосомы, молярное отношение ретиноида к другому компоненту липидов липосомы составляет предпочтительно от 8:1 до 1:4 и более предпочтительно от 4:1 до 1:2, с точки зрения эффективности связывания ретиноида с носителем или включения в него.
Носитель по настоящему изобретению может содержать вещество, подлежащее транспорту, в его внутренней части, он может быть присоединен к внешней части вещества, подлежащего транспорту, или он может быть смешан с веществом, подлежащим транспорту, поскольку он содержит ретиноид в такой форме, что ретиноид способен функционировать в качестве нацеливающего средства. 'Функционировать в качестве нацеливающего средства' здесь означает то, что носитель, который включает ретиноид, достигает и/или захватывается целевыми клетками, т.е., клетками, продуцирующими внеклеточный матрикс в кишечнике, более быстро и/или в большем количестве, чем с носителем, не содержащим ретиноид, и это может просто быть подтверждено посредством, например, добавления меченного или содержащего метку носителя к культуре целевых клеток и анализа распределения метки после предварительно определенного периода времени. Структурно, это требование может быть удовлетворено, например, если ретиноид по меньшей мере частично экспонирован на внешней стороне носителя (например, когда носитель имеет трехмерную структуру и т.д.) или готовой формы, содержащей носитель, как можно более поздно ко времени достижения целевых клеток. 'Готовая форма', как этот термин именуется здесь, представляет собой общее представление, которой включает композицию по настоящему изобретению, которая описана позже, и которая дополнительно имеет форму. Будет ли ретиноид экспонированным на внешней стороне готовой формы или нет, может быть оценено посредством контактирования готовой формы с веществом, которое специфически связывается с ретиноидом, таким как, например, ретинолсвязывающий белок (RBP), и исследования его связывания с готовой формой.
Экспонирование ретиноида по меньшей мере частично на внешней стороне носителя или готовой формы как можно более поздно ко времени достижения целевых клеток может достигаться, например, регулированием соотношения при составлении ретиноида и компонентов носителя, отличных от ретиноида. Кроме того, когда носитель имеет форму липидной структуры, такой как липосома, например, при образовании комплекса из ретиноида и компонента носителя, отличного от ретиноида, может применяться метод, в котором первую липидную структуру, образованную из компонента носителя, отличного от ретиноида, разбавляют в водном растворе, и этот раствор затем контактирует и смешивается и т.д. с ретиноидом. В этом случае ретиноид может находиться в состоянии, в котором он растворяется в растворителе, например, органическом растворителе, таком как ДМСО. Липидная структура, на которую здесь ссылаются, означает структуру, содержащую липид, в качестве компонента и имеющую любую трехмерную структуру, например форму, такую как линейная форма, пленочная форма или сферическая форма, и ее примеры включают, но не ограничены лишь перечисленным, липосому, мицеллу, липидную микросферу, липидную наносферу и липидную эмульсию. Возможность применить к другому носителю лекарственного средства такое же нацеливающее средство, как средство нацеливания липосомы описана, например, в Zhao and Lee, Adv Drug Deliv Rev. 2004; 56(8):1193-204, Temming et al., Drug Resist Updat. 2005; 8(6):381-402, и т.д.
Липидная структура может быть стабилизирована посредством, например, регулирования осмотического давления посредством применения средства, регулирующего осмотическое давление, такого как соль, сахарид, такой как сахароза, глюкоза или мальтоза или многоатомный спирт, такой как глицерин или пропиленгликоль, и предпочтительно, сахароза или глюкоза. Кроме того, может регулироваться рН посредством добавления соответствующего количества средства, регулирующего рН, такого как соль или буфер. Следовательно, является возможным осуществлять производство, хранение и т.д. липидной структуры в среде, содержащей указанные выше вещества. В этом случае, концентрацию средства, регулирующего осмотическое давление, предпочтительно регулируют таким образом, чтобы оно было изотоничным с кровью. Например, в случае сахарозы его концентрация в среде не ограничена, но может составлять от 3 15 масс. %, предпочтительно от 5 до 12 масс. %, более предпочтительно от 8 to 10 масс. %, и особенно 9 масс. %, и, в случае глюкозы ее концентрация в среде не является ограниченной но может составлять от 1 до 10 масс. %, предпочтительно от 3 до 8 масс. %, более предпочтительно от 4 до 6 масс. %, и особенно 5 масс. %.
Настоящее изобретение также относится к способу получения носителя для доставки вещества к клеткам, продуцирующим внеклеточный матрикс в кишечнике, способу, включающему в себя стадию получения ретиноида в виде нацеливающего средства для клеток, продуцирующих внеклеточный матрикс в кишечнике. Способ разработки рецептуры ретиноида не является особым образом ограниченным, поскольку в носителе, в котором его составляют, ретиноид может функционировать в качестве нацеливающего средства на клетки, продуцирующие внеклеточный матрикс в кишечнике, и, например, могут применяться разнообразные способы, описанные в настоящем изобретении. Следовательно, разработка рецептуры ретиноида может осуществляться посредством связывания ретиноида с или заключения его в еще один компонент носителя посредством химического и/или физического метода или посредством смешивания ретиноида с еще одним компонентом носителя при получении носителя. Количество ретиноида в готовой форме и т.д. является таким, как описано выше по отношению к носителю по настоящему изобретению.
Вещество, подлежащее доставке настоящим носителем, не является особым образом ограниченным, и оно предпочтительно имеет такой размер, что оно может физически двигаться в интервале организма от участка введения к участку повреждения, где присутствуют целевые клетки. Следовательно, носитель по настоящему изобретению может транспортировать не только вещество, такое как атом, молекула, соединение, белок или нуклеиновая кислота, но также объект, такой как вектор, вирусная частица, клетка, система высвобождения лекарственного средства, который включает один или несколько элементов или микромашину. Вещество, подлежащее доставке, предпочтительно имеет свойство проявления некоторого эффекта на целевые клетки, и примеры включают вещества, вводящие метку в целевые клетки или управляющие (например, увеличивающие или подавляющие) активность или рост целевых клеток.
Следовательно, в одном варианте выполнения настоящего изобретения, вещество, подлежащее доставке посредством носителя, включает 'лекарственное средство для контроля активности или роста клеток, продуцирующих внеклеточный матрикс в кишечнике'. Активность клеток, продуцирующих внеклеточный матрикс в кишечнике в настоящем изобретении, относится к разнообразным активностям, таким как секреция, поглощение или миграция, проявляемая клетками, продуцирующими внеклеточный матрикс в кишечнике, и в настоящем изобретении, в частности, среди перечисленных, она обычно означает активность, вовлеченную в появление, развитие и/или рецидив фиброза кишечника. Примеры такой активности включают, но не ограничены лишь перечисленными, продуцирование/секрецию компонента внеклеточного матрикса, такого как коллаген, протеогликан, тенасцин, фибронектин, тромбоспондин, остеопонтин, остеонектин или эластин, и подавление деструкционной активности этих компонентов внеклеточного матрикса.
Следовательно, лекарственное средство для контроля активности или роста клеток, продуцирующих внеклеточный матрикс в кишечнике, упоминаемое в настоящем изобретении, может представлять собой любое лекарственное средство, которое ингибирует непосредственно или косвенно физическое, химическое и/или физиологическое действие и т.д. этих клеток, вовлеченных в появление, развитие и/или рецидив фиброза кишечника; примеры включают, но не ограничены лишь перечисленными, вещества для ингибирования продуцирования и секреции компонентов внеклеточного матрикса и т.д., ингибитор роста клеток, апоптоз-индуцирующие вещества, ингибитор TIMP (тканевого ингибитора металлопротеазы), и ингибитор α1-антитрипсина.
Примеры веществ для ингибирования продуцирования и секреции компонента внеклеточного матрикса и т.д. включают, но не ограничены лишь перечисленными, вещество, такое как молекула PHKi, рибозим, или антисмысловая нуклеиновая кислота, или вещество, имеющее доминантный отрицательный эффект, такое как доминантный отрицательный мутант, который ингибирует экспрессию компонента внеклеточного матрикса, такого как коллаген, протеогликан, тенасцин, фибронектин, тромбоспондин, остеопонтин, остеонектин или эластин, вектор, экспрессирующий их, и клетки, трансформируемые им. Среди компонентов внеклеточного матрикса, лекарственные средства для ингибирования продуцирования и секреции коллагена включают, но не ограничены лишь перечисленными, ингибиторы HSP (белка теплового шока) 47, который является коллаген-специфичным молекулярным шапероном, существенным для внутриклеточного транспорта и молекулярного созревания, которые являются обычными для синтетических процессов разнообразных типов коллагена, например, ингибитор экспрессии HSP47, такой как молекула PHKi, рибозим или антисмысловая нуклеиновая кислота для HSP47, вещество, имеющее доминантный отрицательный эффект, такой как доминантный отрицательный мутант HSP47, вектор, экспрессирующий его, и клетки, трансформируемые им.
Примеры ингибитора роста клеток включают, но не ограничены лишь перечисленными, алкилирующее средство, такое как ифосфамид, нимустин (например, нимустина гидрохлорид), циклофосфамид, дакарбазин, мелфалан или ранимустин, антагонист метаболизма, такой как гемцитабин (например, гемцитабина гидрохлорид), эноцитабин, цитарабина окфостат, препарат цитарабина, тегафур/урацил, комбинированное лекарственное средство тегафур/гимерацил/отерацил калия (например, TS-1), доксифлуридин, гидроксикарбамид, фторурацил, метотрексат или меркптопурин, противоопухолевый антибиотик, такой как идарубицин (например, идарубицина гидрохлорид), эпирубицин (например, эпирубицина гидрохлорид), даунорубицин (например, даунорубицина гидрохлорид, даунорубицина цитрат), доксорубицин (например, доксорубицина гидрохлорид), пирпрубицин (например, пирарубицина гидрохлорид), блеомицин (например, блеомицина гидрохлорид), пепломицин (например, пепломицина сульфат), митоксантрон (например, митоксантрона гидрохлорид) или митомицин С, алкалоид, такой как этопозид, иринотекан (например, иринотекана гидрохлорид), винорелбин (например, винорелбина тартрат), доцетаксел (например, доцетаксела гидрат), паклитаксел, винкристин (например, винкристина сульфат), виндезин (например, виндезина сульфат) или винбластин (например, винбластина сульфат), лекарственное средство для гормональной терапии, такое как анастрозол, тамоксифен (например, тамоксифена цитрат), тореми