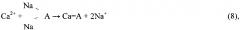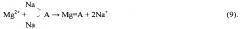Способ получения гипохлорита кальция при комплексной переработке природного поликомпонентного пересыщенного рассола хлоридного кальциево-магниевого типа
Иллюстрации
Показать всеИзобретение может быть использовано в химической промышленности. Способ получения гипохлорита кальция из пересыщенного природного поликомпонентного рассола хлоридного кальциево-магниевого типа включает выделение из рассола кристаллогидрата хлорида кальция и отделение маточного рассола, обогащенного литием и бромом. Проводят мембранный или диафрагменный электролиз водного раствора хлорида натрия для производства хлора и католита. Получают раствор гипохлорита натрия путем эжектирования анодного хлора потоком католита - раствором NaOH. Гипохлорит кальция получают обменной реакцией между гидроксидом кальция и гипохлоритом натрия. Полученный гипохлорит кальция отделяют от маточного раствора и сушат. Маточный раствор перерабатывают с возвратом NaCl в производство. Сначала природный пересыщенный поликомпонентный рассол охлаждают до 0…-1°С, получая твердую фазу кристаллогидрата CaCl2⋅6Н2О с примесью кристаллогидрата MgCl2⋅6H2O и жидкую фазу. Кристаллогидраты отделяют от жидкой фазы, нагревают в присутствии NaOH и перемешивают, отделяя CaCl2⋅6Н2О от твердой фазы MgCl2⋅6H2O и образовавшейся твердой фазы Mg(OH)2. Очищенный от магния CaCl2⋅6Н2О приводят в контакт с католитом. Образующуюся пульпу центрифугируют с получением кека в виде Са(ОН)2 и фугата в виде раствора NaCl, который после очистки от кальция возвращают на операцию мембранного электролиза для получения католита и хлора. Изобретение позволяет осуществить процесс получения гипохлорита кальция в непрерывном режиме, снизить энергоемкость процесса, сократить затраты греющего пара, повысить выход гипохлорита кальция. 2 з.п. ф-лы, 3 ил., 5 пр.
Реферат
Область техники
Изобретение относится к технологии получения хлорсодержащих окислительно-отбеливающих и дезинфицирующих веществ, в частности к технологии получения гипохлорита кальция с использованием в качестве сырьевого источника природного поликомпонентного перенасыщенного рассола хлоридного кальциево-магниевого типа.
Уровень техники
Известен способ, реализованный на практике впервые немецкой фирмой «Грикгейм-электроника», получения гипохлорита кальция, основанный на хлорировании 30%-ного известкового молока до выделения хорошо фильтруемой двухосновной соли Са(ClO)2⋅2Са(ОН)2, состоящей из гипохлорита кальция и гидроксида кальция (А.А. Фурман. Хлорсодержащие окислительно-отбеливающие и дезинфицирующие вещества. Москва, изд. «Химия», 1976, с. 35). Существенным недостатком данного способа является низкое содержание (не более 43% мас.) активного хлора в производимом продукте.
С целью повышения содержания активного хлора этой же фирмой способ был доработан (патент Германии №373847, 1921 г.) [1] в части снижения содержания Са(ОН)2 в производимом продукте. По данному способу хлорирование исходной суспензии Са(ОН)2 проводили при 40-50°С до остаточного содержания Са(ОН)2 около 2% мас. После чего полученную пульпу фильтровали, отжатую массу размалывали и сушили. Доводя содержание активного хлора в продукте до 70%. Недостатком данного способа является необходимость использования для фильтрации суспензии уникального гидравлического пресса с рабочим давлением процесса фильтрации 15 кгс/см2 и высокий риск проскока хлора на заключительной стадии процесса хлорирования.
В США фирма «Мэгисон» использует способы получения гипохлорита кальция (патент США №1713668, 1926, патент США №1767048, 1930) [1], основанные на хлорировании смеси известкового молока и каустической соды. В результате обменной реакции между NaOCl и CaCl2 в конечном продукте содержится незначительное количество хлористого кальция, что существенно облегчает фильтрование суспензий и сушку отжатого продукта. Главным недостатком всех способов получения Са(OCl)2 с использованием извести, вообще, и данного способа, в частности, является наличие в извести большого количества примесей (СаСО3, CaSO4, MgO, Al2O3, Fe2O3, SiO2), отрицательно влияющих на показатели технологического процесса. Сульфат кальция и двуокись кремния повышают содержание в готовом продукте нерастворимых в воде примесей. Окись железа переходит в феррат, окись магния - в хлорит магния, придавая раствору красный оттенок. Кроме того, наличие примесей железа и магния приводит к повышению расхода хлора, так как они являются катализаторами разложения гипохлорита. Неблагоприятно влияет на фильтрацию свежеосажденный карбонат кальция, образующийся при взаимодействии Са(ОН)2 с двуокисью углерода, содержащейся в воздухе или хлоргазе. Повышенное содержание SiO2 и MgO в известковом молоке повышает вязкость суспензии настолько, что это, во-первых, затрудняет перекачивание жидкой фазы, а во-вторых, ухудшает условия хлорирования.
Известен также технологический процесс получения нейтрального гипохлорита кальция (А.А. Фурман. Хлорсодержащие окислительно-отбеливающие и дезинфицирующие вещества, Москва, «Химия», с. 41-44), состоящий из следующих стадий: приготовление раствора гипохлорита натрия путем хлорирования концентрированного раствора NaOH, приготовление известкового молока путем гашения СаО, произведенного из известняка, приготовление известково-каустической смеси путем смешивания раствора гипохлорита натрия с известковым молоком, фильтрация отхлорированной массы и сушка полученного кека гипохлорита кальция с получением продукта, содержащего не менее 60% активного хлора.
К недостаткам способа следует отнести: периодичность процесса, необходимость изменения режима хлорирования, приводящую к разбавлению хлора воздухом, большое количество элементного (свободного) хлора, единовременно находящегося в оборудовании, низкую степень возврата поваренной соли (не более 22%).
Способ получения гипохлорита кальция в составе технологии комплексной переработки в товарные продукты из пересыщенного природного поликомпонентного рассола хлоридного кальциево-магниевого типа (патент RU №2543214) устраняет недостатки вышеописанных способов ввиду исключения из технологического процесса извести. По данному способу гипохлорит кальция производят обменной реакцией между хлоридом кальция, получаемым из природного рассола в виде концентрированного водного раствора CaCl2, и раствором гипохлорита натрия, произведенным эжектированием анодного хлора потоком католита (раствор NaOH), с последующим взаимодействием эжектированного анодного хлора с NaOH, анодный хлор и католит в свою очередь получают электролизом водного раствора поваренной соли, образующийся в результате обменной реакции осадок гипохлорита кальция отделяют от маточного раствора и сушат при 80°С, а маточный раствор перерабатывают, возвращая NaCl и CaCl2 в производственный процесс. Этот способ является наиболее близким к предлагаемому способу получения гипохлорита кальция и выбран авторами в качестве прототипа.
Основными недостатками данного способа являются:
а) использование для проведения обменной реакции водного раствора CaCl2, что неизбежно приводит к образованию большого объема маточного раствора на операции осаждения гипохлорита кальция обменной реакцией, и низкий выход гипохлорита кальция;
б) загрязнение гипохлорита кальция кристаллами поваренной соли и хлоридом кальция в процессе проведения обменной реакции;
в) высокое содержание магния в растворе CaCl2, используемом при проведении обменной реакции, что снижает содержание активного хлора в получаемом продукте;
г) высокое содержание хлората натрия в кристаллах поваренной соли, необходимость переработки маточного раствора операции осаждения гипохлорита кальция упариванием с целью утилизации NaCl и CaCl2⋅6H2O;
д) высокое содержание хлорита кальция в кристаллах поваренной соли, осаждаемой при упаривании маточного раствора операции осаждения гипохлорита кальция обменной реакцией;
е) низкий выход получаемого гипохлорита кальция при проведении обменной реакции;
ж) отсутствие решений по утилизации катодного водорода, обладающего высокой теплотворной способностью; загрязнение атмосферного воздуха продуктами разложения гипохлорита при сушке.
Главными отличительными признаками заявляемого способа являются:
а) использование расплава CaCl2⋅6H2O вместо раствора CaCl2, что позволяет добиться предельно высокого выхода гипохлорита кальция при проведении обменной реакции и получить продукт с содержанием активного хлора не менее 65% мас.;
б) последовательность и параметры технологических операций, позволяющих получить раствор гипохлорита натрия с максимальной концентрацией NaOCl и минимальным содержанием NaCl;
в) последовательность и параметры технологических операций, позволяющих получить осадок гипохлорита кальция обменной реакцией пульпы Са(ОН)2 с раствором гипохлорита натрия в непрерывном режиме;
г) использование расплава CaCl2⋅6H2O и католита для получения Са(ОН)2;
д) использование катодного водорода в качестве энергоносителя для производства греющего пара.
Сущность изобретения
Технический результат достигается тем, что:
а) природный пересыщенный поликомпонентный рассол хлоридного кальциево-магниевого типа охлаждают до 0…-1°С, получая твердую фазу кристаллогидрата CaCl2⋅6H2O с примесью кристаллогидрата MgCl2⋅6H2O и жидкую фазу рассола, поступающего на комплексную переработку для получения литиевых и бромных продуктов. Кристаллогидраты отделяют и нагревают до температуры 40-50°С, в присутствии NaOH и перемешивают в течение 45-60 мин в режиме термостатирования, отделяя затем расплав кристаллогидрата CaCl2⋅6H2O от твердой фазы кристаллогидрата MgCl2⋅6H2O и образовавшейся твердой фазы Mg(OH)2 центрифугированием или фильтрацией в режиме термостатирования;
б) очищенный от магния расплав CaCl2⋅6H2O приводят в контакт с католитом, образующуюся пульпу центрифугируют с получением кека в виде Са(ОН)2 и фугата в виде раствора NaCl, который после очистки от кальция возвращают на операцию мембранного электролиза для получения католита - раствора NaOH и хлора;
в) эжектирование анодного хлора осуществляют непосредственно из анодного газоотделителя электролизного агрегата: первую половину массы хлора в поток постоянно охлаждаемого раствора циркулирующего в замкнутом контуре: эжектор анодного хлора - отстойник-сгуститель, с постоянным выводом из отстойной зоны отстойника-сгустителя потока сгущенной пульпы с показателем остаточной щелочности 4-10 г/л и постоянным вводом в циркулирующий раствор на выходе его из осветленной зоны отстойника-сгустителя потока исходного католита с концентрацией NaOH 32-33,8% мас., центрифугирование выводимой из отстойника-сгустителя пульпы с получением кристаллов хлорида натрия и фугата, представляющего собой продуктивный раствор гипохлорита натрия, содержащего 25,0-27,3% мас. NaOCl, кристаллы хлорида натрия растворяют в деминерализованной воде с добавкой карбамида (NH2)2CO для разложения гипохлорит-ионов и смешивают с раствором NaCl, образующимся на операции получения Са(ОН)2, получая водный раствор хлорида натрия концентрацией 26,0-26,4% мас., полученный водный раствор хлорида натрия вначале подвергают реагентной обработке, осаждая кальций и магний карбонатно-щелочным методом и используя в качестве реагентов NaOH и CO2 или Na2CO3; раствор NaCl после реагентной обработки фильтруют, удаляя дисперсную фазу осажденных примесей, фильтрат подвергают глубокой очистке от остатков кальция, магния и тяжелых металлов на ионообменных амфолитах в Na-форме, например Lewatit 208-ТР или Amberlite, и направляют на операцию электролиза для получения католита и хлора;
г) постоянно выводимый из отстойника-сгустителя поток продуктивного раствора гипохлорита натрия подают на распульповку кека Са(ОН)2, полученную пульпу дозируют в поток постоянно охлаждаемого осветленного гипохлоритного раствора, циркулирующего в замкнутом контуре: эжектор второй половины массы анодного хлора - отстойник-сгуститель образующейся твердой фазы Са(OCl)2⋅3H2O, с постоянным выводом из отстойной зоны отстойника-сгустителя потока сгущенной нейтральной пульпы и ее последующим центрифугированием с получением подаваемого на сушку кека в виде твердой фазы Са(OCl)2⋅3Н2О с примесью NaCl и NaOCl⋅5H2O и фугата, направляемого на смешивание с осветленным раствором, циркулирующим в замкнутом контуре: эжектор первой половины анодного хлора – отстойник-сгуститель кристаллов NaCl; с целью повышения содержания активного хлора в получаемом продукте неустойчивый при сушке NaOCl⋅5H2O переводят в устойчивый Са(OCl)2⋅3H2O путем перемешивания кека с заданным объемом расплава CaCl2⋅6Н2О;
д) катодный водород, образующийся на операции электролиза раствора хлорида натрия, эжектируют непосредственно из катодного газоотделителя электролизного агрегата в поток пропан-бутановой газовой смеси, а полученную газовую смесь водорода с пропан-бутаном применяют в качестве энергоносителя для получения греющего пара, используемого на операциях сушки гипохлорита кальция, плавления CaCl2⋅6H2O и термостатирования;
е) осадок шестиводного хлорида магния в смеси с Mg(OH)2, отделенный от расплава CaCl2⋅6H2O, используют в качестве сырья для получения товарных магниевых продуктов: магнезиального цемента и магнезии.
Технический результат достигается также тем, что: сушку гипохлорита кальция осуществляют при разрежении 50-100 мм вод.ст. потоком воздуха, направленного противоточно движению Са(OCl)2 в сушильном агрегате и циркулирующего в замкнутом контуре: сушильный агрегат - рекуператор - охладитель - конденсатор водяных паров - туманоуловитель - подогреватель - сушильный агрегат, при этом температуру циркулирующего потока воздуха поддерживают на входе в сушильный агрегат в диапазоне 150-160°С, на выходе из сушильного агрегата в диапазоне 85-90°С, на выходе из охладителя-конденсатора 20-25°С, удаляя таким образом влагу из гипохлорита кальция и превращая ее в выводимый из циркулирующего потока воздуха конденсат водяного пара.
Предлагаемый способ получения гипохлорита кальция при комплексной переработке природного поликомпонентного пересыщенного по CaCl2 рассола хлоридного кальциево-магниевого типа в сравнении с прототипом позволяет: осуществить процесс получения гипохлорита кальция в непрерывном режиме; в два раза повысить выход Са(OCl)2 на операции его осаждения обменной реакцией; вернуть в производство до 88% хлорида натрия, исключив при этом образование маточного раствора, требующего переработки; компенсировать полностью затраты тепловой энергии, необходимой для плавления, термостатирования и сушки готового продукта, за счет использования тепла от сжигания катодного водорода, являющегося побочным продуктом электролиза; исключить необходимость создания системы очистки потока сушильного газа за счет решения по организации замкнутой системы в процессе сушки, одновременно снизив риск разложения Са(OCl)2 в процессе его контакта с горячим воздушным потоком.
Сведения, определяющие порядок взаимодействия предлагаемых решений по реализации данного способа получения гипохлорита кальция при комплексной переработке природного поликомпонентного пересыщенного рассола хлоридного кальциево-магниевого типа на практике, представлены на фигуре 1 и в примерах 1-5.
Фиг.1. Технологическая схема производства гипохлорита кальция при комплексной переработке природного поликомпонентного пересыщенного рассола хлоридного кальциево-магниевого типа.
Фиг. 2. Таблица составов кристаллогидратов, получаемых при охлаждении рассола, пересыщенного по содержанию CaCl2 при различных температурах.
Фиг. 3. Таблица составов гипохлорита натрия, получаемого при эжектировании хлора в раствор гидроксида натрия.
Возможность практической реализации данного способа получения Са(OCl)2 показывает технологическая схема, представленная на фиг. 1. Технологическая схема производства гипохлорита кальция при комплексной переработке природного поликомпонентного рассола включает следующие переделы: передел выделения из природного рассола кристаллогидрата CaCl2⋅6H2O с получением расплава CaCl2⋅6H2O, очищенного от кристаллов MgCl2⋅6H2O, растворенного в расплаве MgCl2; передел получения католита (раствор NaOH) и хлора электролизом раствора поваренной соли; передел получения продуктивного раствора гипохлорита натрия; передел получения Са(ОН)2 взаимодействием католита с расплавом CaCl2⋅6H2O; передел переработки побочных продуктов в виде раствора поваренной соли и кристаллов NaCl в раствор хлорида натрия, пригодного для производства NaOH и Cl2 мембранным электролизом; передел получения гипохлорита кальция обменной реакцией при хлорировании известково-каустической смеси в избытке гипохлорита натрия. В соответствии с представленной схемой исходный природный рассол, имеющий температуру 36°С, охлаждают до температуры 0…-1°С, высаливая из рассола кристаллогидрат CaCl2⋅6H2O с примесью кристаллогидрата MgCl2⋅6H2O. Температурный интервал операции охлаждения обосновывается спецификой поведения лития в охлаждаемом рассоле. По мере охлаждения рассола, высаливания кристаллогидратов литий остается в фазе рассола и вплоть до температуры -1°С в твердой фазе выпавших кристаллогидратов присутствует исключительно в составе захватываемого кристаллогидратами маточного рассола. При дальнейшем охлаждении литий частично начинает со осаждаться с кристаллогидратами в виде двойных солей LiCl⋅CaCl2⋅6H2O и LiCl⋅MgCl2⋅6H2O. Ввиду того что дальнейшее понижение температуры рассола не только не обогащает его по литию, но и приводит неизбежно к безвозвратной потере лития, с точки зрения использования маточного рассола после выделения кристаллогидратов для производства литиевых продуктов в составе технологии комплексной переработки природного рассола данного типа, охлаждать рассол до температуры ниже -1°С не целесообразно. В тоже время с точки зрения создания условий для достижения максимальной производительности операции по выводу кристаллогидратов из рассола, при исключении потери лития охлаждать рассол до температур выше 0°С тоже не целесообразно.
Осажденные кристаллогидраты отделяют от маточного рассола центрифугированием, маточный рассол, обогащенный почти на 50% по литию и брому, используют в качестве сырья в производстве литиевых и бромных продуктов. В свою очередь полученные кристаллы CaCl2⋅6H2O и MgCl2⋅6H2O нагревают до температуры 40-50°С, добавляя расчетное количество католита для перевода растворенного магния в нерастворимый Mg(OH)2 при перемешивании. При этом CaCl2⋅6H2O переходит в жидкую фазу, a MgCl2⋅6H2O остается твердофазным вследствие различия в температурах плавления (температура плавления CaCl2⋅6H2O - 30°С, а температура плавления MgCl2⋅6H2O - 110°С), растворенный в расплаве CaCl2⋅6H2O магний переходит в нерастворимый гидроксид магния по реакции:
Далее MgCl2⋅6H2O и Mg(OH)2 отделяют от расплава CaCl2⋅6H2O центрифугированием или фильтрацией в режиме термостатирования. Температурный интервал операции плавления обосновывается: нижний предел - исключением риска вторичной кристаллизации CaCl2⋅6H2O, верхний предел - слабым влиянием температуры на повышение вязкости и текучести расплава за пределом 50°С. Кристаллы MgCl2⋅6H2O (бишофита) в смеси с Mg(OH)2 используют в качестве сырья для производства цементного камня (цемент Сореля) и различного рода магнезий (порошков MgO), а освобожденный от MgCl2⋅6H2O расплав CaCl2⋅6H2O направляют в качестве кальциевого реагента на операцию получения гидроксида кальция обменной реакцией с католитом.
Образующуюся пульпу центрифугируют, получая кек Са(ОН)2 и фугат, представляющий собой концентрированный раствор NaCl, который совместно с NaCl, выводимым с других переделов после очистки от кальция, возвращают на электролиз.
В свою очередь получение продуктивного раствора гипохлорита натрия осуществляют взаимодействием производимых электролизом водного раствора поваренной соли католита (раствор NaOH) и хлора по реакции:
Исходный раствор поваренной соли (содержание NaCl 26,0-26,4% мас.) получают растворением кристаллической товарной поваренной соли в воде. Полученный раствор вначале очищают от кальция и магния реагентным карбонатно-щелочным методом, используя в качестве реагентов NaOH, CO2 или Na2CO3. По этому методу очистка раствора NaCl от кальция и магния осуществляется путем перевода их в нерастворимые соединения по реакциям:
После завершения реагентной обработки раствор фильтруют, удаляя осажденные примеси, и далее подвергают глубокой ионообменной очистке на амфолите в Na-форме (DCR72, Lewatit Т.Р.208, Amberlite или их аналоги). Процесс ионообменной очистки описывается следующими уравнениями реакций:
Регенерацию отработанного амфолита производят раствором соляной кислоты по реакциям:
Раствор 2N соляной кислоты, необходимой для проведения регенерации амфолита может быть получен абсорбцией анодного хлора водным раствором карбамида по реакции:
Перевод амфолита из Н-формы в Na-форму осуществляют 5%-ным раствором католита по реакции:
Очищенный до остаточных концентраций магния и кальция менее 0,5 мг/дм3 раствор NaCl поступает на мембранный электролиз, где в циркуляционном и циркуляционно-подпиточном режиме подается в тракт анолита. В процессе мембранного электролиза осуществляется конверсия NaCl в NaOH и Cl2 по реакциям:
Вывод католита осуществляется в циркуляционно-отборном режиме. Для того чтобы получить в дальнейшем продуктивный раствор гипохлорита с предельно высоким содержанием NaOCl, концентрация NaOH в выводимом потоке католита должна находиться в пределах 32,0-33,8% мас.
Контакт анодного хлора с католитом в процессе производства продуктивного раствора гипохлорита натрия обеспечивают в режиме эжектирования половины анодного хлора непосредственно из газоотделителя потоком гипохлоритно-щелочного раствора в режиме циркуляции через отстойник-осветлитель. Ввиду того что реакция взаимодействия хлора с NaOH экзотермична, с целью предотвращения разложения гипохлорит ионов при взаимодействии NaOH с Cl2 циркулирующий с достаточно высокой скоростью раствор постоянно охлаждают на входе в эжектор из расчета поддержания температуры раствора на входе в отстойник-сгуститель в диапазоне 28-30°С. Поскольку в процессе взаимодействия гипохлоритно-щелочного раствора с хлором и генерирования NaOCl, более 50% попутно образующегося NaCl высаливается и на вход в отстойник-сгуститель из эжектора поступает суспензия, представляющая собой взвесь кристаллов NaCl в продуктивном растворе гипохлорита натрия. Заданный поток сгущенной пульпы постоянно выводят из отстойника-сгустителя на центрифугирование, отделяя продуктивный раствор гипохлорита натрия с содержанием NaOCl 25,0-27,3% мас. от кристаллов NaCl, которые смешивают с раствором NaCl, образующемся на операции получения Са(ОН)2, добавляют карбамид для разложения остаточного количества гипохлорит-ионов по реакции:
и после очистки от магния и кальция (реакции 4-14) возвращают на электролиз. Осветленный поток продуктивного раствора гипохлорита натрия на выходе из отстойника-сгустителя подпитывают постоянно охлаждаемым католитом.
Продуктивный раствор гипохлорита натрия после отделения кристаллов поваренной соли смешивают с Са(ОН2) и образующуюся пульпу дозируют в поток осветленного и постоянно охлаждаемого перед входом в эжектор анодного хлора осветленного циркуляционного гипохлоритного раствора, выводимого из отстойника сгустителя. Смешанный охлажденный поток эжектирует и поглощает вторую половину от массы образующегося анодного хлора непосредственно из газоотделителя (аналогично операции получения продуктивного раствора NaOCl). В процессе поглощения хлора в избытке гипохлорита натрия образуется и выпадает в осадок Са(OCl)2⋅3H2O по реакции:
Ввиду того что реакция (18) экзотермична для предотвращения разложения гипохлорит-ионов циркулирующий с достаточно высокой скоростью осветленный гипохлоритный раствор постоянно охлаждают по аналогии с получением продуктивного раствора гипохлорита натрия. Кроме того, для минимизации разложения гипохлорит-ионов в циркуляционный раствор периодически вводят небольшие количества хромата калия. Сгущенную фазу с заданным расходом выводят из отстойника-сгустителя на центрифугирование. Обращающийся в процессе центрифугирования фугат направляют в отстойник-сгуститель операции получения продуктивного раствора гипохлорита натрия, а кек, представляющий собой смесь твердой фазы Са(OCl)2⋅3H2O (не менее 80% мас.) с примесью NaCl и NaOCl⋅5H2O, подают на сушку. С целью повышения содержания активного хлора в получаемом продукте неустойчивый при сушке NaOCl⋅5H2O переводят в устойчивый Са(OCl)2⋅3H2O путем перемешивания кека с заданным объемом расплава CaCl2⋅6H2O по реакции:
Освобожденный от NaOCl осадок трехводного гипохлорита кальция, содержащий NaCl и H2O в качестве примесей, сушат в токе горячего воздуха (газ-теплоноситель), перемещающегося противоположно движению обезвоживаемого Са(OCl)2. При этом процесс сушки организован без выброса теплоносителя в атмосферу. С этой целью воздушный поток нагревают до 150-160°С, приводят в противоточный контакт с гипохлоритом кальция. В процессе контакта с влажным Са(OCl)2 газ-теплоноситель поглощает влагу, постепенно охлаждаясь с повышением влагосодержания. Газ-теплоноситель покидает зону сушки с температурой 90-95°С и 100% влажностью, далее газ-теплоноситель, рекуперируя тепло, охлаждают до температуры 20-25°С, конденсируя и выводя из него влагу, а также освобождая от выносимых капель (тумана). Пройдя стадию туманоулавливания, газ-теплоноситель при температуре 20-25°С и 100% влажности подогревают до 150-160°С и возвращают на сушку. Такой режим сушки позволяет, с одной стороны, исключить выброс газа-теплоносителя со 100% влажностью и продуктами разложения Са(OCl)2 в атмосферный воздух, с другой стороны, снизить степень разложения Са(OCl)2 при сушке ввиду постоянного присутствия в газе-теплоносителе равновесных концентраций газообразных продуктов разложения обезвоживаемого продукта, препятствующих процессу его термодеструкции. Высушенный гипохлорит кальция с содержанием активного хлора не менее 65% измельчают и фасуют.
Возможность реализации заявленного способа на практике подтверждается нижеследующими примерами.
Пример 1. Для определения температурного интервала при осаждении кристаллогидрата хлорида кальция из пересыщенного рассола хлоридного кальциевого типа был проведен эксперимент с использованием рассола Знаменского месторождения Иркутской области по его охлаждению в холодильной камере, оборудованной видеосистемой с точностью определения температуры ±3°С. После выдержки рассола в сосуде высотой 17 см при заданной температуре осадок фильтровали при той же температуре. Осадок и маточный раствор анализировали на содержание CaCl2, MgCl2, LiCl и Br2. В исследуемом интервале температур от +20°С до -20°С снижение минерализации рассола происходит в основном за счет кристаллизации CaCl2⋅6H2O. При этом в интервале температур от +25°С до -1°С совместно с CaCl2⋅6H2O соосаждается MgCl2⋅6H2O в существенно меньших количествах.
Глубина осаждения кристаллогидратов кальция и магния влияет на содержание хлорида лития и брома в маточном рассоле. В исследованном интервале температур концентрация LiCl повышается с 2.85 г/л до 3.26 г/л, а концентрация брома - с 2.86 г/л до 13.7 г/л (фиг. 2). Однако начиная с температуры -1°С и ниже часть хлорида лития соосаждается с кристаллогидратом MgCl2⋅6H2O в виде двойной соли LiCl⋅MgCl2⋅6H2O либо с кристаллогидратом CaCl2⋅6H2O в виде двойной соли LiCl⋅CaCl2⋅5H2O.
Отсюда следует вывод, что при комплексной переработке пересыщенного по CaCl2 рассола выделение кристаллогидрата CaCl2⋅6H2O с примесью MgCl2⋅6H2O следует проводить при температуре до -1°С, чтобы избежать потерь хлорида лития.
Пример 2. Исходный поликомпонентный природный рассол Знаменского месторождения Иркутской области в количестве 0.1 м3 охлаждали до температуры -1°С, выпавший осадок кристаллогидратов отделяли от маточного раствора, делили примерно на 3 равные части. Одну часть осадка отфильтровывали без использования вакуума (образец №1), две другие части осадка подвергали центрифугированию в фильтрационном режиме, получая образцы осадка №2 и №3.
Все образцы нагревали до температуры 50°С, в образец №3 добавляли NaOH из расчета 2 г-моля на 1 г-моль магния, растворенного в расплаве CaCl2⋅6H2O, и перемешивали в течение 30 мин в условиях термостатирования. Все образцы фильтровали и определяли содержание магния в фильтратах.
Содержание магния в фильтратах образцов №1 и №2 составило соответственно 2.0 и 0.7% мас., а в фильтрате образце №3 - менее 0,01% мас. Полученные результаты показывают, что переход магния в расплав CaCl2⋅6H2O определяется растворением в расплаве маточного раствора, содержащегося в осадке вымороженного кристаллогидрата, поскольку при центрифугировании осадка (образец №2) маточного раствора остается по весу почти в три раза меньше, чем при гравитационной фильтрации (образец №1). Содержание магния в расплаве образца №2 оказалось почти в три раза ниже, чем в расплаве образца №1. Добавка NaOH в расплав обеспечивает практически полное удаление из него магния (образец №3).
Пример 3. На специальной лабораторной установке, содержащей биполярный мембранный электролизер с мембранами Nafion, циркуляционные насосы, соединенные посредством поливинилхлоридных шлангов всасывающими патрубками с католитным и аниолитным бачками и выходными патрубками через католитный и анолитный тракты, и газоотделителем также с католитным и аниолитным бачками, проводили получение продуктивного раствора гипохлорита натрия. В состав установки также входил бак-накопитель католита и бак для приготовления анолита (раствор NaCl), отстойник-сгуститель, нутч-фильтр для отделения кристаллов NaCl из пульпы, выводимой из отстойника-сгустителя, и получения продуктивного раствора гипохлорита натрия, циркуляционный насос, направляющий поток циркулирующего раствора из осветленной зоны отстойника-сгустителя через холодильник в эжектор, соединенный своим всасывающим патрубком через дроссель с патрубком газоотделителя анолитного тракта, расположенным в верхней зоне газоотделителя, и далее на вход отстойника-сгустителя, газовый баллон, из которого пропанобутановая газовая смесь под давлением поступала в эжектор, всасывающий патрубок которого через дроссель соединялся с патрубком, установленным в верхней зоне газоотделителя католитного тракта. Получаемую смесь водорода (30%) с пропан-бутаном сжигали в газовой горелке. В газоотделителях поддерживали разрежение 10-15 мм вод.ст. Для проведения эксперимента готовили водный раствор NaCl концентрацией 26.3% мас., используя поваренную соль «Экстра», деминерализованную воду, полученный раствор NaCl использовали в качестве электролита для получения NaOH и хлора. В отстойник-сгуститель заливали 1 кг концентрированного раствора NaOH, приготовленного растворением товарного безводного NaOH в деминерализованной воде. Запускали установку и проводили эксперименты, контролируя щелочность в циркулирующем растворе, эжектирующем хлор из анодного газоотделителя. Эксперименты проводили, используя для поглощения Cl2 модельные щелочные растворы с содержанием NaOH 32, 33, 33.8 и 34% мас. В процессе проведения каждого эксперимента образующийся католит собирали в накопитель щелочи. При этом концентрацию NaOH в отводимом растворе поддерживали в каждом эксперименте на уровне, соответствующем уровню содержания NaOH в исходном маточном растворе, используемом для поглощения хлора. Эксперимент заканчивали, когда циркулирующий щелочной раствор переходил в нейтральный. Образующуюся в отстойнике-сгустителе пульпу взвешивали, фильтровали, отделяя кристаллы NaCl от раствора гипохлорита натрия. Фильтрат анализировали на содержание NaOCl и NaCl. Полученные результаты представлены в таблице на фиг. 3. Из полученных результатов однозначно следует, что концентрация NaOH в католите не должна быть выше 33.8% мас. во избежание высаливания NaOCl из раствора. Также нецелесообразно поддерживать концентрацию NaOH в католите ниже 33% мас., поскольку это приводит к значимому снижению концентрации NaOCl и повышению концентрации NaCl (примесь) в продуктивном растворе гипохлорита натрия.
Пример 4. На лабораторных установках по методикам, описанным в примерах 2 и 3, было получено 2 кг очищенного от магния расплава CaCl2⋅6H2O (содержание кальция 0,710 кг) и 13 кг циркуляционного гипохлоритного раствора путем эжектирования анодного хлора католитом (раствор NaOH 32% мас.) (содержание NaCl и NaOCl 27.0 и 8.9% мас. соответственно). Растворением CaO2⋅6H2O в воде при комнатной температуре было получено 2,51 кг содержащего 2,5% мас. CaCl2 (содержание кальция 0,710 кг). Циркуляционный гипохлоритный раствор разделили на две равные весовые части. Одну часть использовали при получении гипохлорита кальция по способу прототипа. Другую часть использовали при получении гипохлорита кальция по предлагаемому способу. Расплав CaCl2⋅6H2O (2 кг) обрабатывали 2.3 кг католита (раствор NaCl 32% мас.). Образовавшуюся пульпу фильтровали, получая кек Са(ОН)2 влажностью 30%. Для проведения сравнительных испытаний было наработано 5.32 кг продуктивного раствора NaOCl для проведения испытаний по способу прототипа (образец №1) и 2.66 кг продуктивного раствора NaOCl для проведения испытаний по предлагаемому способу (образец №2). Образец №1 смешивали с 2.51 кг 42.5% раствора CaCl2, получая гипохлорит кальция обменной реакцией по прототипу. Образец №2 использовали для распульповки кека Са(ОН)2. Полученную пульпу использовали для получения гипохлорита кальция по схеме, представленной на фиг. 3: дозировали пульпу в поток циркуляционного гипохлоритного раствора, эжектирующего хлор, проводя обменную реакцию по предлагаемому способу. Выход твердой фазы Са(OCl)2⋅3H2O по способу-прототипу составил 36.1%, а по предлагаемому способу - 74.4%. Содержание хлорида натрия в осадках по способу-прототипу составило 28.7%, а по предлагаемому способу - 11.8%. Возврат в производство по прототипу составил 83.6% с учетом переработки маточного раствора, а по предлагаемому способу до - 88.2% при отсутствии маточного раствора, требующего переработки.
Пример 5. В лабораторных условиях по методикам, прописанным в примерах 1. 2, 3, 4, из природного пересыщенного поликомпонентного рассола Знаменского месторождения Иркутской области было получено 0.464 кг влажного продукта - гипохлорита кальция. Полученный продукт разделили на два равных по весу образца. Образец №1 сушили в токе воздуха, циркулирующего в замкнутой системе, до остаточного влагосодержания 3-4% в шнековой противоточной сушилке. Образец №2 сушили проточным воздухом. Температуру воздушного потока на входе в сушилку в обоих случаях поддерживали в пределах 150-160°С, а на выходе - 90-95°С. После окончания сушки вес образца №1 при остаточном влагосодержании 3.7% мас. составил 154.3 г, а образца №2 при остаточном влагосодержании 3.9% мас. - 150.7 г. Полученные результаты однозначно показывают, что сушка гипохлорита кальция в замкнутой системе не только предотвращает выброс продуктов термического разложения высушиваемого продукта, но и снижает степень его разложения.
Промышленная применимость
Способ получения гипохлорита кальция в рамках комплексной переработки пересыщенных по хлориду кальция рассолов хлоридного Ca-Mg типа при использований осажденного кристаллогидрата позволяет сократить в 1.4 раза массу воды при упаривании маточного рассола после обменной реакции осаждения Са(OCl)2, тем самым сократить затраты греющего пара, а также компенсировать на 70-80% тепловой энергии, необходимой для упаривания маточного раствора и промывных вод и для сушки гипохлорита кальция, за счет использования тепла от сжигания катодного водорода, являющегося побочным продуктом электролиза. Замкнутая система сушки позволяет исключить необходимость создания системы очистки потока сушильного газа.
Осаждение кристаллогидрата CaCl2⋅6Н2О в выбранных условиях позволяет исключи