Производные арилциклоалкиламинов, нейропротектор (варианты), вещество, обладающее сочетанным нейропротекторным, анальгетическим и антидепрессивным действием, фармацевтические композиции на его основе
Иллюстрации
Показать всеИзобретение относится к новым арилциклоалкиламинам общей формулы (I), обладающим нейропротективным, анальгетическим и антидепрессивным действием. Соединения могут быть использованы для лечения нейродегенеративных заболеваний, боли и депрессии. Такими заболеваниями могут быть болезнь Паркинсона, деменция, инсульт, болезнь Альцгеймера, эпилепсия, шизофрения, депрессия. В общей формуле (I)
R1, R2 означают Н, линейный или разветвленный алкил (C1-C4), линейный или разветвленный алкокси (C1-C4), галоген; Y оначает -СН2-O-СН2-, -(СН2)n-, где n: 1-3; X означает -CO-NH-(CH2)6-, -CO-(CH2)k-, -CH2-NH-(CH2)6-, -CH(CH3)-NH-(CH2)6-, -(CO)p-(CHR5)m, где p, m-: 0, 1, k: 2, 4-7, R5: H, линейный алкил C1-C5; R3, R4 представляют собой H, линейный алкил C1-C4, -CH2-C≡CH, -(CH2)2-O-(CH2)2-NH2, циклопропил, циклопропилметил; 4-пиридинил, аминокислотный остаток протеионогенной ациклической или ароматической α-аминокислоты, γ-аминомасляной кислоты, ε-аминокапроновой кислоты, β-аланина; -CHR6-CH2-O-R7, где R6: Н или линейный или разветвленный алкил C1-C4, бензил, R7: Н, линейный алкил С1-С4, или R3, R4 вместе с азотом, к которому присоединены, образуют пирролидиновый, 2-(гидроксиметил) пиролидиновый, 4-аминопиридиниевый цикл; G представляет собой (С1-С4)карбоновую кислоту, метансульфоновую кислоту или минеральную кислоту или воду. В качестве остатка ациклической или ароматической α-аминокислоты они содержат остаток протеиногенной α-аминокислоты. В качестве (С1-С4)карбоновой кислоты они содержат не менее одного соединения из группы, включающей уксусную, фумаровую, янтарную, винную, яблочную и малеиновую кислоты. В качестве минеральной кислоты они содержат не менее одного соединения из группы, включающей соляную, фосфорную, серную кислоты. Предпочтительными соединениями являются производные арилциклоалкиламинов общей формулы (II), где Y: -СН2-O-СН2-, -(СН2)2-. Изобретение также относится к фармацевтической композиции, которая может представлять собой комбинацию производных арилциклоалкиламинов и, по крайней мере, одного вещества из группы, в которую входят леводопа, пальмитоилэтаноламид, N-(2-аминоэтил)пальмитамид гидрохлорид, расагилин, рисперидон, толоксатон, кветиапин, гамма-аминомасляная кислота, натрия вальпроат, амитриптилин, кломепрамин, флуоксетин, пароксетин, сертралин, фенилэфрин, дексаметазон, преднизолон. Композиция может быть выполнена в виде таблетки, капсулы, пеллеты, порошка для приготовления раствора для энтерального введения, раствора для парентерального введения, порошка для приготовления раствора для парентерального введения. 4 н. и 7 з.п. ф-лы, 13 табл., 96 пр.
Реферат
Изобретение относится к области фармацевтической химии, а именно, к новым органическим соединениям, проявляющим нейропротективные свойства, фармацевтическим композициям на их основе, обладающим нейропротекторными свойствами для лечения нейродегенеративных заболеваний, депрессии и боли.
Точнее, изобретение относится к производным арилциклоалкиламинов, а именно к солям и гидратам производных арилциклоалкиламинов общей формулы (I):
где R1, R2: Н, линейный или разветвленный алкил (C1÷C4), линейный или разветвленный алкокси (C1÷C4), галоген;
Y: -СН2-O-СН2-, -(СН2)n-, где n: 1-3;
X: -CO-NH-(CH2)6-, -CO-(CH2)k-, -CH2-NH-(CH2)6-, -CH(CH3)-NH-(CH2)6-, -(CO)p-(CHR5)m-(CH2)n-, где p, m, n: 0, 1, k: 4-7, R5: H, линейный алкил C1-C5;
R3, R4: H, линейный алкил C1-C4, -CH2-C≡CH, -(CH2)2-O-(CH2)2-NH2, циклопропил, циклопропилметил; 4-пиридинил, аминокислотный остаток ациклической или ароматической протоионогенной α-аминокислоты, пролина, γ-аминомасляной кислоты, ε-аминокапроновой кислоты, β-аланина; -CHR6-CH2-O-R7, где R6: Н или линейный или разветвленный алкил С1-С4, бензил, R7: Н, линейный алкил С1-С4, R3, R4 вместе с азотом, к которому присоединены, образуют пирролидиновый, 2-(гидроксиметил)пиролидиновый, 4-аминопиридиниевый цикл; G: низкомолекулярная (С1-С4) карбоновая или минеральная кислота или вода.
Нейродегенеративные заболевания представляют собой заболевания, затрагивающие головной и спинной мозг, периферическую и автономную нервные системы, нервно-мышечную функцию и мышцы. В частности, к нейродегенеративным заболеваниям относят эпилепсию, болезнь Паркинсона, цереброваскулярные заболевания, инсульт, болезнь Альцгеймера и другие деменции, рассеянный склероз, мигрень, травму головного мозга и т.д. Эта группа заболеваний являются широко распространенной, резко ухудшающей качество и продолжительность жизни пациентов. [WHO Press. Neurological disorders: public health challenges, 2007; Neurological and Psychiatric Disorders. Ed. Frank I. Tarazi and John A. Schetz, Humana Press Inc., 2005].
Развитие нейродегенеративного заболевания в каждом конкретном случае имеет свои особенности. Однако во всех случаях заболевание связано с повреждением и апоптозом клеток нервной ткани, гиперактивацией нейронов, нарушением синаптической передачи, функциональной активности нейромедиаторов и ферментных систем и приводит к ухудшению функционирования как нервной системы в целом, так и других систем и органов.
Применение для лечения этой группы заболеваний нейропротективных средств направлено на снижение повреждений нейронов головного мозга, а также на уменьшение патофизиологических и биохимических нарушений в нервной клетке [Pierre Sokoloff.. Levomilnacipran drug for functional rehabilitation after an acute neurological stroke, WO 2013014263 A1; Stacey E. Seidl and Judith A. Potashkin. The promice of neuroprotective agents in Parkinson disease. Front Neurol. 2011. 2, Art. 68]. Лечение каждого из заболеваний этой группы достаточно специфично.
Так, наиболее распространенным препаратом для терапии болезни Паркинсона является леводопа [Merims D, Giladi N. "Dopamine dysregulation syndrome, addiction and behavioral changes in Parkinson's disease". Parkinsonism Relat Disord. 2008, 14 (4): 273-280]. Леводопа проникает через гематоэнцефалический барьер, является источником дофамина. Однако леводопа подвергается декарбоксилированию и метилированию в периферических тканях, что значительно снижает ее уровень в головном мозге. Поэтому в клинике применяются препараты подавляющие активность ДОФА-декарбоксилазы и ингибиторы катехоламин-О-метилтрансферразы, ключевого фермента в биохимическом превращении катехоламинов - Синемет, Мадопар, Толкапон, Энтакапон [Goldenberg MM. "Medical management of Parkinson's disease". P&T, 2008, 33(10): 590-606].
Недостатком применения леводопы является развитие леводопа-индуцированной дискинезии, а также то, что ее использование не подавляет весь комплекс симптомов болезни Паркинсона [Е. Manfred; P. Riederer, D. Scheller. Mechanisms underlying and medical management of L-Dope-associated motor complications. J. of Neural Transmission, December 2011, 118 (12): 1659-1660; Cenci MA. Presynaptic Mechanisms of 1-DOPA-Induced Dyskinesia: The Findings, the Debate, and the Therapeutic Implications. Front Neurol, 2014, 5: 242; Heky MA et al. SydneyMulticenter Study of Parkinson disease: non-L-dopa-responsive problems dominate at 15 years. Movement Disorders, 2005, 20: 190-199]. Компенсацию дефицита дофамина при болезни Паркинсона также обеспечивают дофаминовые агонисты: Адартрель, Мирапекс [Kvernmo Т, S, Burger Е.A review of the receptor-binding and pharmacokinetic properties of dopamine agonists. Clinical Therapeutics, 2006, 28(8): 1065-78]. Однако при этом наблюдаются такие побочные эффекты, как тошнота, бессонница, головокружение, галлюцинации, ночные кошмары, изменения высших психических функций.
Течение эпилепсии в значительной мере обусловлено повышением активности глутаматергической системы, нарушением активности ГАМК-ергической системы головного мозга. Это объясняет использование антиконвульсантов, снижающих активность глутаматергической системы, соединений, повышающих активность ГАМК-ергической системы мозга и потенциал-зависимых натриевых и кальциевых каналов, ограничивая тем самым проведение нервного импульса, таких, как Вальпроат, Фенитоин, Фенобарбитал, Бензодиазепины, Вигабатрин, Габапентин, Карбамазепин [Meldrum BS, Rogawski MA. Molecular targets for antiepileptic drug development. Neurotherapeutics. 2007; 4:18-61]. Однако тормозное действие препаратов на центральную нервную систему приводит к сонливости, астении, головокружению, снижению памяти, ослаблению когнитивных функций (Болдырева С.Р., Ермаков А.Ю. Побочные действия антиэпилептических препаратов. Медицинский Совет. 2008. №9-10).
При терапии эпилепсии используют препараты, увеличивающие активность ГАМК-ергической системы головного мозга, снижающие активность глутаматергической системы. Терапия направлена на подавление судорог, формирование устойчивой ремиссии, однако терапевтическое воздействие на ГАМК-ергическую систему не устраняет, а даже усугубляет многие проявления болезни, например, усиливает депрессию, нарушает когнитивную функцию, вызывает суицидальный синдром [J. Christensen et al. Prenatal Valproate Exposure and Risk of Autism Spectrum Disorders and Childhood Autism JAMA. 2013; 309(16):1696-1703].
Известно использование для лечения нейродегенеративных заболеваний ингибиторов ацетилхолинестеразы (Ache), в частности - Допенезила [Birks J, Harvey RJ (2006). Birks, Jacqueline, ed. "Donepezil for dementia due to Alzheimer's disease". Cochrane Database Syst Rev, 2006, (1): CD001190; S.J. Shimshok et all, Isatin derivatives as acetylcholinesterase inhibitors and analgesics. US 6100276; N. Shakya et all, Substituted carbamic acid quinolin-6-yl esters useful as acetylcholinesterase inhibitors. UD 7655801; S.R. McHardlt et all, oximes for treatment of peripheral and central nervous system explore to acetylcholinesterase inhibitors. US 8653108]. Однако эти препараты не эффективны при лечении деменции у больных на поздней стадии заболевания. Побочные эффекты и невысокая терапевтическая эффективность ингибиторов Ache ограничивают их применение.
Гиперактивация глутаматергической системы, характерная для нейродегенеративных заболеваний (деменция, болезнь Паркинсона (БП), болезнь Альцгеймера (БА), инсульт, рассеянный склероз, шизофрения, эпилепсия и т.п.), приводит к нарушению синаптической пластичности, дисфункции нейронов, деполяризации мембран клеток и т.д, что в итоге усиливает нейродегенерацию и нарушение когнитивных функций [Zukin, S.R. and Javitt, D.C. The NMDA-PCP theory of schizophrenia: implications of receptor interactions. Biol. Psychiatry 27: 91A, 1990; A. Lau, M. Tymianski. Glutamate receptors, neurotoxicity and neurodegeneration. Eur. J. Physiol, 460, 525-542, 2010; Choi, D.W. and Rothman, S.M. The role of glutamate neurotoxicity in hypoxic-ischemic neuronal death. Annu Rev Neurosci. 13: 171-182, 1990]. Сказанное объясняет использование антагонистов НМДА-рецепторов при лечении нейродегенеративных заболеваний [Crosby, N.J. et all, (2003). Clarke, Carl E. ed. "Amantadine in Parkinson's disease". Cochrane Database of Systematic Reviews] и мемантина [Arsland, D. et all, E. Jul. Memantine in patients with Parkinson's disease dementia or dementia with Lewy bodies: a double-blind, placebo-controlled, multicentre tria. Lancet neurology 8 (7): 613-8, 2009; Reisberg B. et all, Memantine Study Group.Memantine in moderate-to-severe Alzheimer's disease. New Engl. J. Med. 348(14): 1333-41, 2003].
Побочными действиями известных НМДА-антагонистов являются головокружение, тошнота, головная боль узкий тепапевтический интевал, что делают целесообразной разработку более безопасных и эффективных веществ с указанным механизмом действия [D.J. Liotta et all, NMDA receptor antagonists for neuroprotection. US 9079852; A. Adejare, Non competitive NMDA receptor antagonists. US 8703799; H. Furukawa, Phenylethanolamine-based NMDA receptor antagonists. US 8648198; R.J. Deorazio et all, Cyclohexylamine derivative as subtype selective NMDA receptor antagonist. US 6919377].
Таким образом, недостатками препаратов, используемых при лечении нейродегенеративных заболеваний, являются их невысокая эффективность, многочисленные побочные эффекты, связанные с появлением нейромедиаторного дисбаланса в центральной нервной системе и действием препаратов на вегетативную нервную систему.
В этой связи вызывают интерес производные арилциклоаминов, незначительное изменение химической структуры которых приводит к существенному изменению спектра их биологической активности. Так, арилциклоалканполиалкиламины и их фармацевтически приемлемые соли общей формулы:
где Ar: арил; R1, R2: H, ОН, низший алкил, циклоалкил, алкокси, нитрогруппа, тиогруппа или галоген; X: нуль, эфир, тиоамид, тиокетон, тиоэфир; R3: морфолин; n: 2-5; m: 0-5, предложены в качестве антипсихотических, антиамнезических и антиишемических агентов [US 5086054]. Активность этой группы веществ обусловлена способностью минимизировать дисфункцию сигма-рецепторов ЦНС.
Аминопроизводные 1-фенилциклоалкил карбоновой кислоты [S.N. Calderon et all, J. Med. Chem. 1991, 3159-3164] проявляют антиконвульсантную активность, производные 1-фенилциклоалкил карбоновой кислоты предложены для лечения БА и рассеянного склероза [US 2015/0065567 А1].
В работе И.М. Федоровой [И.М. Федорова и др. Ж. эволюц. биохим. и физиол., 44, №6, 556-562, 2008] описано производное арилциклоалкиламинов следующей формулы:
Соединение изучено in vitro в качестве блокатора NMDA и АМРА рецепторов. Однако данных о нейропротективным воздействии данного соединения на организм in vivo в проанализированной литературе не выявлено. Вместе с тем, проведенные сравнительные эксперименты показали, что нейропротективный эффект при использовании данного соединения невысокий.
Наиболее близкими к заявляемым веществам являются арилциклоамины общих формул А и С [US 7132551]:
где X: С(R3)2, О, S, SO, SO2, NR2, NC(O)R7, NC(O)OR2, NS(O)2R7, C=O; Z: C(R3)2, C(O), O, NR, NC(O)OR, S, SO, SO2; m: 1-5; n: 1-2; p: 0-3; у: 0-2; R: H, алкил, циклоалкил, арил, гетероарил, аралкил, гетероаралкил; R1: Н, алкил, арил, гетероарил, аралкил, гетероаралкил; R, R1 могут соединяться ковалентной связью; R2: Н, алкил, фторалкил, арил, гетероарил, циклоалкил; R4: Н, алкил, циклоалкил, арил, гетероарил, алкенил, OR; R5, R6: Н, алкил, (СН2)pY, арил, гетероарил, F, OR2 и OC(O)R2, или CR5R6 равен С(О); R7: алкил, циклоалкил, арил, гетероарил, аралкил, гетероаралкил; R8, R9: Н, алкил, (CH2)pY, арил, гетероарил, F, OR2 и OC(O)R2, или CR8R9 равен С(О); Y: OR2, N(R2)2, SR2, S(O)R2, S(O)2R2, P(O)(OR2)2; любые R2 могут быть ковалентно связаны; R4 и R5, R4 и R6, R8 и R9 могут быть ковалентно связаны; А и С являются стереоизомеров. В веществе общей формулы A R3: Н, алкил, арил, OR2, OC(O)R2, CH2OR2 или CO2R2, любые R3 могут быть ковалентно связаны мостиком, состоящим из 1-4 атомов углерода. В веществе общей формулы С, R3: Н, алкил, арил, OR2, OC(O)R2, CH2OR2 или CO2R2.
Данные вещества действуют как лиганды рецепторов и транспортеров моноаминов, ингибируют обратный захват моноаминов, усиливают двигательную активность экспериментальных животных. Однако вещества мало перспективны для лечения нейродегенеративных заболеваний, для которых характерны и нарушения глутаматной или холинергической систем (паркинсонизм, деменция, депрессия). Влияние веществ на функции других нейромедиаторов и рецепторов ЦНС не подтверждены.
Технической задачей, решаемой авторами, являлось создание новых органических веществ, проявляющих нейропротективную активность, а также фармацевтических композиций для лечения нейродегенеративных заболеваний и сопутствующих заболеваний.
Технический результат в отношении новых соединений, обладающих нейропродуктивным действием, был достигнут путем получения производных арилциклоалкиламинов общей формулы (I)
где R1, R2: H, линейный или разветвленный алкил (С1÷C4) линейный или разветвленный алкокси (С1÷C4), галоген;
Y: -СН2-O-СН2-, -(СН2)n-, где n: 1-3;
X: -CO-NH-(CH2)6-, -CO-(CH2)k-, -CH2-NH-(CH2)6-, -CH(CH3)-NH-(CH2)6-, -(CO)p-(CHR5)m-(CH2)n-, где p, m, n: 0, 1, k: 4-7, R5: H, линейный алкил С1-С5;
R3, R4: H, линейный алкил C1-C4, -CH2-C≡CH, -(CH2)2-O-(CH2)2-NH2, циклопропил, циклопропилметил; 4-пиридинил, аминокислотный остаток ациклической или ароматической протоионогенной α-аминокислоты, пролина, γ-аминомасляной кислоты, ε-аминокапроновой кислоты, β-аланина; -CHR6-CH2-O-R7, где R6: Н или линейный или разветвленный алкил С1-С4, бензил, R7: Н, линейный алкил C1-C4, R3, R4 вместе с азотом, к которому присоединены, образуют пирролидиновый, 2-(гидроксиметил)пиролидиновый, 4-аминопиридиниевый цикл; G: (С1-С4) карбоновая или минеральная кислота или вода.
В качестве α-аминокислоты производные арилциклоалкиламинов общей формулы (I) и (II) могут содержать остатки ациклической или ароматической протеиногенной α-аминокислоты, такие, как L-аланин, L-аспарагиновая кислота, L-глутамин, L-глицин, L-лейцин, L-тирозин, L-фенилаланин, L-тирозин и т.п.
В качестве (С1-С4) карбоновой кислоты производные арилциклоалкиламинов общей формулы (I) и (II) могут содержать уксусную, фумаровую, янтарную, винную, яблочную, малеиновую кислоты, а в качестве минеральной - соляную, фосфорную, серную и т.п. кислоты.
Синтез производных арилциклоалкиламинов проводится стандартными методами органического синтеза с использованием коммерчески доступных реагентов. Степень завершения реакций контролировали методом ТСХ на пластинах Merck "TLC Silica gel 60 F254" в системах элюентов: бензол-метанол (20:1); этилацетат-триэтиламин (100:1); гексан-бензол (2:1); гексан-этилацетат (4:1); этилацетат-бензол (1:10); гептан-этилацетат (1:3); гептан-ацетон (25:1).
Подлинность производных арилциклоалкиламинов общей формулы (I) подтверждена методами ЯМР-спектроскопии и масс-спектрометрии. Спектры ЯМР 1Н и 13С записаны на приборе Bruker DPX 300 (Германия) (300 и 75 МГц, соответственно) для растворов в CDCl3, DMSO-d6 или D2O, внутренние стандарты - сигналы остаточных протонов для 1Н (7,26 м. д., 2,50 м. д. и 4,70 м. д., соответственно) и сигналы атомов углерода растворителя для 13С (77,16 м. д. и 40,52 м.д.). Константы спин-спинового взаимодействия (J) в протонных спектрах измеряли в приближении первого порядка. Масс-спектры измерены на приборе Bruker AmaZon (Германия), ионизация по методу электроспрей. Температуры плавления определяли на приборе ПТП-М (Россия). Чистота веществ определена методом ЯМР 1Н и ОФ ВЭЖХ. Содержание основного вещества составляло не менее 98%.
Производные арилциклоалкиламинов общей формулы (I), как показали проведенные эксперименты, проявляют нейропротективную активность, т.е. являются нейропротекторами.
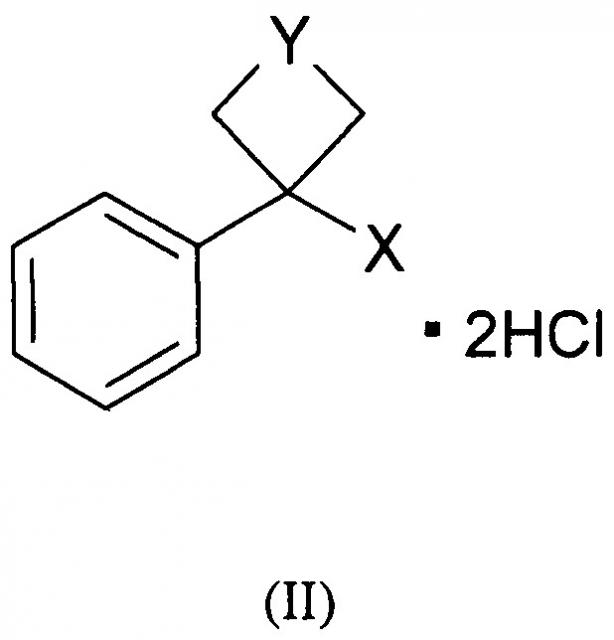
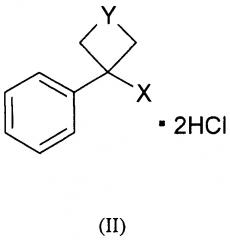
Проведенные исследования показали, что в качестве нейропротектора, как вариант, наряду с соединением общей формулы (I) могут выступать более простые по структуре производные арилциклоалкиламинов общей формулы (II)
где Y: -СН2-O-СН2-, -(СН2)2-; X: -NH-(CH2)6NH2.
Данные соединения в литературе не описаны. Возможность рассмотрения соединений общей формулы (I) и (II) в качестве вариантов данной группы изобретений обусловлено наличием в их структуре общих функциональных групп, сочетание которых, по-видимому, обеспечивает их нейропротективную, антиамне-стическую и анальгетическую активность при действии на организм.
Дальнейшие проведенные фармако-биологические исследования in vivo на экспериментальных моделях показали, что соединения общей формулы (I) и (II) обладают не только нейропротективным воздействием на организм, но и воздействуют на сопутствующие негативные эффекты заболевания, то есть обладают воздействием, включающим нейропротективную, антидепрессантной и анальгетическую активность.
Соединения могут использоваться в качестве активного начала как самостоятельно, так и в смеси с другими биологически активными веществами. При этом в композицию могут дополнительно входить вспомогательные вещества, влияющие на физико-химические свойства используемых композиций.
В качестве дополнительных физиологически активных веществ могут быть использованы леводопа, пальмитоилэтаноламид, расагилин, рисперидон, толоксатон, кветиапин, гамма-аминомасляная кислота (ГАМК), натрия вальпроат, амитриптилин, кломепрамин, флуоксетин, пароксетин, сертралин, адреномиметики, например фенилэфрин, адреналин и т.п.
В качестве вспомогательных веществ в составе композиций для энтерального применения используют фармацевтически инертные вещества, улучшающие условия получения, хранения или применения фармацевтической композиции, такие как растворители, наполнители, связующие, разрыхлители, скользяще-смазывающие вещества, пленкообразователи, пигменты, вкусовые добавки, пластификаторы, пролонгирующие вещества, ароматизаторы, стабилизаторы, консерванты и т.п.
Например, в качестве наполнителей композиции может содержать вещества из группы, в которую входят сахара и их производные, соли магния, кросповидон, коповидоны, сахарин и его соли, соли натрия, соли калия, лимонная кислота и ее соли, янтарная кислота, тартаровая кислота или ее соли, протеиногенные аминокислоты и их производные, а в качестве связующих - сахарозу, эфиры целлюлозы, поливинилпирролидон, желатин, альгиновую кислоту или ее соли, шеллак, гуммиарабик, поливиниловый спирт, метакриловую кислоту и ее сополимеры, натрий карбоксиметилцеллюлозу.
В качестве разрыхлителей в композицию может натрий кроскармеллоза, крахмал кукурузный, крахмал кукурузный прежелатинизированный, кросповидон, кальциевая соль кроскармеллозы; в качестве скользящих-смазывающих веществ - натрий стеарилфумарат, кальция стеарат, магния стеарилфумарат, кальция стеарилфумарат, стеариновая кислота, коллоидная двуокись кремния, воск; в качестве пигмента - титана диоксид, тальк, соли железа, красители, каолин, в качестве пластификатора полисорбаты, глицерин и его эфиры, полиэтиленгликоль, пропиленгликоль, дибутилфталат, триэтилцитрат, триацетин, повидон, минеральные масла, растительные масла; в качестве ароматизирующих веществ - эфирные масла мяты, лимона, апельсина и т.п.
Фармацевтические композиции могут быть использованы для энтерального введения в виде таблеток, таблеток, покрытых оболочкой, капсул, драже, суспензий, растворов, порошков, порошков для приготовления растворов и пр., а для парентерального введения в виде растворов, порошков для приготовления растворов для парентерального введения, эмульсий, суспензий и т.п.
При выполнении композиции в форме таблетки, покрытой оболочкой, или в форме драже, в качестве покрытия используют эфиры целлюлозы, натрий карбоксиметилцеллюлоза и ее производные, повидоны, коповидоны, метакриловая кислота и ее сополимеры, сахароза, готовые смеси для покрытия, содержащие в составе целлюлозу и ее эфиры, повидоны, сополимеры винилпирролидона с винилацетатом, шеллак, желатин, ксантановая камедь, гуммиарабик, альгиновая кислота и ее соли.
Композиции для парентерального введения могут быть получены в виде порошка, например, лиофильзованного порошка, для приготовления раствора для парентерального введения (раствор для инъекций или инфузий), В состав таких композиций могут входить вспомогательные вещества, обеспечивающие пористость и форму порошка, улучшающего его растворимость и обеспечивающие стабильность при хранении, например аргинин, глицин или его эфиры, лимонная кислота и ее соли, янтарная кислота и ее соли, полиолы, бензойная кислота и ее соли, аскорбиновая кислота и т.п.
Разведение композиций, представляющих собой порошок, с целью получения растворов для парентерального, проводится непосредственно перед введением, для чего используются стерильные апирогенные растворители - вода, физраствор, маннитола раствор для инфузий 15%, раствор глюкозы, раствор магния сульфата, раствор Рингера, растворы аминокислот для парентерального питания и т.п. Разведение порошков для энтерального введения проводится водой.
Композиции для парентерального введения могут быть получены в виде раствора, содержащего в качестве физиологически активного вещества производные арилциклоалкиламинов общей формулы (I), или их смеси с одним или более других физиологически активных веществ. В качестве вспомогательных веществ такие композиции содержат воду и, например, декстрозу, хлорид натрия, смесь декстрозы и хлорида натрия, лимонную кислоту и ее соли, янтарную кислоту и ее соли, соли магния, вспомогательный растворитель, например, полиэтиленгликоль, хелатирующий агент, например, натриевую соль этилендиаминтетрауксусной кислоты, солюбилизатор, например, циклодекстрин, маннитол, консервант, например, нипагин, нипазол, соли бензойной кислоты, антиоксидант, например, аскорбиновую кислоту, натрия метабисульфит и т.п.
Физиологически активные вещества в составе фармацевтических композиций проявляют эффективность в широком интервале доз, и вводятся в терапевтически эффективном количестве с учетом данных о пациенте, способе введения композиции, курсе введения и т.п. Суточная доза может быть введена в виде однократной дозы или в виде раздельных доз.
Лечение нейродегенеративных заболеваний с помощью заявляемых композиции, как правило, проводят путем энтерального или парентерального введения лекарственного средства.
Энтерально средство вводят в организм физиологически активного вещества в виде таблеток, таблеток, покрытых оболочкой, драже, капсул, раствора, порошков или гранул при содержании производных арилциклоалкиламинов от 0,001 до 0,100 г в одной дозе. При этом при введении их с другими физиологически активными веществами содержание производных арилциклоалкиламинов во вводимой дозе должно составлять не менее 0,001 г. Курс применения таких фармацевтических композиций может составлять от нескольких недель до нескольких месяцев и более.
Парентерально лечение осуществляют в виде инъекций или инфузий при суточной дозе от 0,005 г до 0,100 г и содержании активного вещества от 0,001 до 0,05 г на одну дозу. Разведение композиций апирогенными растворителями с целью получения растворов для внутривенных инъекций и/или инфузий проводится непосредственно перед введением. Полученный раствор вводят внутривенно инъекционно или путем внутривенной капельной инфузий, внутримышечно, подкожно. Курс парентерального применения фармацевтических композиций может быть от нескольких суток до нескольких месяцев и более.
Проведенные испытания показали, что заявляемые соединения перспективны для лечения таких заболеваний, как болезнь Паркинсона, деменция, инсульт, болезнь Альцгеймера, эпилепсия, шизофрения.
Примеры промышленного применения заявляемой группы изобретений представлены ниже. Сводные данные об отражении в примерах синтеза и использования отдельных соединений, имеющих различные функциональные группы, соответствующие формулам (I) и (I1), приведены в таблице 1.
Пример 1. Синтез 2-(диметиламино)-1-(1-фенилциклопентил)этан-1-он гидрохлорида
1-Фенилциклопентан-1-карбонитрил.
К кипящей суспензии гидрида натрия (10,6 г, 0,44 моль) в тетрагидрофуране (500 мл) при перемешивании, в течение 1,5 час, прикапывают смесь бензилцианида (23,43 г, 0,2 моль) и 1,4-дибромбутана (45,34 г, 0,21 моль). Смесь кипятят 18 час, охлаждают льдом, прикапывают воду (60 мл). Фазы разделяют, органическую фазу упаривают в вакууме, при температуре 50°C. Остаток растворяют в 250 мл гептана, промывают водой (3×50 мл), насыщенным раствором NaCl (25 мл), сушат над MgSO4, фильтруют и упаривают в вакууме при температуре 45°C. Остаток перегоняют в вакууме, собирают фракцию с Ткип.=113-117°C (5-6 мм.рт.ст.). Получают 1-фенилциклопентан-1-карбонитрил в виде бесцветного масла, 26,4 г (77%). Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц): 1,90-2,16 (6Н, м., c-C5H8); 2,46-2,56 (2Н, м., c-C5H8); 7,30-7,49 (5Н, м., Ph).
1-(1-Фенилциклопентил)этан-1-он.
К раствору 1-фенилциклопентан-1-карбонитрила (26,40 г, 0,154 моль) в 150 мл бензола прибавляют хлорид меди (I) (0,6 г, 0,006 моль), при температуре 60°C и перемешивании по каплям прибавляют раствор метилмагний йодида (0,31 моль) в диэтиловом эфире (103 мл), эфир отгоняют, остаток кипятят 18 час. Охлаждают реакционную смесь льдом с солью, при перемешивании прибавляют 900 мл 5% соляной кислоты, кипятят в течение 2 час, охлаждают. Фазы разделяют, водную фазу экстрагируют бензолом (3×75 мл), Экстракт промывают насыщенным раствором NaHCO3 (2×150 мл), насыщенным раствором NaCl (100 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 50°С. Остаток перегоняют в вакууме, собирают фракцию с Ткип.=93-98°С (5-6 мм.рт.ст.). Получают 1-(1-фенилцикло-пентил)этан-1-он в виде светло-желтого масла, 26,09 г (90%). Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц): 1,60-1,78 (4Н, м., c-C5H8); 1,86-1,98 (2Н, м., c-C5H8); 2,45-2,55 (2Н, м., c-C5H8); 1,95 (3Н, с., COCH3); 7,22-7,39 (5Н, м., Ph).
2-Бром-1-(1-фенилциклопентил)этан-1-он.
К раствору 1-(1-фенилциклопентил)этан-1-она (9,41 г, 0,05 моль) в 50 мл метанола при перемешивании и охлаждении прибавляют бром (8,0 г, 0,05 моль), перемешивают 2 час при комнатной температуре, прибавляют 30 мл воды. Смесь оставляют на 12 час, разбавляют 100 мл воды, экстрагируют хлористым метиленом (4×20 мл). Экстракт промывают насыщенным раствором NaHCO3 (2×25 мл), насыщенным раствором NaCl (25 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 50°C. Получают 2-бром-1-(1-фенилциклопентил)этан-1-он в виде желтого масла, 12,15 г (91%). Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц): 1,68-1,81 (4Н, м., c-C5H8); 1,93-2,05 (2Н, м., c-C5H8); 2,50-2,58 (2Н, м., c-C5H8); 3,90 (2Н, с., COCH2Br); 7,25-7,39 (5Н, м., Ph).
2-(Диметиламино)-1-(1-фенилциклопентил)этан-1-он гидрохлорид
В толстостенный реактор для работы под давлением помещают 2-бром-1-(1-фенилциклопентил)этан-1-он (10,7 г, 0,04 моль), диметиламин гидрохлорид (13,1 г, 0,16 моль) и 100 мл метанола, быстро прибавляют K2CO3 (45 г, 0,32 моль), реактор плотно закрывают, перемешивают 12 час при комнатной температуре. Содержимое переносят в колбу, упаривают в вакууме, при температуре 45°С. Остаток растворяют в 250 мл воды, прибавляют 50 мл 10% раствора KOH, экстрагируют бензолом (3×50 мл). Бензольный экстракт промывают водой (3×50 мл), экстрагируют 10% соляной кислотой (3×25 мл). Водный экстракт упаривают в вакууме, при температуре 45°С. Остаток обрабатывают кипящим диэтиловым эфиром (3×25 мл), высушивают в вакууме, при температуре 50°С, перекристаллизовывают из пропан-2-ола. Получают 2-(диметиламино)-1-(1-фенилциклопентил)этан-1-он гидрохлорид (бесцветные кристаллы), 7,82 г (73%), Тпл=142,9°С. Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц): 1,60-1,82 (4Н, м.); 1,90-2,06 (2Н, м., c-C5H8); 2,35-2,44 (2Н, м., с-С5Н8); 2,79 (3Н, с); 2,81 (3Н, с) (+NH(CH3)2); 3,92 (2Н, д., J=3,6, COCH2N+Н(CH3)2); 7,14-7,41 (5Н, м., Ph); 12,40 (1Н, ш.с., +NH(CH3)2). Спектр ЯМР 1Н (D2O), δ, м.д. (J, Гц): 1,45-1,67 (4Н, м.); 1,85-2,00 (2Н, м.); 2,22-2,38 (2Н, м.) (c-C5H8); 2,57 (6Н, с, +NH(CH3)2); 4,01 (2Н, с, COCH2N+Н(СН3)2); 7,19-7,38 (5Н, м., Ph). Спектр ЯМР 13С (CDCl3), δ, м.д.: 23,9 (С-3, 4 c-C5H8); 34,6 (С-2, 5 c-C5H8); 43,0 (N(CH3)2); 59,2 (COCH2N); 64,9 (С-1 c-C5H8); 127,2 (С-3, 5 Ph); 128,4 (С-4 Ph); 129,8 (С-2, 6 Ph); 140,5 (С-1 Ph); 203,1 (СО). Масс-спектр: MH+ найдено - 232,10, МН+ вычислено - 232,17.
Пример 2. Синтез 2-(диметиламино)-1-(1-фенилциклогексил)этан-1-он гидрохлорида
1-Фенилциклогексан-1-карбонитрил
К кипящей суспензии гидрида натрия (10,6 г, 0,44 моль) в тетрагидрофуране (500 мл) при перемешивании в течение 1,5 час прикапывают смесь бензилцианида (23,43 г, 0,2 моль) и 1,5-дибромпентана (48,30 г, 0,21 моль), кипятят 15 час, охлаждают льдом, прикапывают воду (60 мл). Фазы разделяют, органическую фазу упаривают в вакууме, при температуре 50°С. Остаток растворяют в 250 мл гептана, промывают водой (3×50 мл), насыщенным раствором NaCl (25 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 50°С. Остаток перегоняют в вакууме, собирают фракцию с Ткип.=124-130°С (5-мм.рт.ст.). Получают 1-фенилциклогексан-1-карбонитрил в виде светло-желтого масла, 23,29 г (63%). Спектр ЯМР 1H (CDCl3), δ, м.д. (J, Гц): 1,20-1,37 (1Н, м., c-C6H10); 1,74-1,93 (7Н, м., с-С6Н10); 2,12-2,23 (2Н, м., с-С6Н10); 7,30-7,45 (3Н, м., Ph); 7,48-7,56 (2Н, м., Ph).
1-(1-Фенилциклогексил)этан-1-он
К раствору 1-фенилциклогексан-1-карбонитрила (9,26 г, 0,05 моль) в 50 мл бензола прибавляют хлорид меди (I) (0,2 г, 0,002 моль), при температуре 60°С и перемешивании по каплям, прибавляют раствор метилмагний йодида (0,1 моль) в диэтиловом эфире (35 мл, 3М раствор), эфир отгоняют, остаток кипятят 12 час. Реакционную смесь охлаждают льдом с солью, прибавляют 300 мл 5% соляной кислоты, кипятят в течение 2 час, охлаждают. Фазы разделяют, водную фазу экстрагируют бензолом (3×25 мл), экстракт объединяют с органической фазой, промывают насыщенным раствором NaHCO3 (2×50 мл), насыщенным раствором NaCl (30 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 50°С. Получают 1-(1-фенилциклогексил)этан-1-он в виде светло-желтого масла, 9,91 г (98%). Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц): 1,27-1,38 (1Н, м., c-C6H10); 1,43-1,71 (5Н,м., с-С6Н10); 1,78-1,95 (2Н, м., c-C6H10); 2,28-2,41 (2Н, м., с-С6Н10); 1,91 (3Н, с., COCH3); 7,22-7,39 (5Н, м., Ph).
2-Бром-1-(1-фенилциклогексил)этан-1-он
К раствору 1-(1-фенилциклогексил)этан-1-она (10,1 г, 0,05 моль) в 50 мл метанола при перемешивании и охлаждении прибавляют бром (8,0 г, 0,05 моль). Перемешивают при комнатной температуре 2 час, прибавляют 30 мл воды. Смесь оставляют на 12 час, разбавляют 100 мл воды, экстрагируют хлористым метиленом (4×20 мл). Экстракт промывают насыщенным раствором NaHCO3 (2×25 мл), насыщенным раствором NaCl (25 мл), сушат над MgSO4, фильтруют, упаривают в вакууме, при температуре 40°С. Получают 2-бром-1-(1-фенилциклогексил)этан-1-он в виде желтого масла, 13,50 г (96%). Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц): 1,20-1,43 (1Н, м., c-C6H10); 1,45-1,73 (5H, м., с-С6Н10); 1,75-2,02 (2Н, м., с-С6Н10); 2,25-2,42 (2Н, м., c-C6H10); 3,88 (2Н, с., COCH2Br); 7,23-7,42 (5Н, м., Ph).
2-(Диметиламино)-1-(1-фенилциклогексил)этан-1-он гидрохлорид
В толстостенный реактор для работы под давлением помещают 2-бром-1-(1-фенилциклогексил)этан-1-он (11,2 г, 0,04 моль), диметиламина гидрохлорид (13,1 г, 0,16 моль) и 100 мл метанола, быстро прибавляют K2CO3 (45 г, 0,32 моль), плотно закрывают. Суспензию перемешивают 12 час при комнатной температуре, переносят в колбу, упаривают в вакууме, при температуре 50°С. Остаток растворяют в 250 мл воды, прибавляют 50 мл 10% раствора KOH, экстрагируют бензолом (3×50 мл). Органический экстракт промывают водой (3×50 мл), экстрагируют 10% соляной кислотой (3×25 мл). Водный экстракт упаривают в вакууме, при температуре 45°С. Остаток перекристаллизовывают из пропан-2-ола. Получают 2-(диметиламино)-1-(1-фенилциклогексил)этан-1-он гидрохлорид в виде бесцветных игольчатых кристаллов, 8,90 г (79%), Тпл=143,1°С. Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц): 1,31-1,71 (6Н, м.); 1,84-1,97 (2Н, м., c-C6H10); 2,25-2,36 (2Н, м. с-С6Н10); 2,77 (3Н, с); 2,78 (3Н, с) (+NH(CH3)2); 3,86 (2Н, с, COCH2N+Н(CH3)2); 7,20-7,42 (5Н, м., Ph); 12,36 (1Н, ш.с., +NH(CH3)2). Спектр ЯМР 13С (CDCl3), δ, м.д.: 23,0 (С-3, 5 с-С6Н10); 25,7 (С-4 с-С6Н10); 32,8 (С-2, 6 с-С6Н10); 43,4 (N(CH3)2); 55,8 (COCH2N); 60,2 (С-1 с-С6Н10); 127,0 (С-3, 5 Ph); 128,1 (С-4 Ph); 129,7 (С-2, 6 Ph); 139,7 (С-1 Ph); 203,6 (CO). Масс-спектр: МН+ найдено - 246,14, МН+ вычислено - 246,19.
Пример 3. Синтез 2-(диэтиламино)-1-(1-фенилциклопентил)этан-1-он гидрохлорида
В колбе с обратным холодильником, защищенным от влаги, смешивают 2-бром-1-(1-фенилциклопентил)этан-1-он (8,00 г, 0,03 моль), полученный по примеру 1, диэтиламин (3,3 г, 0,045 моль) и K2CO3 (6,22 г, 0,045 моль) в 20 мл метанола. Суспензию перемешивают 12 час при комнатной температуре, упаривают в вакууме, при температуре 45°С. Остаток растворяют в 50 мл воды, прибавляют 10 мл 20% раствора KOH, экстрагируют диэтиловым эфиром (3×25 мл). Экстракт промывают водой (3×25 мл), экстрагируют 10% соляной кислотой (3×25 мл). Водный экстракт упаривают в вакууме, при температуре 50°С. Остаток кристаллизуют в смеси пропан-2-ола и н-гептана (1:3), высушивают в вакууме при температуре 50°С Получают 2-(диэтиламино)-1-(1-фенилциклопентил)этан-1-он гидрохлорид в виде бесцветных кристаллов, 4,19 г (47%), Тпл=148,5°C. Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц): 1,13 (6Н, тр, J=7,3, N+H(CH2CH3)2); 1,54-1,83 (4Н, м.); 1,88-2,07 (2Н, м.); 2,40-2,54 (2Н, м.) (c-C5H8); 3,23 (4Н, кв, J=7,3, N+H(CH2CH3)2); 3,90 (2Н, д., J=2,9, COCH2N+H(C2H5)2); 7,21-7,44 (5Н, м., Ph); 12,15 (1Н, ш.с, +NH(C2H5)2). Спектр ЯМР 13С (CDCl3), δ, м.д.: 10,1 (N+H(CH2CH3)2); 23,7 (С-3, 4 с-C5H8); 34,5 (С-2, 5 c-C5H8); 48,8 ((N+Н(СН2СН3)2); 51,1 (COCH2N); 65,1 (С-1 c-C5H8); 127,1 (С-3, 5 Ph); 128,4 (С-4 Ph); 129,7 (С-2, 6 Ph); 140,5 (C-1 Ph); 203,7 (CO). Масс-спектр: МН+ найдено - 260,16, МН+ вычислено - 260,20.
Пример 4. Синтез 2-(диэтиламино)-1-(1-фенилциклопентил)этан-1-он фосфата
2-(Диэтиламино)-1-(1-фенилциклопентил)этан-1-он гидрохлорид (1,05 г, 3,4 ммоль), полученный по примеру 3, растворяют в 10 мл воды, прибавляют 10 мл 20% раствора KOH, экстрагируют диэтиловым эфиром (3×15 мл), экстракт промывают водой (3×25 мл), эфирный раствор сушат над K2CO3, фильтруют, упаривают в вакууме, при температуре 50°С. Получают 2-(диэтиламино)-1-(1-фенилциклопентил)этан-1-он в виде желтого масла, 0,87 г (100%). Масло растворяют в 10 мл диэтилового эфира, прибавляют смесь 10 мл диэтилового эфира с фосфорной кислотой (85%, 0,39 г, 3,4 ммоль). Упаривают в вакууме, при температуре 45°С. Остаток растворяют в 5 мл ацетона, осаждают 20 мл диэтилового эфира, осадок фильтруют, промывают эфиром (2×10 мл), высушивают в вакууме при температуре 50°С. Получают 2-(диэтиламино)-1-(1-фенилциклопентил)этан-1-он фосфат в виде бесцветных кристаллов, 1,12 г (92%), Тпл=126-128°С. Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц): 0,92 (6Н, тр, J=6, N+H(СН2СН3)2); 1,54-1,75 (4Н, м.); 1,88-2,07 (2Н, м.); 2,40-2,54 (2Н, м.) (c-C5H8); 2,81 (4Н, кв, J=6, N+H(CH2CH3)2); 3,64 (2Н, с, COCH2N+H(C2H5)2); 7,21-7,44 (5Н, м., Ph); 11,09 (3Н, ш.с, +NH(C2H5)2)
Пример 5. Синтез 2-(диэтиламино)-1-(1-фенилциклопентил)этан-1-он сульфата
2-(Диэтиламино)-1-(1-фенилциклопентил)этан-1-он гидрохлорид (1,05 г, 3,4 ммоль), полученный по примеру 3, растворяют в 10 мл воды, прибавляют 10 мл 20% раствора KOH, экстрагируют диэтиловым эфиром (3×15 мл), экстракт промывают водой (3×25 мл), эфирный раствор сушат над безводным K2CO3, фильтруют, упаривают в вакууме, при температуре 50°С. Получают 2-(диэтиламино)-1-(1-фенилциклопентил)этан-1-он в виде желтого масла, 0,87 г (100%). Масло растворяют в 10 мл диэтилового эфира, прибавляют смесь 10 мл диэтилового эфира с серной кислотой (98%, 0,17 г, 1,7 ммоль). Упаривают в вакууме, при температуре 45°С. Получают 2-(диэтиламино)-1-(1-фенилциклопентил)этан-1-он сульфат, 1,21 г (100%). Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц): 1,05 (6Н, тр, J=7,1, N+H(CH2CH3)2); 1,54-1,75 (4Н, м.); 1,88-2,07 (2Н, м.); 2,40-2,54 (2Н, м.) (c-C5H8); 3,26 (4Н, кв, J=7,4, N+H(CH2CH3)2); 4,14 (2Н, с, COCH2N+H(C2H5)2); 7,21-7,44 (5Н, м., Ph); 9,64 (1Н, ш.с., +NH(C2H5)2).
Пример 6. Синтез 2-(диэтиламино)-1-(1-фенилциклопентил)эта