Энантиомеры 2-гидроксипроизводных жирных кислот
Иллюстрации
Показать всеНастоящее изобретение относится к энантиомеру [-] формулы: [-]NaOOC-HOCH-(CH2)6-(CH=CH-CH2)1-(CH2)6-CH3, а также к фармацевтической композиции для лечения патологии, вызванной аномально низким уровнем сфингомиелина, и/или аномально низким уровнем глиофибриллярного кислого белка (ГФКБ), и/или аномально высоким уровнем дигидрофолатредуктазы (ДГФР), содержащей терапевтически эффективное количество энантиомера следующей формулы: [-]HOOC-HOCH-(CH2)6-(CH=CH-CH2)1-(CH2)6-CH3 и/или по меньшей мере одной из его фармацевтически приемлемых солей и, необязательно, фармацевтически приемлемый носитель. Изобретение также относится к способу лечения патологий, общая этиология которых представляет собой аномально низкий уровень сфингомиелина, и/или аномально низкий уровень глиофибриллярного кислого белка (ГФКБ), и/или аномально высокий уровень дигидрофолатредуктазы (ДГФР), включающему введение пациенту терапевтически эффективного количества энантиомера следующей формулы: [-]НООС-НОСН-(СН2)6-(СН=СН-СН2)1-(СН2)6-СН3 и/или по меньшей мере одной из его фармацевтически приемлемых солей или композиции, содержащей указанный энантиомер и/или по меньшей мере одну из его фармацевтически приемлемых солей. 3 н. и 6 з.п. ф-лы, 10 ил., 5 табл., 9 пр.
Реферат
Настоящее изобретение относится к способу синтеза рацемических продуктов 2-гидроксипроизводных жирных кислот и разделения оптических изомеров [-] (который соответствует S-энантиомеру) и [+] (который соответствует R-энантиомеру), самим выделенным энантиомерам, содержащих их фармацевтическим композициям и применению указанных соединений в качестве лекарственных средств для лечения заболеваний, общая этиология которых основана на изменениях (независимо от их природы) липидов клеточной мембраны, таких как, например, изменения уровня, состава или структуры указанных липидов, а также для лечения заболеваний, при которых регулирование состава и структуры липидов в мембране может вызвать ремиссию патологического состояния. Терапевтический эффект достигается предпочтительно посредством регулирования (активации или ингибирования) активности фермента церамид : фосфохолинхолинфосфотрансферазы (также известного как сфингомиелинсинтаза, или ЕС 2.7.8.27 согласно номенклатуре ферментов IUBMB) или уровней продукта реакции, катализируемой указанным ферментом, - сфингомиелина (СМ). В результате активности указанного фермента, выработки СМ и накопления указанного продукта в мембране опухолевых клеток происходит повышение (вплоть до 600%) уровня глиофибриллярного кислого белка (ГФКБ) и снижение (вплоть до более чем на 90%) уровня фермента дигидрофолатредуктазы (ДГФР). Таким образом как ГФКБ, так и ДГФР могут быть применены для определения терапевтической эффективности лекарственных средств для лечения заболеваний, обусловленных активностью сфингомиелинсинтазы или самим СМ. Настоящее изобретение также относится к разработке набора для обнаружения указанных заболеваний.
Кроме того, и фермент ЕС 2.7.8.27, и сфингомиелин (СМ) могут быть применены в качестве молекулярных маркеров действия соединений согласно настоящему изобретению в отношении вышеупомянутых заболеваний. Таким образом, настоящее изобретение также включает способ in vitro диагностики/прогнозирования указанных заболеваний на основании активности оценки регуляции активности или уровня указанного фермента ЕС 2.7.8.27 и/или уровня СМ, ГФКБ или ДГФР, а также наборы, включающие специально разработанные средства для осуществления указанных диагностики/прогнозирования. Указанные способы и наборы будут основаны на определении изменений, вызванных лечением с применением молекул, упомянутых в настоящей заявке, или на возможности изменения вышеупомянутых химических соединений при применении указанных способов лечения.
Кроме того, фермент ЕС 2.7.8.27 и/или СМ могут быть применены в качестве терапевтических мишеней, на которые можно направить молекулы, которые способны обеспечивать измененное состояние и, таким образом, лечить такие патологические процессы, которые, возможно, уже развились или могут развиться в будущем в результате аномальной активности фермента ЕС 2.7.8.27 или аномального уровня СМ. Таким образом, как фермент ЕС 2.7.8.27, так и сам СМ могут быть применены в качестве основы для разработки способов скрининга (отбора) возможных соединений для получения молекул, которые подобно, например, энантиомерам [-] (также известному как S) и [+] (соответствующему форме R) 2-гидроксипроизводных жирных кислот согласно настоящему изобретению, способны регулировать активность фермента ЕС 2.7.8.27 и/или уровня СМ, оказывая терапевтический эффект.
Таким образом, благодаря широкому спектру применения настоящее изобретение может быть в целом отнесено к области медицины и фармации. Необходимо отметить, что регулирующие органы в области фармации требуют наличия способов или наборов для мониторинга эффективности соединения, обладающего определенной терапевтической активностью, поэтому не только описание указанных соединений, но и описание их синтеза, их терапевтических возможностей и их обнаружения следует рассматривать как части настоящего изобретения.
УРОВЕНЬ ТЕХНИКИ
Клеточные мембраны представляют собой структуры, которые определяют целостность клеток и органелл внутри них. Большинство биологических процессов происходят в клетках или рядом с ними. Липиды не только играют структурную роль, но также регулируют активность важных процессов. Более того, регуляция липидного состава мембраны также влияет на расположение или функционирование важных белков, участвующих в управлении клеточной физиологией, таких как G-белки или РКС ( с соавт., 1995; с соавт., 1997; Yang с соавт., 2005; с соавт., 2005). Указанные и другие исследования демонстрируют важность липидов для управления важными клеточными функциями. Действительно, многие заболевания людей, такие как (среди прочих) рак, сердечно-сосудистые заболевания, нейродегенеративные процессы, ожирение, нарушения обмена веществ, воспаление, инфекционные заболевания и аутоиммунные заболевания, связывают с изменениями уровней или состава липидов, присутствующих в биологических мембранах, что также доказывает, что положительные эффекты лечения с применением других жирных кислот, отличных от предложенных в настоящем изобретении и которые регулируют состав и структуру липидов мембран, могут быть применены для обеспечения ремиссии указанных заболеваний ( с соавт., 2006).
Липиды, которые мы принимаем с пищей, регулируют липидный состав клеточных мембран (Alemany с соавт., 2007). В то же время различные физиологические и патологические состояния могут изменять липиды, присутствующие в клеточных мембранах (Buda с соавт., 1994; с соавт., 2006). Изменения липидного состава мембран могут влиять на клеточную сигнализацию, вызывая развитие заболеваний или их ремиссию ( с соавт., 2006).
Различные исследования, проведенные в последние годы, свидетельствуют о том, что липиды в мембране играют намного более важную роль, чем предполагалось до настоящего времени ( с соавт., 2008). Одним из примеров указанной важной роли служат рыбы, которые живут в реках с различной температурой: их липиды подвергаются важным изменениям (касающимся количества и видов липидов в мембране) при падении температуры от 20°С (летом) до 4°С (зимой) (Buda с соавт., 1994). Указанные изменения позволяют поддерживать работоспособность самых разных видов клеток. На основании этого авторы настоящего изобретения могут утверждать, что мембранные липиды могут определять правильность или неправильность функционирования многочисленных механизмов клеточной сигнализации. Учитывая, что пораженный заболеванием организм болен, поскольку больны его клетки, изменения липидов мембран могут вызывать возникновение заболеваний. Аналогичным образом, терапевтические, нутрицевтические или косметические составы, которые ориентированы на регулирование уровней липидов мембран, могут предотвращать и вызывать ремиссию (излечение) патологических процессов. Кроме того, многочисленные исследования свидетельствуют о том, что потребление насыщенных и транс-мононенасыщенных жиров связано с ухудшением здоровья. Сосудистые заболевания и опухоли в числе прочих непосредственно связаны с указанным видом липидов (Stender с соавт., 2004). Указанное ухудшение состояния организма может выражаться в появлении указанных и других видов заболеваний.
Клеточные мембраны образуют селективный барьер, через который клетка обменивается метаболитами и информацией с другими клетками и с внешней средой. Однако мембраны обладают и другими важными функциями на клеточном уровне. С одной стороны, указанные мембраны выступают в качестве носителя для белков, участвующих в приеме и передаче сообщений, которые управляют важными органическими параметрами. Указанные сообщения с помощью многочисленных гормонов, нейромедиаторов, цитокинов, факторов роста и т.д. активируют мембранные белки, которые распространяют полученный сигнал внутрь клетки с помощью других белков, некоторые из которых также расположены в мембране. Учитывая, что (1) указанные системы функционируют как каскады усиления и что (2) мембранные липиды могут регулировать расположение и функционирование вышеуказанных белков, липидный состав мембран может оказывать значительное влияние на клеточные функции. Более конкретно, взаимодействие некоторых белков (известных как периферические белки, такие как G-белки, протеинкиназа С, белок Ras и т.д.) с клеточной мембраной зависит от липидного состава указанной мембраны ( с соавт., 2004; с соавт., 2008). С другой стороны, липидный состав клеточных мембран зависит от вида и количества принимаемых липидов (Perona с соавт., 2007). Отсюда может быть сделать вывод, что потребление липидов может регулировать липидный состав мембран, а это может в свою очередь регулировать взаимодействие (и, следовательно, активность) белков, важных для обеспечения клеточной сигнализации (Yang с соавт., 2005).
Тот факт, что мембранные липиды могут управлять клеточной сигнализацией, свидетельствует о том, что указанные липиды также могут регулировать физиологическое состояние клеток. Действительно, было описано как положительное, так и отрицательное влияние липидов на здоровье ( с соавт., 2006; с соавт., 2008). Предварительные исследования показали, что 2-гидроксиолеиновая кислота, которая представляет собой мононенасыщенную жирную кислоту, способна вызывать ремиссию некоторых патологических состояний, таких как избыточный вес, гипертония и рак (Alemany с соавт., 2004; с соавт., 2005; с соавт., 2008).
Сердечно-сосудистые заболевания часто связаны с гиперпролиферацией клеток, образующих сердечную и сосудистую ткань. Указанная гиперпролиферация сердечно-сосудистых клеток приводит к образованию отложений во внутреннем просвете сосудов и полостей сердечно-сосудистой системы, которые вызывают широкий диапазон заболеваний, таких как гипертония, артериосклероз, ишемическая болезнь, сердечные приступы и т.д. (Schwartz с соавт., 1985). Разработка лекарственного средства, которое позволяет предотвратить пролиферацию клеток, фактически была предложена для предотвращения и лечения сердечно-сосудистых заболеваний (Jackson с соавт., 1992).
Ожирение или избыточный вес являются результатом изменения баланса между поступлением энергии в организм и ее расходом, частично вследствие изменений механизмов, которые регулируют указанные процессы. С другой стороны, указанная патология характеризуется гиперплазией (увеличением числа клеток) или гипертрофией (увеличением их размера) клеток жировой ткани, то есть адипоцитов. Многие исследования свидетельствуют о том, что жирные кислоты как свободные радикалы или как часть других молекул могут влиять на ряд параметров, связанных с энергетическим гомеостазом, в том числе таких как масса жира в организме, метаболизм липидов, термогенез или потребление ( с соавт., 2008). В этом смысле модификация жирных кислот может представлять собой способ регулирования энергетического гомеостаза и, следовательно, массы тела. Действительно, настоящее изобретение демонстрирует, как низкие уровни СМ в клетках связаны с повышенной клеточной пролиферацией и что указанное изменение связано с патологическим состоянием клеток человека. Кроме того, регулирование фермента ЕС 2.7.8.27 с применением молекул, описанных в настоящем изобретении, может нормализовать уровни СМ в патологических клетках и таким образом способствовать ремиссии патофизиологических изменений, описанных в настоящей заявке. В случае метаболических патологий потребление липидов помимо ожирения также определяет возможность возникновения других патологических процессов, таких как гиперхолестеринемия, гипертриглицеридемия, диабет или метаболический синдром (Sloan с соавт., 2008).
Нейродегенеративные процессы приводят к возникновению ряда заболеваний с различными симптомами, но с общей особенностью, заключающейся в том, что указанные заболевания вызваны дегенерацией клеток центральной и/или периферической нервной системы. Некоторые из указанных нейродегенеративных процессов предполагают значительное снижение когнитивной способности пациентов, как в случае болезни Альцгеймера или старческого слабоумия. Другие нейродегенеративные процессы вызывают изменения двигательных способностей, как в случае болезни Паркинсона или различных видов склероза. Наконец, некоторые нейродегенеративные заболевания могут вызывать процессы, которые приводят к слепоте, проблемам со слухом, нарушению пространственной ориентации, перепадам настроения и т.д.
Одним из примеров хорошо охарактеризованного нейродегенеративного расстройства является болезнь Альцгеймера, в ходе которой наблюдается образование сенильных бляшек, состоящих из остатков неправильно переработанных мембранных белков (таких как β-амилоидный пептид), которые накапливаются на внешней поверхности клеток, и клубков нейрофиламентов тау-белка, которые появляются внутри клетки. Указанный процесс связан с изменениями метаболизма холестерина и возникающим в результате изменением уровней холестерина в клеточных мембранах (Sagin с соавт., 2008). Действительно, развитие указанного заболевания связано с другими заболеваниями, при которых были описаны изменения метаболизма липидов, в частности холестерина, как в случае сердечно-сосудистых заболеваний.
С другой стороны, склероз и другие нейродегенеративные процессы связаны с «демиелинизацией», конечным результатом которой является потеря липидов оболочкой нейрональных аксонов, что приводит к изменениям процесса распространения электрических сигналов, в котором задействованы указанные аксоны. Миелин представляет собой липидный слой вокруг аксонов многих нейронов и образован несколькими спиральными складками плазматической мембраны клеток глии (шванновских клеток). Исходя из всего вышеизложенного очевидно, что липиды играют очень важную роль в развитии нейродегенеративных заболеваний. Более того, было продемонстрировано, что неизмененные природные полиненасыщенные жирные кислоты оказывают умеренное профилактическое воздействие на развитие нейродегенеративных процессов (Lane с соавт., 2005).
Нарушения обмена веществ составляют группу патологий, характеризующихся накоплением или дефицитом некоторых молекул. Типичным примером является накопление холестерина и/или триглицеридов выше нормальных уровней. Повышение уровней холестерина и/или триглицеридов как на системном (например, повышение уровней в плазме), так и на клеточном (например, в клеточных мембранах) уровне, связано с изменениями клеточной сигнализации, которые приводят к функциональным нарушениям на нескольких уровнях, и которые обычно обусловлены отклонениями в активности некоторых ферментов или управлении указанными белками. Было обнаружено, что одними из основных метаболических патологий являются гиперхолестеринемия (высокий уровень холестерина) и гипертриглицеридемия (высокий уровень триглицеридов). Для указанных заболеваний характерны повышенные показатели заболеваемости, развития осложнений и смертности, поэтому их лечение является первоочередной задачей. Кроме того, принимаемые липиды могут обуславливать появление диабета (Sloan с соавт., 2008).
Защитная роль некоторых ненасыщенных жирных кислот в отношении некоторых заболеваний уже была описана различными исследователями. Таким образом, ненасыщенные жирные кислоты замедляют развитие рака и обеспечивают положительные эффекты, направленные против развития сердечно-сосудистых заболеваний, нейродегенеративных патологий, патологий обмена веществ, ожирения, воспаления и т.д. (Trombetta с соавт., 2007; Jung с соавт., 2008; Florent с соавт., 2006). Однако фармакологическая активность указанных соединений сильно ограничена вследствие быстрого метаболизма и короткого периода полураспада в крови. Следовательно, необходимо разработать ненасыщенные жирные кислоты, которые характеризуются более медленным метаболизмом, приводящим к увеличению количества указанных кислот в клеточной мембране по сравнению с ненасыщенными жирными кислотами, применяемыми до сих пор, и облегчают взаимодействие между периферическими белками при клеточной сигнализации. Молекулы, описанные в настоящей заявке, соответствуют структурным характеристикам, которые обуславливают положительное воздействие некоторых природных жирных кислот на здоровье, в сочетании с молекулярными модификациями, которые усиливают воздействие первоначальных молекул и, кроме того, предотвращают их быстрый метаболизм, причем обе эти характеристики являются существенными для определения их фармакологической активности.
Говоря подробнее о важности липидов в клеточной мембране, следует заметить, что сфинголипиды или сфингофосфолипиды представляют собой важный класс липидов клеточной мембраны и наиболее распространенный класс липидов в тканях более сложных организмов. Молекулы сфинголипидов проявляют амфипатические свойства, то есть как гидрофобные, так и гидрофильные свойства, которые позволяют указанным молекулам играть важную роль в образовании биологических мембран. Некоторые из глюкосфинголипидов находятся на поверхности красных кровяных телец и в других клетках, действуя в качестве антигенов и определяя группы крови.
Таким образом, сфинголипиды очень важны с биологической точки зрения ввиду той роли, которую они играют в клеточной сигнализации. Если быть точным, СМ представляет собой вид сфинголипида, который в большом количестве содержится в клеточной мембране всех организмов (Huitema с соавт., 2004). Указанный липид в основном находится во внешнем монослое плазматической мембраны, где выполняет основную функцию в образовании микродоменов, известных как липидные рафты, которые являются специализированными частями клеточной мембраны с важными ролями в клеточной сигнализации, так как белки, которые взаимодействуют друг с другом благодаря сближению, которое происходит в результате их соединения с липидами, сконцентрированы в указанных доменах (Simons у Toomre, 2000). Фермент ЕС 2.7.8.27 отвечает за синтез СМ посредством переноса фосфохолина к первичной гидроксильной группе церамида с получением СМ и 1,2-диацилглицерола (ДАГ). Указанный фермент занимает центральное место в метаболизме сфинголипидов и глицерофосфолипидов. ЕС 2.7.8.27 находится в плазматической мембране, в аппарате Гольджи, активность указанного фермента также зафиксирована в ядерной мембране и в хроматине (Albi с соавт., 1999). ЕС 2.7.8.27 также регулирует уровни церамидов и диацилглицерола (ДАГ), при этом обе указанные молекулы являются в свою очередь регуляторами программируемой гибели клеток посредством апоптоза и аутофагии (Jiang с соавт., 2011; Van Helvoort с соавт., 1994; Tafesse с соавт., 2006). Полярная «головка» СМ имеет очень большой размер и препятствует закреплению белков, подобных Ras, которые содержат разветвленные липиды (подобные изопренильному, фарнезильному или геранил геранильному фрагментам), и при этом способствует закреплению других белков с фрагментами насыщенных жирных кислот (подобных миристиновой или пальмитиновой кислотам).
Таким образом, принимая во внимание важность фермента ЕС 2.7.8.27 и СМ для правильного функционирования и структуры клеточной мембраны и зная о связи между структурными и функциональными изменениями липидов, расположенных в клеточной мембране, и возникновением различных заболеваний, таких как, например, рак, сердечно-сосудистые заболевания, ожирение, нейродегенеративные расстройства и нарушения обмена веществ, было бы очень важно обнаружить соединения, способные регулировать активность указанного фермента и, как следствие, уровень СМ, с тем чтобы иметь возможность обеспечить ремиссию патологий, происхождение которых обусловлено аномальной активностью фермента и/или изменением уровня СМ. Учитывая, что органы регулирования фармацевтического рынка, такие как Испанское фармацевтическое агентство, Европейское агентство лекарственных средств (ЕАЛС) и Управление по контролю качества пищевых продуктов и лекарственных препаратов, в настоящее время требуют наличия методик, позволяющих контролировать эффективность лекарственных средств, выявление молекул, на основании изменений экспрессии или активности (в числе прочих) которых можно было бы прогнозировать эффективность соединения, является желательным, чтобы гарантировать получение пациентами надлежащего лекарственного средства. Таким образом, изобретения, которые позволяют корректировать применение указанных способов лечения, могут считаться родственными изобретениями. Настоящее изобретение относится к синтезу ряда 2-гидроксипроизводных жирных кислот, разделению их рацемических форм и способам терапевтического применения указанных соединений. Кроме того, настоящее изобретение также включает описание клеток, на которые нацелена активность указанных соединений, активности указанных соединений и, кроме того, описание биомаркеров, которые позволяют определить эффективность указанных соединений, а также способ, применяемый для данной цели.
Более того, важно обнаружить соединения, которые могут регулировать активность других ферментов, участвующих в метаболизме липидов, например фермента серинпальмитоилтрансферазы (ЕС 2.3.1.50) или фермента стеароил-коА-десатуразы (ECD, ЕС 1.14.19.1), который отвечает за синтез олеиновой кислоты. Церамид, вырабатываемый вследствие активности ЕС 2.3.1.50, является липидной молекулой, представляющей большой биологический интерес. Важная роль, относящаяся к церамиду, заключается в его участии в индукции апоптоза, также известного как программируемая гибель клеток ( с соавт., 2010). Апоптоз представляет собой высокорегулируемый биологический процесс, функция которого заключается в уничтожении бесполезных клеток или клеток, которые представляют собой угрозу для здоровья организма. Таким образом, опухолевые клетки часто разрабатывают молекулярные механизмы избегания апоптоза ( с соавт., 2010).
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Краткое описание изобретения
Предпочтительно настоящее изобретение направлено на устранение изменений уровня СМ в клетках, в результате чего предложены соединения, которые могут инвертировать измененный уровень экспрессии фермента ЕС 2.7.8.27 посредством активации (в случае если фермент недостаточно экспрессирован или обладает пониженной активностью) или ингибирования (в случае если фермент сверхэкспрессирован или обладает повышенной активностью) с обеспечением таким образом регуляции уровня СМ, синтезируемого указанным ферментом, и ремиссии патологических процессов, вызванных дерегуляцией указанного фермента или аномальным уровнем СМ.
Таким образом, для достижения указанного результата в настоящем изобретении осуществляют способ, в котором молекулы синтезируют в их рацемической форме и далее выделяют [-]- и [+]-энантиомеры 2-гидроксипроизводных жирных кислот, которые, как показано в приведенных ниже примерах, способны регулировать активность фермента ЕС 2.7.8.27 и, следовательно, уровень синтезируемого СМ. Указанные жирные кислоты характеризуются большим периодом полураспада в крови, чем природные жирные кислоты. Фактически настоящее изобретение относится к фармацевтическим композициям, которые содержат вышеуказанные энантиомеры, и к их применению в качестве лекарственных средств для лечения заболеваний, общая этиология которых основана на изменениях (независимо от их происхождения) липидов клеточной мембраны, таких как, например, изменения уровня, состава или структуры указанных липидов, а также для лечения заболеваний, при которых регулирование структуры и состава липидов мембраны может вызвать ремиссию патологического состояния. Терапевтический эффект предпочтительно достигается посредством регулирования (активации или ингибирования) активности фермента ЕС 2.7.8.27 и/или уровня продукта реакции, катализируемой указанным ферментом, - СМ - или даже уровня ГФКБ и/или ДГФР.
Помимо регулирования фермента ЕС 2.7.8.27 настоящее изобретение демонстрирует, что соединение 2OHOA (2-гидроксиолеиновая кислота) регулирует активность других ферментов, участвующих в метаболизме липидов, например, в клетках U118. Так, например, был исследован фермент ЕС 2.3.1.50. В настоящем изобретении показано, что 2OHOA стимулирует активность ЕС 2.3.1.50 (Пример 8 и Фигура 9), вызывая программируемую гибель лейкозных клеток человека. С другой стороны, в мембранах клеток U118, подвергаемых лечению 2OHOA, было также обнаружено значительное снижение уровня олеиновой кислоты, что свидетельствует о том, что 2OHOA является мощным ингибитором фермента ЕС 1.14.19.1, отвечающего за синтез олеиновой кислоты из стеариновой кислоты (Пример 9 и Фигура 10). В связи с этим необходимо отметить, что как ЕС 2.7.8.27, так и ЕС 2.3.1.50 представляют собой ферменты, отвечающие за метаболизм сфинголипидов, которые связаны друг с другом тем, что принадлежат к метаболическому пути одного вида молекул. С другой стороны, фермент ЕС 1.14.19.1 представляет собой модификатор жирных кислот. Связь указанного фермента с двумя другими ферментами заключается в том, что сфинголипиды всегда содержат в своей структуре цепи жирных кислот. Поскольку каждая жирная кислота обеспечивает различные свойства сфинголипидов, то обстоятельство, что они могут быть модифицированы, влияет на их биологическую активность. Таким образом, можно констатировать, что три фермента, упомянутые в настоящем изобретении, тесно связаны друг с другом и, следовательно, это нормально, что всего лишь одна молекула может регулировать активность указанных трех ферментов.
В настоящем изобретении [-]-энантиомеры (также изомер S) и [+] (также изомер R) отличаются направлением отклонения поляризованного света. В случае если оптический изомер поворачивает поляризованный свет вправо (по часовой стрелке), его обозначают знаком [+] (указанный изомер представляет собой правовращающий изомер или правую форму). Однако в случае если оптический изомер поворачивает поляризованный свет влево (против часовой стрелки), его обозначают знаком [-] (указанный изомер представляет собой левовращающий изомер или левую форму).
Конкретно в данном случае настоящее изобретение демонстрирует, что [-]-энантиомер 2-гидроксипроизводных жирных кислот действует как активатор фермента ЕС 2.7.8.27, осуществляя положительное регулирование синтеза СМ, представляющего собой сфинголипид, который, как указано выше, является соединением, преобладающим в мембранах клеток человека и животных, и является незаменимым для формирования правильной структуры липидного бислоя и функционирования клетки. Таким образом, указанный [-]-энантиомер может быть применен для получения фармацевтической композиции, предназначенной для лечения таких патологий, общая этиология которых заключается в структурных и/или функциональных изменениях липидов, расположенных в клеточной мембране, таких как рак, ожирение, гипертония, гипертриглицеридемия, гиперхолестеринемия или диабет и т.д., обусловленных аномально низкой активностью указанного фермента ЕС 2.7.8.27. Кроме того, рацемическая форма представляет собой активатор указанного фермента, принимая во внимание тот факт, что активность изомера [-] (который представляет собой активное вещество) является преобладающей по сравнению с изомером [+] (который не вызывает ферментативную активность). В связи с этим полагают, что положительная активность рацемической формы обусловлена тем обстоятельством, что активация, которая вызывает синтез новых молекул СМ, является более сильной в отношении активности данного фермента, чем ингибирование, которое может «выключить» молекулы фермента, которые ранее не были активны. В любом случае сила активирующего воздействия рацемической формы меньше, чем сила активирующего воздействия [-]-энантиомера, что объясняет более низкую терапевтическую активность рацемической формы.
Как можно увидеть из примеров в настоящем изобретении, важным является тот факт, что [-]-энантиомер 2-гидроксипроизводных жирных кислот проявляет улучшенный терапевтический эффект по сравнению с рацематом (который содержит равные количества обоих энантиомеров). Более того, следует подчеркнуть, что [-]-энантиомер 2-гидроксипроизводных жирных кислот имеет более низкую токсичность и меньше побочных эффектов, чем рацемат и [+]-энантиомер (см. Таблицу 3, Пример 7).
Кроме того, настоящее изобретение также демонстрирует, что [+]-энантиомер 2-гидроксипроизводных жирных кислот действует как ингибитор фермента ЕС 2.7.8.27, осуществляя отрицательное регулирование синтеза СМ, и может быть применен в фундаментальном исследовании для изучения регуляции самого фермента ЕС 2.7.8.27 или для лечения заболеваний, характеризующихся аномально высокой активностью фермента ЕС 2.7.8.27 и/или аномально высоким уровнем СМ, таких как, например, муковисцидоз (Slomiany с соавт., 1982). С другой стороны, высокий уровень холестерина и триглицеридов связан с важными изменениями в сердечно-сосудистой системе. В связи с этим холестерин обычно связывается с СМ для образования высоко упорядоченных мембранных доменов, известных в научной литературе как «липидные рафты» или «Lo» (liquid ordered, то есть жидкая упорядоченная фаза). Увеличение количества холестерина способствует увеличению указанных липидных областей, которое вызывает изменения клеточной сигнализации, которые могут привести к различным сердечно-сосудистым и метаболических изменениям или заболеваниям. Таким образом, снижение уровня СМ в случае гиперхолестеринемии и гипертриглицеридемии может помочь снизить уровни холестерина и триглицеридов в плазме и мембранах. Соответственно, [+]-энантиомер играл бы защитную роль при нескольких видах нарушений, таких как гиперхолестеринемия и гипертриглицеридемия, поскольку указанный энантиомер вызывает снижение уровней указанных липидов в сыворотке крови, а также снижение уровня СМ, которое приводит к снижению плотности липидных рафтов в клетках.
Кроме того, учитывая, что фермент ЕС 2.7.8.27 отвечает за синтез СМ и, следовательно, за правильную структуру и функцию клеточной мембраны, как указанный фермент, так и сам СМ следует рассматривать в качестве молекулярных маркеров, применяемых для осуществления способа in vitro диагностики и/или прогнозирования заболеваний на основе изменений в клеточной мембране. Указанные изменения не происходят в естественных условиях, напротив, они вызваны активностью соединений, описанных в настоящем изобретении. Кроме того, было подтверждено, что соединения согласно настоящему изобретению также регулируют уровни белков ГФКБ и/или ДГФР. В результате настоящее изобретение также относится к способу/набору для осуществления диагностики или прогнозирования таких патологий, связанных с измененными уровнями белков ГФКБ и ДГФР по отношению к нормальным уровням. Указанный набор включает реагенты или средства, с помощью которых можно оценить активность фермента ЕС 2.7.8.27 и/или уровень СМ, ГФКБ или ДГФР и, соответственно, осуществить указанные диагностику/прогнозирование как способ мониторинга эффективности лечения пациентов.
В связи с этим указанный фермент ЕС 2.7.8.27 и/или продукт реакции, катализируемой указанным ферментом, представляющий собой СМ, можно рассматривать в качестве терапевтических мишеней, на которые можно направить молекулы, способные регулировать активность указанного фермента и/или уровень СМ и, таким образом вызывать ремиссию тех патологических процессов, которые могли развиться или могут начать развиться в будущем в результате изменений активности указанного фермента или уровня СМ, ГФКБ или ДГФР. Таким образом, например, [-]-энантиомер в настоящем изобретении приведен для иллюстрации возможного применения фермента ЕС 2.7.8.27 в качестве терапевтической мишени путем активации ферментативной функции указанного фермента в ходе патологических процессов, при которых указанная функция является недостаточной, с восстановлением таким образом нормального уровня СМ. С другой стороны, измерение активности фермента ЕС 2.7.8.27, и/или уровня СМ, и/или уровня ГФКБ, и/или уровня ДГФР также было бы подходящим для осуществления способов скрининга для отбора соединений-кандидатов для получения других молекул, которые подобно [-]- и [+]-энантиомерам согласно настоящему изобретению должны быть способны регулировать активность фермента ЕС 2.7.8.27, и/или уровень СМ, и/или уровень ГФКБ, и/или уровень ДГФР, а следовательно, способны вызывать ремиссию патологических процессов.
Следовательно, настоящее изобретение демонстрирует исключительную важность отбора соединений с особыми структурными характеристиками, таких как жирные кислоты с по меньшей мере одной двойной связью, общим количеством атомов углерода (С), равным или меньшим 20, и заместителем, представляющим собой радикал, в частности гидроксильный радикал (ОН) при атоме углерода в положении 2 (или атома углерода в α-положении).
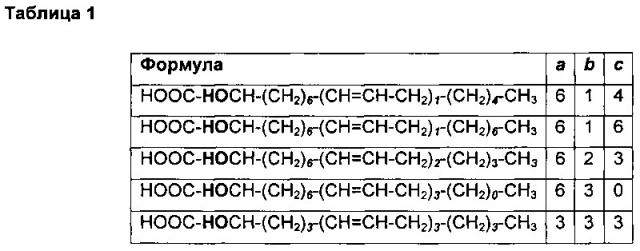
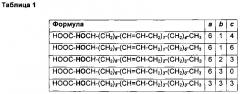
Точнее, настоящее изобретение относится к соединениям, которые представляют собой [-]- и [+]-энантиомеры Формулы I:
где a, b и c независимо принимают значения от 0 до 6 с учетом того, что общее количество атомов углерода в молекуле ≤20.
Кроме того, установлено, что предпочтительная терапевтическая форма согласно настоящему изобретению представляет собой [-]-энантиомер (соответствующий пространственной конфигурации S) Формулы I, который, как показано, является наиболее эффективной формой при активации фермента ЕС 2.7.8.27, более эффективной, чем рацемическая форма и [+]-энантиомер (соответствующий пространственной конфигурации R) Формулы I, который, как показано, является ингибитором фермента ЕС 2.7.8.27.
В предпочтительном варианте реализации настоящее изобретение, в частности, относится к [-]- и [+]-энантиомерам Формулы I со следующими значениями a, b и с:
В особенно предпочтительном варианте реализации настоящее изобретение, в частности, относится к [-]-энантиомеру формулы [-] НООС-НОСН-(СН2)6-(СН=СН-СН2)1-(СН2)6-СН3, для целей настоящего изобретения именуемому [-]2OHOA.
Другой особенно предпочтительный вариант реализации настоящего изобретения относится к [+]-энантиомеру формулы [+] НООС-НОСН-(СН2)6-(СН=СН-СН2)1-(СН2)6-СН3, для целей настоящего изобретения именуемому [+]2OHOA.
В качестве примера, заболевания, характеризующиеся недостаточной активностью фермента ЕС 2.7.8.27 и, следовательно, аномально низким уровнем СМ в клеточных мембранах, которые могли бы быть подвергнуты лечению с применением [-]-энантиомера согласно настоящему изобретению, включают:
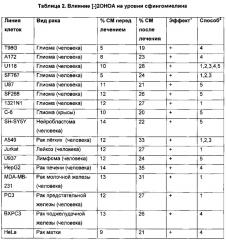
- рак: рак предстательной железы, рак молочной железы, рак поджелудочной железы, лейкоз, рак матки, рак толстой кишки, рак мозга, рак легких, злокачественную меланому и рак печени (см. Таблицу 2);
- сосудистые патологии: гипертонию, артериосклероз, кардиомиопатии, ангиогенез, гиперплазию сердца и т.д.;
- патологии обмена веществ: диабет, метаболический синдром или ожирение;
- другие патологии: поражения продолговатого мозга, болезнь Альцгеймера, склероз, целлюлит и т.д.
Таким образом, более конкретно первый вариант реализации настоящего изобретения относится к [-]- или [+]-энантиомеру соединения Формулы I и/или по меньшей мере одной из его фармацевтически приемлемых солей:
характеризующегося тем, что а, b и с независимо могут принимать значения от 0 до 6 с учетом того, что общее количество атомов углерода в молекуле ≤20. В предпочтительном варианте реализации настоящего изобретения указанное соединен