Lc-ms/ms способ мониторинга множественных реакций для выявления терапевтических антител в образцах животных с помощью каркасных сигнатурных пептидов
Иллюстрации
Показать всеИзобретение относится к медицине и касается способа выявления человеческих или гуманизированных антител, включающего стадии обработки содержащего человеческое или гуманизированное антитело биологического образца расщепляющим ферментом с образованием образца расщепленного антитела, причем биологическим образцом является сыворотка, плазма крови, ткань или клетки от животного, которое было обработано человеческим или гуманизированным антителом; и анализа образца расщепленного антитела с помощью масс-спектрометрии с выявлением одного или нескольких человеческих каркасных пептидов. Изобретение обеспечивает обнаружение терапевтических антител в образцах от животного, обработанного с помощью терапевтического антитела; при этом обнаружения других антител, присутствующих в образце, таких как нативные антитела животных, не происходит. 11 з.п. ф-лы, 4 пр., 25 ил., 13 табл.
Реферат
Ссылка на родственную заявку
Согласно настоящей заявке, поданной в соответствии с 37 CFR §1.53(b), испрашивается приоритет в соответствии с 35 USC §119(е) по предварительной заявке на выдачу патента США №61/485249, поданной 12 мая 2011 года, которая включена в виде ссылки в полном объеме.
Область техники
Настоящее изобретение относится к способам выявления и определения количества представляющего интерес человеческого или гуманизированного антитела из образца животного, такого как ткань, плазма или сыворотка крови. Способы предусматривают аффинное обогащение и протеазное расщепление образца с получением одного или нескольких пептидов, которые являются консервативными и характерными для каркасного участка человеческого или гуманизированного антитела, выявляемого или количественно оцениваемого при помощи масс-спектрометрии.
Уровень техники
Анализ полученных в результате исследований in vivo терапевтических белков образцов плазмы/сыворотки крови представляет интерес в биофармацевтической промышленности. На протяжении более 25 лет применялся традиционный ELISA-подход, и он характеризуется некоторыми недостатками. Для ELISA необходимы высококачественные специализированные реактивы, на создание которых может уходить несколько месяцев, а оптимизация анализа может занимать еще несколько дополнительных месяцев. Таким образом, ELISA характеризуется длительным временем разработки анализа, что является недостатком как на ранней стадии исследования, так и на стадии разработки белковых лекарственных средств (Murray et al (2001) J. Imm. Methods 255:41-56; Kirchner et al (2004) Clin. Pharmacokinetics 43(2):83-95). В некоторых случаях подходящие реактивы для ELISA и условия проведения анализа могут быть невозможны по причине сильно специфических требований для связывания для каждого белкового терапевтического средства. Другой недостаток ELISA заключается в том, что реактивы могут неспецифично связываться с белками плазмы/сыворотки крови, причем взаимодействие с матрицей является широко распространенным явлением. Количественное определение белка с помощью масс-спектрометрии, с другой стороны, является высокоспецифичным и, следовательно, взаимодействие с матрицей происходит редко по сравнению с ELISA. Разработка анализов ELISA может быть трудоемкой и нуждается в сложных, специфических реактивах. ELISA также чувствителен к случаям взаимодействия с матрицей и перекрестной реактивности антител. При помощи ELISA опосредованно измеряют концентрацию аналита с помощью свойств связывания. Это множество факторов делает ELISA способы количественной оценки белка затруднительными для разработки и переноса в другие лаборатории с устойчивыми эксплуатационными показателями. Исходя из этих отличий, масс-спектрометрия является ортогональным способом по отношению к ELISA. Масс-спектрометрические способы количественной оценки белка, и LC-MS/MS в частности, не нуждаются в специфических реактивах и обычно дают более быстрые результаты при разработке анализа. Кроме того, масс-спектрометрия менее подвержена влиянию взаимодействий с матрицей и предусматривает типичные условия проведения анализа, которые являются высокоспецифичными и могут быть уплотнены и автоматизированы. Благодаря высокой специфичности масс-спектрометрии измеряют концентрацию аналита по характерным физико-химическим свойствам аналита, т.е. массовому и фрагментационному паттерну. Устойчивый формат делает возможным легкий перенос из лаборатории в лабораторию, что является значительным преимуществом для одобренных терапевтических средств на основе антител. Общая методика количественной оценки белков при помощи масс-спектрометрии заключается в расщеплении при помощи трипсина интактного белка. Полученные пептиды анализируют с помощью масс-спектрометрии путем введения соответствующих меченных стабильным изотопом внутренних стандартов в фиксированной концентрации.
Последние достижения в области пептидного и белкового анализа с помощью масс-спектрометрии (MS) являются результатом разработок передовых методик ионизации и введения в газовой фазе, таких как электрораспылительная ионизация (ESI) и лазерная десорбция-ионизация в присутствии матрицы (MALDI, US 2003/0027216), а также усовершенствований чувствительности, разрешения, погрешности измерения приборов, биоинформатики и алгоритмов деконволюции данных в программном обеспечении ("Electrospray lonization Mass Spectrometry: Fundamentals, Instrumentation, and Applications", Cole, R.B., Ed. (1997) Wiley, New York; "Modem Protein Chemistry: Practical Aspects", Howard, G.C. and Brown, W.E., Eds. (2002) CRC Press, Boca Raton, FL, p.71-102; Martin et al (1997) Cancer Chemother. Pharmacol. 40:189-201; WO 03/046571; WO 03/046572).
Жидкостная хроматография в тандеме с масс-спектрометрией является мощным инструментом для анализа и количественной оценки белка в очень сложных матрицах, таких как образцы плазмы/сыворотки крови. Поскольку пептиды, полученные в результате расщепления представляющего интерес белка и других белкой плазмы/сыворотки крови, могут обладать одинаковой или сходной номинальной массой, то второй размер MS-фрагментации зачастую дает уникальный фрагмент представляющего интерес пептида. Сочетание конкретного исходного пептида и иона уникального фрагмента используется для избирательного мониторинга подвергаемой количественной оценке молекулы. Такой подход называется "мониторинг множественных реакций" (MRM), второе название которого "контроль селективных реакций" (SRM), который также является широко используемым способом количественной оценки белка.
Электрораспылительная ионизация (ESI) предусматривает ионизацию при атмосферном давлении (API) жидкого образца. В ходе процесса электрораспыления создаются высокозаряженные капли, которые при испарении создают ионы, характерные для содержащихся в растворе соединений. Для забора образца этих ионов в газовой фазе на анализ масс может быть использовано отверстие для забора образца ионов в масс-спектрометре. Измеряемый с помощью детектора масс-спектрометра ответ на аналит зависит от концентрации аналита в жидкости и не зависит от скорости потока жидкости.
Сущность изобретения
Настоящее изобретение относится к способу выявления человеческих или гуманизированных антител, включающему следующие стадии:
(a) обработка биологического образца расщепляющим ферментом с образованием образца расщепленного антитела, причем биологическим образцом является сыворотка, плазма крови, ткань или клетки от животного, которое было обработано человеческим или гуманизированным антителом; и
(b) анализ образца расщепленного антитела с помощью масс-спектрометрии с выявлением одного или нескольких человеческих каркасных пептидов.
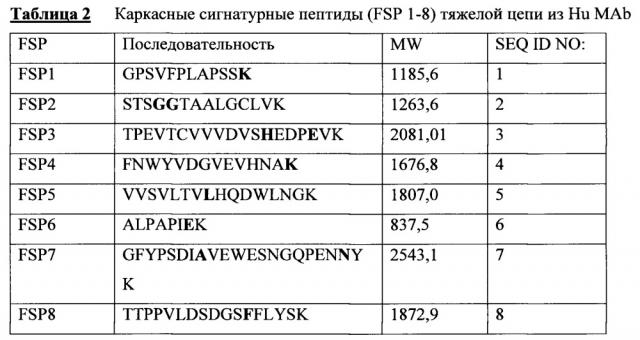
В соответствии с иллюстративным вариантом осуществления человеческие каркасные пептиды содержат одну или несколько последовательностей, выбранных из SEQ ID NO 1-8.
В соответствии с иллюстративным вариантом осуществления расщепляющим ферментом является трипсин.
В соответствии с иллюстративным вариантом осуществления осуществляют контакт биологического образца со средой для аффинного захвата или хроматографическим адсорбентом. Элюируют обогащенный биологический образец, затем обрабатывают расщепляющим ферментом.
В соответствии с иллюстративным вариантом осуществления измеряют концентрацию образца расщепленного антитела.
В соответствии с одним аспектом настоящее изобретение относится к способам протеазного расщепления образца или иммунноаффинного захвата с последующим протеазным расщеплением с получением одного или нескольких пептидов, характерных исключительно для каркасного участка человеческого или гуманизированного антитела, т.е. не присутствующих в животных биологических образцах, выявляемых и количественно оцениваемых с помощью масс-спектрометрии (LC-MS/MS).
В соответствии с вариантом осуществления настоящее изобретение относится к человеческим или гуманизированным антителам, конъюгированным с лекарственными частями, причем конъюгаты антитело-лекарственное средство измеряются с помощью способов согласно настоящему изобретению.
Краткое описание чертежей
На фигуре 1 показано выравнивание аминокислотных последовательностей тяжелой цепи человеческого антитела 2Н7, окрелизумаба, Hu2H7 (SEQ ID NO:11), начиная от остатка 101, и пяти антител яванского макака к CD20: CynoHC 1a D3 1 (SEQ ID NO:12), CynoHC 1b E5 1 (SEQ ID NO:13), Cyno HC 2a (SEQ ID NO:14), CynoHC 2b E6 1 (SEQ ID NO:15), CynoHC 3 (SEQ ID NO:16). Подчеркнутыми показаны каркасные сигнатурные пептиды (FSP 1-8), которые характерны исключительно человеческому Mab 2H7 (hu 2H7) и отсутствуют в тяжелой цепи IgG яванского макака, причем каждый имеет по меньшей мере одно отличие по аминокислоте в последовательностях.
На фигуре 2 показана тяжелая цепь (SEQ ID NO:17) и легкая цепь (SEQ ID NO:18) трастузумаба (Herceptin®, Genentech Inc.; rhuMAbHER2, Anti p185HER2), полученного рекомбинатным способом гуманизированного моноклонального антитела, регистрационный номер CAS 180288-69-1.
На фигуре 3 показана тяжелая цепь (SEQ ID NO:11) и легкая цепь (SEQ ID NO:19) окрелизумаба, rhuMAb 2H7, PR070769, гуманизированного антитела к CD20, регистрационный номер CAS 637334-45-3.
На фигуре 4 показана тяжелая цепь (SEQ ID NO:20) и легкая цепь (SEQ ID NO:21) пертузумаба, rhuMAb 2C4, регистрационный номер CAS 380610-27-5. У FSP2, FSP3, FSP8 подчеркнутой указана тяжелая цепь (SEQ ID NO:20).
На фигуре 5 показана тяжелая цепь (SEQ ID NO:22) и легкая цепь (SEQ ID NO:23) антитела к PDL1, член расширенного семейства CD28/CTLA-4 Т-клеточных регуляторов. У FSP2, FSP4, FSP8 подчеркнутой указана тяжелая цепь (SEQ ID NO:22).
На фигуре 6 показана тяжелая цепь (SEQ ID NO:24) и легкая цепь (SEQ ID NO:25) антитела к нейропилину-1, антитела к NRP1, MNRP1685A. У FSP2, FSP4, FSP8 подчеркнутой указана тяжелая цепь (SEQ ID NO:24).
На фигуре 7 показана тяжелая цепь (SEQ ID NO:26) и легкая цепь (SEQ ID NO:27) антитела к MUC16, MMUC3333A/DMUC4064A. У FSP2, FSP4, FSP8 подчеркнутой указана тяжелая цепь (SEQ ID NO:26).
На фигуре 8 показана (SEQ ID NO:28) и легкая цепь (SEQ ID NO:29) ритуксимаба, С2 В8, MabThera, (Rituxan®, Genentech Inc., Biogen/Idec), регистрационный номер CAS 174722-31-7. У FSP2, FSP4, FSP8 подчеркнутой указана тяжелая цепь (SEQ ID NO:28).
На фигуре 9 показаны общие стадии LC-MS/MS способа количественной оценки терапевтического антитела в плазме/сыворотке крови животного с помощью одного или нескольких каркасных сигнатурных пептидов (FSP).
На фигуре 10 показан мониторинг множественных реакций расщепленного трипсином трастузумаба. Каркасные сигнатурные пептиды FSP3 (12,5 мин), FSP8 (15 мин) и FSP5 (17 мин) разделены и количественно оценены относительно исходного уровня.
На фигуре 11 показан MS/MS спектр FSP5 от аффинно-захваченного, а затем расщепленного конъюгата антитела к MUC16 и лекарственного средства, который был внесен в плазму крови.
На фигуре 12 показана калибровочная кривая FSP8, внесенного с различными концентрациями от 1 до 1000 мкг/мл в обработанную литиевой солью гепарина плазму крови яванского макака, которая была получена при помощи подхода расщепления/SPE цельной плазмы крови.
На фигуре 13 показаны LC-MS/MS хроматограммы, демонстрирующие выявление FSP8, внесенного в обработанную литиевой солью гепарина плазму крови яванского макака, при LLOQ=1 мкг/мл после подготовки образца посредством расщепления/SPE цельной плазмы крови.
На фигуре 14 показана блок-схема стадий LC-MS/MS способа с аффинным захватом белкового терапевтического средства и ферментативным расщеплением с образованием каркасных сигнатурных пептидов (FSP) mAb в плазме/сыворотке крови животного.
На фигуре 15 показан рисунок захвата mAb из плазмы/сыворотки животного на покрытых стрептавидином магнитных частицах, связанных с биотинилированным зондом захвата, или покрытой белками A, G магнитной частице с последующим выделением путем разделения в магнитном поле, расщеплением захваченного антитела и анализом с помощью LC-MS/MS.
На фигуре 16 изображены варианты осуществления покрытой белками A, G магнитной частице (сверху) для общего захвата антитела и покрытых стрептавидином магнитных частиц, связанных с биотинилированным зондом захвата (снизу), для специфического захвата антитела.
На фигуре 17а показано LC-MS/MS разделение и выявление FSP8 при концентрации 1 мкг/мл антитела трастузумаб в плазме крови крысы.
На фигуре 17b показано LC-MS/MS разделение и выявление внутреннего стандарта, представляющего собой меченный стабильным изотопом (SIL) FSP8.
На фигуре 18 показана линейность выявления в виде графика соотношения FSP8 к внутреннему стандарту, представляющему собой меченный стабильным изотопом FSP8, относительно концентрации трастузумаба (HERCEPTIN®) от 1 до 250 мкг/мл в плазме крови крысы.
На фигуре 19а показан рисунок моноклонального антитела (mAb-терапевтического средства), захваченного путем связывания с иммобилизированным внеклеточным доменом (ECD) или поликлональным антителом к IgG человека и выявляемого при помощи меченного пероксидазой хрена (HRP) поликлонального антитела к IgG человека в анализе ELISA при помощи электрохемилюминисцентного или колориметрического выявления.
На фигуре 19b показаны элементы LC-MS/MS анализа, начинающегося с захвата частицы с белком А mAb-терапевтического средства из биологического образца, расщепления трипсином захваченного mAb-терапевтического средства с образованием одного или нескольких каркасных сигнатурных пептидов (FSP), например FSP8, и LC/MS/MS выявления мониторинга множественных реакций (MRM) для выявления перехода от 938,0 (М, 2+) до 836,7 (у15, 2+).
На фигуре 20 показана согласованность показанного на фигуре 19b LC-MS/MS анализа и ELISA-анализа из фигуры 19а на основе индивидуальной фармакокинетики (ФК) образцов плазмы/сыворотки крови крыс, которым были введены дозы трастазумаба, mAb к HER2.
На фигуре 21 показана согласованность показанного на фигуре 19b LC-MS/MS анализа и ELISA-анализа из фигуры 19а на основе индивидуальной фармакокинетики (ФК) образцов плазмы/сыворотки крови крыс, которым были введены дозы 3А5, mAb к MUC 16.
На фигуре 22 показана согласованность показанного на фигуре 19b LC-MS/MS анализа и ELISA-анализа из фигуры 19а на основе индивидуальной фармакокинетики (ФК) образцов плазмы/сыворотки крови крыс, которым были введены дозы mAb к мезотелину (Msln).
На фигуре 23 показана согласованность показанного на фигуре 19b LC-MS/MS анализа и ELISA-анализа из фигуры 19а на основе средних фармакокинетических параметров (ФК) образцов плазмы/сыворотки крови яванского макака, которому были введены дозы 3А5 (MMUC1206A), mAb к MUC 16, путем измерения антитела в плазме крови на протяжении 28 дней.
На фигуре 24 показана согласованность показанного на фигуре 19b LC-MS/MS анализа и ELISA-анализа из фигуры 19а на основе средних фармакокинетических параметров (ФК) образцов плазмы/сыворотки крови яванского макака, которому были введены дозы mAb к мезотелину (Msln), путем измерения антитела в плазме крови на протяжении 40 дней.
На фигуре 25 показана согласованность показанного на фигуре 19b LC-MS/MS анализа и ELISA-анализа из фигуры 19а на основе индивидуальной фармакокинетики (ФК) образцов плазмы/сыворотки крови мышей (А, В, С), которым были введены дозы конъюгата антитела-лекарственного средства (ADC), anti-LY6E-MC-vc-PAB-MMAE, в исследованиях эффективности на мышах.
Подробное описание изобретения
Если не указано иное, то используемые в настоящем документе технические и научные термины имеют то же значение, которое обычно понимается рядовым специалистом в данной области техники, к которой относится настоящее изобретение, и согласуются с Singleton et al, (1994) "Dictionary of Microbiology and Molecular Biology", 2nd Ed., J. Wiley & Sons, New York, NY; и Janeway, et al (2001) "Immunobiology", 5th Ed., Garland Publishing, New York. При использовании в настоящем документе торговых названий также подразумевается состав продукта с торговым названием, генерик и активный фармацевтический ингредиент(ы) продукта с торговым названием.
ОПРЕДЕЛЕНИЯ
Термин "биологический образец" относится к любому полученному или выделенному от животного компоненту и включает кровь, плазму, сыворотку крови, клетки, мочу, спинномозговую жидкость (CSF), молоко, бронхиальный лаваж, костный мозг, амниотическую жидкость, слюну, желчь, образец стекловидного тела, слезы или ткань.
Термин "расщепляющий фермент" относится к ферменту, способному расщеплять или гидролизировать пептиды или белки на ферменты либо специфическим, либо общим, случайным образом. Расщепляющий фермент может сформировать из антитела образец расщепленного антитела, причем антитело представляет собой компонент биологического образца. Расщепляющие ферменты включают протеазы, такие как трипсин, папаин, эндопротеиназа LysC, эндопротеиназа ArgC, V8 золотистого стафилококка, химотрипсин, Asp-N, Asn-C, пепсин и эндопротеиназа GluC.
Термин "антитело" в настоящем документе используется в наиболее широком смысле и охватывает различные структуры по типу антител, в том числе без ограничения моноклональные антитела, поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела) и фрагменты антител при условии, что они проявляют необходимую антиген-связывающую активность.
"Фрагмент антитела" относится к отличной от интактного антитела молекуле, которая содержит часть интактного антитела, связывающегося с антигеном, с которым связывается интактное антитело. Примеры фрагментов антитела включают без ограничения Fv, Fab, Fab', Fab'-SH, F(ab')2; диатела; линейные антитела; молекулы одноцепочечных антител (например, scFv); и образованные из фрагментов антител мультиспецифические антитела.
В соответствии с определенными вариантами осуществления приведенное в настоящем документе антитело представляет собой фрагмент антитела. Фрагменты антител включают без ограничения Fab, Fab', Fab'-SH, F(ab')2, Fv и scFv фрагменты и другие описываемые ниже фрагменты. Обзор некоторых фрагментов антител см. в работе Hudson et al. Nat. Med. 9:129-134 (2003). Обзор scFv фрагментов см., например, в работе Pluckthim, The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., (Springer-Verlag, New York), pp.269-315 (1994); патентных документах WO 93/16185; US 5571894; US 5587458. Рассмотрение Fab и F(ab')2 фрагментов, содержащих остатки связывающегося с рецептором спасения эпитопа и характеризующихся повышенным периодом полужизни in vivo, см. в патентном документе US 5869046.
Диатела представляют собой фрагменты антител с двумя антиген-связывающими сайтами, которые могут быть бивалентными или биспецифичными (ЕР 404097; WO 1993/01161; Hudson et al. (2003) Nat. Med. 9:129-134; Hollinger et al. (1993) Proc. Natl. Acad. Sci. USA 90: 6444-6448). Триотела и тетратела также описаны в Hudson et al. (2003) Nat. Med. 9:129-134.
Однодоменные антитела представляют собой фрагменты антител, содержащие весь или часть вариабельного домена тяжелой цепи или весь или часть вариабельного домена легкой цепи антитела. В соответствии с определенными вариантами осуществления однодоменное антитело представляет собой однодоменное человеческое антитело (US 6248516).
Фрагменты антител можно получить с помощью различных методик, в том числе без ограничения протеолитическое расщепление интактного антитела, а также продуцирование рекомбинантными клетками-хозяевами (например, Е. coli или фаг), как описывается в настоящем документе.
Термин "химерное" антитело относится к антителу, у которого часть тяжелой и/или легкой цепи происходит от конкретного источника или вида, в то время как другая тяжелая и/или легкая цепь происходит от другого источника или вида.
Термин "Fc участок" в настоящем документе используется для обозначения С-концевого участка иммуноглобулиновой тяжелой цепи, который содержит по меньшей мере часть константного участка. Термин включает Fc участки с нативной последовательностью и вариантные Fc участки. В соответствии с одним вариантом осуществления Fc участок тяжелой цепи IgG человека длится от Cys226, или от Pro230, до карбоксильного конца тяжелой цепи. Однако, С-концевой лизин (Lys447) Fc участка может присутствовать или может не присутствовать. Если в настоящем документе не указано иное, нумерация аминокислотных остатков в Fc участке или константном участке соответствует системе нумерации EU, также называемой EU-нумерация, которая описана в работе Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, 1991.
"Каркас" или "FR" относится к остаткам константного домена, отличным от остатков гипервариабельного участка (HVR). FR константного домена обычно состоит из четырех FR доменов: FR1, FR2, FR3 и FR4. Соответственно, последовательности HVR и FR обычно представлены в следующей последовательности в VH (или VL): FR1-Н1 (L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
Термины "антитело полной длины", "интактное антитело" и "целое антитело" используются в настоящем документе взаимозаменяемо для обозначения антитела со структурой, по сути схожей со структурой естественного антитела, или с тяжелыми цепями, которые содержат указанный в настоящем документе Fc участок.
"Человеческое антитело" представляет собой антитело, обладающее аминокислотной последовательностью, которая соответствует последовательности антитела, продуцируемого человеком или клеткой человека или полученного из любого источника, за исключением человека, в котором используются репертуары человеческих антител или другие кодирующие человеческие антитела последовательности. Это определение человеческого антитела, в частности, исключает гуманизированное антитело, содержащее отличные от человеческих антиген-связывающие остатки.
"Человеческий консенсусный каркас" является каркасным участком антитела, который представляет собой наиболее часто встречающиеся аминокислотные остатки при выборе каркасных VL или VH последовательностей иммуноглобулина человека. Обычно, выбор VL или VH последовательностей иммуноглобулина человека происходит из подгруппы последовательностей вариабельного домена. Обычно, подгруппа последовательностей представляет собой подгруппу согласно работе Kabat et al. Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication 91-3242, Bethesda MD (1991), vols.1-3. В соответствии с одним вариантом осуществления для VL подгруппой является подгруппа каппа I согласно приведенной выше работе Kabat et al. В соответствии с одним вариантом осуществления для VH подгруппой является подгруппа III согласно приведенной выше работе Kabat et al.
Термин "гуманизированное" антитело относится к химерному антителу, содержащему аминокислотные остатки из нечеловеческих HVR и аминокислотные остатки из человеческих FR. В соответствии с определенными вариантами осуществления гуманизированное антитело будет содержать практически все из по меньшей мере одного, и как правило двух, вариабельных доменов, в которых все или по сути все HVR (например, CDR) соответствуют таковым отличного от человеческого антитела и все или практически все FR соответствуют таковым человеческого антитела. Гуманизированное антитело необязательно может содержать по меньшей мере часть константного участка антитела, происходящего от человеческого антитела. Термин "гуманизированная форма антитела, например отличного от человеческого антитела, относится к антителу, которое было подвергнуто гуманизации.
Термин "химерное" антитело включает отличный от человеческого вариабельный участок (например, вариабельный участок, полученный от мыши, крысы, хомяка, кролика или низшего примата, такого как мартышка) и человеческий константный участок (US 4816567; Morrison et al. (1984) Proc. Natl. Acad. Sci. USA, 81:6851-6855). В следующем примере химерное антитело представляет собой антитело с "переключенным классом", у которого класс или подкласс был изменен по сравнению с таковым исходного антитела. Химерные антитела включают их антиген-связывающие фрагменты.
В соответствии с определенными вариантами осуществления химерным антителом является гуманизированное антитело. Как правило, отличное от человеческого антитело гуманизируют для снижения иммуногенности для людей, в то же время сохраняя специфичность и аффинность исходного отличного от человеческого антитела. В целом, гуманизированное антитело содержит один или несколько вариабельных доменов, в которых HVR, например CDR, (или их части) получены из последовательностей отличного от человеческого антитела. Гуманизированное антитело необязательно будет также содержать по меньшей мере часть человеческого константного участка. В соответствии с некоторыми вариантами осуществления некоторые FR остатки в гуманизированном антителе заменены соответствующими остатками из отличного от человеческого антитела (например, антитела, из которого получены остатки HVR), например, для восстановления или повышения специфичности или аффинности антитела.
Гуманизированные антитела и способы их получения рассматриваются, например, в работе Almagro and Fransson, Front. Biosci. 13:1619-1633 (2008), и дополнительно описаны, например, в работе Riechmann et al., Nature 332:323-329 (1988); Queen et al, Proc. Nat'l Acad. Sci. USA 86:10029-10033 (1989); US 5821337; US 7527791; US 6982321; US 7087409; Kashmiri et al. (2005) Methods 36:25-34 (описывающая прививку SDR (a-CDR)); Padlan, (1991) Mol. Immunol. 28:489-498 (описывающая "изменение поверхности"); Dall'Acqua et al. (2005) Methods 36:43-60 (описывающая "FR шаффлинг"); и Osboum et al, (2005) Methods 36:61-68; Klimka et al. (2000) Br. J. Cancer 83:252-260 (описывающая подход "управляемого отбора" для FR шаффлинга).
Человеческие каркасные участки, которые могут быть использованы для гуманизации, включают без ограничения: каркасные участки, отобранные с помощью способа "наибольшего соответствия" (см., например, Sims et al. J. Immunol. 151:2296 (1993)); каркасные участки, полученные из консенсусной последовательности человеческих антител конкретной подгруппы вариабельных участков легкой или тяжелой цепи (Carter et al. (1992) Proc. Natl. Acad. Sci. USA, 89:4285; Presta et al. (1993) J. Immunol., 151:2623); человеческие зрелые (с соматической мутацией) каркасные участки или человеческие каркасные участки эмбрионального типа (Almagro and Fransson, (2008) Front. Biosci. 13:1619-1633); и каркасные участки, полученные в результате скрининга FR библиотек (см, например, Васа et al. (1997) J. Biol. Chem. 272:10678-10684; и Rosok et al. (1996) J. Biol. Chem. 271:22611-22618).
Человеческие антитела могут быть получены с помощью различных известных в данной области техники методик. Человеческие антитела, в целом, описаны в работе van Dijk and van de Winkel, (2001) Curr. Opin. Pharmacol. 5: 368-74; Lonberg, Curr. Opin. Immunol. 20:450-459 (2008).
Человеческие антитела могут быть получены путем введения иммуногена трансгенному животному, которые было модифицировано с тем, чтобы продуцировать интактные человеческие антитела или интактные антитела с человеческими вариабельными участками в ответ на стимуляцию антигеном. Такие животные, как правило, содержат весь или часть человеческого иммуноглобулинового локуса, который заменяет эндогенный иммуноглобулиновый локус или который присутствует внехромосомно или рандомно интегрируется в хромосомы животного. У таких трансгенных мышей эндогенный иммуноглобулиновый локус, в целом, был инактивирован. Обзор способов получения человеческих антител от трансгенных животных см. в работе Lonberg, Nat. Biotech. 23:1117-1125 (2005). См. также, например, патенты США №№6075181 и 6150584, описывающие технологию XENOMOUSE™; US 5770429, описывающий технологию HuMAB®; US 7041870, описывающий технологию K-М MOUSE®, и US 2007/0061900, описывающий технологию VELOCiMousE®). Человеческие вариабельные участки из интактных антител, выработанных такими животными, могут быть дополнительно модифицированы, например, путем комбинирования с другим человеческим константным участком.
Человеческие антитела также могут быть получены при помощи гибридомных способов. Были описаны линии миеломных клеток человека и гетеромиеломных клеток мыши-человека для получения человеческих моноклональных антител. (См., например, Kozbor J. Immunol., 133: 3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp.51-63 (Marcel Dekker, Inc., New York, 1987); и Boemer et al., (1991) J. Immunol,, 147: 86). Человеческие антитела, полученные с помощью технологии человеческих В-клеточных гибридом, также были описаны в работе Li et al., Proc. Natl. Acad. Sci. USA, 103:3557-3562 (2006). Дополнительные способы включают способы, описанные, например, в патенте США №7189826 (в котором описано получение моноклональных человеческих антител IgM от линий гибридомных клеток); Ni, (2006) Xiandai Mianyixue, 26(4):265-268 (описывающей гибридомы человек-человек). Технология человеческой гибридомы (технология Trioma) также описана в работах Vollmers and Brandlein, (2005) Histology and Histopathology, 20(3):927-937 и Vollmers and Brandlein, (2005) Methods and Findings in Experimental and Clinical Pharmacology, 27(3): 185-91.
Человеческие антитела также могут быть получены путем выделения последовательностей клонированных Fv вариабельных доменов, отобранных из полученных от человека фаг-дисплейных библиотек. Такие последовательности вариабельных доменов затем могут быть скомбинированы с необходимым человеческим константным доменом. Техники отбора человеческих антител из библиотек антител описаны ниже.
Антитела согласно настоящему изобретению могут быть выделены путем скрининга комбинаторных библиотек в отношении антител с необходимой активностью или активностями. Например, в данной области техники известен ряд способов создания фаг-дисплейных библиотек и скрининга таких библиотек в отношении антител, обладающих необходимыми характеристиками связывания. Такие способы рассматриваются, например, в работе Hoogenboom et al. in Methods in Molecular Biology 178:1-37 (O'Brien et al., ed., Human Press, Totowa, NJ, 2001) и дополнительно описаны, например, в работе McCafferty et al., Nature 348:552-554; Clackson et al., Nature 352: 624-628 (1991); Marks et al. (1992) J. Mol. Biol. III: 581-597; Marks and Bradbury, in Methods in Molecular Biology 248:161-175 (Lo, ed., Human Press, Totowa, NJ, 2003); Sidhu et al. (2004) J. Mol. Biol. 338(2): 299-310; Lee et al. (2004) J. Mol. Biol. 340(5): 1073-1093; ellouse, (2004) Proc. Natl. Acad. Sci. USA 101(34): 12467-12472; и Lee et al. (2004) J. Immunol. Methods 284(1-2): 119-132.
В некоторых способах фагового дисплея репертуары генов VH и VL раздельно клонируют при помощи полимеразной цепной реакции (ПЦР) и рандомно рекомбинируют в фаговых библиотеках, которые затем могут быть подвергнуты скринингу в отношении связывающегося с антигеном фага, как описано в работе Winter et al., Ann. Rev. Immunol., 12: 433-455 (1994). Фаг, как правило, воспроизводит фрагменты антитела, либо в виде одноцепочечных Fv (scFv) фрагментов, либо в виде Fab фрагментов. Библиотеки из иммунизированных источников дают высокоаффинные антитела на иммуноген без необходимости построения гибридом. Альтернативно, может быть клонирован интактный репертуар (например, человека) с получением одного источника антител к широкому диапазону "чужих", а также "своих" антигенов без какой-либо иммунизации, как описано в работе Griffiths et al., EMBO J, 12: 725-734 (1993). Наконец, интактные библиотеки также можно получить синтетически путем клонирования сегментов неперестроенного V-гена из стволовых клеток, а также с применением ПЦР-праймеров, содержащих случайную последовательность, с тем, чтобы закодировать высоковариабельные CDR3 участки и осуществить перестройку in vitro, как описано в работе Hoogenboom and Winter, J. Mol. Biol., 227: 381-388 (1992). Фаговые библиотеки человеческих антител описаны в патентных документах US 5750373, US 2005/0079574, US 2005/0119455, US 2005/0266000, US 2007/0117126, US 2007/0160598, US 2007/0237764, US 2007/0292936, US 2009/0002360. Выделенные из библиотек человеческих антител антитела или фрагменты антител рассматривают в настоящем документе как человеческие антитела или фрагменты человеческих антител.
В соответствии с определенными вариантами осуществления антитело представляет собой мультиспецифичное антитело, например, биспецифичное антитело. Мультиспецифичные антитела представляют собой моноклональные антитела, которые характеризуются специфичностями связывания по меньшей мере для двух различных сайтов. В соответствии с определенными вариантами осуществления одна из специфичностей связывания предназначена для одного антигена, а другая предназначена для второго антигена. В соответствии с определенными вариантами осуществления биспецифичные антитела могут связываться с двумя различными эпитопами одного антигена. Биспецифичные антитела также могут быть использованы для связывания цитотоксических средств с экспрессирующими антиген клетками. Биспецифичные антитела могут быть получены в виде антител полной длины или в виде фрагментов антител.
Методики получения мультиспецифичных антител включают без ограничения рекомбинантную коэкспрессию двух пар тяжелая цепь-легкая цепь иммуноглобулина с различными специфичностями (см. работу Milstein and Cuello, Nature 305: 537 (1983)), WO 93/08829, и Traunecker et al., EMBO J. 10: 3655 (1991)), и конструирование "knob-in-hole" (US 5731168). Мультиспецифичные антитела также можно получить путем создания эффектов электростатического управления для создания Fc-гетеродимерных молекул антител (WO 2009/089004A1); сшивания двух или более антител или фрагментов (см., например, патент США №4676980 и работу Brennan et al„ Science, 229: 81 (1985)); применения лейциновых застежек с получением биспецифичных антител (см, например, работу Kostelny et al., J. Immunol., 148(5):1547-1553 (1992)); применения технологии "диатела" для получения биспецифичных фрагментов антител (см., например, работу Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993)); и применения одноцепочечных Fv (sFv) димеров (Gruber et al., J. Immunol., 152:5368 (1994)); и получения триспецифичных антител (Tutt et al. (1991) J. Immunol. 147: 60).
Также включены в настоящий документ сконструированные антитела с тремя или более функциональными антиген-связывающими сайтами, в том числе "осьминоговые антитела" (см., например, US 2006/0025576 A1).
Антитело или фрагмент в настоящем документе также включают "FAb двойного действия" или "DAF", содержащий антиген-связывающий сайт, который связывается с одним антигеном, а также с другим, отличным антигеном (см., например, US 2008/0069820).
Варианты антител
В соответствии с определенными вариантами осуществления предусматриваются приведенные в настоящем документе варианты аминокислотных последовательностей антител. Например, может быть необходимо увеличивать аффинность связывания и/или другие биологические свойства антитела. Варианты аминокислотных последовательностей антитела могут быть получены путем введения соответствующих модификаций в кодирующую антитело нуклеотидную последовательность или путем пептидного синтеза. Такие модификации включают, например, делеции из, и/или вставки в, и/или замены остатков в аминокислотной последовательности антитела. Для получения конечного конструкта может быть осуществлена любая комбинация делеции, вставки и замены при условии, что конечный конструкт обладает необходимыми характеристиками, например, антиген-связывающей характеристикой.
Антитела включают химерные белки, содержащие антитело, белок, лекарственную часть, метку или другую группу. Химерные белки могут быть получены с помощью рекомбинационных методик, конъюгации или пептидного синтеза с оптимизацией таких свойств, как фармакокинетика. Человеческое или гуманизированное антитело согласно настоящему изобретению также может представлять собой химерный белок, содержащий последовательность альбумин-связывающего пептида (АВР) (Dennis et al, (2002) "Albumin Binding As A General Strategy For Improving The Pharmacokinetics Of Proteins" V Biol Chem. 277:35035-35043; WO 01/45746). Антитела согласно настоящему изобретению включают химерные белки с последовательностями АВР, которые изложены в следующих источниках: (i) Dennis et al (2002) J Biol Chem. 277:35035-35043 в таблицах III и IV, страница 35038; (ii) US 2004/0001827 в параграфе [0076]; и (iii) WO 01/45746 на страницах 12-13, и причем все они включены в настоящий документ при помощи ссылки.
Варианты замен, вставок и делеции
В соответствии с определенными вариантами осуществления настоящее изобретение относится к вариантам антител с одной или несколькими аминокислотными заменами. Представляющие интерес сайты для приводящего к замене мутагенеза включают HVR и FR. Консервативные замены показаны в таблице 1 под заголовком "консервативные замены". Более заметные замены приведены в таблице 1 под заголовком "иллюстративные замены" и дополнительно описаны ниже на основании классов боковых цепей аминокислот. Аминокислотные замены могут быть введены в представляющее интерес антитело, а продукты подвергнуты скринингу на необходимую активность, например, сохраненное/улучшенное связывание с антигеном, пониженная иммуногенность или повышенная ADCC или CDC.
| Таблица 1 | ||
| Исходный остаток | Иллюстративные замены | Предпочтительны e замены |
| Ala (A) | Val; Leu; He | Val |
| Arg (R) | Lys; Gin; Asn | Lys |
| Asn (N) | Gln; His; Asp, Lys; Arg | Gln |
| Asp (D) | Glu; Asn | Glu |
| Cys (C) | Ser; Ala | Ser |
| Gin (Q) | Asn; Glu | Asn |
| Glu (E) | Asp; Gln | Asp |
| Gly (G) | Ala | Ala |
| His (H) | Asn; Gln; Lys; Arg | Arg |
| Ile (I) | Leu; Val; Met; Ala; Phe; норлейцин | Leu |