Трансдермальные фармацевтические композиции, содержащие активные агенты
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности и представляет собой фармацевтическую композицию замедленного высвобождения для местного введения на поверхности кожи, которая включает: фармацевтически активный агент, выбранный из группы, включающей эстрогены, антиэстрогены, андрогены, антиандрогены, прогестины, и их смеси, 0,01 - 5 масс. % от общей массы фармацевтической композиции эфира жирных кислот, выбранных из группы, состоящей из этилолеата, изопропилмиристата, изопропилизостеарата, изопропилпальмитата, этилоктаноата, этилдодеканоата, этиллинолеата, этилпальмитолеата, этилизостеарата и этиллинолеата, воду, С2-С6 моноспирт, выбранный из группы, состоящей из этанола, n-пропанола, изопропанола, n-бутанола, изобутанола, трет-бутанола и их смесей, жирную кислоту, выбранную из группы, состоящей из каприновой кислоты, лауриновой кислоты, миристиновой кислоты, пальмитиновой кислоты, стеариновой кислоты, олеиновой кислоты, изостеариновой кислоты, пальмитолеиновой кислоты, линолевой кислоты и линоленовой кислоты и от 0,05 до 5 масс. % гелеобразующего агента, где массовое соотношение сложного эфира жирной кислоты в композиции к общему активному агенту в указанной композиции составляет по меньшей мере 4:1 сложный эфир жирной кислоты : активный агент, предпочтительно от 4:1 до 20:1. Изобретение обеспечивает замедленное высвобождение, соответствующие профили доставки в диапазоне концентраций активных агентов, а также воспроизводимость от применения к применению и от пациента к пациенту. 2 н. и 19 з.п. ф-лы, 11 пр., 10 ил., 24 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к композициям и способам подачи терапевтически активного агента через кожу субъекта, например, к трансдермальным фармацевтическим композициям.
Уровень техники
Хорошо известно, что некоторые терапевтически активные агенты непригодны для орального назначения по различным причинам, связанным, в частности, или с высоким уровнем обмена веществ в печени ("эффект первичного превращения") или с высоким уровнем разложения в желудочно-кишечном тракте. Композиции чрескожного переноса или через слизистую оболочку были разработаны с целью устранения указанных недостатков. Конкретно, фармацевтические композиции для трансдермального или трансмукозного назначения обладают несколькими преимуществами перед пероральными формами, в том числе исключаются проблемы, связанные с обменом веществ терапевтически активного агента под действием печени и с разложением активного агента в желудке. Однако для трансдермальных и трансмукозных композиций возникают проблемы, связанные с кинетикой транспорта терапевтически активных агентов с поверхности кожи в кровоток.
Разумеется, кожа представляет собой гетерогенную ткань, которая включает в себя два слоя: дерма и самый верхний слой эпидермиса, который может быть дополнительно разделен на роговой слой и жизнеспособный эпидермис. Указанные слои придают коже характеристики барьера, предотвращающего поступление посторонних веществ, таких как лекарственные препараты. Роговой слой действует как физический диффузионный барьер, тогда как эпидермис и дерма, кроме того, могут обеспечить биохимический или ферментативный барьер.
Исследования, относящиеся к абсорбции терапевтически активных агентов кожей, главным образом, сосредоточены на увеличении скорости абсорбции компонентов активных агентов через кожу, чем на выяснении судьбы абсорбированных активных агентов. Например, для увеличения начальной скорости проникновения активных агентов через кожу было предложено использовать промоторы проницаемости. Обычно термин "промотор проницаемости" относится к любой молекуле, которая облегчает обратимую диффузию активного агента через кожные или мукозные мембраны, и к любому растворяющему реагенту, который способствует распределению активного агента между носителем и роговым слоем эпидермиса или мукозных мембран. Большинство промоторов проницаемости влияют на характеристики барьера рогового слоя кожи, т.е. промоторы обратимо изменяют структуру рогового слоя, и таким образом, повышается диффузионная способность и растворимость лекарственного препарата. Конечно, это усиливает проницаемость кожи активными агентами, но это также может вызывать непосредственную абсорбцию большого количества лекарственного препарата внутри тканей, что приводит к пиковой концентрации активного агента в крови, в первые часы после приема композиции. После этого начального пика часто следует спад концентрации в крови, до следующего приема композиции, который обычно происходит позже, через несколько часов, или один раз в день. Указанный внезапный скачок концентрации лекарственного препарата в крови может быть опасным для пациента, так как может превышать допустимую дозу лекарственного препарата для организма. Кроме того, поскольку вся доза активного агента поступает в кровоток и ткани в первые часы после приема, намеченный эффект лекарственного препарата не может поддерживаться до следующего приема.
Следовательно, остается потребность в трансдермальных фармацевтических композициях, которые способны подавать, по меньшей мере, часть их активного содержания в режиме контролируемого высвобождения, например, с помощью промежуточного хранения в дерме.
Сущность изобретения
В изобретении описаны трансдермальные фармацевтические композиции замедленного высвобождения, и способы их получения и применения.
В соответствии с некоторыми вариантами осуществления, разработаны фармацевтические композиции замедленного высвобождения для местного применения на поверхность кожи, которые включают в себя: фармацевтически активный агент, содержащий один или несколько стероидов, эфир жирной кислоты, воду, С2-С6 моноспирт и жирную кислоту, причем отношение массы эфира жирной кислоты в композиции ко всей массе активного агента в композиции составляет, по меньшей мере, 4:1 эфир жирной кислоты/активный агент, и предпочтительно изменяется приблизительно от 4:1 до 20:1.
В некоторых вариантах осуществления композиция дополнительно содержит сорастворитель, такой как пропиленгликоль. В некоторых вариантах осуществления сорастворитель присутствует в количестве от 0,01% до 7 масс.%, от общей массы фармацевтической композиции, или в количестве от 3% до 7 масс.%, от общей массы фармацевтической композиции.
В некоторых вариантах осуществления, эфир жирной кислоты выбирают из группы, состоящей из этилолеата, изопропил олеата, изопропилмиристата, изопропилизостеарата, изопропилпальмитата, этилоктаноата, этилдодеканоата, этиллинолеата, этилпальмитолеата, этилизостеарата и этил линолената. В некоторых вариантах осуществления, эфир жирной кислоты представляет собой эфир, который будет получаться при взаимодействии жирной кислоты, входящей в состав композиции, со спиртом. В других вариантах осуществления эфир жирной кислоты не является эфиром, который будет получаться при взаимодействии жирной кислоты, входящей в состав композиции, со спиртом, находящимся в композиции. В некоторых вариантах осуществления эфир жирной кислоты присутствует в количестве от 0,01% до 5 масс.%, от общей массы фармацевтической композиции, или в количестве от 0,05% до 2,4 масс.%, от общей массы фармацевтической композиции, или в количестве от 0,1% до 2,2 масс.%, от общей массы фармацевтической композиции.
В некоторых вариантах осуществления жирная кислота представляет собой С8-С22 жирную кислоту. В некоторых вариантах осуществления жирную кислоту выбирают из группы, состоящей из каприновой кислоты, лауриновой кислоты, миристиновой кислоты, пальмитиновой кислоты, стеариновой кислоты, олеиновой кислоты, изостеариновой кислоты, пальмитолеиновой кислоты, линолеиновой кислоты и линоленовой кислоты. В предпочтительном варианте осуществления жирная кислота является олеиновой кислотой. В некоторых вариантах осуществления жирная кислота присутствует в количестве от 0,01% до 5 масс.%, от общей массы фармацевтической композиции, или в количестве от 0,05% до 3,5 масс.%, от общей массы фармацевтической композиции, или в количестве от 1,0% до 3,0 масс.%, от общей массы фармацевтической композиции.
В специфических вариантах осуществления композиции содержат 2% этилолеата в качестве эфира жирной кислоты, 2% олеиновой кислоты в качестве жирной кислоты, и 5% пропиленгликоля в качестве сорастворителя, все проценты от общей массы фармацевтической композиции. В других специфических вариантах осуществления композиции содержат 0,3% этилолеата в качестве эфира жирной кислоты, 0,3% олеиновой кислоты в качестве жирной кислоты, и 0,75% пропиленгликоля в качестве сорастворителя, все проценты от общей массы фармацевтической композиции.
В некоторых вариантах осуществления, фармацевтически активный агент выбирают из группы, состоящей из гормонов: эстрогенов, анти-эстрогенов (или SERMs), андрогенов, анти-андрогенов, прогестинов, и их смесей. В некоторых вариантах осуществления фармацевтически активный агент выбирают из эстрадиола и прогестерона, и эфиром жирной кислоты является этилолеат. В других специфических вариантах осуществления фармацевтически активный агент выбирают из тестостерона и дигидротестостерона (DHT), и эфир жирной кислоты выбирают из этилолеата и изопропилмиристата. В некоторых вариантах осуществления активный агент присутствует в количестве от 0,01% до 5 масс.%, от общей массы фармацевтической композиции.
В некоторых вариантах осуществления спирт выбирают из группы, состоящей из этанола, н-пропанола, изопропанола, н-бутанола, изобутанола, трет-бутанола, и их смесей. В предпочтительном варианте осуществления, спирт является этанолом. В некоторых вариантах осуществления спирт присутствует в количестве от 10% до 90 масс.%, от общей массы фармацевтической композиции, или в количестве от 20% до 80 масс.%, от общей массы фармацевтической композиции, или в количестве от 45% до 75 масс.%, от общей массы фармацевтической композиции.
В соответствии с другими вариантами осуществления разработаны способы получения фармацевтической композиции замедленного высвобождения для местного применения на поверхность кожи, которые включают смешение фармацевтически активного агента, содержащего один или несколько стероидов, эфира жирной кислоты, воды, С2-С6 моноспирта и жирной кислоты, где отношение массы эфира жирной кислоты в композиции к массе активного агента в указанной композиции составляет, по меньшей мере, 4:1 эфир жирной кислоты/активный агент, предпочтительно приблизительно от 4:1 до 20:1. Любая композиция из описанных в настоящем изобретении может быть получена указанными способами.
В соответствии с другими вариантами осуществления разработаны способы обеспечения замедленного высвобождения фармацевтически активного агента через кожу субъекта, включающие местное нанесение на кожу субъекта фармацевтической композиции, включающей фармацевтически активный агент, содержащей один или несколько стероидов, эфир жирной кислоты, воду, С2-С6 моноспирт и жирную кислоту, где отношение массы эфира жирной кислоты в композиции к общей массе активного агента в композиции составляет, по меньшей мере, 4:1 эфир жирной кислоты/активный агент. Любая композиция из описанных в настоящем изобретении может быть получена указанными способами. В специфических вариантах осуществления эфир жирной кислоты присутствует в композиции в количестве от 0,1% до 20 масс.%, от общей массы фармацевтической композиции.
В некоторых вариантах осуществления замедленное высвобождение фармацевтически активного агента через кожу наблюдается, по меньшей мере, в течение 24 часов после его применения. В других вариантах осуществления замедленное высвобождение фармацевтически активного агента через кожу наблюдается, по меньшей мере, в течение 36 часов после его применения. В дополнительных вариантах осуществления замедленное высвобождение фармацевтически активного агента через кожу наблюдается, по меньшей мере, в течение 48 часов после его применения.
Краткое описание чертежей
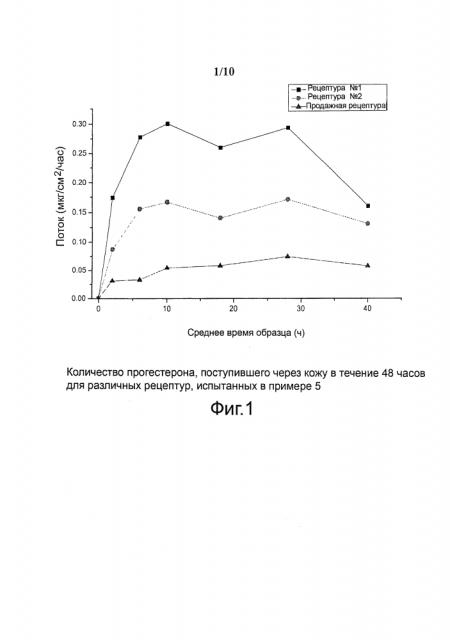
На фигуре 1 приведено количество прогестерона, поступившего через кожу в течение 48 часов (поток, мкг/см2/час) для различных композиций, испытанных в примере 5. (■ - Композиция 1; • -Композиция 2; ▲ - Прогестогель (гель 1% прогестерона в водном спирте) (фирма Besins Healthcare)).
На фигуре 2 приведено количество эстрадиола (мкг), поступившего через кожу через 48 часов относительно лекарственного препарата, входящего в типичную композицию (ромбы) и по сравнению с Estrogel® (гель 0,06% эстрадиола, квадрат) (фирма Ascend Therapeutics).
На фигуре 3 представлено влияние концентрации олеиновой кислоты, пропиленгликоля и эстрадиола на общую проницаемость эстрадиола (мкг) в течение 48 часов.
На фигуре 4 представлено влияние концентрации олеиновой кислоты, пропиленгликоля и эстрадиола на общую проницаемость эстрадиола (мкг) в течение 48 ч.
На фигуре 5 представлено влияние концентрации этилолеата и эстрадиола на общую проницаемость эстрадиола (мкг) в течение 48 ч.
На фигуре 6 представлено влияние концентрации этилолеата и эстрадиола на общую проницаемость эстрадиола (мкг) в течение 48 ч.
На фигуре 7 приведен профиль потока (мкг/см2/час) с течением времени для трех композиций, испытанных в примере 7 (■ – Композиция 301; • - Композиция 303; ▲ – Композиция 309).
На фигуре 8 приведен профиль потока (мкг/см2/час) с течением времени для трех композиций, испытанных в примере 7 (■ – Композиция 306; • - Композиций 307; ▲ – Композиция 311).
На фигуре 9 приведен профиль потока (мкг/см2/час) с течением времени для пяти композиций, испытанных в примере 7. (■ – Композиция 302; • - Композиция 304; ▲ – Композиция 305; ▼ – Композиция 308; ◄ - Композиция 310.)
На фигуре 10 представлена растворимость этилолеата (г/100 г) в зависимости от концентрации 96%-го этанола (по объему) в смеси, содержащей 0,24% эстрадиола, 5% пропиленгликоля и 2% олеиновой кислоты, все проценты даны в расчете на общую массу композиции.
Раскрытие изобретения
В немногих работах было исследовано, проходят ли активные агенты трансдермального назначения в кровоток непосредственно через кожу, или они сначала удерживаются внутри отделений кожи, которые служат в качестве склада-накопителя активного агента, до высвобождения в кровообращение. Из статьи, названной «Может ли систематически поглощаться кожный уровень абсорбированного материала?» (Drugs and Pharmaceutical Science, Vol.97, 235-239, 1999) известно, что кожа может играть роль склада-накопителя абсорбированных материалов. Например, кожный склад-накопитель химикалий был описан в статье Vickers, Adv. Biol. Skin. Vol.12, 177-89 (1972), который находится в роговом слое для локально нанесенных липофильных химикалий, таких как стероиды.
Однако, согласно настоящему изобретению, было установлено, что склад-накопитель в дерме может быть более эффективным, чем склад-накопитель в роговом слое кожи, и может обеспечить лучшее средство регулирования диффузионной кинетики активных агентов в тканях и более эффективную подачу лекарственного препарата во времени. Конечно, дерма составляет большую часть массы кожи. В ней имеется плотная сеть кровеносных и лимфатических сосудов, причем дерма является местом абсорбции лекарственных препаратов в системном кровообращении. Тем не менее, дерма редко является целью в качестве места для применения или отложения веществ, по-видимому, из-за трудности регулирования слоя кожи, в котором фактически удерживается активный агент.
Таким образом, в изобретении описаны трансдермальные фармацевтические композиции, которые проявляют выгодные свойства и позволяют получить выгодные результаты в связи с их профилем подачи лекарственного препарата. Например, в вариантах осуществления композиций, описанных в изобретении, достигается системная подача терапевтически активного агента через внешние слои кожи в дерму, где образуется хранилище, из которого активный агент подается в кровоток в течение длительного периода, такого как временной период, по меньшей мере, 12 часов, по меньшей мере, 24 часа, по меньшей мере, 36 часов, или по меньшей мере, 48 часов. Это можно наблюдать, например, когда активный агент продолжает выделяться в кровоток в течение 24 часов или больше, после промывки кожи.
Композиции изобретения также обеспечивают выгодно высокий уровень подачи активного агента в широком диапазоне концентраций активного агента. Кроме того, композиции имеют состав, который обеспечивает воспроизводимость уровня абсорбции среди различных областей применения и между различными пациентами.
Таким образом, в соответствии с некоторыми вариантами осуществления, разработаны трансдермальные фармацевтические композиции замедленного высвобождения для местного применения на поверхность кожи, которые содержат фармацевтически активный агент и эфир жирной кислоты, причем отношение массы эфира жирной кислоты в композиции к массе активного агента в указанной композиции составляет, по меньшей мере, 4:1 эфир жирной кислоты/активный агент, предпочтительно приблизительно от 4:1 до 20:1. В некоторых вариантах осуществления композиция дополнительно содержит воду, спирт и жирную кислоту. В некоторых вариантах осуществления композиция дополнительно содержит также сорастворитель, такой как пропиленгликоль. Другие традиционные компоненты также могут быть введены в трансдермальные фармацевтические композиции, которые рассматриваются ниже более подробно.
В частности, как обсуждается более подробно в приведенных ниже примерах, настоящее изобретение имеет отношение к неожиданному открытию, что добавка эфира жирной кислоты, по меньшей мере, в четырехкратном избытке относительно терапевтически активного агента (в расчете на массу) приводит к трансдермальной фармацевтической композиции с выгодными свойствами, включая замедленное высвобождение, постоянство профилей подачи в широком диапазоне концентраций активного агента, и воспроизводимость для различных областей применения и различных пациентов. Не желая ограничиваться какой-либо теорией, авторы полагают, что при таком высоком соотношении эфир жирной кислоты/активный агент облегчается распределение активного агента в дерме и образование хранилища внутри дермы, что приводит к удерживанию активного агента в дерме, с последующим замедленным высвобождением препарата в кровоток. Следовательно, описанные в изобретении композиции и методы также обеспечивают способ увеличения степени удерживания активного агента и • достижение подачи с замедленным высвобождением.
Таким образом, в соответствии с некоторыми вариантами осуществления, разработан способ получения замедленного высвобождения фармацевтически активного агента через кожу субъекта, который включает в себя местное нанесение на кожу субъекта фармацевтической композиции, содержащей терапевтически эффективное количество активного агента и эфир жирной кислоты, причем отношение массы эфира жирной кислоты в композиции к массе активного агента в указанной композиции составляет, по меньшей мере, 4:1 эфир жирной кислоты/активный агент. В некоторых вариантах осуществления, композиция дополнительно содержит воду, спирт и жирную кислоту. В некоторых вариантах осуществления, композиция дополнительно содержит также сорастворитель, такой как пропиленгликоль. Другие традиционные компоненты также могут быть введены в трансдермальные фармацевтические композиции, что рассматривается ниже более подробно.
Используемое в изобретении выражение «замедленная» подача означает, что композиция продолжает высвобождать активный агент в течение периода, по меньшей мере, 12 часов, по меньшей мере, 24 часа, по меньшей мере, 36 часов, или по меньшей мере, 48 часов, в том числе в течение периода, по меньшей мере, 24 часа. Например, композиции с замедленной подачей могут продолжать высвобождать активный агент в течение первых 24 часов после применения. В некоторых вариантах осуществления, описанные в изобретении композиции замедленной подачи продолжают высвобождать терапевтически эффективное количество активного агента спустя первые 24 часа после применения. В зависимости от природы композиции активного агента это может означать подачу, спустя первые 24 часа, например, по меньшей мере, 5%, по меньшей мере, 10%, по меньшей мере, 15%, по меньшей мере, 20%, по меньшей мере, 25%, по меньшей мере, 30% или больше, от общего количества поданного активного агента. И в этом случае, в зависимости от композиции и активного агента, это может означать подачу, спустя первые 24 часа, например, по меньшей мере, 2%, по меньшей мере, 3%, по меньшей мере, 4%, по меньшей мере, 5% или больше, от общего количества активного агента, имеющегося в композиции. Это можно наблюдать, например, когда активный агент продолжает выделяться в кровоток в течение 24 часов, или больше, после применения.
В некоторых вариантах осуществления, описанные в изобретении композиции замедленной подачи продолжают высвобождать активный агент, спустя первые 12, 24, 36, или 48 часов после применения, на уровне, который выше соответствующего количества, поданного в течение такого же периода времени с помощью сравнительной композиции, которая не содержит эфира жирной кислоты. Как показано в примере 2, это можно наблюдать, например, при испытании композиции, описанной в изобретении, и сравнительной композиции, которая не содержит эфира жирной кислоты (например, композиции, такого же состава, за исключением того, что отсутствует эфир жирной кислоты) в in vitro анализе в ячейке Франца, где композиции наносят на образец кожи в ячейке Франца, выдерживают 24 часа, и затем смывают, и затем определяют и сопоставляют подачу лекарственного препарата через кожу после промывки (например, спустя первые 24 часа после применения).
Композиции и способы описаны ниже более подробно и проиллюстрированы в примерах.
Если не указано другое, используемые в изобретении неопределенные артикли.
Означают «один или несколько».
Термин «приблизительно» и использование диапазонов, характеризуемых или не характеризуемых термином приблизительно, обычно означает, что обсуждаемое число не ограничено точным значением, указанным в изобретении, и предполагается, что оно относится к диапазонам практически внутри цитированного диапазона, в то же время без отклонения от объема изобретения. Используемый в изобретении термин «приблизительно» будет ясен специалистам в этой области техники, причем он может изменяться в некоторой степени, в связи с контекстом, где он используется. Если используются термины, которые не ясны специалистам в этой области техники в данном контексте, в котором используется термин, «приблизительно» будет означать плюс или минус 10% от конкретного значения.
Фармацевтические композиции
Как указано выше, в изобретении описаны композиции, которые содержат терапевтически эффективное количество терапевтически активного агента и эфир жирной кислоты, причем отношение массы эфира жирной кислоты в композиции к массе активного агента в указанной композиции составляет, по меньшей мере, 4:1 эфир жирной кислоты/активный агент, предпочтительно от 4:1 до 20:1. В конкретных вариантах осуществления композиции содержат фармацевтически активный агент, эфир жирной кислоты, воду, спирт и жирную кислоту. В дополнительных конкретных вариантах осуществления композиция, кроме того, содержит сорастворитель, такой как пропиленгликоль.
В специфических вариантах осуществления композиция содержит приблизительно 2% жирной кислоты (такой как олеиновая кислота), около 2% эфира жирной кислоты (такого как этилолеат), и приблизительно 5% сорастворителя (такого как пропиленгликоль). В дополнительных специфических вариантах осуществления композиция содержит 2% жирной кислоты (такой как олеиновая кислота), 2% эфира жирной кислоты (такого как этилолеат), и 5% сорастворителя (такого как пропиленгликоль). В других специфических вариантах осуществления композиция содержит приблизительно 0,3% жирной кислоты (такой как олеиновая кислота), около 0,3% эфира жирной кислоты (такого как этилолеат), и приблизительно 0,75% сорастворителя (такого как пропиленгликоль). В дополнительных специфических вариантах осуществления композиция содержит 0,3% жирной кислоты (такой как олеиновая кислота), 0,3% эфира жирной кислоты (такого как этилолеат), и 0,75%. Сорастворителя (такого как пропиленгликоль). Как отмечено выше, используемое выражение «приблизительно» включает в себя плюс или минус 10% от конкретного значения.
В некоторых вариантах осуществления композиция содержит специфические компоненты. В некоторых вариантах осуществления композиция состоит из специфических компонентов. В других вариантах осуществления композиция фактически состоит из специфических компонентов. Используемое в изобретении выражение «композиция фактически состоит из» специфических компонентов означает, что композиция включает, по меньшей мере, специфические компоненты, и кроме того, может включать другие компоненты, которые фактически не влияют на основные и новые характеристики изобретения.
Специфические компоненты композиций подробно описаны ниже.
Активные агенты
Описанные в изобретении композиции включают, по меньшей мере, один терапевтически активный агент. Активный агент может быть, например, молекулой лекарственного препарата, обычно гидрофобной природы, небольшого размера, например, с молекулярной массой менее 500 ед. Дальтона. В некоторых вариантах осуществления активный агент выбирают из стероидов, включая гормоны и половые гормоны. Термин «половые гормоны» относится к природным или синтетическим стероидным гормонам, которые взаимодействуют с андрогеном позвоночных или эстрогенными рецепторами, такими как эстрогены, анти-эстрогены или селективные модуляторы эстрогенных рецепторов (SERM), андрогены, анти-андрогены, прогестины и их смеси.
Когда композиция содержит более одного стероида, отношение массы эфира жирной кислоты в композиции к общему количеству стероида в композиции составляет, по меньшей мере, 4:1 эфир жирной кислоты/стероид, предпочтительно от 4:1 до 20:1.
Когда композиция изобретения содержит один или несколько стероидов и один или несколько других терапевтически активных агентов, отношение массы эфира жирной кислоты в композиции к общему количеству активных агентов в композиции составляет, по меньшей мере, 4:1 эфир жирной кислоты/активные агенты. В других вариантах осуществления отношение массы эфира жирной кислоты в композиции к общему количеству активных агентов в композиции составляет меньше, чем 4:1 эфир жирной кислоты/активный агент, хотя отношение массы эфира жирной кислоты в композиции к общему количеству стероида в композиции составляет, по меньшей мере, 4:1 эфир жирной кислоты: стероид.
Например, стероидные гормоны, подходящие для применения в композициях, описанных в изобретении, включают многочисленные природные и синтетические стероидные гормоны, в том числе андрогены, эстрогены, и прогестагены и их производные, такие как дегидроэпиандростерон (DHEA), андростендион, андростендиол, дигидротестостерон, тестостерон, прогестерон, прогестины, эстриол, эстрадиол. Другие подходящие стероидные гормоны включают глюкокортикоиды, гормоны щитовидной железы, кальциферол, прегненолон, альдостерон, кортизол, и их производные. Конкретно, подходящие стероидные гормоны включают половые гормоны, обладающие эстрогенным, способствующим наступлению беременности, андрогенным, или анаболическим действием, такие как эстроген, эстрадиол и их эфиры, например, валерат, бензоат, или ундецилат, этинилэстрадиол, и др.; прогестогены, такие как ацетат норэтистерона, левоноргестрел, ацетат хлормадинон, ацетат ципротерона, десогестрел, или гестоден, и др.; андрогены, такие как тестостерон и его эфиры (пропионат, ундецилат, и др.), и т.д.;
анаболические препараты, такие как метандростенолон, нандролон и его эфиры.
Эстрогены
В специфических вариантах осуществления один или несколько эстрогенов выбирают из группы, состоящей из природных эстрогенов, таких как 17β-эстрадиол, эстрон, сопряженные лошадиные эстрогены, эстриол и фитоэстрогены; полуприродные эстрогены, такие как валерат эстрадиола; или синтетические эстрогены, такие как этинилэстрадиол.
В некоторых вариантах осуществления изобретения разработана фармацевтическая композиция для местного применения на поверхность кожи, которая содержит воду, по меньшей мере, один терапевтически активный агент, выбранный из эстрогенов, спирта и эфира жирной кислоты. В некоторых вариантах осуществления изобретения разработана фармацевтическая композиция для местного применения на поверхность кожи, которая. Содержит воду, по меньшей мере, один терапевтически активный агент, являющийся эстрадиолом, спиртом, и эфиром жирной кислоты. В конкретных вариантах осуществления таких композиций, когда активный агент представляет собой эстрадиол, композиция не содержит дополнительную комбинацию прогестерона, пропиленгликоля, олеиновой кислоты, этилолеата, этанола, гидроксипропилцеллюлозы и очищенную воду.
Анти-эстрогены
Анти-эстрогены представляют собой класс фармацевтически активных агентов которые теперь называются селективными модуляторами эстрогенных рецепторов (SERM), причем обычно подразумевалось, что эти вещества способны блокировать действие эстрадиола, без проявления какой-либо собственной эстрогенной активности. Однако теперь такое описание признано неполным. Термин SERM предназначается для описания веществ, которые в отличие от чистых агонистов или антагонистов эстрогена обладают смешанным и селективным характером активности агониста-антагониста эстрогена, который, главным образом, зависит от целевой ткани. Фармакологической целью указанных лекарственных препаратов является производство эстрогенного действия в тех тканях, где такое действие является желательным (таких как костная ткань, мозг, печень), причем эти препараты или не обладают активностью, или имеют антагонистическую активность в таких тканях, как молочная железа и эндометрий, где эстрогенное действие (разрастание клеток) может быть вредным.
В специфических вариантах осуществления анти-эстрогены (SERM) выбирают из группы, состоящей из эндоксифена, дролоксифена, кломифена, ралоксифена, тамоксифена, 4-ОН тамоксифена, торемифена, даназола, и их фармацевтически приемлемых солей. В более конкретном варианте осуществления изобретения разработана фармацевтическая композиция для местного применения на поверхность кожи, которая содержит воду, по меньшей мере, один терапевтически активный агент, выбранный из анти-эстрогенов (SERM), выбирают из группы, состоящей из кломифена, ралоксифена, дролоксифена, эндоксифена, или их фармацевтически приемлемых солей, спирта и эфира жирной кислоты.
В конкретном варианте осуществления, в изобретении разработана фармацевтическая композиция для местного применения на поверхность кожи, которая содержит воду, по меньшей мере, один терапевтически активный агент, выбранный из анти-эстрогенов (SERM), спирта и эфира жирной кислоты. В некоторых конкретных вариантах осуществления таких композиций, когда активный агент представляет собой –тамоксифен, эфир жирной кислоты не является изопропилмиристатом. В других конкретных вариантах осуществления таких композиций, когда активный агент представляет собой тамоксифен, композиция дополнительно содержит жирную кислоту. В других дополнительных конкретных вариантах осуществления таких композиций, когда активный агент представляет собой 4-ОН тамоксифен, эфир жирной кислоты не является изопропилмиристатом. В других конкретных вариантах осуществления таких композиций, когда активный агент представляет собой 4-ОН тамоксифен, композиция дополнительно содержит жирную кислоту.
Андрогены
Андрогены можно выбирать из группы, состоящей из природного андрогена, тестостерона, и его полуприродных или синтетических производных, например, метилтестостерон; физиологические предшественники тестостерона, такие как дегидроэпиандростерон или DHEA, или в качестве альтернативы, прастерон и его производные, например, сульфат DHEA, А-4-андростендион и его производные;
метаболиты тестостерона, например, дигидротестостерон (DHT), полученный после ферментативного воздействия 5-а-редуктаз; или веществ с действием андрогенного типа, таких как тиболон.
В конкретном варианте осуществления, в изобретении разработана фармацевтическая композиция для местного применения на поверхность кожи, которая содержит воду, по меньшей мере, один активный агент, выбранный из андрогенов, спирта, и эфира жирной кислоты. В конкретных вариантах осуществления указанных композиций, когда активный агент представляет собой тестостерон или дигидротестостерон (DHT), композиция также содержит жирную кислоту в качестве усилителя проницаемости.
Анти-Андрогены
Анти-андрогены можно выбирать из группы, состоящей из стероидных веществ, таких как ацетат ципротерона и медроксипрогестерон, или нестероидных веществ, таких как флутамид, нилутамид или бикалутамид.
В конкретном варианте осуществления, в изобретении разработана фармацевтическая композиция для местного применения на поверхность кожи, которая содержит воду, по меньшей мере, один активный агент, выбранный из анти-андрогенов, спирта, и эфира жирной кислоты.
Прогестины
Прогестин (прогестины), используемый в фармацевтической композиции согласно изобретению, может быть выбран из группы, состоящей из природных прогестинов,
прогестерона или его производных эфирного типа, и синтетических прогестинов типа 1, 2 или 3.
Первая группа включает в себя молекулы, аналогичные прогестерону или синтетическим прогестинам 1 (SP1) (прегнаны), например изомер прогестерона (ретропрогестерон), медрогестерон, и производные норпрогестерона (демегестон или промегестон).
Вторая группа включает в себя производные 17а-гидроксипрогестерона или синтетические прогестины 2 (SP2) (прегнаны), например ацетат ципротерона и ацетат медроксипрогестерона.
Третья группа включает в себя норстероиды или синтетические прогестины 3 (SP3) (эстраны или норандростан). Эти вещества являются производными 19-нортестостерона, например, норэтиндрон. Кроме того, эта группа содержит молекулы типа гонана, которые произведены из этих норандростанов или эстранов и имеют метальную группу при атоме С 18 и этильную группу при атоме С 13. Примеры, которые могут быть упомянуты, включают норгестимат, десогестрел (3-кетодесогестрел) или гестоден. Тиболон, который обладает прогестиновой, а также андрогенной активностью, предпочтительно также может быть включен в фармацевтическую композицию согласно изобретению.
В конкретном варианте осуществления в изобретении разработана фармацевтическая композиция для местного применения на поверхность кожи, которая содержит воду, по меньшей мере, один терапевтически активный агент, выбранный из прогестинов, спирта, и эфира жирной кислоты. В конкретных вариантах осуществления таких композиций, когда активный агент является прогестероном, композиция дополнительно не содержит комбинацию эстрадиола, пропиленгликоля, олеиновой кислоты, этилолеата, этанола, гидроксипропилцеллюлозы и очищенной воды.
В конкретных вариантах осуществления, терапевтически активный агент в фармацевтической композиции согласно изобретению представляет собой прогестин, эстроген или их комбинацию.
Как отмечалось выше, когда композиция содержит больше одного стероида, отношение массы эфира жирной кислоты в композиции к общему количеству стероидного активного агента в композиции составляет, по меньшей мере, 4:1 эфир жирной кислоты/активный агент, например, от 4:1 до 20:1.
Обычно на количество терапевтически активного агента, присутствующего в композиции, будет влиять дозировка, которая должна быть подана для терапевтического эффекта, и фармакологические соображения. Обычно композиции включают в себя терапевтически эффективное количество активного агента. Используемое в изобретении выражение «терапевтически эффективное количество» означает количество (дозировку), при котором у субъекта достигается специфический фармакологический отклик, для чего вводится лекарственный препарат. Подчеркивается, что «терапевтически эффективное количество» лекарственного препарата, которое вводится конкретному пациенту в конкретном случае, не всегда может быть эффективным при лечении целевого состояния/заболевания, даже если специалист в этой области техники предполагает, что указанная дозировка будет терапевтически эффективным количеством. Специалисты в этой области техники могут признать, что «терапевтически эффективное количество» может изменяться для различных пациентов или различных состояний, и могут определить «терапевтически эффективное количество» для данного пациента/состояния традиционными средствами.
Выгодно, чтобы терапевтически активный агент присутствовал в композиции в количестве приблизительно от 0,01% до 5%, или от 0,01% до 5%, в том числе приблизительно от 0,02% до 3%, или от 0,02% до 3%, например, приблизительно от 0,03% до 2%, или от 0,03% до 2%, в том числе приблизительно от 0,05% до 0,5%, или от 0,05% до 0,5%, например, приблизительно от 0,2% до 0,4%, или от 0,2% до 0,4%, причем указанные проценты выражены по массе, в расчете на всю массу фармацевтической композиции.
Согласно одному выгодному варианту осуществления, когда активный агент содержит прогестин, его содержание изменяется приблизительно от 0,01% до 5%, в том числе приблизительно от 0,05% до 3%, например, приблизительно от 0,1% до 1%, причем указанные проценты выражены по массе, в расчете на всю массу фармацевтической композиции. Таким образом, содержание прогестина может изменяться от 0,01% до 5%, в том числе от 0,05% до 3%, например, от 0,1% до 1%.
Согласно другому варианту осуществления