Получение белков в культуральных средах без глутамина
Иллюстрации
Показать всеНастоящее изобретение относится к области генной инженерии, конкретно к клеточным культуральным средам без глутамина, дополненным аспарагином, и может быть использовано для получения полипептида, выбранного из антител, фрагментов антител и иммуноадгезинов, в клетке-хозяине млекопитающего. Для получения полипептида в фазе продукции предложена готовая к использованию клеточная культуральная среда без глутамина, которая содержит аспарагин от 7,5 мМ до 15 мМ и аспарагиновую кислоту от 1 мМ до 10 мМ. Изобретение позволяет увеличить продолжительность жизни культуры клеток, специфическую продуктивность и конечный титр рекомбинантного белка. 2 н. и 40 з.п. ф-лы, 13 ил., 1 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится главным образом к культуральным средам без глутамина. Изобретение дополнительно рассматривает получение рекомбинантных белков, таких как антитела, в клеточной культуре млекопитающих без глутамина.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Клетки млекопитающих стали доминирующими системами для получения белков млекопитающих для применения в медицинской практике главным образом из-за их способности продуцировать правильно уложенные и собранные гетерологичные белки и наличия у них возможности для посттрансляционных модификаций. Общепринятым является наличие глутамина в средах культивирования клеток во время рекомбинантного получения гетерологичных белков, включая антитела. L-глутамин является незаменимой аминокислотой, которая является основным источником энергии и азота для клеток в культуре. Наиболее коммерчески доступные среды составлены с использованием свободного L-глутамина, который либо включают в основную смесь, либо добавляют к композициям жидких сред в момент использования. Таким образом, все питательные среды для выращивания клеток млекопитающих содержат глутамин за исключением таковых для трансфицированных глутаминсинтетазой клеточных линий, таких как клеточные линии GS NS0 и GS CHO, где в самих клетках продуцируется глутамин, необходимый для роста. Глутамин широко используется в различных концентрациях обычно в диапазоне от 1 до 20 мМ в основных средах и в более высоких концентрациях в кормовых добавках для подпитки. Например, концентрация L-глутамина равна 0,5 мМ в питательной среде Ames и 10 мМ в питательной среде MCDP 131. Питательная смесь DMEM/Ham’s F-12 (50:50) обычно используется в качестве исходной композиции для индивидуально изготовляемых питательных сред, используемых с клетками яичника китайского хомячка (CHO). Концентрация L-глутамина в питательной смеси DMEM/Ham’s F-12 равна 2,5 мМ. Концентрация L-глутамина в бессывороточной/безбелковой среде для выращивания клеток гибридомы равна 2,7 мМ. Концентрация L-глутамина в питательных средах DMEM, GMEM, IMDM и H-Y равна 4 мМ, из которых IMDM обычно используется в качестве исходной композиции для индивидуально изготовляемых питательных сред для выращивания клеток гибридомы. Как правило, считается, что клетки гибридомы растут лучше в концентрациях L-глутамина, превышающих средние уровни, создаваемые в питательных средах. (Dennis R. Conrad, Glutamine in Cell Culture, Sigma-Aldrich Media Expert)
Было показано, что глутамин является главным источником аммиака, накапливаемого в клеточной культуре (см. обзор Markus Schneider, et al. 1996, Journal of Biotechnology 46:161-185). Таким образом, уменьшение концентрации глутамина в культуральных средах значительно снижало накопление NH4+, приводя к снижению цитотоксичности (см. выше Markus Schneider, et al. 1996). Сниженная цитотоксичность NH4+ обусловливала более высокую жизнеспособность клеток, таким образом, увеличивала продолжительность жизни культуры. На основе расчетного исследования потребления глутамина, используя клетки CHO, было предположено, что клетки могут потреблять глутамин со скоростью 0,3-0,4 мМ в день (Miller, et al. 1988, Biotechnol. Bioeng. 32: 947-965). Altamirano et al. (2001, J. Biotechnol. 110:171-9) изучали влияние замены глутамина на глутамат и баланс между метаболизмом глутамата и глюкозы на перераспределение клеток СНО, продуцирующих рекомбинантный тканевой активатор плазминогена (rhut-PA). Когда глутамин был заменен на глутамат и уравновешен катаболизмом глюкозы (соотношение углерода и азота, соотношение C/N), было обнаружено, что клеточный метаболизм перераспределен и вынужден использовать источник углерода и энергии более предпочтительно для продукции rhut-PA. Было также опубликовано, что клетки СНО в плотно прилегающих культурах клеток могут расти в отсутствие добавленного глутамина благодаря активности эндогенной глутаминсинтетазы, позволяющей клеткам синтезировать глутамин из глутаминовой кислоты в среде (Sanfeliu and Stephanopoulos, 1999, Biotechnol. Bioeng. 64:46-53). Однако, по сравнению с контрольными культурами в содержащих глутамин питательных средах скорость клеточного роста в питательных средах без глутамина была медленнее с повышенной фракцией клеток, находящихся в фазе G0/G1. Истощение запасов как глутамина, так и глутаминовой кислоты действительно вызывало клеточную гибель.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано, по меньшей мере, частично, на неожиданном обнаружении того, что мало того, что рекомбинантные белки могут быть продуцированы в клетке-хозяине млекопитающего, используя питательную среду для продукции без глутамина без какого-либо значимого неблагоприятного эффекта, фактически использование питательной среды без глутамина в фазе продукции значительно увеличивают жизнеспособность клеток, продолжительность жизни культуры, специфическую продуктивность и/или конечный титр рекомбинантного белка.
Настоящее изобретение также основано на неожиданном обнаружении того, что добавление аспарагина в питательную среду для продукции без глутамина может дополнительно увеличивать жизнеспособность клетки, продолжительность жизни культуры, специфическую продуктивность и/или конечный титр рекомбинантного белка в клетке-хозяине млекопитающего, используя среду для продукции без глутамина без какого-либо значимого неблагоприятного эффекта.
В одном аспекте изобретение рассматривает способ получения полипептида в клетке-хозяине млекопитающего, экспрессирующей указанный полипептид, включающий культивирование клетки-хозяина млекопитающего в фазе продукции клеточной культурой в культуральной среде для продукции без глутамина, дополненной аспарагином.
В одном варианте осуществления изобретения клеткой-хозяином млекопитающего является клетка яичника китайского хомячка (СНО).
В другом варианте осуществления изобретения клеткой-хозяином млекопитающего является клетка СНО dhfr-.
В еще одном варианте осуществления изобретения среда для продукции является бессывороточной.
В дополнительном варианте осуществления изобретения культуральная среда для продукции включает один или несколько ингредиентов, выбранных из группы, состоящей из:
1) источника энергии;
2) незаменимых аминокислот;
3) витаминов;
4) свободных жирных кислот; и
5) следовых элементов.
В ином дополнительном варианте осуществления изобретения, где культуральная среда для продукции дополнительно включает один или несколько ингредиентов, выбранных из группы, состоящей из:
1) гормонов и других ростовых факторов;
2) солей и буферов; и
3) нуклеозидов.
Во всех вариантах осуществления изобретения фаза продукции может, например, быть фазой периодической или подпитываемой культуры.
Во всех вариантах осуществления изобретения способ может дополнительно включать этап выделения указанного полипептида.
В дополнительном варианте осуществления изобретения после выделения может следовать определение одного или нескольких параметров: жизнеспособности клеток, продолжительности жизни культуры, специфической продуктивности и конечного титра рекомбинантного белка вслед за выделением.
В ином дополнительном варианте осуществления изобретения по меньшей мере один из параметров - жизнеспособность клеток, продолжительность жизни культуры, специфическая продуктивность и конечный титр рекомбинантного белка - увеличен относительно того же самого полипептида, продуцированного в содержащей глутамин питательной среде для продукции такого же состава.
В дополнительном аспекте изобретение рассматривает готовую к использованию культуральную питательную среду без глутамина для получения полипептида в фазе продукции.
В еще одном варианте осуществления изобретения полипептид является гликопротеином млекопитающих.
В других вариантах осуществления изобретения полипептид выбран из группы, состоящей из антител, фрагментов антител и иммуноадгезинов.
Во всех вариантах осуществления изобретения полипептид может, например, быть антителом или биологически функциональным фрагментом антитела. Иллюстративные фрагменты антитела включают Fab, Fab’, F(ab’)2, scFv, (scFv)2, dAb, фрагменты определяющих комплементарность областей (CDR), линейные антитела, одноцепочечные молекулы антитела, минитела, диатела и мультиспецифичные антитела, образованные из фрагментов антитела.
В ином дополнительном варианте осуществления изобретения антитело или фрагмент антитела является химерным, гуманизированным или человеческим.
Терапевтические антитела включают, помимо прочего, антитела против HER2, антитела против CD20; антитела против IL-8; антитела против VEGF; антитела против CD40; антитела против CD11a; антитела против CD18; антитела против IgE; антитела против рецептора Apo-2; антитела против Тканевого фактора (TF); антитела против интегрина α4β7 человека; антитела против EGFR; антитела против CD3; антитела против CD25; антитела против CD4; антитела против CD52; антитела против рецептора Fc; антитела против раковоэмбрионального антигена (СЕА); антитела, направленные против эпителиальных клеток молочной железы; антитела, связывающиеся с клетками карциномы толстой кишки; антитела против CD38; антитела против CD33; антитела против CD22; антитела против EpCAM; антитела против GpIIb/IIIa; антитела против RSV; антитела против CMV; антитела против HIV; антитела против гепатита; антитела против CA 125; антитела против avβ3; антитела против почечно-клеточной карциномы человека; антитела против 17-1А человека; антитела против колоректальной опухоли человека; антитело R24 по выявлению меланомы человека, направленное против ганглиозида GD3; антитела против плоскоклеточной карциномы человека; и антитела против лейкоцитарного антигена человека (HLA) и антитела против HLA-DR.
В других вариантах осуществления изобретения терапевтическим антителом является антитело, связывающееся с рецептором HER, VEGF, IgE, CD20, CD11a, CD40 или DR5.
В других вариантах осуществления изобретения терапевтическим антителом является антитело против BR3 или иммуноадгезин BR3-Fc.
В других вариантах осуществления метода по настоящему изобретению полипептид, экспрессируемый в рекомбинантной клетке-хозяине, является терапевтическим полипептидом. Например, терапевтический полипептид может быть выбран из группы, состоящей из гормона роста, включая гормон роста человека и гормон роста крупного рогатого скота; фактора высвобождения гормона роста; паратиреоидного гормона; тиреотропного гормона; липопротеинов; альфа-1-антитрипсина; А-цепи инсулина; В-цепи инсулина; проинсулина; фолликулостимулирующего гормона; кальцитонина; лютеинизирующего гормона; глюкагона; факторов свертывания крови, таких как фактор VIIIC, фактор IX, тканевой фактор и фактор Виллебранда; противосвертывающих факторов, таких как протеин С; предсердного натрийуретического фактора; сурфактанта легкого; активатора плазминогена, такого как урокиназа или мочевой или тканевой активатор плазминогена человека (t-PA); бомбезина; тромбина; гемопоэтического ростового фактора; фактора некроза опухолей альфа и бета; энкефалиназы; RANTES (регулируемого при активации нормальных Т-клеток, его экспрессирующих и секретирующих); макрофагального белка воспаления человека (MIP-1-альфа); сывороточного альбумина, такого как сывороточный альбумин человека; мюллерова ингибирующего фактора; А-цепи релаксина; В-цепи релаксина; прорелаксина; мышиного гонадотропин-ассоциированного пептида; микробного белка, такого как бета-лактамаза; ДНКазы; IgE; ассоциированного с цитотоксическими Т-лимфоцитами антигена (CTLA), такого как CTLA-4; ингибина; активина; фактора роста сосудистого эндотелия (VEGF); рецепторов к гормонам или ростовым факторам; протеина А или D; ревматоидных факторов; нейротрофического фактора, такого как костный нейротрофический фактор (BDNF), нейротрофин-3, -4, -5 или -6 (NT-3, NT-4, NT-5 или NT-6), или фактора роста нервов, такого как NGF-β; тромбоцитарного ростового фактора (PDGF); фактора роста фибробластов, такого как aFGF и bFGF4; эпидермального ростового фактора (EGF); трансформирующего ростового фактора (TGF), такого как TGF-альфа и TGF-бета, включая TGF-β1, TGF-β2, TGF-β3, TGF-β4 или TGF-β5; инсулиноподобного ростового фактора-I и -II (IGF-I и IGF-II); des(1-3)-IGF-I (мозгового IGF-I); связывающих инсулиноподобный ростовой фактор белков; белков CD, таких как CD3, CD4, CD8, CD19, CD20, CD34 и CD40; эритропоэтина; остеоиндуктивных факторов; иммунотоксинов; костного морфогенетического белка (BMP); интерферона, такого как интерферон-альфа, -бета и -гамма; колониестимулирующих факторов (CSF), например, M-CSF, GM-CSF и G-CSF; интерлейкинов (IL), например, IL-1 - IL-10; супероксиддисмутазы; Т-клеточных рецепторов; поверхностных мембранных белков; комплементзависимого стимулятора гемолиза; вирусного антигена, такого как, например, часть оболочки AIDS; транспортных белков; «хоминг»-рецепторов; аддрессинов; регуляторных белков; интегринов, таких как CD11a, CD11b, CD11c, CD18, ICAM, VLA-4 и VCAM; опухолеассоциированного антигена, такого как рецептор HER2, HER3 или HER4; и фрагментов указанных полипептидов.
Во всех вариантах осуществления изобретения рекомбинантной клеткой-хозяином может быть эукариотическая клетка-хозяин, такая как клетка-хозяин млекопитающего, включая, например, клетки яичника китайского хомячка (СНО).
Эти и другие аспекты будут очевидными из приведенного ниже описания, включая Примеры и прилагаемую формулу изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
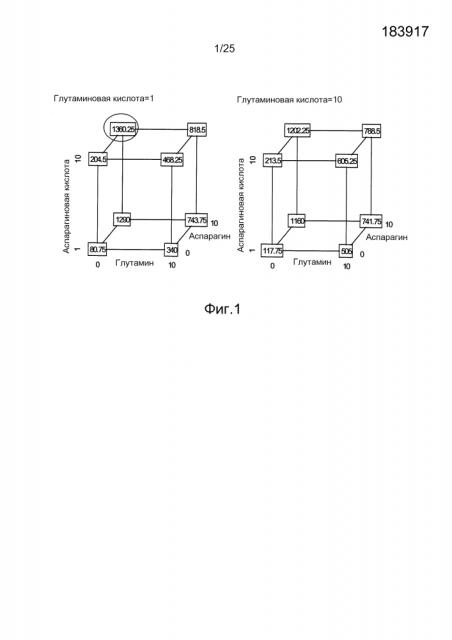
Фиг.1. Анализ титра антитела Apomab с помощью кубического построения, являющегося результатом факторного полного плана эксперимента (DOE), оценивающего влияние различных концентраций глутамина, глутамата, аспарагина и аспартата. Модель прогнозирует, что наибольший титр достигается в питательной среде без глутамина, дополненной 10 мМ аспарагином, 10 мМ аспарагиновой кислотой и 1 мМ глутаминовой кислотой.
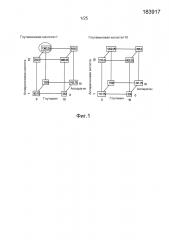
Фиг.2. Анализ титра иммуноадгезина BR3-Fc с помощью кубического построения, являющегося результатом полнофакторного DOE, оценивающего влияние различных концентраций глутамина, глутамата, аспарагина и аспартата. Модель прогнозирует, что наибольший титр достигается в питательной среде без глутамина, дополненной 10 мМ аспарагином, 10 мМ аспарагиновой кислотой и 1 мМ глутаминовой кислотой.
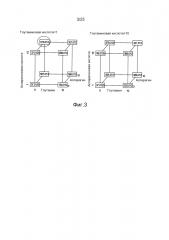
Фиг.3. Анализ титра антитела против VEGF с помощью кубического построения, являющегося результатом полнофакторного DOE, оценивающего влияние различных концентраций глутамина, глутамата, аспарагина и аспартата. Модель прогнозирует, что наибольший титр достигается в питательной среде без глутамина, дополненной 10 мМ аспарагином, 10 мМ аспарагиновой кислотой и 1 мМ глутаминовой кислотой.
Фиг.4. Влияние аспарагина в условиях отсутствия глутамина, низкой концентрации глутамата и высокой концентрации аспартата на титр антитела Apomab. В питательной среде без глутамина титр антитела Apomab значительно увеличился в присутствии 2,5-15 мМ аспарагина по сравнению с культурами в отсутствие глутамина без аспарагина. В этих условиях наличие или отсутствие глутамата не оказывало влияния на титр.
Фиг.5. Получение титра антитела Apomab при различных концентрациях аспарагина и аспартата в условиях отсутствия глутамина и низкой концентрации глутамата. Положительный эффект титрования наблюдали при повышении концентрации аспартата от 0 до 10 мМ в этих условиях.
Фиг.6А-С. Влияние питательной среды без глутамина, дополненной 10 мМ аспарагином, 10 мМ аспарагиновой кислотой и 1 мМ глутаминовой кислотой, на титр. Конечный титр для антитела Apomab, антитела против VEGF и иммуноадгезина BR3-Fc был значительно выше в питательной среде без глутамина по сравнению с содержащей глутамин питательной средой.
Фиг.7А и В. Влияние питательной среды DMEM/F12 без глутамина, дополненной 10 мМ аспарагином, 10 мМ аспарагиновой кислотой и 1 мМ глутаминовой кислотой, на титр. Конечный титр для антитела Apomab и антитела против VEGF был значительно выше в питательной среде DMEM/F12 без глутамина по сравнению с содержащей глутамин питательной средой DMEM/F12.
Фиг.8А-С. Влияние питательной среды без глутамина, дополненной 10 мМ аспарагином, 10 мМ аспарагиновой кислотой и 1 мМ глутаминовой кислотой, на клеточно-специфичную продуктивность (Qp). Клеточно-специфичная продуктивность для антитела Apomab, антитела против VEGF и иммуноадгезина BR3-Fc была значительно выше в питательной среде без глутамина по сравнению с содержащей глутамин питательной средой.
Фиг.9А и В. Влияние питательной среды DMEM/F12 без глутамина, дополненной 10 мМ аспарагином, 10 мМ аспарагиновой кислотой и 1 мМ глутаминовой кислотой, на клеточно-специфичную продуктивность (Qp). Клеточно-специфичная продуктивность для антитела Apomab и антитела против VEGF была значительно выше в питательной среде DMEM/F12 без глутамина по сравнению с содержащей глутамин питательной средой DMEM/F12.
Фиг.10А-С. Влияние питательной среды без глутамина, дополненной 10 мМ аспарагином, 10 мМ аспарагиновой кислотой и 1 мМ глутаминовой кислотой, на жизнеспособность клеток. Жизнеспособность клеток для антитела Apomab, антитела против VEGF и иммуноадгезина BR3-Fc была выше в питательной среде без глутамина по сравнению с содержащей глутамин питательной средой.
Фиг.11 А и В. Влияние питательной среды DMEM/F12 без глутамина, дополненной 10 мМ аспарагином, 10 мМ аспарагиновой кислотой и 1 мМ глутаминовой кислотой, на жизнеспособность клеток. В питательной среде DMEM/F12 жизнеспособность клеток не была стабильно улучшена в питательной среде без глутамина. Жизнеспособность была выше для антитела Apomab, но ниже для антитела против VEGF по сравнению с содержащей глутамин питательной средой.
Фиг.12А-С. Влияние питательной среды без глутамина, дополненной 10 мМ аспарагином, 10 мМ аспарагиновой кислотой и 1 мМ глутаминовой кислотой, на образование аммиака. Уровень аммиака был, как правило, ниже в культурах клеток без глутамина по сравнению с содержащими глутамин культурами.
Фиг.13А и В. Влияние питательной среды DMEM/F12 без глутамина, дополненной 10 мМ аспарагином, 10 мМ аспарагиновой кислотой и 1 мМ глутаминовой кислотой, на образование аммиака. Уровень аммиака был значительно снижен в питательной среде DMEM/F12 без глутамина по сравнению с содержащей глутамин питательной средой DMEM/F12.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
А. Определения
Термины «среда культивирования клеток», «культуральная среда» и «питательная смесь» относятся к питательному раствору, используемому для выращивания клеток млекопитающих, который, как правило, обеспечивает по меньшей мере одним компонентом из одной или нескольких нижеперечисленных категорий:
1) источником энергии, как правило, в форме углевода, такого как глюкоза;
2) некоторыми или всеми незаменимыми аминокислотами и обычно основным набором из двадцати аминокислот плюс цистин;
3) витаминами и/или другими органическими соединениями, как правило, требуемыми в низких концентрациях;
4) свободными жирными кислотами; и
5) следовыми элементами, где под следовыми элементами понимают неорганические соединения или природные элементы, которые обычно требуются в очень низких концентрациях, как правило, в микромолярном диапазоне.
Питательная смесь может в некоторых случаях быть дополнена одним или несколькими компонентами из любых нижеперечисленных категорий:
1) гормонами и другими ростовыми факторами как, например, инсулин, трансферрин и эпидермальный ростовой фактор;
2) солями и буферами, такими как, например, кальций, магний и фосфат; и
3) нуклеозидами, такими как, например, аденозин и тимидин.
Среда культивирования клеток является, как правило, «бессывороточной», когда среда по существу лишена сыворотки из любого источника млекопитающих (например, фетальная телячья сыворотка (FBS)). Под выражением «по существу лишена» понимают то, что среда культивирования клеток содержит приблизительно 0-5% сыворотки, предпочтительно приблизительно 0-1% сыворотки и наиболее предпочтительно приблизительно 0-0,1% сыворотки. Предпочтительно, может быть использована бессывороточная среда «определенного состава», где подлинность и концентрация каждого из компонентов в среде известна (т.е., не идентифицированный компонент, такой как экстракт гипофиза быка (BPE), не присутствует в культуральной среде).
В контексте настоящего изобретения выражения «клетка», «клеточная линия» и «клеточная культура» используются взаимозаменяемо, и все такие обозначения включают потомство. Таким образом, слова «трансформанты» и «трансформированные клетки (хозяева)» включают исходную рассматриваемую клетку и культуры, получаемые из нее, не обращая внимания на число транспозиций. Также считается, что все потомство может не быть полностью идентичным по составу ДНК вследствие искусственных или спонтанных мутаций. Мутантное потомство, которое имеет ту же функцию или биологическую активность, подвергнутую скринингу в исходно трансформированной клетке, учитывают. Где предполагаются отдельные обозначения, будет ясно из контекста.
Термин «клетка-хозяин животного», «клетка животного», «рекомбинантная клетка-хозяин животного» и т.п. охватывает клетки беспозвоночных, отличных от млекопитающих позвоночных (например, птица, рептилия и амфибия) и млекопитающих. Примеры клеток беспозвоночных включают следующие клетки насекомых: Spodoptera frugiperda (гусеница), Aedes aegypti (комар), Aedes albopictus (комар), Drosophila melanogaster (плодовая мушка) и Bombyx mori. См., например, Luckow et al., Bio/Technology, 6:47-55 (1988); Miller et al., in Genetic Engineering, Setlow, J. K. et al., eds., Vol. 8 (Plenum Publishing, 1986), pp. 277-279; и Maeda et al., Nature, 315:592-594 (1985).
Термины «клетка-хозяин млекопитающего», «клетка млекопитающего», «рекомбинантная клетка-хозяин млекопитающего» и т.п. относятся к клеточным линиям, полученным из млекопитающих, которые способны расти и выживать при помещении либо в монослойную культуру, либо в суспензионную культуру в среде, содержащей соответствующие питательные вещества и ростовые факторы. Необходимые питательные и ростовые факторы для конкретной клеточной линии легко определяются эмпирически без лишних экспериментов, как описано, например, в Mammalian Cell Culture (Mather, J. P. ed., Plenum Press, N. Y. (1984)), и исследователями Barnes и Sato (Cell, 22:649 (1980)). Как правило, клетки способны экспрессировать и секретировать большие количества определенного представляющего интерес белка (обычно рекомбинантного белка) в культуральную среду, и их культивируют с этой целью. Однако, клетки могут быть культивированы для целого ряда других целей, и объем данного изобретения не ограничивается культивированием клеток только для получения рекомбинантных белков. Примеры пригодных клеточных линий млекопитающих, способных расти в средах по данному изобретению, включают трансформированную SV40 линию CVI почек обезьяны (COS-7, ATCC® CRL 1651); линию 293S эмбриональной почки человека (Graham et al., J. Gen. Virolo., 36:59 (1977)); клетки почки новорожденного хомяка (BHK, ATCC® CCL 10); мышиные клетки Сертоли (TM4, Mather, Biol. Reprod., 23:243 (1980)); клетки почки обезьяны (CVI-76, ATCC® CCL 70); клетки почки африканской зеленой мартышки (VERO-76, ATCC® CRL-1587); клетки карциномы шейки матки человека (HELA, ATCC® CCL 2); клетки почки собаки (MDCK, ATCC® CCL 34); клетки печени крысы buffalo (BRL 3A, ATCC® CRL 1442); клетки легкого человека (W138, ATCC® CCL 75); клетки печени человека (Hep G2, HB 8065); клетки опухоли молочной железы мыши (MMT 060562, ATCC® CCL 51); клетки гепатомы крысы (HTC, MI.54, Baumann et al., J. Cell Biol., 85:1 (1980)); и клетки TR-1 (Mather et al., Annals N.Y. Acad. Sci., 383:44 (1982)) и клеточные линии гибридомы. Клетки яичника китайского хомячка (Urlab and Chasin, Proc. Natl. Acad. Sci. USA, 77:4216 (1980)) являются предпочтительной клеточной линией для осуществления данного изобретения. Клетки СНО, пригодные для использования в способах настоящего изобретения, также были описаны в следующих документах: ЕР 117159, опубликованного 29 августа 1989 года; патентах США №№ 4766075; 4853330; 5185259; Lubiniecki et al., в Advances in Animal Cell Biology and Technology for Bioprocesses, Spier et al., eds. (1989), pp. 442-451. Известные производные СНО, пригодные для использования, в настоящем документе включают, например, CHO/-DHFR (Urlaub and Chasin, Proc. Natl. Acad. Sci. USA, 77: 4216 (1980)), CHO-K1 DUX B11 (Simonsen and Levinson, Proc. Natl. Acad. Sci. USA 80: 2495-2499 (1983); Urlab and Chasin, см. выше), и клетки dp 12.CHO (EP 307247, опубликованный 15 марта 1989 года). Предпочтительные клетки-хозяева включают клетки CHO-K1 DUX B11 и dp 12.CHO.
«Клетка СНО dhfr-» относится к клетке СНО, лишенной дигидрофолатредуктазы (DHFR). Получение рекомбинантных белков в клетках млекопитающих создает возможность производства целого ряда больших, сложных гликозилированных полипептидов для применения в медицинской практике. Клетки DHFR- яичника китайского хомячка (СНО) и амплифицируемый селектируемый маркер DHFR стандартно используются для выявления клеточных линий, продуцирующих клинически пригодные количества продукта. (Urlab, G. and Chasin, L.A. (1980) Proc. Natl. Acad. Sci. USA, 77, 4216-4220; Kaufman, R. J. and Sharp, P. (1982) J. Mol. Biol., 159, 601-621; Gasser, C. S., Simonsen, C. S., Schilling, J. W. and Schmike, R. T. (1982) Proc. Natl. Acad. Sci. USA, 79, 6522-6526).
«Фаза» означает определенную фазу культивирования клеток, как это принято считать специалистом-практиком.
«Фаза роста» клеточной культуры относится к периоду экспоненциального клеточного роста (log-фаза), где клетки в основном быстро делятся. Во время этой фазы клетки культивируют в течение периода времени обычно в промежутке 1-4 дней и в таких условиях, чтобы клеточный рост был максимизирован. Цикл роста для клетки-хозяина может быть определен для определенной клетки-хозяина, предусмотренный без лишних экспериментов. Во время фазы роста клетки культивируют в питательной среде, содержащей необходимые добавки, в основном, приблизительно при 30-40°С, предпочтительно приблизительно 37°С, в увлажненной, контролируемой атмосфере, такой, что оптимальный рост достигается для конкретной клеточной линии. Клетки поддерживают в фазе роста в течение периода в промежутке приблизительно от одного до четырех дней, обычно в промежутке от двух до трех дней.
«Переходная фаза» клеточной культуры относится к периоду времени, в течение которого создаются культуральные условия для фазы продукции. В течение переходной фазы факторы внешней среды, такие как температура, сдвигаются от условий роста к условиям синтеза.
«Фаза продукции» клеточной культуры относится к периоду времени, в течение которого рост клетки выходит на плато. Во время фазы продукции заканчивается логарифмический рост клеток, и синтез белка является преимущественным. Во время этого периода времени среду, как правило, дополняют для поддержания продолжающегося синтеза белка и для получения желаемого белкового продукта.
Фраза «клеточная культура с подпиткой» в том смысле, в котором она здесь используется, относится к периодической культуре, где клетки животного (например, млекопитающих) и культуральная среда изначально поставляются в емкость для культивирования, и дополнительные культуральные питательные вещества подают, непрерывно или с пошаговым количественным увеличением, к культуре во время культивирования с или без периодического забора клеток и/или продукта до завершения культивирования. Клеточная культура с подпиткой включает «полунепрерывную культуру с подпиткой», где целую культуру (включая клетки и среду) периодически удаляют и заменяют на свежую среду. Клеточная культура с подпиткой отличается от простой «периодической культуры», в которой все компоненты для культивирования клеток (включая клетки животных и все культуральные питательные вещества) поставляют в емкость для культивирования в начале процесса культивирования. Клеточная культура с подпиткой может дополнительно отличаться от перфузионного культивирования в такой степени, что супернатант не удаляют из емкости для культивирования во время процесса (при перфузионном культивировании клетки удерживают в культуре посредством, например, фильтрации, инкапсулирования, фиксации на микроносителях и т.п., и культуральную среду непрерывно или периодически вводят или удаляют из емкости для культивирования). Однако, предусмотрено взятие образцов для исследовательских целей во время культивирования культуры с подпиткой.
Термин «глутамин» в том смысле, в котором он здесь используется, относится к аминокислоте L-глутамин (также известной как «Gln» и «Q» в трехбуквенном и однобуквенном обозначении, соответственно), которая считается как аминокислотным строительным блоком для белкового синтеза, так и источником энергии в клеточной культуре. Таким образом, «глутамин» и «L-глутамин» используются в настоящем документе взаимозаменяемо.
Слово «глюкоза» относится либо к α-D-глюкозе, либо к β-D-глюкозе, по отдельности или в комбинации. Отмечают, что α и β формы глюкозы являются взаимопревращаемыми в растворе.
Выражение «осмоляльность» является мерой осмотического давления растворенных частиц раствора в водном растворе. Частицы раствора включают как ионы, так и неионизированные молекулы. Осмоляльность выражают в виде концентрации осмотически активных частиц (т.е., осмоль), растворенных в 1 кг воды (1 мосмоль/кг Н2О при 38°С эквивалентно осмотическому давлению, равному 19 мм рт.ст.). «Осмолярность» относится к числу частиц раствора, растворенных в 1 литре раствора. Осмолиты, которые могут быть добавлены в культуральную среду с тем, чтобы увеличить ее осмоляльность, включают белки, пептиды, аминокислоты, неметаболизированные полимеры, витамины, ионы, соли, сахара, метаболиты, органические кислоты, липиды и т.п. В предпочтительном варианте осуществления изобретения концентрацию аминокислот и NaCl в культуральной среде увеличивают для достижения желаемых диапазонов осмоляльности, излагаемых в данном документе. Аббревиатура «мосмоль» в том смысле, в котором она здесь используется, означает «миллиосмоль/кг Н2О».
Термин «плотность клеток» в том смысле, в котором он здесь используется, относится к числу клеток, находящихся в данном объеме среды.
Термин «жизнеспособность клеток» в том смысле, в котором он здесь используется, относится к способности клеток в культуре выживать в данной совокупности культуральных условий или в условиях экспериментальных вариаций. Термин в том смысле, в котором он здесь используется, также относится к доле клеток, которые являются живыми в определенный момент времени относительно общего числа клеток, живых или мертвых, в культуре в это время.
Термины «аминокислоты» и «аминокислота» относятся ко всем встречающимся в природе альфа-аминокислотам в обеих их стереоизомерным D или L формам, и их аналогам и производным. Аналог определяют как замену атома в аминокислоте другим атомом, который, как правило, имеет подобные свойства. Производное определено как аминокислота, которая имеет другую молекулу или атом, прикрепленные к ней. Производные включают, например, ацетилирование аминогруппы, аминирование карбоксильной группы или окисление серосодержащих остатков двух молекул цистеина с образованием цистина.
Термин «белок» предназначен для обозначения последовательности аминокислот, для которой длина цепи достаточна для образования более высоких уровней третичной и/или четвертичной структуры. Указанное следует отличать от «пептидов» или других лекарственных средств с малым молекулярным весом, которые не обладают такой структурой. Как правило, белок в настоящем документе имеет молекулярный вес величиной по меньшей мере приблизительно 15-20 кДа, предпочтительно по меньшей мере приблизительно 20 кДа. Примеры белков, подходящих под данное определение, в настоящем документе включают все белки млекопитающих, в частности, белки для терапевтических и диагностических целей, такие как терапевтические и диагностические антитела, и, в основном, белки, которые содержат одну или несколько дисульфидных связей, включая многоцепочечные полипептиды, включающие одну или несколько меж- и/или внутрицепочечные дисульфидные связи.
Термин «терапевтический белок» или «терапевтический полипептид» относится к белку, который используется в лечении заболевания, независимо от его свойств или механизма действия. Чтобы терапевтические белки были пригодными для клинического использования, они должны быть синтезированы в больших количествах. Производство терапевтических белков, или других белков, «промышленного масштаба» использует клеточные культуры объемом в диапазоне приблизительно от 400 л до приблизительно 80000 л, в зависимости от продуцируемого белка и от потребностей. Как правило, такое производство промышленного масштаба использует объемы клеточных культур величиной приблизительно от 400 л до приблизительно 25000 л. В пределах данного диапазона используются объемы специфичных клеточных культур, такие как 4000 л, приблизительно 6000 л, приблизительно 8000 л, приблизительно 10000 л, приблизительно 12000 л, приблизительно 14000 л или приблизительно 16000 л.
«Представляющий интерес полипептид» в том смысле, в котором он здесь используется, относится в основном к пептидам и белкам, имеющим приблизительно более десяти аминокислот. Полипептиды могут быть гомологичными таковым клетки-хозяина или предпочтительно могут быть экзогенными, означая, что они являются гетерологичными, т.е. чужеродными, для используемой клетки-хозяина, как, например, белок человека продуцируемый отличным от человека млекопитающим, например, клеткой яичника китайского хомячка (СНО). Предпочтительно, используют полипептиды млекопитающих (полипептиды, которые были исходно получены из организма млекопитающего), более предпочтительно используют те, которые непосредственно секретируются в питательную среду. Термин «полипептид» или «представляющий интерес полипептид», например, включает антитела, в частности, антитела, связывающиеся с полипептидами млекопитающих, такими как любые из полипептидов млекопитающих, перечисленных ниже, или их фрагменты, а также иммуноадгезины (соединение полипептида-Ig), такие, как включающие любой из полипептидов млекопитающих, перечисленных ниже, или их фрагменты.
Примеры полипептидов млекопитающих включают, помимо прочего, трансмембранные молекулы (например, рецепторы) и лиганды, такие как ростовые факторы. Иллюстративные полипептиды включают молекулы, такие как ренин; гормон роста, включая гормон роста человека и гормон роста крупного рогатого скота; фактор высвобождения гормона роста; паратиреоидный гормон; тиреотропный гормон; интерферон, такой как интерферон-α, -β и -γ; липопротеины; α-1-антитрипсин; А-цепь инсулина; В-цепь инсулина; проинсулин; фолликулостимулирующий гормон; кальцитонин; лютеинизирующий гормон; глюкагон; факторы свертывания крови, такие как фактор VIIIC, фактор IX, тканевой фактор и фактор Виллебранда; противосвертывающие факторы, такие как протеин С; предсердный натрийуретический фактор; сурфактант легкого; активатор плазминогена, такой как урокиназа или мочевой или тканевой активатор плазминогена человека (t-PA), включая варианты t-PA; бомбезин; тромбин; гемопоэтический ростовой фактор; фактор некроза опухолей -альфа и -бета; энкефалиназу; RANTES (регулируемый при активации нормальных Т-клеток, его экспрессирующих и секретирующих); макрофагальный белок воспаления человека (MIP-1-α); сывороточный альбумин, такой как сывороточный альбумин человека; мюллеров ингибирующий фактор; А-цепь релаксина; В-цепь релаксина; прорелаксин; мышиный гонадотропин-ассоциированный пептид; микробный белок, такой как β-лактамаза; ДНКаза; IgE; ассоциированный с цитотоксическими Т-лимфоцитами антиген (CTLA), такой как CTLA-4; ингибин; активин; фактор роста сосудистого эндотелия (VEGF); рецепторы к гормонам или ростовым факторам; протеин А или D; ревматоидные факторы; нейротрофический фактор, такой как костный нейротрофический фактор (BDNF), нейротрофин-3, -4, -5 или -6 (NT-3, NT4, NT-5 или NT-6), или фактор роста нервов, такой как NGF-β; тромбоцитарный ростовой фактор (PDGF); фактор роста фибобластов, такой как aFGF и bFGF4; эпидермальный ростовой фактор (EGF); трансформирующий ростовой фактор (TGF), такой как TGF-α и TGF-β, включая TGF-β1, TGF-β2, TGF-β3, TGF-β4 или TGF-β5; инсулиноподобный ростовой фактор-I и -II (IGF-I и IGF-II); des(1-3)-IGF-I (мозговой IGF-I), связывающие инсулиноподобный ростовой фактор белки; белки CD, такие как CD3, CD4, CD8, CD19, CD20, CD34 и CD40; эритропоэтин; остеоиндуктивные факторы; иммунотоксины; костный морфогенетический белок (BMP); интерферон, такой как интерферон-α, -β и -γ; колониестимулирующие факторы (CSF), например, M-CSF, GM-CSF и G-CSF; интерлейкины (IL), например, IL-1 - IL-10; супероксиддисмутазу; Т-клеточные рецепторы; поверхностные мембранные белки; комплементзависимый стимулятор гемолиза; вирусный антиген, такой как, например, часть оболочки AIDS; транспортные белки; «хоминг»-рецепторы; аддрессины; регуляторные бел