Апоптоз-индуцирующее средство
Иллюстрации
Показать всеГруппа изобретений относится к области фармакологии и медицины и касается фармацевтической композиции для индукции апоптоза в клетке, имеющей мутированный KRAS, содержащей эффективное количество лекарственного средства, которое подавляет GST-π; и эффективное количество лекарственного средства, которое подавляет аутофагию. Заявлен также способ индукции апоптоза в клетке, имеющей мутированный KRAS, в частности в раковой клетке с мутацией KRAS. Группа изобретений обеспечивает повышение эффективности апоптоза в клетке. 2 н. и 6 з.п. ф-лы, 18 ил., 6 пр.
Реферат
Область техники
Настоящее изобретение относится к новому применению GST-π и средству его подавления новым, апоптоз-индуцирующим средством, фармацевтической композицией, содержащей апоптоз-индуцирующий средство, и новый терапевтический способ для заболевания, связанного с аномальным апоптозом.
Уровень техники
Рак является одним из самых важных и проблемных заболеваний, с которыми сталкивается человечество, и ведется огромное количество научно-исследовательских работ в области его лечения. Рак является заболеванием, при котором клетки растут бесконтрольно из-за генной мутации, эпигенетической аномалии и т. д. Что касается генетических аномалий при раке, большое количество уже сообщалось (например, Futreal et al., Nat Rev Cancer. 2004; 4 (3): 177-83, etc.), и считается, что многие из них так или иначе связаны с сигнальной трансдукцией, связанной с клеточной пролиферацией, дифференцировкой и выживанием. Кроме того, вследствие таких генетических аномалий, аномалии возникают в сигнальной трансдукции в клетках, состоящих из нормальных молекул, и это приводит к активации или инактивации конкретного сигнального каскада и может в конце концов стать одним из факторов, вызывающих аномальную клеточную пролиферацию. Раннее лечение рака было сосредоточено на подавлении собственно клеточной пролиферации, но так как такое лечение также подавляет пролиферацию клеток с физиологически нормальной пролиферацией, оно сопровождается побочными эффектами, такими как выпадение волос, желудочно-кишечная дисфункция, или подавлением деятельности костного мозга. Для того чтобы уменьшить такие побочные эффекты, предпринимается разработка лекарственных средств для лечения рака на основе новой концепции, такой как молекулярно нацеливаемые лекарственные средства, которые нацеливаются на опухоль-специфические аномалии или аномалии в передаче сигнала.
В качестве рак-специфической генетической аномалии хорошо известна аномалия KRAS (V-Ki-ras2 Kirsten rat sarcoma viral oncogene homolog). KRAS представляет собой низкомолекулярный GTP-связывающий белок (называемый также низкомолекулярный G-белок), расположенный ниже по течению от рецептора тирозинкиназы, такого как EGFR или PDGFR, и отвечает за передачу сигнала, связанную с пролиферацией или дифференцировкой от этих рецепторов к расположенному далее МАРK-каскаду. Нормальный KRAS активируется через Grb2 и SOS посредством активации рецептора тирозинкиназы, активированного связыванием лиганда, и фосфорилирует МАРK, такой как Raf, таким образом, чтобы запустить каскад МАРK, но мутированный KRAS постоянно активируется без стимуляции от рецептора и продолжает передавать сигнал к пролиферации. Считается, что из-за этого происходит аномальная клеточная пролиферация.
С одной стороны, экспрессия глутатион-8-трансферазы (GST), которая является одним из ферментов, которые катализируют конъюгацию глутатиона, в особенности GST-π (глутатион S-трансферазу пи, также называемую GSTP1), возрастает в различных раковых клетках, и было отмечено, что существует вероятность, что это является одним из факторов устойчивости к некоторым противоопухолевым агентам. На самом деле, известно, что когда антисмысловая ДНК GST-π или ингибитор GST-π изготовлены, чтобы действовать на раковую клеточную линию, которая сверхэкспрессирует GST-π, и проявляет лекарственную устойчивость, устойчивость к лекарственному средству подавляется (Takahashi and Niitsu, Gan To Kagaku Ryoho. 1994; 21 (7): 945-51, Ban et al., Cancer Res. 1996; 56 (15): 3577-82, Nakajima et al., J Pharmacol Exp Ther. 2003; 306 (3): 861-9). Кроме того, в недавнем сообщении, когда миРНК GST-π изготовленные, чтобы действовать на клеточную линию андроген-независимого рака простаты, которая сверхэкспрессирует GST-π, их пролиферация подавляется и усиливается апоптоз (Hokaiwado et al., Carcinogenesis. 2008; 29 (6): 1134-8). Кроме того, было высказано предположение, что при раке толстого кишечника человека, мутация KRAS, по-видимому, индуцирует сверхэкспрессию GST-π через активацию АР-1 (Miyanishi et al., Gastroenterology. 2001; 121 (4): 865-74).
Тем не менее, до сих пор почти не выяснены отношения между GST-π и клеточной пролиферацией или апоптозом, молекулярный механизм GST-π, а также роль и т. д. GST-π в различных типах внутриклеточной передачи сигнала. Внутриклеточная передача сигнала является очень сложной, одна молекула может влиять на эффект множества молекул, или, наоборот, одна молекула может зависеть от множества молекул, когда эффект определенной молекулы ингибируется, другой сигнальный каскад может активироваться, и часто не может быть получен ожидаемый эффект. Таким образом, необходимо выяснить сложный механизм сигнальной трансдукции клетки для разработки лучших молекулярно нацеливаемых лекарственных средств, но только очень небольшая часть механизма была выяснена в многолетних исследованиях, и для этого требуются дальнейшие исследовательские усилия.
Сущность изобретения
Проблемы, решаемые с помощью изобретения
Задачей настоящего изобретения является обеспечение нового применения GST-π и средства его подавления, композиции для эффективного индукции апоптоза в клетках, и способ их применения.
Средства для решения проблем
При проведении интенсивных исследований с целью выяснения молекулярного механизма GST-π авторы настоящего изобретения обнаружили, что когда экспрессия GST-π ингибируется, активация Raf-1, MEK и ERK значительно ингибируется, и похожим образом в сигнальном каскаде PI3K (фосфоинозитид-3-киназы), который активируется посредством активации рецептора, связанного с G-белком, или рецептором тирозин-киназы, имеет место подавление передачи сигнала, и было выяснено, что хотя апоптоз вызывается ингибированием экспрессии GST-π, аутофагия индуцируется быстрее, чем апоптоз. В результате дальнейших исследований также было обнаружено, что путем подавления аутофагии в то же время, когда происходит ингибирование GST-π, клетки могут быть индуцированы к апоптозу с высокой эффективностью, и таким образом было осуществлено настоящее изобретение.
То есть, настоящее изобретение имеет отношение к следующему.
(1) Средство для индукции апоптоза, средство, содержащее в качестве активных ингредиентов лекарственное средство, которое подавляет GST-π, и лекарственное средство, которое подавляет аутофагию.
(2) Средство для индукции апоптоза в клетке, в которой подавляется GST-π, средство, содержащее в качестве активного ингредиента лекарственное средство, которое подавляет аутофагию.
(3) Средство по (1) или (2), приведенные выше, средство предназначенное для индукции апоптоза в клетке, обладающей мутированным KRAS.
(4) Средство по любому из пунктов с (1) по (3), приведенные выше, в котором активный ингредиент выбирается из группы, состоящей из молекулы RNAi, рибозима, антисмысловой нуклеиновой кислоты, ДНК/РНК химерного полинуклеотида и вектора, экспрессирующего вышеперечисленное.
(5) Фармацевтическая композиция, содержащая средство по любому из пунктов с (1) по (4), приведенных выше.
(6) Фармацевтическая композиция по п. (5), приведенного выше, композиция, предназначенная для использования для лечения заболеваний, вызванных аномальной клеточной пролиферацией.
(7) Фармацевтическая композиция по п. (5), приведенного выше, композиция предназначенная для использования для лечения заболевания, вызванного мутацией KRAS.
(8) Фармацевтическая композиция по п. (5), приведенного выше, композиция предназначенная для применения в лечении рака.
(9) Средство для стимуляции сигнального каскада PI3K/Akt/mTOR и/или сигнального каскада RAS/Raf/MAPK, средство, содержащее в качестве активного ингредиента GST-π и/или его функциональный вариант.
(10) Средство для подавления сигнального каскада PI3 K/Akt/mTOR и/или сигнального каскада RAS/Raf/MAPK, средство, содержащее в качестве активного ингредиента лекарственное средство, которое подавляет GST-π.
(11) Средство для подавления убиквитинирования, средство, содержащее в качестве активного ингредиента GST-π и/или его функциональный вариант.
(12) Средство для стимуляции убиквитинирования, средство, содержащее в качестве активного ингредиента лекарственное средство, которое подавляет GST-π.
(13) Средство для подавления аутофагии, средство, содержащее в качестве активного ингредиента GST-π и/или его функциональный вариант.
(14) Средство для стимуляции аутофагии, средство, содержащее в качестве активного ингредиента лекарственное средство, которое подавляет GST-π.
Эффекты изобретения
Поскольку апоптоз-индуцирующее средство по настоящему изобретению может эффективно индуцировать апоптоз по сравнению с обычным средством, его эффективность в качестве фармацевтической композиции также высока. При лечении рака, в частности, так как раковые клетки могут быть убиты посредством апоптоза, возможно не только ингибирование прогрессии рака, но можно ожидать эффект, который приводит к регрессу рака. Кроме того, поскольку тот же самый уровень эффекта, что и от обычной рецептуры могут демонстрироваться при более низкой дозе, чем у обычной рецептуры, становится возможным уменьшить побочные эффекты.
Кроме того, в соответствии с настоящим изобретением стал ясен молекулярный механизм GST-π, и было обнаружено новое применение GST-π или средство для его подавления. Это обеспечивает новые возможности для лечения болезни, экспериментальных методик и т.д., и можно ожидать огромный вклад не только в медицине и ветеринарии, но и в области биологии, биохимии, молекулярной биологии и т. д.
Краткое описание чертежей
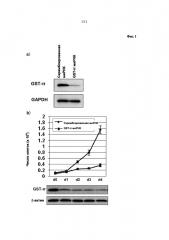
Фиг. 1а) представляет собой результат вестерн-блоттинга, показывающего состояние, в котором экспрессия GST-π специфически подавляется посредством миРНК GST-π. Фиг. 1b) является схемой, показывающей изменение числа клеток и уровень экспрессии GST-π на 1-ый - на 4-й день после трансфекции миРНК GST-π.
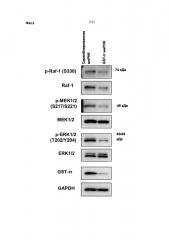
Фиг. 2 представляет собой результат вестерн-блоттинга, показывающего состояние экспрессии белка, участвующего в сигнальном каскаде RAS/Raf/MAPK на второй день после трансфекции миРНК GST-π. Можно видеть, что сопровождающий подавление экспрессии GST-π, уровень экспрессии белка Raf уменьшается, и кроме того, подавляется фосфорилирование МАРК, таких как МЕК или ERK.
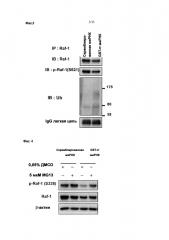
Фиг. 3 показывает результат эксперимента по иммунопреципитации белка Raf. Можно видеть, что в группе, обработанной миРНК GST-π, экспрессия белка Raf и белка Raf, фосфорилированного по Ser621 (π-Raf-l (S621)) слегка уменьшается, в то время как в отличие от этого убиквитинированный белок Raf увеличивается.
Фиг. 4 представляет собой схему сравнения представленности белка Raf, когда трансфектант миРНК GST-π и скремблированный трансфектант миРНК обрабатывали протеасомным ингибитором MG132 и ДМСО, что представлял собой негативный контроль. Было отмечено, что для трансфектанта миРНК GST-π обработка протеасомным ингибитором увеличило представленность фосфорилированного белка Raf (p-Raf-1 (S338)), но никаких изменений не наблюдалось для скремблированной миРНК. То есть, это говорит о том, что за счет подавления экспрессии GST-π фосфорилированный белок Raf подвергается деградации посредством протеасомы, и это соответствует увеличению убиквитинированного белка Raf на Фиг. 3.
Фиг. 5 показывает результаты эксперимента по коиммунопреципитации белка Raf и GST-π. Вследствие реакции с антителом анти-GST-π, показываемой для белка, преципитируемого посредством антитела анти-π-Raf-1, предполагается, что p-Raf-1 и GST-π образуют комплекс.
Фиг. 6 показывает изображение иммунофлюоресцентного окрашивания клеток с нокдауном по GST-π. Верхние ряды представляют собой изображения, окрашенные антителами анти-LC3, и нижние ряды представляют собой изображения, окрашенные DAPI. Слева наверху находятся окрашенные изображения 1-го дня, 2-ого дня и 3-его дня после трансфекции, а слева в нижней части 4-ого дня и 5-ого дня после трансфекции, соответственно. В клетках, отмеченных стрелками на чертеже, точечный сигнал, который можно считать наблюдением аутофагосом, что приводит к выводу, что индуцируется аутофагия.
Фиг. 7 показывает электронно-микроскопические изображения клеток с нокдауном по GST-π в момент времени, когда прошли 2 дня после трансфекции миРНК GST-π. В левой фигуре N обозначает ядро, а правая фигура представляет собой увеличенное изображение фрагмента А, выделенного квадратом. На правой фигуре M обозначает митохондрии, иа L обозначает лизосомы. Было отмечено, что аутофагосомы образовывались таким образом, чтобы окружать митохондрии в местах, показанных стрелками.
Фиг. 8 показывает результаты вестерн-блоттинга экстракта клеток с нокдауном (KD) по GST-π с помощью анти-LC3 антитела. Было отмечено, что в клетках KD по GST-π (миРНК GST-π), экспрессия LC3 заметно возросла по сравнению с контролем (скремблированная миРНК). Поскольку тип LC3-II (LC3-II), в частности, значительно увеличился, это свидетельствует об индукции аутофагосомы.
Фиг. 9 показывает результаты TUNEL-окрашивания. Верхний ряд показывает изображения контрольной группы, а нижний ряд показывает изображения группы KD клеток GST-π. Они показывают слева направо окрашенные изображения на 3-й день, на 4-й день и на 5-й день после трансфекции. В группе KD клеток GST-π наблюдались TUNEL-положительные клетки.
Фиг. 10 представляет собой график (сверху), показывающий изменение с течением времени пропорций аутофагия-положительных клеток и апоптоз-положительных клеток в группе клеток KD GST-π и в контрольной группе клеток в момент времени, когда прошло от 1 до 4 дней после миРНК-трансфекции, и схему (внизу), показывающую уровень экспрессии GST-π в KD клетках GST-π. Это показывает, что в контрольной группе едва ли наблюдались аутофагия или апоптоз, тогда как в группе KD GST-π аутофагия-положительные клетки сначала быстро возрастали с пиком на 2-й день, а затем индуцировался апоптоз.
Фиг. 11 показывает результаты вестерн-блоттинга белков, участвующих в передаче сигналов EGFR/PI3K/Akt/mTOR в KD клетках GST-π. Можно видеть, что в группе KD клеток GST-π фосфорилирование EGFR, PI3K и Akt было в значительной степени подавлено.
Фиг. 12 показывает результаты вестерн-блоттинга, показывающие изменение экспрессии фосфорилированного EGFR (p-EGFR), когда KD клетки GST-π обрабатывали протеасомным ингибитором MG132. Так как снижение уровня экспрессии p-EGFR в KD клетках GST-π было восстановлено посредством обработки протеасомным ингибитором, был сделан вывод о том, что снижение экспрессии p-EGFR произошло вследствие деградации посредством протеасомы.
Фиг. 13 показывает результат вестерн-блоттинга белка, коиммунопреципитированного с использованием анти-p-EGFR. Поскольку сигнал наблюдался для антитела анти-GST-π, был сделан вывод, что p-EGFR и GST-π взаимодействовали друг с другом.
Фиг. 14 показывает результаты при исследовании изменения уровня экспрессии белка Raf и EGFR в зависимости от концентрации ингибитора при использовании ингибитора GST-π С16С2. Было отмечено, что как и в случае с нокдауном GST-π, фосфорилирование EGFR или белка Raf также было подавлено при использовании ингибитора GST-π.
Фиг. 15 представляет собой график, показьшающий изменение числа клеток при добавлении ингибитора GST-π С16С2. Можно видеть, что при добавлении ингибитора GST-π почти не было увеличения числа клеток.
Фиг. 16 представляет собой график, показывающий долю аутофагия-положительных клеток в группе обработанной скремблированной миРНК, группы GST-π KD и группы GST-π KD + 3МА. Можно видеть, что аутофагия, которая была увеличена посредством нокдауна GST-π, подавлялась посредством 3-МА.
Фиг. 17 показывает TUNEL-окрашенные изображения, когда добавляли 3-МА к KD клеткам GST-π. Верхний ряд представляет собой случай, когда 3-МА добавляли в концентрации 1 мМ, а нижний ряд представляет собой случай, когда 3-МА добавляли в концентрации 5 мМ. Он показывает слева направо окрашенные изображений на 2-й день, на 3-й день и на 4-й день после трансфекции. Чем большее количество 3-МА добавляли, тем больше наблюдали апоптотических клеток.
Фиг. 18 представляет собой график, показывающий результаты, когда исследовали процент апоптоза с течением времени в контрольной группе клеток (скремблированная миРНК), в группе KD клеток GST-π (миРНК GST-π), в группе KD клеток GST-π + 1 мМ 3-МА (миРНК GST-π + 1 мМ 3-МА), и в группе KD клеток GST-π + 5 мМ 3-МА (миРНК GST-π + 5 мМ 3-МА). Было обнаружено, что происходило дальнейшее зависимое от дозы 3-МА индуцирование апоптоза.
Варианты выполнения изобретения
Настоящее изобретение относится к средству или композиции для индуцирования апоптоза (далее также называется «апоптоз-индуцирующее средство» или «апоптоз-индуцирующая композиция»), которые содержат в качестве активных ингредиентов лекарственное средство, которое подавляют GST-π и лекарственное средство, которое подавляет аутофагию.
При использовании в настоящем изобретении GST-π обозначает фермент, кодируемый геном GSTP1, который катализирует конъюгацию глутатиона. GST-π присутствует в различных животных, включая человека, и информация о его последовательности известна (например, человеческая: NP_000843 (NM 000852), крысиная: NP 036709 (NM_012577), мышиная: NP_038569 (NM_013541) и др. Числа обозначают номера доступа базы данных NCBI; числа вне скобок представляет собой номера аминокислотной последовательности, а числа внутри скобок представляют собой номера последовательности оснований).
Поскольку существует возможность возникновения мутации в генной последовательности или аминокислотной последовательности между биологическими индивидуумами, которые не ухудшает физиологическую функцию белка, GST-π и ген GSTP1 в настоящем изобретении, не ограничиваются белком или нуклеиновой кислотой, имеющей ту же последовательность, что и выше названные последовательности, а могут включать последовательности, которые имеют последовательность, которая отличается от приведенной выше последовательности одной или более аминокислотами или основаниями, как правило, одной или несколькими, например одной, двумя, тремя, четырьмя, пятью, шестью, семью, восемью, девятью или десятью аминокислотами или основаниями, но обладают функциями, аналогичными тем, что и известные GST-π. Конкретные функции GST-π описываются ниже.
В настоящем описании выражения, такие как «при использовании в настоящем изобретении», «использован в настоящем изобретении», «в настоящем описании» и «описано в настоящем изобретении» означает, если не указано иное, что описание, следующее за ними, относится ко всем изобретениям, описанным в настоящем описании. Кроме того, если иное не определено, все технические термины и научные термины, используемые в настоящем изобретении, имеют то же значение, которое обычно понимается специалистом в данной области техники. Все патенты, патентные публикации и других публикации, указанные в настоящем изобретении, включены в настоящем изобретении в качестве ссылки во всех полноте.
Примеры «лекарственного средства, которое подавляет GST-π», используемого в настоящем изобретении, включают, но не ограничиваются этим, лекарственное средство, которое подавляет продукцию и/или активность GST-π, и лекарственное средство, которое способствует деградации GST-π и/или инактивации. Примеры лекарственного средства, которое подавляет продукцию GST-π, включают, но не ограничиваются этим, молекулы RNAi, рибозим, антисмысловую нуклеиновую кислоту, или ДНК/РНК химерный полинуклеотид для ДНК, кодирующей GST-π, или же вектор, экспрессирующий вышеуказанное.
Примеры лекарственного средства, которое подавляет активность GST-π, включают, но не ограничиваясь этим, вещество, которое связывается с GST-π, такое как, например, глутатион, аналог глутатиона (например, такие, которые описаны в WO 95/08563, WO 96/40205, WO 99/54346, Nakajima et al., 2003, см. выше и т.д.), кетопрофен (Takahashi and Niitsu, 1994, см. выше), индометацин (Hall et al., Cancer Res. 1989; 49 (22): 6265-8), этакриновая кислота, Piloprost (Tew et al., Cancer Res. 1988; 48 (13): 3622-5), антитело анти-GST-π, и доминантный негативный мутант GST-π. Эти лекарственные средства являются либо коммерчески доступными, либо могут быть получены соответствующим образом на основе известных методик.
Лекарственное средство, которое подавляет продукцию или активность GST-π, предпочтительно представляет собой молекулу RNAi, рибозим, антисмысловую нуклеиновую кислоту или ДНК/РНК химерный полинуклеотид для ДНК, кодирующей GST-π, или вектор, экспрессирующий вышеперечисленное, с точки зрения высокой специфичности и низкой вероятности побочных эффектов.
Подавление GST-π может быть определено посредством экспрессии или активности GST-π в клетках, в которых они подавляются по сравнению со случаем, в котором средство, подавляющее GST-π, не используется. Экспрессия GST-π может быть оценена любой известной методикой; примеры включают, но не ограничиваются этим, метод иммунопреципитации с использованием антитела анти-GST-π, EIA, ELISA, IRA, IRMA, метод вестерн-блотинга, иммуногистохимический метод, иммуноцитохимический метод, метод проточной цитометрии, различные методы гибридизации, использующие нуклеиновые кислоты, которые специфически гибридизуются с нуклеиновой кислотой, кодирующей GST-π, или его уникальный фрагмент, или продуктом транскрипции (например, мРНК) или продуктом сплайсинга указанной нуклеиновой кислотой, метод Нозерн-блотинга, метод Саузерн-блотинга, а также различные методы ПЦР.
Кроме того, активность GST-π может быть оценена посредством анализа известной активности GST-π, включая, но не ограничиваясь этим, связывание с белком, таким как, например, Raf-1 (в частности фосфорилированным Raf-1) или EGFR (в частности фосфорилированным EGFR) с помощью любого известного способа, такого как, например, метод иммунопреципитации, метод вестерн-блотинга, метод анализа масс, метод пул-даун, или метод поверхностного плазмонного резонанса (SPR).
При использовании в настоящем изобретении, молекула RNAi обозначает любую молекулу, которая вызывает интерференцию РНК, включая, но не ограничиваясь этим, дуплексную РНК, такую как миРНК (малую интерферирующую РНК), микроРНК (micro RNA), кшРНК (короткошпилечную РНК), ddRNA (ДНК-направляемая РНК), пиРНК (РНК, взаимодействующие по piwi-типу), или rasiRNA (ассоциированная с повторами миРНК) и их модифицированные формы. Эти молекулы RNAi могут быть коммерчески доступными или могут быть сконструированы и получены на основе известной информации о последовательности, и т. д.
Кроме того, при использовании в настоящем изобретении, антисмысловая нуклеиновая кислота включает РНК, ДНК, ПНК, или их комплекс.
При использовании в настоящем изобретении, ДНК/РНК химерный полинуклеотид включает, но не ограничиваясь этим, двухцепочечный полинуклеотид, состоящий из ДНК и РНК, который ингибирует экспрессию гена-мишени, описанный, например, в JP, А, 2003-219893.
При использовании в настоящем изобретении аутофагия может включать в себя макроаутофагию, микроаутофаги, шаперон-опосредованную аутофагию и т. д., но обычно означает макроаутофагию. Таким образом, термин «аутофагия» в настоящем изобретении относится к «макроаутофагии», если не указано иное.
Аутофагия, означающая «самопожирание», является одним из внутриклеточных механизмов деградации белков и отвечает за деградацию и утилизации белков в клетке. Аутофагию можно наблюдать в различных биологических видах, включая дрожжи и млекопитающих и, как правило, сопровождается рядом процессов в том числе: (а) образованием PAS (сайта сборки фагофора), (b) удлинением и расширением фагофора, окружающего белок, предназначенного для деградации (мембранная изоляция) и формированием аутофагосом-инкапсулированного белка, предназначенного для деградации, (с) формированием аутолизосомы путем слияния с аутофагосомы и лизосомы, и (d) деградацией белка внутри аутолизосомы.
Указанные процессы от (а) до (с) включают факторы, специфически связанные с аутофагией. Что касается факторов, связанных с аутофагией, первое исследование было проведено с дрожжами, и большое количество, включая от ATG1 до ATG27, идентифицированы к настоящему моменту (Klionsky et al., Dev Cell. 2003; 5 (4): 539-45); исследования с млекопитающими также продвинулись, были идентифицированы множество гомологов, и основной молекулярный механизм аутофагии становится понятным (Yang and Klionsky, Curr Opin Cell Biol. 2010; 22 (2): 124-31).
Примеры факторов, связанных с аутофагией, участвующих в центральном молекулярном механизме аутофагии у млекопитающих, включают факторы, участвующие в формировании PAS, таких как VMP1, ΤΡ53IΝΡ2, mAtg9, комплекса ULK (состоящий из ULK1, ULK2, mAtgl3 и FIP200), PI3K комплекс (комплекс Atg14L, состоящий из Beclinl, hVPS34, р150, Ambrai и Atg14L, и UVRAG комплекс, состоящий из Beclinl, hVPS34, p 150, Bif-1 и UVRAG) и факторов, участвующих в удлинении фагофора таких как LC3-II и Atg12-Atg5-Atgl6L комплекс.
Таким образом, примеры лекарственного средства, которое подавляет аутофагию, включают, но не ограничиваясь этим, лекарственное средство, которое подавляет образование и/или активность фактора, связанного с аутофагией, такие как описанные выше, и лекарственное средство для содействия деградации и/или инактивации фактора, связанного с аутофагией. Примеры лекарственного средства, которое подавляет выработку фактора, связанного с аутофагией, включают молекулу RNAi, рибозим, антисмысловую нуклеиновую кислоту, или ДНК/РНК химерный полинуклеотид для ДНК, кодирующей фактор, связанный с аутофагией, или вектор, экспрессирующий вышеперечисленное.
Примеры лекарственного средства, которое подавляет активность фактора, связанного с аутофагией, включают, но не ограничиваются этим, ингибитор PI3K (например, вортманнин и т. д.), в частности ингибитор PI3K класса III (например, 3-МА (3-метиладенин) и т. д.), вещество, которое ингибирует слияние с аутофагосомой и лизосомой (например, бафиломицин A1 и т. д.), вещество, которое ингибирует деградацию белков в аутолизосомах (например, хлорохин, лейпептин и т. д.), вещество, которое связывается с фактором, связанным с аутофагией, (например, антитело для фактора, связанного с аутофагией, и т. д.), и доминантно-негативного мутанта фактора, связанного с аутофагией. Эти лекарственные средства являются коммерчески доступными или могут быть получены соответствующим образом на основе известных методик. В одном варианте выполнения настоящего изобретения лекарственное средство, которое подавляет аутофагию, не содержит GST-π и/или его функциональный вариант.
С точки зрения высокой специфичности и редких побочных эффектов лекарственного средства, которое подавляет аутофагию, предпочтительны молекула RNAi, рибозим, антисмысловая нуклеиновая кислота или ДНК/РНК химерный полинуклеотид для ДНК, кодирующей фактор, связанный с аутофагией, или вектор, экспрессирующий вышеперечисленное.
Подавление аутофагии может быть определено посредством наблюдения, что аутофагия подавляется в клетках по сравнению со случаем, в котором не используется агент, подавляющий аутофагию по настоящему изобретению. Ингибирование аутофагии может быть оценено на основе любой известной методики, примеры которых включают, но не ограничиваются этим, обнаружение аутофагосом методом электронной микроскопии и обнаружении маркера аутофагии (например, Atg5, Atg12, LC3, в частности LC3-II и др.). LC3-II может быть обнаружен, например, но не ограничивается этим, посредством использования специфических антител против LC3-II, или может быть обнаружен посредством разделения образца электрофорезом и т. д., и затем детектированием LC3-II, разделенного в виде полосы, которая отличается от LC3-I, с помощью метода вестерн-блотинга и т. д. с использованием антитела, которое реагирует с LC3-II или как с LC3-I, так и с LC3-II. Кроме того, поскольку LC3-I распределен в цитоплазме, в то время LC3-II локализован в аутофагия-специфичной структуре, такой как изолированная мембрана, аутофагосома или аутолизосомы, наличие ряда сигналов в виде пятна, показывающих эти структуры, которые проявляются иммунноокрашиванием и т. д., с антителом, которое вступает в реакцию с LC3-II (включая антитело, которое реагирует как с LC3-I, так и LC3-II), могут быть использованы в качестве индикатора аутофагии.
Лекарственное средство, которое подавляет GST-π, и лекарственное средство, которое подавляет аутофагию, может содержаться в единой композиции или может содержаться отдельно в двух или более составах. В последнем случае каждое лекарственное средство можно вводить одновременно или они могут быть введены с временным интервалом между ними. При введении с временным интервалом между ними, состав, содержащий лекарственное средство, которое подавляет GST-π, можно вводить до композиции, содержащей лекарственное средство, которое подавляет аутофагию или можно вводить после нее.
Настоящее изобретение также относится к средству или композиции для индуцирования апоптоза (далее также называемой «апоптоз-индуцирующее средство» или «апоптоз-индуцирующая композиция») в клетках, в которых подавляется GST-π, средство или композиция, содержащая в качестве активного ингредиента лекарственное средство, которое подавляет аутофагию.
При использовании в настоящем изобретении «подавляется GST-π» включает, например, состояние, при котором подавляется GST-π в клетках, экспрессирующих GST-π. Примеры такого состояния включают в себя состояние, в котором лекарственное средство, которое подавляет GST-π (например, такие, которые описаны выше и т. д.), вводится в клетки, экспрессирующие GST-π.
Экспрессируется ли GST-π в определенных клетках или нет, он известен из литературы или может быть определен посредством обнаружения экспрессии GST-π в клетках. Экспрессия GST-π может быть обнаружена любой известной методикой, включая методики, которые описаны выше.
Средство или композиция по настоящему изобретению может быть средством или композицией для индукции апоптоза в клетках, имеющих мутантный KRAS.
При использовании в настоящем изобретении примеры мутантного KRAS включают, но не ограничиваются этим, такие, которые имеют мутацию, которая вызывает постоянную активацию KRAS, такие как мутация, которая ингибирует эндогенную GTPase, или мутация, которая увеличивает скорость обмена гуанинового нуклеотида. Конкретные примеры такой мутации включают, но не ограничиваются этим, например мутации в аминокислотах 12, 13 и/или 61 в человеческом KRAS (ингибирование эндогенную GTPase) и мутации в аминокислотах 116 и/или 119 в человеческого KRAS (увеличение скорости обмена гуанинового нуклеотида) (Bos, Cancer Res. 1989; 49 (17): 4682-9, Levi et al., Cancer Res. 1991; 51 (13): 3497-502). Таким образом, в одном варианте выполнения настоящего изобретения, мутантный KRAS может быть KRAS, имеющим мутацию по меньшей мере одной из аминокислот 12, 13, 61, 116 и 119 человеческого KRAS. В одном варианте выполнения настоящего изобретения мутантный KRAS имеет мутацию в аминокислоте 12 человеческого KRAS. Кроме того, в одном варианте выполнения настоящего изобретения мутантный KRAS может быть таким, который вызывает сверхэкспрессию GST-π. Таким образом, клетки, имеющие мутированный KRAS, могут проявлять сверхэкспрессию GST-π.
Обнаружение мутантного KRAS может быть осуществлено с использованием любой известной методики. Примеры такой методики включают, но не ограничиваются этим, селективная гибридизация с помощью зонда нуклеиновой кислоты, специфичного к известной мутированной последовательности, способ неспецифического ферментативного расщепления, секвенирование (Bos, 1989, см. выше), и способ ПЦР-ПДРФ (Miyanishi et al., 2001, см. выше).
Кроме того, обнаружение экспрессии GST-π может быть осуществлено с использованием любой известной методики, в том числе методик, которые описаны выше. Сверхэкспрессируется GST-π или нет может быть оценено, например, посредством сравнения степени экспрессии GST-π в клетках, имеющих мутированный KRAS, со степенью экспрессии GST-π в том же типе клеток, имеющих нормальный KRAS. В этом случае можно сказать, что GST-π сверхэкспрессируется, если степень экспрессии GST-π в клетках, имеющих мутантный KRAS, превышает степень экспрессии GST-π в том же типе клеток, имеющих нормальный KRAS.
Количество активного ингредиента, включенного в средство или композицию по настоящему изобретению, может быть таким количеством, которое индуцирует апоптоз, когда вводится средство или композиция. Кроме того, предпочтительно количество, которое не вызывает побочного эффекта, который превышает пользу введения. Такое количество известно или может быть определено надлежащим образом с помощью исследований in vitro с использованием культивируемых клеток и т. д., или посредством исследования на животной модели, такой как мышь, крыса, собака или свиньи, и такие методы исследования хорошо известны специалисту в данной области техники. Индукция апоптоза может быть оценена различными известными методиками, например, посредством обнаружении апоптоз-специфического явления такого как фрагментации ДНК, связывание аннексина V на клеточной мембране, изменение мембранного потенциала митохондрий, или активация каспазы или TUNEL-окрашивание. Количество входящего в состав активного ингредиента может варьироваться в зависимости от способа, которым вводится средство или композиция. Например, когда множество единиц композиции используется для одного введения, количество активного ингредиента, которое должно быть включено в одну единицу композиции, может быть определено посредством деления количества активного ингредиента, необходимого для одного введения посредством указанного множества единиц. Корректировка такого количества композиции может быть осуществлено соответствующим образом специалистом в данной области техники.
Настоящее изобретение также относится к способу для изготовления средства или композиции для индукции апоптоза, включающего введение в качестве активного ингредиента лекарственного средства, которое подавляет GST-π, и лекарственного средства, которое подавляет аутофагию; применение лекарственного средства, которое подавляет GST-π, и лекарственного средства, которое подавляет аутофагию в продуцировании средства или композиции для индукции апоптоза; комбинация лекарственного средства, которое подавляет GST-π, и лекарственного средства, которое подавляет аутофагию, для использования для индукции апоптоза, и способ индукции апоптоза, включающий введение эффективных количеств лекарственного средства, которое подавляет GST-π и лекарственного средства, которое подавляет аутофагию.
Настоящее изобретение также относится к способу для изготовления средства или композиции для индукции апоптоза в клетках, в которых GST-π подавляется, при этом способ содержит включение в состав в качестве активного ингредиента лекарственного средства, которое подавляет аутофагию; использование лекарственного средства, которое подавляет аутофагию в производстве средства или композиции для индукции апоптоза в клетках, в которых GST-π подавляется; лекарственного средства, которое подавляет аутофагию для использования для индукции апоптоза в клетках, в которых GST-π подавляется, и способ индукции апоптоза в клетках, в которой подавляется GST-π, причем способ включает введение эффективного количества препарата, который подавляет аутофагию.
Лекарственное средство или его количество в композиции в вышеупомянутом способе производства или применение описаны выше. Приготовление лекарственной формы каждого лекарственного средства может быть осуществлено в соответствии с любой известной методикой.
Все вышеперечисленные методы индукции апоптоза могут быть либо методом in vitro или методом in vivo. Кроме того, лекарственные средства в этих способах используются такие, как описано выше, и эффективное количество лекарственного средства может быть таким количеством, которое индуцирует апоптоз в клетках, в которые оно вводится. Также предпочтительно количество, которое не вызывает неблагоприятное воздействие, которое превышает положительный эффект введения. Такое количество известно или может быть определено надлежащим образом с помощью исследований in vitro с использованием культивируемых клеток и т. д., и такой метод исследования хорошо известен специалисту в данной области техники. Индукция апоптоза может быть оценена различными известными методиками, в том числе теми, которые описаны выше. Эффективное количество, описанное выше, не обязательно должны быть таким, которое индуцирует апоптоз во всех клетках клеточной популяции, в которые вводится лекарственное средство. Например, эффективное количество, описанное выше, может быть таким количеством, которое индуцирует апоптоз в клеточной популяции по меньшей мере в 1% клеток, по меньшей мере в 2%, по меньшей мере в 3%, по меньшей мере в 4%, по меньшей мере в 5%, по меньшей мере в 6%, по меньшей мере в 8%, по меньшей мере в 10%, по меньшей мере в 12%, по меньшей мере в 15%, по меньшей мере в 20%, по меньшей мере в 25% и т. д.
Апоптоз-индуцирующее средство по настоящему изобрете