Фармацевтическая композиция, содержащая биотин, и способ ее получения
Иллюстрации
Показать всеГруппа изобретений относится к области фармацевтики, а именно к фармацевтической композиции для предупреждения и лечения полинейропатии в виде твердой лекарственной формы пролонгированного высвобождения, включающей в качестве активного агента Биотин – 40-60 мас.%, а в качестве вспомогательных веществ: Метоцел К100 LV – 14-21 мас.%, Метоцел К4М – 5-10 мас.%, микрокристаллическую целлюлозу (МКЦ) – 7-18 мас.%, коповидон – 1,5-3 мас.%, коллоидный диоксид кремния – 0,4-1 мас.% и фармацевтически приемлемую соль стеариновой кислоты – 0,6-1 мас.%, а также к способу ее получения, согласно которому Биотин, Метоцел К4М, Метоцел К100 LV, МКЦ и коповидон просеивают и перемешивают до однородности, добавляют соль стеариновой кислоты, коллоидный диоксид кремния, перемешивают, смесь уплотняют вальцеванием, добавляют коллоидный диоксид кремния и перемешивают вместе с предварительно уплотненными гранулами с последующим добавлением соли стеариновой кислоты, перемешиванием и формованием твердой лекарственной формы. Группа изобретений обеспечивает создание нового лекарственного состава с высокими технологическими свойствами, высокой стабильностью и воспроизводимой кинетикой высвобождения активного агента. 2 н. и 7 з.п. ф-лы, 8 пр., 5 табл., 1 ил.
Реферат
Настоящее изобретение относится к области химико-фармацевтической промышленности и медицины, более конкретно к новому лекарственному средству для лечения нейропатических поражений у млекопитающих.
Нейропатические поражения - это поражения нервов, которые относятся к периферической нервной системе. Это нервы, с помощью которых головной и спинной мозг управляют мышцами и внутренними органами. Нейропатические поражения - распространенное и опасное осложнение не только сахарного диабета, но и при других трофических поражениях периферических тканей. Эти нарушения вызывают разнообразные симптомы.
Периферическая нервная система делится на соматическую и вегетативную, так называемую автономную. Соматический отдел нервной системы человека, как элемент высшей нервной деятельности, управляет в том числе и движением мускулов. Автономная нервная система регулирует вегетативные функции организма: дыхание, сердцебиение, выработку гормонов, пищеварение и т.д.
Нейропатические поражения, как правило, реализуются в виде так называемых «полинейропатий».
Полинейропатией называют множественное структурное поражение волокон периферической нервной системы. Болезнь проявляется в виде частичных параличей, нарушений чувствительности и других расстройств, возникающих преимущественно в нижних конечностях.
При полинейропатии нижних конечностей поражаются отдаленные участки нервных волокон, иннервирующие стопы. Поражаются и двигательные, и чувствительные нервы. Признаки и интенсивность проявления симптомов зависит от разновидности заболевания.
Выделяют следующие виды полинейропатий:
- воспалительные (возникающие вследствие воспалительных процессов в нервной ткани);
- токсические (вызванные отравлением организма каким-либо токсичным агентом, например свинцом);
- аллергические (являющиеся следствием сбоев защитных механизмов организма);
- травматические (появляющиеся в результате травматических поражений) [http://www.neuroplus.ru/bolezni/nevropatiya/polineyropatiya-nizhnih-konechnostey.html#ixzz4NXidjgMS].
Эпидемиология полинейропатии. Полинейропатии - весьма распространенная группа заболеваний. Их выявляют у 2,4%, а в старших возрастных группах - доходит до 8% населения. К наиболее распространенным полинейропатиям относятся диабетическая и другие метаболические, токсические, а также некоторые наследственные полинейропатии. В клинической практике весьма распространена формулировка «полинейропатия неясного генеза», которые в действительности в большинстве случаев имеют аутоиммунный либо наследственный генез. 10% всех полиневропатий неясного генеза составляют парапротеинемические, около 25% - токсические полиневропатии.
В настоящее время принято разделение всех полинейропатий на аксонопатии, в основе патогенеза которых лежит первичное повреждение осевых цилиндров нервов, и миелинопатии, характеризующиеся нарушением функции проводимости вследствие поражения миелиновых оболочек. Однако такое разделение возможно лишь на ранних стадиях патологического процесса, т.к. по мере прогрессирования заболевания развивается сочетанное повреждение как осевых цилиндров, так и миелиновых оболочек нервов [The effect of intensive diabetes therapy on the development and progression of neuropathy. The Diabetes Control and Complications Trial Research Group / Annals of Internal Medicine, 1995, V. 122, P. 561-568; Su-Yen Goh and Mark E. Cooper. The Role of Advanced Glycation End Products in Progression and Complications of Diabetes / The Journal of Clinical Endocrinology & Metabolism, 2008, V. 93. P. 1143-1152].
Эффективное лечение полинейропатий заключается в воздействии на первопричину патологии, а именно контроль сахара; устранение токсического воздействия; лечение аутоиммунного заболевания и прочее.
Однако стоит отметить, что патологический процесс полинейропатии имеет тенденцию к возвращению. Даже на фоне контроля за основным заболеванием. Т.о. процесс полинейропатии становится самостоятельным и самоподдерживающим состоянием.
Симптомы полинейропатии включают усталость, онемение, дрожь, покалывание, дизестезию, нарушение зрения, головокружение, урологические дисфункции, снижение подвижности и депрессии. Различают четыре типа классификации клинических моделей болезни: ремитирующий, вторично-прогрессирующий, первично-прогрессирующий и прогрессивно-рецидивирующий [Hauserand S.L. et al. Multiple Sclerosis and Other Demyelinating Diseases in Harrison's Principles of Internal Medicine 14th Edition, V. 2, McGraw-Hill, 1998, Р. 2409-2419].
Современные методы терапии направлены на облегчение симптомов заболевания, насколько это возможно. В зависимости от типа препарата лечение обычно предполагает использование обезболивающих препаратов из класса нестероидных противовоспалительных средств (НПВС), причем в самых разнообразных лекарственных формах, включая местное применение. В качестве выраженного противовоспалительного эффекта применяют кортикостероиды, такие как метилпреднизолон и преднизолон.
Для лечения полинейропатии используют витамины и витаминоподобные композиции, например альфа-алиполиевую кислоту и комплекс витаминов группы «В». Эти лекарства стимулируют восстановительные процессы в нервных волокнах, уменьшают болевой синдром.
Данный патологический процесс можно успешно контролировать антиконвульсантами, антидепрессантами, местными анестетиками.
Механизм влияния антиконвульсантов до конца не ясен. По-видимому, они тормозят генерацию нервных импульсов от поврежденных периферических нервов на уровне спинного и головного мозга.
Из антиконвульсантов чаще всего используют прегабалин, габапентин, карбамазепин.
Антидепрессанты помогают при полиневропатии за счет активизации норадренергических и, в меньшей степени, серотонинергических систем. Они тормозят проникновение болевых импульсов в головной мозг. При нейропатической боли применяют трициклические антидепрессанты.
В этой группе препаратов с недавнего времени начинает применяться Биотин (Витамин Н, витамин В7). Биотин является водорастворимым витамином группы В, кофактором в метаболизме жирных кислот, лейцина и в процессе глюконеогенеза.
Биотин регулирует уровень сахара в крови и очень важен для углеводного обмена, контролирует процессы глюконеогенеза, отвечая за участие глюкозы в обмене веществ. Биотин играет важную роль в усвоении белка и сжигании жира.
Витамин Н необходим для нормальной деятельности нервной системы.
Дефицит голокарбоксилазсинтетазы (Holocarboxylasesynthetase - HLCS) считается автосомальным рецессивным заболеванием, a HLCS является ферментом, который катализирует инкорпорацию биотина в карбоксилазу и гистоны. Больные дети, имеющие мутантную форму HLCS, хорошо отвечают на целевую терапию биотином.
Кофермент ацетилкарбоксилазы - биотинзависимый фермент, катализирует карбоксилацию ацетила-СоА, чтобы воспроизвести малонил-СоА. Он играет большую роль в жировом обмене. Исследование молекулярного механизма функционирования описываемого кофермента - это важный шаг к созданию новых лекарственных препаратов с улучшением метаболизма липидов.
Достаточно убедительно показано, что биотин является простетической группой карбоксилаз. Кроме того, он не только выступает в роли карбоксилазного кофактора, но и участвует в иммунитете и во многих проявлениях метаболизма.
Предполагается, что коррекция содержания в организме биотина может способствовать снижению активности процессов старения. Установлено, что Биотин регулирует экспрессию генов, ответственных за метаболизм инсулина и глюкозы. Он стимулирует работу генов, ответственных за усвоение глюкозы крови (через продукцию инсулина, через инсулиновые рецепторы, панкреатическую и печеночную глюкокиназу). Биотин уменьшает экспрессию печеночной фосфоэнолпируваткарбооксикиназы - фермента, стимулирующего производство глюкозы печенью. Таким образом, Биотин регулирует деятельность генов, которые обеспечивают интермедиаторный обмен, особенно углеводный и жировой.
Обнаружение того факта, что недостаток биотина можно представить как тяжелое и диффузное миелинизирующее нарушение, послужило в дальнейшем поддержкой идеи о том, что биотин вовлечен в миелиновый метаболизм [Tourbah A. Biotin and demyelinating diseases - a new connection? / Multiple Sclerosis Journal, 2015, V. 21, N. 12, P. 1608-1609].
В источнике [Krause KH et al. Impaired biotin status in anticonvulsant therapy / Annals of Neurology, 1982, V. 12, N. 5, P. 485-486] описывается исследование, согласно которому при применении высокой дозы биотина (10 мг внутримышечно три раза в неделю на протяжении шести недель, далее пероральный прием 5 мг биотина ежедневно) у трех страдающих диабетом субъектов с невропатией на инсулиновой терапии было отмечено улучшение симптомов невропатии с лечебным действием в отношении парестезии по прошествии одного года (мышечная функция полностью не восстановилась). Так как у субъектов с невропатией наблюдаются низкие концентрации биотина (эпилептики, подвергающиеся терапии, и алкоголики), это предположительно играет причинную роль и возможно связано с изменениями метаболизма пирувата и биотинзависимого фермента пируват карбоксилазы во время невропатии.
В настоящее время выпускаются таблетки [http://compendium.com.ua/info/171919/kusum/volvit-sup-sup-] для лечения заболевания кожи, ногтей, волос, содержащие биотин 5 мг и вспомогательные вещества: целактозу 80, лаурилсульфат натрия, кроскармеллозу натрия, магний стеариновокислый, кремния диоксид коллоидный (безводный), покрытие Opadry II 85 G 54348 розовый.
В уровне техники [заявка на патент WO 2014016003 А1, опубл. 30.01.2014] раскрывается применение Биотина в высоких дозировках, 50-700 мг в день, для лечения рассеянного склероза. Отмечается, что биотин может использоваться в форме гелевых капсул, таблеток, в том числе с пленочным покрытием, пастилок и пилюль. Также раскрывается ряд наполнителей, которые могут использоваться при создании лекарственных форм, включающих Биотин, такие как тальк, микрокристаллическая целлюлоза, лактоза, манноза, крахмал (в частности кукурузный крахмал), стеарат магния (Е572) и стеариновая кислота (Е570). Этот список не является исчерпывающим. Предпочтительным наполнителем для приготовления лекарственного состава в форме капсул является микрокристаллическая целлюлоза. Для получения лекарственного состава в форме таблетки, покрытой оболочкой, покрытие пленки может быть сформировано из любого вещества, известного в данной области, такого как гипромелоза (Е464), этилцеллюлоза, макрогол, тальк, диоксид титана (Е171) или оксид железа (Е172). Указанный источник может быть выбран в качестве ближайшего аналога.
Хотя в указанном документе и перечислены некоторые вспомогательные вещества, однако отсутствуют данные о наличии разработанных и описанных конкретных готовых лекарственных формах с высокими дозировками Биотина. Из источника не ясно, удалось ли авторам создать формы с высоким процентным содержанием вещества или их нужно принимать несколько для приема определенной дозы. Кроме того, в данном документе не раскрывается и не исследуется применение Биотина для предупреждения и лечения полинейропатии не демиелинизирующего характера.
Технический результат настоящего изобретения заключается в создании нового лекарственного состава для предупреждения и лечения полинейропатии с высокими технологическими свойствами и высокой стабильностью, а также воспроизводимой кинетикой высвобождения активного агента.
Технический результат достигается фармацевтической композицией для предупреждения и лечения полинейропатии в виде твердой лекарственной формы, включающей в качестве активного агента Биотин, а в качестве вспомогательных веществ Метоцел К100 LV, Метоцел К4М, мкрокристаллическую целлюлозу, коповидон, коллоидный диоксид кремния и фармацевтически приемлемую соль стеариновой кислоты, при следующем содержании компонентов, мас. %:
| Биотин | 40-60 |
| Метоцел К100 LV | 14-21 |
| Метоцел К4М | 5-10 |
| Микрокристаллическая целлюлоза | 7-18 |
| Коповидон | 1,5-3 |
| Коллоидный диоксид кремния | 0,4-1 |
| Фармацевтически приемлемая соль | |
| стеариновой кислоты | 0,6-1 |
Такая фармацевтическая композиция может быть выполнена в виде различных твердых лекарственных форм: таблетки, капсулы, гранулы, пеллеты, порошок для приготовления парентеральной формы введения или порошок, фасованный в саше.
В некоторых вариантах фармацевтически приемлемая соль стеариновой кислоты может быть выбрана из стеарата магния, стеарата кальция или их смеси.
Технический результат также достигается способом получения такой фармацевтической композиции, согласно которому Биотин, комбинацию Метоцел К4М и Метоцел К100 LV, микрокристаллическую целлюлозу и коповидон просеивают вместе, перемешивают до однородности, добавляют фармацевтически приемлемую соль стеариновой кислоты, коллоидный диоксид кремния, перемешивают, смесь уплотняют вальцеванием, добавляют коллоидный диоксид кремния и перемешивают вместе с предварительно уплотненными гранулами с последующим добавлением фармацевтически приемлемой соли стеариновой кислоты, перемешиванием и формованием твердой лекарственной формы.
Предпочтительно перемешивание ведут при скорости мешалки 20 об./минуту. Любую из стадий перемешивания осуществляют до однородного состояния, предпочтительно в течение 3-6 минут. На стадии вальцевания может использоваться сетка размером 1,6 мм для предварительной грануляции и 0,63 мм - для тонкой грануляции, при этом процесс осуществляют предпочтительно при гидравлическом давлении 90 бар.
В результате проведенных исследований и испытаний авторами было обнаружено, что влажная грануляция проявляет тенденцию к потенциальному воздействию на стабильность вследствие влияния влаги и вероятности термического разложения лекарственного вещества во время сушки. Для сухой грануляции методом вальцевания порошкообразные частицы лекарственного вещества и наполнители соединяются под высоким давлением для образования ленты, а перед прессованием (таблетирование) разбиваются для образования гранул размалыванием. Также было обнаружено, что риск неудовлетворительной однородности состава таблетки и отклонение массы таблетки с Биотином может быть снижен при осуществлении контроля фракционного состава и свойств сыпучести. Предпочтительно использовать субстанцию биотина микронизированную с распределением частиц по размеру d90<50 микрон. В частности, гранулометрический состав частиц с d90<50 микрон: d90 - 62,62 мкм, d50 - 25,86 мкм, d10 - 8,23 мкм.
Предложенный способ обеспечивает особенно хорошую текучесть, однородность и сжимаемость в готовой смеси при использовании определенных вспомогательных компонентов согласно предложенному составу.
Наполнители или разбавители добавляют к активному веществу с целью гомогенизации готового лекарственного средства и подобраны таким образом, чтобы обеспечить высокую биодоступность и высокие технологические свойства, в частности оптимальные показатели сыпучести, насыпной плотности.
Таблетки могут быть спрессованы в капсулообразной форме. Либо полученная таблет-смесь может быть рассыпана в капсулы.
Возможность осуществления изобретения и достижения технического результата продемонстрирована ниже представленными примерами.
Пример 1.
Подтверждение терапевтического действия Биотина на диабетическую периферическую полинейропатию
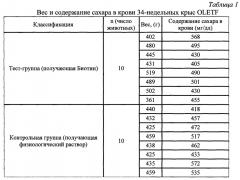
Исследования проводили на животных. Животную модель диабетической периферической нейропатии получают, используя метод, аналогичный методу, описанному в литературе [Nakamura J et al. Physiological and morphometric analyses of neuropathy in sucrose-fed OLETF rats/Diabetes Research Clinical Practice, 2001, V. 51, N. 1, P. 9-20].
Генетически измененных крыс с диабетом типа II разводят в хорошо освещенном и проветриваемом месте, при температуре 20-24°C и влажности 40-70%. Во время разведения животные имеют свободный доступ к пище и питьевой воде в поилке. Примерно через 10 недель вместо обычной воды вводят 30% вес./об. раствор сахара в воде. Общее время введения сахарной воды составляет 24 недели, и через каждые 5 недель проверяют вес и содержание сахара в крови. Примерно через 34 недели определяют вес и содержание сахара в крови в группе, получающей Биотин, и в контрольной группе. Результаты представлены в Таблице 1.
Примерно на 34-й неделе крыс делят на группы: группа, получающая Биотин, и контрольная группа. В группе, получающей Биотин, животным в течение 5 дней подряд подкожно в область живота инъецируют по 35 мг/кг/день Биотина. В то же время животным контрольной группы в течение 5 дней подряд подкожно в область живота инъецируют по 0,2 мл физиологического раствора.
Перед введением Биотина измеряют разницу между скоростями нервной проводимости хвостовых нервов двух групп животных. Затем через 4 недели после введения Биотина измеряют скорость нервной проводимости и болевую чувствительность.
Результаты представлены в нижеприведенных Таблицах 2 и 3.
Представленные исследования демонстрируют, что заявленная композиция может быть применена в качестве лекарственного средства для лечения полинейропатических заболеваний, не демиелинизирующего характера.
Примеры 2-5 касаются создания готовых лекарственных форм Биотина.
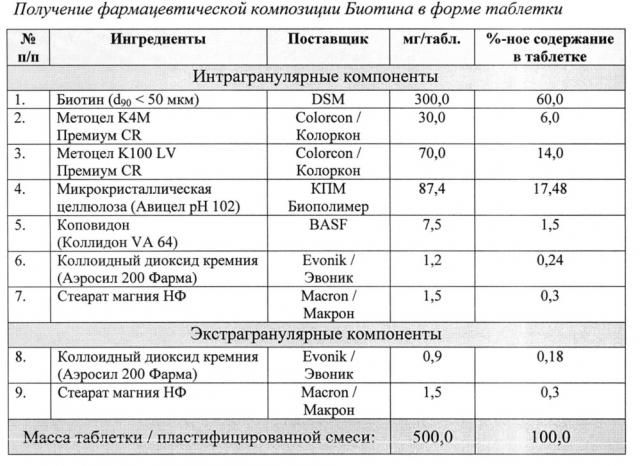
Пример 2.
Пример 4.
Способ получения фармацевтической композиции Биотина в форме таблетки
i) Просеивание интрагранулярных компонентов. Через сито ASTM#30 просеивали вместе субстанцию Биотина, комбинацию Метоцел К4М и Метоцел К100 LV, Микрокристаллическую целлюлозу и Коповидон. Через сито ASTM#20 просеивали Коллоидный диоксид кремния. Через сито ASTM#60 просеивали Стеарат магния.
ii) Смешивание (предварительное компактирование). Просеянные вспомогательные вещества перемешивали в смесителе. Длительность перемешивания составила 6 минут при 20 об./мин. Просеянный Стеарат магния и Коллоидный диоксид кремния добавляли к предыдущей фазе и вновь перемешивали. Длительность перемешивания составила 3 минуты при 20 об./мин.
iii) Уплотнение (компактирование) вальцеванием. Вышеуказанную смесь поместили в роликовый пресс (Alexanderwerk WP120), оснащенный вальцами 25 мм. Пресс был запущен в работу согласно нижеприведенным параметрам, использовалась сетка размером 1,6 мм для предварительной грануляции и 0,63 мм - для тонкой грануляции.
| Винтовой питатель, об./мин | 30 |
| Вальцы, об./мин | 5 |
| Тонкий гранулятор, об./мин | 60 |
| Ширина зазора между вальцами | 2 мм |
| Гидравлическое давление | 90 бар |
iv) Просеивание экстрагранулярных вспомогательных компонентов. Через сито ASTM#20 просеивали Коллоидный диоксид кремния. Через сито ASTM#60 просеивали Стеарат магния.
v) Смешивание (предварительное смазывание). В смеситель емкостью 1 л помещали просеянный Коллоидный диоксид кремния вместе с предварительно уплотненными гранулами. Длительность перемешивания составила 4 мин при 20 об./мин. Просеянный Стеарат магния поместили в вышеупомянутый смеситель. Смеситель запустили в работу на 2 минуты при 20 об./мин.
vi) Прессование. Пластифицированную смесь помещают в таблеточный пресс с пуансонами типа D, прессуют согласно следующим параметрам: насыпная плотность - 0,516 г/мл, плотность после уплотнения - 0,727 г/мл, индекс Карра - 29,03%, соотношение по Хауснеру - 1,41. Прессование состава было равномерным с минимизированным отклонением от установленных параметров (менее 0,3%). Среднее значение прочности - 20,63 Кр.
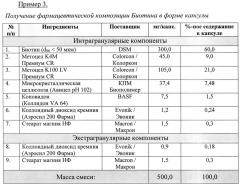
Пример 5.
Способ получения фармацевтической композиции Биотина в форме капсулы
i) Просеивание интрагранулярных компонентов. Через сито ASTM#30 просеивали вместе субстанцию Биотина, комбинацию Метоцел К4М и Метоцел К100 LV, Микрокристаллическую целлюлозу и Коповидон. Через сито ASTM#20 просеивали Коллоидный диоксид кремния. Через сито ASTM#60 просеивали Стеарат магния.
ii) Смешивание (предварительное компактирование). Просеянные вспомогательные вещества перемешивали в смесителе. Длительность перемешивания составила 6 минут при 20 об./мин. Просеянный Стеарат магния и Коллоидный диоксид кремния добавляли к предыдущей фазе и вновь перемешивали. Длительность перемешивания составила 3 минуты при 20 об./мин.
iii) Уплотнение (компактирование) вальцеванием. Вышеуказанную смесь поместили в роликовый пресс (Alexanderwerk WP120), оснащенный вальцами 25 мм. Пресс был запущен в работу согласно нижеприведенным параметрам, использовалась сетка размером 1,6 мм для предварительной грануляции и 0,63 мм - для тонкой грануляции.
| Винтовой питатель, об./мин | 30 |
| Вальцы, об./мин | 5 |
| Тонкий гранулятор, об./мин | 60 |
| Ширина зазора между вальцами | 2 мм |
| Гидравлическое давление | 90 бар |
iv) Просеивание экстрагранулярных вспомогательных компонентов. Через сито ASTM#20 просеивали Коллоидный диоксид кремния. Через сито ASTM#60 просеивали Стеарат магния.
v) Смешивание (предварительное смазывание). В смеситель емкостью 1 л помещали просеянный Коллоидный диоксид кремния вместе с предварительно уплотненными гранулами. Длительность перемешивания составила 4 мин при 20 об./мин. Просеянный Стеарат магния поместили в вышеупомянутый смеситель. Смеситель запустили в работу на 2 минуты при 20 об./мин. Затем полученная смесь на капсуляторе рассыпается в капсулы и капсулируется.
Способ обеспечивает высокую точность заполнения капсул наполнителем (с допуском, не превышающим ±3%).
Следующие примеры 6-8 демонстрируют устойчивые технологические свойства (на примере профилей растворимости), высокую стабильность и воспроизводимую кинетику высвобождения активного агента для лекарственных составов Биотина, полученных в настоящем изобретении. Составы, полученные в настоящем изобретении, были сравнены с лекарственными составами Биотина, которые в общем виде раскрыты в заявке на патент [WO 2014016003 А1, опубл. 30.01.2014]. Такие составы Биотина включают в качестве вспомогательных компонентов тальк, микрокристаллическую целлюлозу, лактозу и маннозу.
Пример 6.
Исследование растворимости составов Биотина
Исследования растворимости составов Биотина проводились при следующих параметрах и условиях:
Профили растворимости составов Биотина приведены в таблицах 4 и 5.
Полученные результаты демонстрируют, что составы Биотина, полученные в настоящем изобретении, характеризуются оптимальными профилями растворимости, что нельзя сказать о составах Биотина, полученных в соответствии с WO 2014016033. При этом профили растворимости составов по настоящему изобретению в зависимости от полученной лекарственной формы (таблетка или капсула) значительно не изменялись.
Далее исследовалось влияние различных технологических параметров (гидравлическое давление во время вальцевания, количество Стеарата магния в составе) на профиль растворимости состава Биотина по примеру 1 (таблица 5).
Приведенные в таблице 5 данные свидетельствуют о том, что при изменениях гидравлического давления во время вальцевания и концентрации Стеарата магния значительных изменений растворимости не наблюдается.
Пример 7.
Определение стабильности при хранении составов Биотина
Стабильность при хранении составов Биотина, полученных в примерах 1 и 2 настоящего изобретения, оценивали по содержанию активного агента (Биотина), а также наличию примесей и содержанию воды, и сравнивали ее со стабильностью составов, изготовленных в соответствии с WO 2014016033.
Составы в форме таблетки и капсулы, полученные в соответствии с примерами 1 и 2, и таблетки, изготовленные в соответствии с WO 2014016033, были упакованы в блистеры из алюминиевой фольги (‘Alu-Alu’) и помещены в климатическую камеру на 6 месяцев в условия ускоренных и долгосрочных («в реальном времени») испытаний. Содержание Биотина и каких-либо примесей определялось методом ВЭЖХ с использованием стандартов.
В результате проведенных исследований установлено, что при ускоренном хранении на 6-й месяц таблетки и капсулы, полученные в примерах 1 и 2, обладали практически равноценными показателями стабильности и оставались химически чистыми (количество примесей не превышало 0,3%, содержание Биотина уменьшалось не более чем на 0,2%). В таблетках, изготовленных в соответствии с WO 2014016033, количество примесей составляло более 1%, при этом содержание Биотина уменьшалось практически на 1,5%. Таким образом, составы Биотина по настоящему изобретению являются более стабильными.
Пример 8.
Исследование кинетики высвобождения Биотина
При исследовании на собаках предлагаемые в настоящем изобретении составы Биотина (в частности, представлены результаты, полученные для состава по примеру 1) показали необходимое замедленное действие, максимальная концентрация Биотина в плазме крови достигается постепенно и не ранее чем через 9-11 часов и поддерживается более 22 часов. На фиг. 1 показано, что при проведении трех отдельных исследований по высвобождению Биотина из состава, полученного по примеру 1, демонстрируется воспроизводимая кинетика высвобождения активного вещества (кривые 1, 2, 3), при этом составы Биотина, изготовленные в соответствии с WO 2014016033, не характеризуются воспроизводимой кинетикой высвобождения (кривые 5, 6).
1. Фармацевтическая композиция пролонгированного высвобождения для предупреждения и лечения полинейропатии в виде твердой лекарственной формы, включающая в качестве активного агента Биотин, а в качестве вспомогательных веществ Метоцел К100 LV, Метоцел К4М, микрокристаллическую целлюлозу, коповидон, коллоидный диоксид кремния и фармацевтически приемлемую соль стеариновой кислоты, при следующем содержании компонентов, мас.%:
| Биотин | 40-60 |
| Метоцел | К100 LV 14-21 |
| Метоцел К4М | 5-10 |
| Микрокристаллическая целлюлоза | 7-18 |
| Коповидон | 1,5-3 |
| Коллоидный диоксид кремния | 0,4-1 |
| Фармацевтически приемлемая соль | |
| стеариновой кислоты | 0,6-1 |
2. Фармацевтическая композиция по п. 1, характеризующаяся тем, что представляет собой таблетку или капсулу.
3. Фармацевтическая композиция по п. 1, характеризующаяся тем, что представляет собой гранулы или пеллеты.
4. Фармацевтическая композиция по п. 1, характеризующаяся тем, что представляет собой порошок для приготовления парентеральной формы введения или порошок, фасованный в саше.
5. Фармацевтическая композиция по п. 1, характеризующаяся тем, что фармацевтически приемлемая соль стеариновой кислоты выбирается из стеарата магния, стеарата кальция или их смеси.
6. Способ получения фармацевтической композиции по п. 1, характеризующийся тем, что Биотин, комбинацию Метоцел К4М и Метоцел К100 LV, микрокристаллическую целлюлозу и коповидон просеивают вместе, перемешивают до однородности, добавляют фармацевтически приемлемую соль стеариновой кислоты, коллоидный диоксид кремния, перемешивают, смесь уплотняют вальцеванием, добавляют коллоидный диоксид кремния и перемешивают вместе с предварительно уплотненными гранулами с последующим добавлением фармацевтически приемлемой соли стеариновой кислоты, перемешиванием и формованием твердой лекарственной формы.
7. Способ по п. 6, характеризующийся тем, что перемешивание ведут при скорости мешалки 20 об./мин.
8. Способ по п. 6, характеризующийся тем, что любую из стадий перемешивания осуществляют в течение 3-6 мин.
9. Способ по п. 6, характеризующийся тем, что на стадии вальцевания использовалась сетка размером 1,6 мм для предварительной грануляции и сетка размером 0,63 мм для тонкой грануляции и процесс осуществляют при гидравлическом давлении 90 бар.