Применение аскорбата лития для профилактики и лечения хронической алкогольной интоксикации
Иллюстрации
Показать всеИзобретение относится к медицине, конкретно к химико-фармацевтической промышленности, а именно к применению аскорбата лития в дозе, по меньшей мере, 5 мг/кг в качестве средства для профилактики и лечения хронической алкогольной интоксикации. Применение, в том числе, характеризуется защитой нейронов мозга и снижением демиелинизирующих осложнений. Изобретение обеспечивает расширение арсенала средств указанного назначения. 3 з.п. ф-лы, 1 пр., 3 табл., 10 ил.
Реферат
Изобретение относится к области медицины и химико-фармацевтической промышленности, а именно к созданию средства для профилактики и лечения хронической алкогольной интоксикации.
Алкоголизм остается одной из актуальнейших социальных и медицинских проблем в современном обществе. Злоупотребление алкоголем является основным фактором демографического и социального кризиса, общенациональной угрозой на уровне личности, семьи, общества, государства. В настоящее время в России злоупотребление алкоголем приводит к преждевременной смерти около 500 тысяч человек ежегодно [Злоупотребление алкоголем в Российской Федерации: социально-экономические последствия и меры противодействия / Доклад Комиссии по социальной и демографической политике Общественной палаты Российской Федерации. - М., 2009, 84 с.].
Систематическое употребление этанола приводит к развитию нарушений деятельности мозга и центральной нервной системы (ЦНС). Осложнениями алкоголизма являются демиелинизация нервных проводящих путей, приводящая к алкогольной полинейропатией и провокации судорог. Нарушая нормальное функционирование нервной ткани, алкоголь вызывает необратимое повреждение и/или гибель нервных клеток. Влияние острой и хронической алкогольной интоксикации на здоровье человека является одной из до конца не решенных задач современной медицины. Поражая все органы и системы организма, алкоголь приводит к ранней инвалидизации молодого и наиболее трудоспособного населения.
Несмотря на широкое применение в медицине антиалкогольных лекарственных средств разных фармакологических групп, в том числе седативных, снотворных, антипсихотических, антидепрессантов и т.д., до сих пор остается актуальным поиск новых эффективных средств для профилактики и лечения хронической алкогольной интоксикации.
Механизмы развития алкогольной зависимости включают нарушения функционирования дофаминергической и других медиаторных систем головного мозга [Myers R.D. et al. Neurotransmitter and neuromodulator mechanisms involved in alcohol abuse and alcoholism: Epitome of cerebral complexity / Neurochemistry International, 1995, Vol. 26, N. 4, pp. 337-342], гуморальных и нейротрофических факторов [Darcq Е. et al. MicroRNA-30a-5p in the prefrontal cortex controls the transition from moderate to excessive alcohol consumption / Molecular Psychiatry, 2014, pp. 1-11]. Перспективным направлением исследований является изучение ролей обеспеченности макро- и микроэлементами в формировании, профилактике и лечении алкогольной зависимости, т.к. микроэлементный статус организма может высокоспецифично регулироваться специальными препаратами, содержащими микроэлементы.
Ионы лития играют важные роли в регуляции нейромедиаторного баланса, поддержании баланса нейротрофических факторов и многих других физиологических процессах, важных для ЦНС. Наиболее изучены фармакологические применения сверхвысоких доз карбоната лития при психиатрических расстройствах [Chia-Ming Chang et al. Utilization of Psychopharmacological Treatment Among Patients With Newly Diagnosed Bipolar Disorder From 2001 to 2010 / Journal of Clinical Psychopharmacology, 2016, Vol. 36, N. 1, pp. 32-44]. Однако спектр биологических ролей лития гораздо шире.
Установлено участие ионов лития в метаболизме простых сахаров (в том числе в регуляции секреции инсулина [Zawalich W.S. et al. Interactions between lithium, inositol and mono-oleoylglycerol in the regulation of insulin secretion from isolated perifused rat islets / Biochemistry Journal, 1989, Vol. 262, N. 2, pp. 557-561]), участие ионов лития в обмене липидов [Diaz-Sastre С. et al. Cholesterol and lithium levels were correlated but serum HDL and total cholesterol levels were not associated with current mood state in bipolar patients / Journal of Clinical Psychiatry, 2005, Vol. 66, N. 3, pp. 399-400], регуляции артериального давления [Koda L.Y. et al. Lithium treatment decreases blood pressure in genetically hypertensive rats / European Journal of Pharmacology, 1981, Vol. 76, N. 4, pp. 411-415], кроветворения [Focosi D. et al. Lithium and hematology: established and proposed uses / Journal of Leukocyte Biology, 2009, Vol. 85, N. 1, pp. 20-28]. Ионы лития способствуют ингибированию циклооксигеназы-2, что снижает концентрации пирогенного простагландина Е2 в головном мозге и в других тканях и приводит к противовоспалительному действию препаратов лития [Phelan K.M. et al. Lithium interaction with the cyclooxygenase 2 inhibitors rofecoxib and celecoxib and other nonsteroidal anti-inflammatory drugs / Journal of Clinical Psychiatry, 2003, Vol. 64, N. 11, pp. 1328-1334].
Особо следует подчеркнуть важность участия ионов лития в гомеостазе нейромедиаторов. Ионы лития избирательно накапливаются в ЦНС и оказывают существенное воздействие на гомеостаз многих нейротрансмиттеров. Так, ионы лития влияют на метаболизм и активность рецепторов ацетилхолина, активность ацетилхолинэстеразы и секрецию ацетилхолина в коре головного мозга [Hillert М.Н. et al. Dynamics of hippocampal acetylcholine release during lithium-pilocarpine-induced status epilepticus in rats / Journal of Neurochemistry, 2014, Vol. 131, N. 1, pp. 42-52]. В эксперименте [Stengaard-Pedersen K. et al. In vitro and in vivo inhibition by lithium of enkephalin binding to opiate receptors in rat brain / Neuropharmacology, 1982, Vol. 21, N. 8, pp. 817-823], ионы лития регулировали уровни энкефалинов в гипофизе. Ионы лития ингибируют накопление циклического аденозинмонофосфата (АМФ) в нейронах мозга, происходящее при активации адренергических рецепторов [Ebstein R.P. et al. The effect of lithium on noradrenaline-induced cyclic AMP accumulation in rat brain: inhibition after chronic treatment and absence of supersensitivity / Journal of Pharmacology and Experimental Therapeutics, 1980, Vol. 213, N. 1, pp. 161-167].
Важно отметить, что ионы лития воздействуют на гомеостаз допамина [Basselin М. et al. Chronic lithium chloride administration to unanesthetized rats attenuates brain dopamine D2-like receptor-initiated signaling via arachidonic acid / Neuropsychopharmacology, 2005, Vol.30, N.6, pp. 1064-1075], активность рецепторов серотонина [Castro L. et al. Central 5-HT2B/2C and 5-HT3 receptor stimulation decreases salt intake in sodium-depleted rats. Brain Research, 2003, Vol. 981, N. 1-2, pp. 151-159], повышают уровни рецепторов ГАМК, ослабляют активность сигнальных каскадов, активируемых посредством NMDA-рецепторов [Basselin М. et al. Chronic lithium chloride administration attenuates brain NMDA receptor-initiated signaling via arachidonic acid in unanesthetized rats / Neuropsychopharmacology, 2006, Vol. 31, N. 8, pp. 1659-1674], тормозят формирование зависимости от каннабиноидов посредством модуляции сигнальных путей цАМФ, ERK1/2 и ГСК-3. Изучаются и другие гормональные эффекты лития: установлено воздействие ионов лития на нейроактивные стероиды и нейропластичность [Marx С.Е. et al. Neuroactive steroids, mood stabilizers, and neuroplasticity: alterations following lithium and changes in Bcl-2 knockout mice / International Journal of Neuropsychopharmacology, 2008, Vol. 11, N. 4, pp. 547-552]. Все эти биохимические механизмы, так или иначе, нарушаются при воздействии алкоголя.
Предлагаемое изобретение решает задачу создания нового эффективного средства для профилактики осложнений алкоголизма и лечения хронической алкогольной интоксикации, которое в том числе обладает низкой токсичностью.
Технический результат настоящего изобретения заключается в расширении арсенала средств, используемых для профилактики и лечения хронической алкогольной интоксикации.
Указанный технический результат достигается применением в качестве такого средства аскорбата лития в дозе, по меньшей мере, 5 мг/кг.
Применение, в том числе, характеризуется защитой нейронов мозга и снижением демиелинизирующих осложнений. Для осуществления настоящего изобретения аскорбат лития предпочтительно используется в дозе от 5 до 30 мг/кг.
Известно [Остренко К.С. и др. Определение острой токсичности и негативного воздействия высоких доз аскорбата лития при длительном применении на крысах линии Вистар / Фармакокинетика и фармакодинамика, 2016, №4, с. 44-54], что аскорбат-лития относится к соединениям 5-го класса токсичности, то есть является практически нетоксичным.
Проведены испытания, подтверждающие возможность применения аскорбата лития в качестве средства для профилактики и лечения хронической алкогольной интоксикации, что иллюстрируется следующим примером. Исследовано действие аскорбата лития на модели хронической алкогольной интоксикации. Исследование включало определение минимально эффективных доз аскорбата лития, предупреждающих развитие алкогольной зависимости у крыс линии Вистар, и эффективность терапии алкогольной интоксикации.
Пример
Средства и методы. В качестве модельного объекта были использованы самцы белых крыс линии Вистар массой 200-250 г (n=168). Исследование прошло апробацию на этическом комитете ФГБОУ ВО ИвГМА МЗ России от 24 марта 2016 г.; все процедуры и опыты на крысах проводились в соответствии с международными правилами обращения с животными. Животные содержались в одинаковых комнатах в клетках по 7 крыс в каждой, при температуре 19-21°С. Животных ежедневно кормили комбикормом из расчета 40-50 г на особь.
Создание модели алкогольной зависимости. Критерием отбора крыс, наряду с отсутствием видимых отклонений в состоянии и поведении, являлось исходное предпочтение 6% раствора этилового спирта перед водопроводной водой. Для выявления этого предпочтения в течение 3-х дней проводился предварительный эксперимент в индивидуальных клетках со свободным доступом к обеим жидкостям. После отбора в качестве единственного источника жидкости предлагался 6% раствор этилового спирта, через неделю концентрация спирта была увеличена до 15%. Через 2 недели спирт заменялся водопроводной водой.
Дозировка и применение препарата. Эксперимент проводился в двух сериях - «профилактика» и «лечение», по четыре группы в каждой серии: (1) доза 30 мг/кг (опытная группа 1), (2) доза 10 мг/кг (опытная группа 2), (3) доза 5 мг/кг (опытная группа 3), (4) группа плацебо. В серии экспериментов «профилактика» препарат вводился параллельно с созданием модели, а в серии экспериментов «лечение» - после создания модели. В каждую группу входило 21 животное. В течение 14 дней препарат вводился в растворенном виде внутрижелудочно с помощью зонда 1 раз в сутки в объеме 0,5 мл на каждое животное.
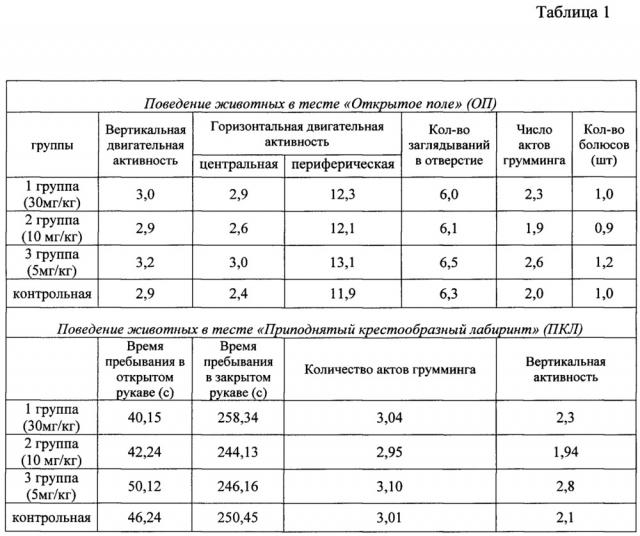
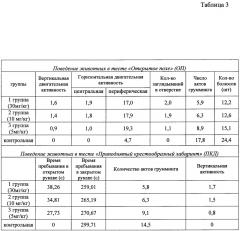
Неврологическое тестирование. Проводилась общая оценка соматического и неврологического статуса животных всех исследованных групп. Оценку уровня тревожности, адаптогенности и негативного воздействия алкоголя на ЦНС осуществляли путем наблюдения за поведением животных в тестах «открытое поле» (ОП) и «приподнятого крестообразного лабиринта» (ПКЛ) через 7 и 14 дней введения аскорбата лития.
В тесте «открытое поле» (ОП) регистрировалась вертикальная двигательная активность, горизонтальная двигательная активность, количество заглядываний в отверстия (так называемый «норочный рефлекс»), число актов грумминга, количество выходов в центральную зону. В тесте ОП животное помещали в один и тот же квадрат, расположенный возле стенки. Время экспозиции каждого животного в модели составило 5 минут. Круглое ОП представляет собой арену 1 м в диаметре с высотой стенки 0,4 м, дно которой имело деления на сектора. В открытом поле было очерчено 3 зоны: центральная, промежуточная (6 секторов), периферическая (12 секторов). Освещение производиться 2-мя лампами, мощностью по 60 Вт, которые располагались на высоте 1,5 м от дна камеры над центральными сегментами поля. В тесте фиксировалась горизонтальная активность в центральной и периферической зоне, вертикальная активность, количество актов грумминга, количество актов дефекации, норковые рефлексы. После каждого животного стенки и дно обрабатывались влажной и сухой салфеткой.
В тесте «приподнятого крестообразного лабиринта» (ПКЛ) регистрировали время нахождения животных в открытых и закрытых рукавах и в центре лабиринта, длительность грумминга в закрытом рукаве, количество эпизодов грумминга в закрытом рукаве. Объект помещают в центр ПКЛ носом к открытому рукаву. Время тестирования животных в ПКЛ составляло 5 минут. Тест ПКЛ представлял установку, имеющую два рукава, в месте пересечения которых находилась открытая площадка. Один из рукавов лабиринта имел закрытые отсеки. Лабиринт устанавливали на высоте одного метра от пола. Регистрировалось время нахождения в открытом и закрытом рукаве, количество актов грумминга, количество вертикальных стоек.
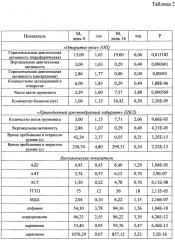
Измерения биохимических показателей. На день 0 и день 14 у животных всех групп определялись биохимические показатели аланиновой трансаминазы (АЛТ), аспартатаминотрансферазы (ACT), гамма-глютамилтранспептидазы (ГГТП), малонового диальдегида (МДА), дофамина, норадреналина, адреналина, серотонина в сыворотке крови и алкогольдегидрогеназы (АДГ) в клетках печени. Отбор крови производился из подъязычной вены при помощи подрезки подъязычной уздечки. Из цельной крови получали сыворотку согласно [Сидоров Евгений «Руководству по назначению и интерпретации биохимических анализов крови», 2015 г.]. Определение проводилось на автоматическом биохимическом анализаторе «Konelab-20i» (Финляндия-США). Клетки печени для определения алькогольдегидрогеназы (АДГ) отбирались у животных после проведения эксперимента. Активность АДГ в гепатоцитах определялось фотометрическим методом.
АЛТ и ACT в мкмоль/мл/ч определялись на автоматическом фотометрическом анализаторе СНЕМ WELL 2910 (С) (Combi) (США), гамма-глютамилпептидаза (ГГТП) в Ед/л определялась кинетическим колориметрическим методом. Использовались стандартные наборы производства ООО «Эйлитон» (Россия) «АЛТ - UTS», «АСТ - UTS» и соответственно для определение ГГТП наборов «Human» (Германия) [O'Connor K. At al. The Triple-Negative Test for Alcohol Dependence: A Reliability Study / Am Surg. 2016, Jun; 82 (6), P. 120-122.; Горюшкин И.И. Механизмы алкоголизма: регуляционно-структурные отношения (патогенез, диагностика, лечение), монография, М.: Спутник+, 2008. - с. 51-67.], МДА в нмоль/мл [Mihara М. et al. Thiobarbituric acid value on fresh homogenate of rat as a parameter of lipid peroxidation in aging, CCl4 intoxication, and vitamin E deficiency / Biochem Med., 1980, V. 23, N.3, pp. 302-311] и АДГ в нмоль/мг белка/мин [Бочкарева А.В. и др. Изменение активности алкогольдегидрогеназы клеток печени крыс при действии этанола и гепарина / Нижегородского университета им. Н.И. Лобачевского, 2010, Т. 2, №2, с. 490-493] - на микроспектрофотометре NanoDrop™ 2000. Серотонин определялся по методу Майкеля. Катехоламины (дофамин, норадреналин, адреналин) в нмоль/мл определялись на жидкостном хроматографе Waters 590 с амперометрическим детектором (НПО «Химавтоматика») (материал рабочего электрода - стеклоуглерод), колонка Ascentic С18 (5 мкм, 4,6×250 мм). Электрофоретическое определение проводилось на системе капиллярного электрофореза «Капель-105» (ООО «НПФ Люмэкс») со спектрофотометрическим детектором, немодифицированный кварцевый капилляр общая длина - 60 см, эффективная длина - 50 см, внутренний диаметр - 50 мкм.
Гистологический анализ нервной ткани. После краниотомии головной мозг извлекался целиком и фиксировался в 10% растворе нейтрального формалина, через 1 сутки с помощью фронтальных разрезов выделялась зона прецентральной извилины переднего мозга. Проводка нервной ткани осуществлялась по стандартной схеме (обезвоживание в этиловом спирте, ксилоле) с последующим изготовлением парафиновых блоков. Изготовленные на санном микротоме «Microm» гистологические срезы толщиной 5-6 мкм окрашивались гематоксилином и эозином. Дубликаты срезов с помощью набора реактивов компании «Биовитрум» были окрашены по методу Ниссля и импрегнированы серебром. Морфометрическое исследование гистологических срезов проводилось на анализаторе изображения «BioVision» (Австрия) и заключалось в подсчете поврежденных нейроцитов пирамидного слоя коры полушарий переднего мозга в 10 различных полях зрения с последующей статистической обработкой результатов. Микрофотографии получены с помощью исследовательского микроскопа «Micros» и цифровой окулярной камеры DCM 900.
Обработка результатов. Результаты обрабатывали с использованием программных пакетов Excel 2003 и Statistica 8.0. Достоверность различий между группами определяли по непараметрическому U-критерию - тесту Вилкоксона-Манна-Уитни.
Модель алкогольной интоксикации. Интактные животные демонстрировали нормальные показатели при неврологическом тестировании (Таблица 1), имели блестящую, гладкую шерстку, были активны.
Замена воды на 6%, а затем 15% спиртовой раствор, в течении двух недель приводил к нарушению поведенческих реакций у крыс. У крыс контрольной группы, получавших только спиртовой раствор, при тестировании в тестах «открытое поле» и «приподнятый крестообразный лабиринт» отмечалось повышение горизонтальной периферической активности при полном исключении захождения в центр. У животных отмечалась тусклая шерстка с очагами аллопеции. Животные двигались хаотично, вдоль стенки, не проявляя исследовательского поведения и поисковых навыков. Это может свидетельствовать о превалировании у животных чувств тревоги и страха на фоне интоксикации алкоголем. На данном фоне заметно увеличение актов дефекации и грумминга. Более подробно изменения показателей неврологического тестирования и биохимического анализа крови, происходившие при создании модели, представлены в Таблице 2.
Фиг. 1 демонстрирует гистологию нервной ткани в модели алкогольной интоксикации. Гистологический анализ показал, что при моделировании хронической алкогольной интоксикации во всех наблюдениях контрольной группы выявлены нарушения кровообращения, которые характеризовались гемостазом в капиллярах и венулах с развитием выраженного периваскулярного отека нервной ткани (Фиг. 1А). В условиях нарушения гемоциркуляции на уровне микроциркуляторного русла (МЦР) постепенно нарастал перицеллюлярный отек белого вещества больших полушарий и ствола головного мозга (Фиг. 1Б). В коре больших полушарий и стволовом отделе головного мозга выявлены мелкоочаговые кровоизлияния (Фиг. 1В). Токсическое повреждение нейроцитов коры больших полушарий характеризовалось острым набуханием пирамидных клеток с округлением клеточного тела, набуханием аксона, гомогенизацией цитоплазмы с исчезновением грануляций Ниссля, нарушением контуров ядра (Фиг. 1Г).
Необратимые изменения нейронов коры больших полушарий (Фиг. 2) сопровождались гиперхроматозом, пикнозом нейроцитов с последующим глыбчатым распадом и формированием нейрофагических узелков (Фиг. 2А, Фиг. 2Б). При изучении зон головного мозга, содержащих проводящие пути, выявлено набухание миелиновых волокон с неравномерным распределением миелина, варикозными утолщениями по ходу волокон (Фиг. 2В). Таким образом, при создании модели алкогольной интоксикации отмечаются выраженные неврологические и биохимические нарушения, которые соответствуют тяжелой патологии нервной ткани.
Результаты профилактического применения аскорбата лития при алкогольной интоксикации. Совместное введение со спиртовым раствором аскорбата лития в различных дозировках заметно изменяло картину интоксикации у подопытных животных. Курсовое введение в течение 2-х недель в различных дозировках аскорбата лития на фоне алкогольной интоксикации увеличивало в тестах вертикальную активность и другие показатели тестов (Фиг. 3). Количество посещений центральных квадратов и показатель норкового рефлекса у животных данных групп сравнимо с показателями для здоровых животных. Эффективная профилактика неврологических нарушений отмечалась, начиная с дозы аскорбата лития в 5 мг/кг.
Длительная алкогольная интоксикация вызывала повышения концентрации катехоламинов (дофамина, норадреналина, адреналина) в крови, что указывает на выраженную активацию симпатико-адреналовой системы (Фиг. 4). Применения аскорбата лития совместно с алкоголем препятствовало повышению содержания катехоламинов в крови животных и предупреждало развитие негативного действия алкоголя. Эффективность аскорбата лития проявляется активацией АДГ в печени, что соответствует ускорению элиминации этанола.
Известно [Шабанов П.Д. и др. Биология алкоголизма / СПб.: Из-во «Лань», 1998. - 272 с.], что введение этанола вызывает активацию перекисного окисления липидов (ПОЛ) в мембранах клеток печени, мозга и сердца, что приводит к накоплению содержания первичных и вторичных продуктов окисления в биологических жидкостях. В ходе исследования было установлено, что алкоголь вызывает значимое повышение МДА в сыворотке крови. Введение аскорбата лития снижало уровни МДА (Фиг. 4), что соответствует ингибированию ПОЛ.
Таким образом, аскорбат лития достоверно активирует механизмы нейроадаптации, нормализует поведенческие реакции в тестах «открытое поле» (ОП) и «приподнятый крестообразный лабиринт» (ПКЛ). Эти результаты согласуются с результатами гистологического анализа образов тканей мозга.
Профилактическое использование аскорбата лития в условиях хронической алкогольной интоксикации значительно смягчает гистологические проявления ишемии мозга. По сравнению с группой плацебо, во всех группах животных, получавших аскорбат лития, расстройства кровообращения нервной ткани характеризовались очаговым гемостазом в капиллярах и умеренно выраженным перикапиллярным отеком нервной ткани коры, белого вещества больших полушарий и ствола головного мозга.
Важно отметить, что значительная часть нейроцитов коры и подкорковых ядер характеризовалась обратимыми изменениями, которые выражались распылением и нечеткостью контуров тигроида, очаговым слиянием глыбок Ниссля в цитоплазме, умеренно выраженным набуханием ядра и аксонального отростка (Фиг. 5А). Макроглиальная реакция нервной ткани была минимальной и выражалась отеком периартериолярных астроцитов. Импрегнация проводящих путей головного мозга серебром показала сохранность миелиновых оболочек нервных волокон, которые имели четкие контуры (Фиг. 5Б).
Морфометрический анализ показал, что в группе животных, получавших аскорбат лития в дозе 5 мг/кг, количество поврежденных нервных клеток коры составило 18,5%, а в группе плацебо количество поврежденных клеток составило 34,8% при достоверных морфологических признаках необратимой гибели нейроцитов.
Анализ эффектов различных доз аскорбата лития при профилактическом применении показал, что достаточная эффективность аскорбата лития отмечается уже при дозе в 5 мг/кг. Более высокие дозы не приводили к существенному повышению эффективности действия аскорбата лития на исследованные показатели (Фиг. 6).
Результаты применения аскорбата лития для лечения алкогольной интоксикации. В серии экспериментов «лечение» аскорбат лития (в дозах 5, 10, 30 мг/кг) начали вводить сразу после отмены спиртового раствора. «Лечение» представляет собой более жесткую модель алкогольной интоксикации для оценки эффективности препарата. В группе плацебо после отмены спиртового раствора наблюдалась ярко выраженная абстиненция в виде агрессивности, особенно во время кормления, перепадов настроения в течение короткого промежутка времени. Резкие и внезапные приступы агрессии сменялись ступорообразным состоянием; у животных отмечались эпизодические судороги. Животные выглядели измождено, впадали в поверхностный неглубокий сон. После пробуждения животные снова проявляли признаки агрессии, дрались, отказывались пить воду, кусали поилки. При введении аскорбата лития количество агрессивных инцидентов было снижено. У животных наблюдался более глубокий и длительный сон, реже отмечалось впадение в ступор. При приеме аскорбата лития судороги не отмечались. Тестирование по шкалам «открытое поле» (ОП) и «приподнятый крестообразный лабиринт» (ПКЛ) показало достоверно улучшение состояния (Таблица 3, Фиг. 7), подтверждаемое результатами биохимических тестов (Фиг. 8).
Таким образом, лечебное применение аскорбата лития в различных дозах способствует более быстрому восстановлению организма крыс после алкогольной интоксикации. В группах, получавших аскорбат лития, животные быстрее адаптировались к отсутствию алкоголя в рационе, у них быстрее восстанавливались поведенческие и исследовательские рефлексы.
Гистологический анализ показал, что при использовании аскорбата лития с лечебной целью расстройства кровообращения нервной ткани характеризовались меньшей степенью диффузно-очаговым гемостаза в капиллярах, чем в группе плацебо. Образцы мозга при приеме аскорбата лития характеризовались умеренной дилятацией и полнокровием венул, менее выраженным перикапиллярным отеком нервной ткани коры и белого вещества больших полушарий и ствола головного мозга (Фиг. 9А). В образцах мозга животных, получавших аскорбат лития, обнаруживались мелкоочаговые, а не крупноочаговые диапедезные кровоизлияния в коре больших полушарий (как в группе плацебо). В группах на аскорбате лития отмечены только единичные нейроциты с достаточно легкими повреждениями, которые выражались распылением и нечеткостью контуров тигроида, очаговым слиянием глыбок Ниссля в цитоплазме и умеренно выраженным набуханием ядра (Фиг. 9Б). Состояние проводящей системы головного мозга животных, получавших плацебо, характеризовалось очаговым набуханием миелиновых волокон с неравномерным распределением миелина, что при импрегнации серебром создавало картину нечетких контуров (Фиг. 9В). Структурные изменения нервных волокон головного мозга в группе принимавших аскорбат лития ограничивались локальным отеком нервных волокон при полной сохранности миелиновой оболочки.
Анализ эффектов различных доз аскорбата лития при лечебном применении показал, что достаточная эффективность аскорбата лития отмечается уже при дозе в 5 мг/кг. Более высокие дозы приводили к незначительному повышению эффективности действия аскорбата лития на исследованные показатели через 7 дней эксперимента и эффективность выравнивалась на 14 день приема (Фиг. 10).
Воздействие алкоголя в течение длительного времени приводит к возникновению девиантного поведения у животных, повышает агрессию; вызывает необратимые дегенеративные изменения в печени, активирует симпатико-адреналовою систему. Использованная модель хронического алкогольного отравления имела отчетливые характерные морфологические повреждения в печени, в мозге, проводящих нервных путях во всех случаях наблюдений.
В результате исследования было установлено, что аскорбат лития был эффективен в терапии и профилактике последствий алкогольной интоксикации. Показатели неврологических тестов и биохимического анализа крови достоверно улучшались уже при дозе аскорбата лития 5 мг/кг.
Аскорбат лития активирует адаптивные механизмы, нормализуя поведенческие реакции в тестах «открытое поле» и «приподнятый крестообразный лабиринт». Когнитивные функции мозга могут улучшаться, в частности, за счет ингибирования перекисного окисления липидов и активации антиоксидантной системы. Кроме того, аскорбат лития вне зависимости от дозировки предупреждает активацию этанолом симпатико-адреналовой системы и ускоряет элиминацию этанола из крови. Гистологический анализ показал, что использование аскорбата лития минимизировало уровень ишемического повреждения нейроцитов до уровня обратимого состояния и сохраняло миелиновые оболочки проводящих нервных путей. В целом, применение аскорбата лития способствует купированию абстинентного синдрома, блокирует возникновение судорог и способствует выживаемости животных. Активируя защитно-приспособительные механизмы организма в условиях хронической алкогольной интоксикации, аскорбат лития препятствует возникновению демиелинизации, необратимых дегенеративных изменений нервной ткани.
1. Применение аскорбата лития в дозе, по меньшей мере, 5 мг/кг в качестве средства для профилактики и лечения хронической алкогольной интоксикации.
2. Применение по п. 1, характеризующееся защитой нейронов мозга.
3. Применение по п. 1, характеризующееся снижением демиелинизирующих осложнений.
4. Применение по пп. 1-3, характеризующееся тем, что доза аскорбата лития предпочтительно составляет от 5 до 30 мг/кг.