Штамм, продуцирующий d-молочную кислоту, и его применение
Иллюстрации
Показать всеГруппа изобретений относится к рекомбинантному микроорганизму Lactobacillus sp., продуцирующему D-молочную кислоту, способу его получения и способу получения D-молочной кислоты с использованием указанного микроорганизма. Рекомбинантный микроорганизм Lactobacillus sp. получают инактивированием L-лактатдегидрогеназы (L-LDH) и усилением активности D-лактатдегидрогеназы (D-LDH) в микроорганизме Lactobacillus sp., продуцирующем больше L-молочной кислоты, чем D-молочной кислоты. При этом указанный микроорганизм Lactobacillus sp. выбран из группы, состоящей из Lactobacillus casei, Lactobacillus paracasei и Lactobacillus rhamnosus. Способ получения D-молочной кислоты включает культивирование указанного рекомбинантного микроорганизма Lactobacillus sp. с получением культурального бульона и извлечение D-молочной кислоты из культурального бульона. Группа изобретений обеспечивает высокий выход D-молочной кислоты. 3 н. и 10 з.п. ф-лы, 1 ил., 3 табл., 5 пр.
Реферат
Предшествующий уровень техники
1. Область изобретения
Настоящее изобретение относится к новому продуцирующему D-молочную кислоту штамму и его применению. Конкретно настоящее изобретение относится к способу получения продуцирующего D-молочную кислоту штамма, включающему стадии ингибирования активности L-лактатдегидрогеназы (L-LDH) и введения активности D-лактатдегидрогеназы (D-LDH) в продуцирующем L-молочную кислоту штамме, к модифицированному продуцирующему D-молочную кислоту штамму, полученному упомянутым выше способом, и к способу получения D-молочной кислоты, включающему стадии культивирования штамма и извлечения D-молочной кислоты из культурального бульона.
2. Описание предшествующего уровня техники
Молочная кислота имеет широкий диапазон промышленных применений в пищевых продуктах, лекарственных средствах, косметических средствах и так далее. В последние годы молочную кислоту использовали в качестве мономера полимолочной кислоты (ПМК), и таким образом произошло заметное увеличение спроса на молочную кислоту.
Молочную кислоту можно производить посредством химического синтеза или биологическим процессом ферментации, используя углеводы в качестве субстрата. Последний является предпочтительным с коммерческой точки зрения, так как химический синтез молочной кислоты создает проблему увеличения стоимости, вызванную увеличением цены на газ, или загрязнения окружающей среды. Кроме того, также существуют проблемы получения L-молочной кислоты в форме рацемической смеси, состоящей из равных количеств D-молочной кислоты и L-молочной кислоты. К сожалению, соотношение D-молочной кислоты и L-молочной кислоты в ее составе нельзя контролировать. Когда молочную кислоту в форме рацемической смеси используют для получения полимолочной кислоты (ПМК), производят аморфный полимер с низкой точкой плавления, таким образом, ее применение ограничено. С другой стороны, биологический процесс ферментации с использованием микроорганизмов позволяет избирательно получать D- или L-молочную кислоту в зависимости от используемого штамма. Например, микроорганизмы, такие как Lactobacillus sp., Bacillus sp., Rhizopus sp., Streptococcus sp. или Enterococcus sp., обычно продуцируют L-молочную кислоту. Микроорганизмы, такие как Leuconostoc sp. и Lactobacillus vulgaricus, обычно продуцируют D-молочную кислоту. В частности, благодаря тому, что D-молочная кислота не метаболизируется в организме, D-молочную кислоту можно использовать в качестве биологически совместимого материала в области медицины и также использовать в качестве оптически активного гербицида посредством этерификации и хлорирования. Известно, что оптически активный гербицид может значительно улучшать фармацевтический эффект и также имеет такой же фармацевтический эффект в меньшем количестве. По этой причине увеличивался спрос на D-молочную кислоту. Кроме того, sc-полимолочная кислота (стереокомплекс-ПМК) имеет значительно более высокую точку плавления и температуру термической деградации, чем известные полимолочные кислоты. Следовательно, ее можно использовать в качестве термостойкого пластика, получающегося при использовании смеси чистой L-полимолочной кислоты и чистой D-полимолочной кислоты. Следовательно, необходим мономер D-молочной кислоты, и спрос на него постепенно растет.
В производстве такой оптически чистой D-молочной кислоты предпочтительным является биологический процесс ферментации с использованием энантиоселективной субстратной специфичности микробного фермента. Однако обычно встречающиеся в природе микроорганизмы дикого типа, продуцирующие D-молочную кислоту, еще не являются подходящими для промышленного применения в отношении оптической чистоты или производительности. Примеры микроорганизмов, продуцирующих D-молочную кислоту, представляют собой Lb. plantarum, Lb. pentosus, Lb. fermentum, Lb delbrueckii или тому подобные. Однако существуют затруднения в том, что они не способны продуцировать молочную кислоту с высокой производительностью и высоким выходом, и приблизительно от 20 до 40% молочной кислоты представляют собой L-молочную кислоту в качестве оптического загрязнения. Для преодоления этих затруднений были сделаны попытки разработать вариант, продуцирующий высокие концентрации молочной кислоты в среде с высоким содержанием глюкозы, посредством введения мутаций у продуцирующих молочную кислоту бактерий, при помощи обработки EMS (этилметансульфонатом), (J. Industrial Microbiol, 11: 23-28, 1992). В результате селекционировали штамм, демонстрирующий примерно в 4,8 раза более высокую производительность, чем контрольная группа, но его активность понижалась во время продолжительного хранения. При этом, в случае создания штамма, используя вариант, штамм с улучшенным выходом имеет тенденцию проявлять пониженную производительность, в то время как штамм с улучшенной производительностью имеет тенденцию проявлять пониженный выход.
Основываясь на той идее, что штаммы для промышленной ферментации молочной кислоты обычно представляют собой продуцирующие L-молочную кислоту микроорганизмы, и эти микроорганизмы имеют в основном лучшие производительность и выход по сравнению с продуцирующими D-молочную кислоту микроорганизмами, авторы настоящего изобретения обнаружили, что D-молочную кислоту можно производить с высоким выходом путем инактивирования гена, кодирующего L-лактатдегидрогеназу (L-LDH) в микроорганизме с высоким продуцированием L-молочной кислоты, и затем введения туда гена, кодирующего гетерогенную D-лактатдегидрогеназу (D-LDH), завершая этим настоящее изобретение.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В одном воплощении настоящего изобретения предложен способ получения модифицированного штамма, продуцирующего D-молочную кислоту, включающий стадии ослабления или инактивирования активности L-лактатдегидрогеназы и введения или усиления активности D-лактатдегидрогеназы в штамме, продуцирующем L-молочную кислоту.
В другом воплощении настоящего изобретения предложен модифицированный штамм, продуцирующий D-молочную кислоту, который получают упомянутым выше способом.
В еще одном воплощении настоящего изобретения предложен способ получения D-молочной кислоты, используя модифицированный штамм, продуцирующий D-молочную кислоту.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг. 1 показан график, представляющий результаты анализа соотношения D-молочной кислоты и L-молочной кислоты, продуцированных 10 различными типами микроорганизмов дикого типа, продуцирующих молочную кислоту (L-LA - L-молочная кислота, D-LA - D-молочная кислота).
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВОПЛОЩЕНИЙ ИЗОБРЕТЕНИЯ
В одном воплощении настоящего изобретения предложен способ получения модифицированного штамма, продуцирующего D-молочную кислоту, путем ослабления или инактивирования активности L-лактатдегидрогеназы (L-LDH) и введения или усиления активности D-лактатдегидрогеназы (D-LDH) в штамме, продуцирующем L-молочную кислоту.
Подробнее, способ получения модифицированного штамма по настоящему изобретению, продуцирующего D-молочную кислоту, включает (а) ослабление или инактивирование активности L-лактатдегидрогеназы (L-LDH) в штамме, продуцирующем L-молочную кислоту, для получения модифицированного штамма, продуцирующего молочную кислоту, и (б) введение или усиление активности D-лактатдегидрогеназы (D-LDH) в модифицированном штамме, продуцирующем молочную кислоту.
В связи с этим штамм, продуцирующий L-молочную кислоту, может представлять собой штамм, экспрессирующий только L-LDH-кодирующий полинуклеотид для продуцирования L-молочной кислоты, или штамм, экспрессирующий L-LDH-кодирующий полинуклеотид и D-LDH-кодирующий полинуклеотид в одно и то же время, для продуцирования как L-молочной кислоты, так и D-молочной кислоты. Способ ослабления или инактивирования активности L-LDH можно выполнять путем замещения, делеции, вставки или добавления одного или нескольких нуклеотидов в одно или более положений L-LDH-кодирующего полинуклеотида. Способ введения или усиления активности D-LDH можно выполнять введением D-LDH-кодирующего полинуклеотида в хромосому модифицированного штамма, продуцирующего молочную кислоту, введением полинуклеотида, кодирующего вариант D-LDH, имеющий улучшенную активность, в хромосому модифицированного штамма, продуцирующего молочную кислоту, введением сильного промотора перед D-LDH-кодирующим полинуклеотидом в хромосому мутированного штамма, продуцирующего молочную кислоту, введением сильного промотора и D-LDH-кодирующего полинуклеотида, функционально связанного с промотором, в хромосому модифицированного штамма, продуцирующего молочную кислоту, введением сильного промотора и полинуклеотида, кодирующего вариант D-LDH, имеющий улучшенную активность, который функционально связан с промотором, в хромосому модифицированного штамма, продуцирующего молочную кислоту, введением вектора экспрессии, включающего D-LDH-кодирующий полинуклеотид, в модифицированный штамм, продуцирующий молочную кислоту, введением вектора экспрессии, включающего полинуклеотид, кодирующий вариант D-LDH, имеющий улучшенную активность, в модифицированный штамм, продуцирующий молочную кислоту, введением вектора экспрессии, включающего сильный промотор и D-LDH-кодирующий полинуклеотид, функционально связанный с промотором, в модифицированный штамм, продуцирующий молочную кислоту, введением вектора экспрессии, включающего сильный промотор и полинуклеотид, кодирующий вариант D-LDH, имеющий улучшенную активность, который функционально связан с промотором, в модифицированный штамм, продуцирующий молочную кислоту, или тому подобным.
При использовании в данном описании изобретения термин «лактатдегидрогеназа (LDH)» относится к ферменту, который катализирует получение пирувата из лактата путем удаления водорода или получение лактата из пирувата путем восстановления NADH (никотинамидадениндинуклеотид). LDH имеет молекулярную массу примерно 140 кДа и может быть отнесена к L-LDH (ЕС 1.1.1.27.), продуцирующей L-молочную кислоту, D-LDH (ЕС 1.1.1.28.), продуцирующей D-молочную кислоту, и L-LDH (цитохром b2, ЕС 1.1.2.3), содержащей FMN (флавинмононуклеотид) и ген.
При использовании в данном описании изобретения термин «штамм, продуцирующий L-молочную кислоту», относится к штамму, который экспрессирует L-LDH-кодирующий полинуклеотид и продуцирует L-молочную кислоту, используя экспрессированную L-LDH. Кроме того, такой штамм также включает штамм, который продуцирует и L-молочную кислоту, и D-молочную кислоту путем экспрессии L-LDH-кодирующего полинуклеотида и D-LDH-кодирующего полинуклеотида в одно и то же время, в качестве штамма, который продуцирует L-молочную кислоту посредством экпрессии только L-LDH-кодирующего полинуклеотида. Штамм, продуцирующий L-молочную кислоту, в частности не ограничен, при условии, что он может продуцировать L-молочную кислоту. Например, можно использовать Lactobacillus brevis, Lactobacillus pentosus, Lactobacillus rhamnosus, Lactobacillus jensenii, Lactobacillus plantarum, Lactobacillus paraplantarum, Lactobacillus fermentum, Lactobacillus paracasei, Lactobacillus acidophilus, Lactobacillus johnsonii и Lactobacillus casei, конкретно можно использовать Lactobacillus rhamnosus, Lactobacillus paracasei и Lactobacillus casei, и, более конкретно, можно использовать Lactobacillus paracasei.
Способ ослабления или инактивирования активности L-LDH в штамме, продуцирующем L-молочную кислоту, можно выполнять, используя способ, известный в данной области техники. Например, способ ингибирования экспрессии L-LDH-кодирующего полинуклеотида или продуцирования инактивированной L-LDH может представлять собой способ замещения, делеции, вставки или добавления одного или нескольких нуклеотидов, конкретно от 2 до 20 нуклеотидов, более конкретно от 2 до 10 нуклеотидов и еще более конкретно от 2 до 5 нуклеотидов L-LDH-кодирующего полинуклеотида, свойственного для штамма, продуцирующего L-молочную кислоту. Кроме того, можно использовать любой способ без конкретного ограничения, при условии, что его используют для ослабления или инактивирования активности L-LDH в штамме, продуцирующем L-молочную кислоту.
В настоящем изобретении L-LDH, которая должна быть ослаблена или инактивирована, может быть свойственна штамму, продуцирующему L-молочную кислоту. Аминокислотную последовательность L-LDH или кодирующую ее пол и нуклеотидную последовательность, в частности, не ограничены. L-LDH может быть представлена полинуклеотидной последовательностью (SEQ ID NO: 25), кодирующей LDH, и полинуклеотидной последовательностью (SEQ ID NO: 26), кодирующей LDH1 Lactobacillus paracasei, полинуклеотидной последовательностью (SEQ ID NO: 27), кодирующей LDH1, и полинуклеотидной последовательностью (SEQ ID NO: 28), кодирующей LDH2 Lactobacillus casei, полинуклеотидной последовательностью (SEQ ID NO: 29), кодирующей LGG_02523, и полинуклеотидной последовательностью (SEQ ID NO: 30), кодирующей LGG_00606 Lactobacillus rhamnosus.
При использовании в данном описании изобретения термин «модифицированный штамм, продуцирующий молочную кислоту» относится к штамму, продуцирующему L-молочную кислоту, активность L-LDH которого ослабляют или инактивируют. Штамм, продуцирующий молочную кислоту, можно модифицировать для ослабления или инактивирования активности L-LDH, вызывая искусственные мутации в нормальном штамме, продуцирующем L-молочную кислоту, или природных мутаций без индуцирования искусственных мутаций.
Способ включения или усиления активности D-LDH в модифицированном штамме, продуцирующем молочную кислоту, может представлять собой способ введения D-LDH-кодирующего полинуклеотида в хромосому модифицированного штамма, продуцирующего молочную кислоту, способ введения полинуклеотида, кодирующего вариант D-LDH, имеющий улучшенную активность, в хромосому мутированного штамма, продуцирующего молочную кислоту, способ введения сильного промотора перед D-LDH-кодирующим полинуклеотидом в хромосому модифицированного штамма, продуцирующего молочную кислоту, способ введения сильного промотора и D-LDH-кодирующего полинуклеотида, функционально связанного с промотором, в хромосому модифицированного штамма, продуцирующего молочную кислоту, способ введения сильного промотора и полинуклеотида, кодирующего вариант D-LDH, имеющий улучшенную активность, который функционально связан с промотором, в хромосому модифицированного штамма, продуцирующего молочную кислоту, способ введения вектора экспрессии, включающего D-LDH-кодирующий полинуклеотид, в модифицированный штамм, продуцирующий молочную кислоту, способ введения вектора экспрессии, включающего полинуклеотид, кодирующий вариант D-LDH, имеющий улучшенную активность, в модифицированный штамм, продуцирующий молочную кислоту, способ введения вектора экспрессии, включающего сильный промотор и D-LDH-кодирующий полинуклеотид, функционально связанный с промотором, в модифицированный штамм, продуцирующий молочную кислоту, способ введения вектора экспрессии, включающего сильный промотор и полинуклеотид, кодирующий вариант D-LDH, имеющий улучшенную активность, который функционально связан с промотором, в модифицированный штамм, продуцирующий молочную кислоту, но, в частности, не ограничен ими, или тому подобный.
При использовании в данном описании изобретения термин «вектор экспрессии» относится к продукту ДНК, содержащему нуклеотидную последовательность полинуклеотида, кодирующего целевой белок, который функционально связан с подходящей регуляторной последовательностью, для экспрессии полинуклеотида, кодирующего целевой белок в подходящем хозяине. Регуляторная последовательность может включать промотор, способный к инициации транскрипции, произвольную последовательность оператора для регулирования транскрипции, последовательность, кодирующую соответствующий сайт связывания рибосом мРНК, и последовательности для регулирования окончания транскрипции и трансляции. После того как вектор трансформируют в подходящего хозяина, вектор может реплицироваться и функционировать независимо от генома хозяина или может сам интегрироваться в геном.
При условии, что он является реплицируемым в хозяевах, любой вектор, известный в данной области техники, можно использовать в качестве вектора экспрессии по настоящему изобретению, без конкретных ограничений. Пример обычно применяемого вектора экспрессии может включать природную или рекомбинантную плазмиду, космиду, вирус и бактериофаг. Пример фагового вектора или космидного вектора может включать pWE15, М13, λMBL3, λMBL4, λIXII, λASHII, λAPII, λt10, λt11, Charon4A и Charon21A. Плазмидный вектор может включать тип pBR, тип pUC, тип pBlueschptll, тип pGEM, тип pTZ, тип pCL, тип рЕТ и так далее.
Подробнее, вектор, применяемый в воплощениях настоящего изобретения, представляет собой pG+host6, который является вектором, используемым в широком диапазоне грамположительных бактерий. Этот вектор отличается тем, что он содержит ген устойчивости к ампициллину и точку начала репликации для применения в Е.coli, ген устойчивости к эритромицину и точку начала репликации для применения в грамположительных бактериях. В частности, точка начала репликации у грамположительных бактерий содержит теплочувствительную мутацию, и, следовательно, репликация не происходит при температуре выше 37°С. Следовательно, это делает возможной вставку гена при помощи гомологичной последовательности в грамположительных бактериях (публикация патентной заявки US 20060025190).
При использовании в данном описании изобретения термин «трансформация» означает последовательность операций введения вектора, включающего полинуклеотид, кодирующий целевой белок, в клетку-хозяина, экспрессии полинуклеотида в клетке-хозяине и получения продукта экспрессии, мРНК или белка. Полинуклеотид для введения в клетку-хозяина может находиться в любой форме, при условии, что он может быть введен в клетку-хозяина и экспрессироваться в ней. Например, полинуклеотид может быть введен в клетку-хозяина в форме кассеты экспрессии, которая представляет собой структуру, включающую все элементы (промотор, функционально связанный с полинуклеотидом, сигнал терминации транскрипции, сайт связывания рибосом, сигнал терминации трансляции и так далее), необходимые для самоэкспрессии. Кассета экспрессии может находиться в форме самореплицирующегося вектора экспрессии. Кроме того, можно вводить в клетку-хозяина сам полинуклеотид, подлежащий функциональному связыванию с последовательностью, необходимой для экспрессии в клетке-хозяине.
D-LDH, используемая в настоящем изобретении, может иметь происхождение из штамма, продуцирующего D-молочную кислоту, но, в частности, не ограничена им. Конкретно, она может быть получена из Lactobacillus plantarum или Lactobacillus delbrueckii, и, еще более конкретно, из полипептида, представленного аминокислотной последовательностью SEQ ID NO: 31 Lactobacillus delbrueckii или аминокислотной последовательностью SEQ ID NO: 32 Lactobacillus plantarum. Кроме того, можно включать замену, делецию, вставку, добавление или инверсию одной аминокислоты или нескольких аминокислот (может составлять, в зависимости от положений аминокислотных остатков в третичной структуре белка или от типов аминокислотных остатков, конкретно от 2 до 20, более конкретно от 2 до 10, еще более конкретно от 2 до 5 аминокислот) в одном или больше положениях аминокислотной последовательности SEQ ID NO: 31 или 32. Может быть включена аминокислотная последовательность, имеющая гомологию с аминокислотной последовательностью SEQ ID NO: 31 или 32 80% или более, более конкретно 90% или более, более конкретно 95% или более, еще более конкретно 97% или более, при условии, что она может сохранять или усиливать активность D-LDH. Так как аминокислотная последовательность фермента может быть различной в зависимости от видов или от штамма микроорганизма, замена, делеция, вставка, добавление или инверсия аминокислоты также включает встречающуюся в природе мутированную последовательность или искусственным путем мутированную последовательность, но, в частности, не ограничена ими.
При использовании в данном описании изобретения термин «гомология» относится к идентичности между двумя различными аминокислотными последовательностями или двумя различными нуклеотидными последовательностями, которую можно определять посредством способа, хорошо известного специалисту в данной области техники. Например, можно использовать, но к тому же без конкретного ограничения, BLAST 2.0, вычисляющую параметры, такие как сопоставление, идентичность и сходство.
Обычно штамм, продуцирующий L-молочную кислоту, продуцирует молочную кислоту с более высоким выходом продукта, чем штамм, продуцирующий D-молочную кислоту. Таким образом, авторы настоящего изобретения были намерены получить штамм, обладающий превосходной продуктивностью D-молочной кислоты, посредством модифицирования штамма, продуцирующего L-молочную кислоту, в штамм, продуцирующий D-молочную кислоту. С этой целью сравнивали соотношение ферментации D- и L-молочных кислот между штаммами Lactobacillus sp. дикого типа. В результате обнаружили, что штаммы Lactobacillus paracasei, Lactobacillus casei и Lactobacillus rhamnosus демонстрировали превосходную общую продуктивность молочной кислоты и их соотношения L-молочных кислот были в большинстве случаев превосходными. Следовательно, авторы настоящего изобретения были намерены получить их модифицированные штаммы (ФИГ. 1). Например, гены ldh и ldh1 у L-LDHin Lactobacillus paracasei удаляли и в то же самое время получали δldh1-ldhA(Lb. db) и δldh-ldhD(Lb. pl) в виде кассет для вставки в D-LDH, и затем каждую из них вводили в теплочувствительный вектор pG+host6 с получением двух типов векторов, pG+host6-δldh1-ldhA(Lb. db) и pG+host6-δldh-ldhD(Lb. pl) (Пример 3). Затем каждый вектор вводили в Lactobacillus paracasei с удаленным геном L-LDH с получением трансформанта, модифицированного для ослабления или инактивирования активности L-LDH и для усиления активности D-LDH (Пример 4). Таким образом, полученные трансформанты культивировали и анализировали молочную кислоту, продуцированную ими. В результате D-молочная кислота продуцировалась в концентрации 41,6 г/л, но L-молочная кислота не продуцировалась. Выход продукта D-молочной кислоты, получаемой по настоящему изобретению, был выше, чем выход D-молочной кислоты, продуцированной известным штаммом, продуцирующим D-молочную кислоту (Пример 5).
Таким образом, когда ослабляют или инактивируют активность L-LDH и вводят или усиливают активность D-LDH в штамме, продуцирующем L-молочную кислоту, имеющем высокий выход продукта молочной кислоты, D-молочную кислоту можно получать с более высоким выходом, чем при помощи известных штаммов, продуцирующих D-молочную кислоту.
В одном воплощении настоящего изобретения предложен штамм, продуцирующий D-молочную кислоту, модифицированный для ослабления или инактивирования активности L-LDH и для введения или усиления активности D-LDH в штамме, продуцирующем L-молочную кислоту, демонстрирующем активность L-LDH, с применением упомянутого выше способа.
Модифицированный штамм, продуцирующий D-молочную кислоту, может представлять собой штамм, в котором D-LDH-кодирующий полинуклеотид замещает L-LDH-кодирующий полинуклеотид в хромосоме штамма, продуцирующего L-молочную кислоту, или сверх-экспрессируется. Модифицированный штамм, продуцирующий D-молочную кислоту, может представлять собой штамм, в котором полинуклеотид, кодирующий LDH1 (SEQ ID NO: 27), и полинуклеотид, кодирующий LDH2 (SEQ ID NO: 28) Lactobacillus casei, замещают полинуклеотидом, кодирующим LDHA (SEQ ID NO: 31) Lactobacillus delbrueckii, и полинуклеотидом, кодирующим LDHD (SEQ ID NO: 32) Lactobacillus plantarum, соответственно; штамм, в котором полинуклеотид, кодирующий LDH (LGG_02523) (SEQ ID NO: 29), и полинуклеотид, кодирующий LDH (LGG_00606) (SEQ ID NO: 30) Lactobacillus rhamnosus, замещают полинуклеотидом, кодирующим LDHA (SEQ ID NO: 31) Lactobacillus delbrueckii, и полинуклеотидом, кодирующим LDHD (SEQ ID NO: 32) Lactobacillus plantarum, соответственно; штамм, в котором полинуклеотид, кодирующий LDH (SEQ ID NO: 25), и полинуклеотид, кодирующий LDH1 (SEQ ID NO: 26) Lactobacillus paracasei, замещают полинуклеотидом, кодирующим LDHA (SEQ ID NO: 31) Lactobacillus delbrueckii, и полинуклеотидом, кодирующим LDHD (SEQ ID NO: 32) Lactobacillus plantarum, соответственно, но, в частности, не ограничен ими. Конкретно, модифицированный штамм, продуцирующий D-молочную кислоту, может представлять собой штамм, в котором полинуклеотид, кодирующий LDH (SEQ ID NO: 25), и полинуклеотид, кодирующий LDH1 (SEQ ID NO: 26) Lactobacillus paracasei, замещают полинуклеотидом, кодирующим LDHA (SEQ ID NO: 31) Lactobacillus delbrueckii, и полинуклеотидом, кодирующим LDHD (SEQ ID NO: 32) Lactobacillus plantarum, соответственно, и, более конкретно, Lactobacillus paracasei CC02-0095(KCCM11273P).
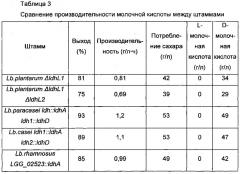
Авторы настоящего изобретения получали D-молочную кислоту, используя каждый из трансформантов, которые модифицировали с делецией каждого из L-LDH-кодирующих полинуклеотидов в штаммах Lactobacillus paracasei, Lactobacillus casei и Lactobacillus rhamnosus и с введением в них полинуклеотида, кодирующего LDHA (SEQ ID NO: 31) Lactobacillus delbrueckii, и полинуклеотида, кодирующего LDHD (SEQ ID NO: 32) Lactobacillus plantarum, соответственно. Сравнивали выход, производительность, количество продукта D-молочной кислоты и так далее. В результате подтвердили, что трансформант, полученный из Lactobacillus paracasei (Lb. paracasei ldh::ldhA ldh1::ldhD), является наиболее превосходным в показателях выхода, производительности и количества продукта D-молочной кислоты.
Таким образом, авторы настоящего изобретения назвали трансформант Lactobacillus paracasei СС02-0095 (Lb. paracasei ldh::ldhA ldh1::ldhD), при этом трансформант являлся наиболее превосходным в показателях выхода, производительности и количества продукта D-молочной кислоты. СС02-095 представлял собой штамм, полученный путем замещения полинуклеотида, кодирующего LDH (SEQ ID NO: 25), и полинуклеотида, кодирующего LDH1 (SEQ ID NO: 26) Lactobacillus paracasei, полинуклеотидом, кодирующим LDHA (SEQ ID NO: 31) Lactobacillus delbrueckii, и полинуклеотидом, кодирующим LDHD (SEQ ID NO: 32) Lactobacillus plantarum. Трансформант депонировали в Корейском Центре Культур Микроорганизмов (в дальнейшем в этом документе сокращено до «КССМ») согласно Будапештскому договору, 2 апреля 2012 с номером доступа КССМ 11273Р.
В другом воплощении настоящего изобретения предложен способ получения D-молочной кислоты, включающий стадии (а) культивирования модифицированного штамма, продуцирующего D-молочную кислоту, до получения культурального бульона; и (б) извлечения D-молочной кислоты из культурального бульона.
Модифицированный штамм по настоящему изобретению, продуцирующий D-молочную кислоту, представляет собой штамм, полученный из штамма, продуцирующего L-молочную кислоту, имеющего превосходную продуктивность молочной кислоты, с целью создания штамма, продуцирующего D-молочную кислоту. Таким образом, когда культивируют модифицированный штамм, продуцирующий D-молочную кислоту, продуцированная D-молочная кислота может накапливаться в штамме или в культуральной среде. Следовательно, D-молочную кислоту можно получать путем извлечения D-молочной кислоты, которая накапливается в культивируемом штамме или в культуральной среде.
При использовании в данном описании изобретения термин «культивирование» обозначает все действия для выращивания микроорганизма в умеренно контролируемых искусственных условиях окружающей среды. В настоящем изобретении культивирование проводят для получения D-молочной кислоты от модифицированного штамма, продуцирующего D-молочную кислоту, и определенный способ культивирования, в частности, не ограничен, при условии что им можно получать D-молочную кислоту от модифицированного штамма, продуцирующего D-молочную кислоту. Культивирование можно проводить, используя любой способ, широко известный в данной области техники. Конкретно, его можно проводить посредством периодического процесса, периодического процесса с добавлением субстрата или непрерывного процесса.
Конкретно, среда, используемая для культивирования, должна отвечать требованиям конкретного штамма надлежащим образом при контролировании температуры, рН, и так далее, в аэробных условиях, в типичной среде, содержащей подходящий источник углерода, источник азота, аминокислоты, витамины и так далее. Возможные источники углерода могут включать смесь глюкозы и ксилозы в качестве главного источника углерода, сахара и углеводы, такие как сахароза, лактоза, фруктоза, мальтоза, крахмал и целлюлоза, масла и жиры, такие как масло соевых бобов, подсолнечное масло, касторовое масло и кокосовый жир, жирные кислоты, такие как пальмитиновая кислота, стеариновая кислота и линолевая кислота, спирты, такие как глицерин и этанол, и органические кислоты, такие как уксусная кислота. Эти вещества можно использовать в одиночку или в комбинации. Возможные источники азота могут включать неорганические источники азота, такие как аммиак, сульфат аммония, хлорид аммония, ацетат аммония, фосфат аммония, карбонат аммония и нитрат аммония; аминокислоты, такие как глутаминовая кислота, метионин и глутамин; и органические источники азота, такие как пептон, NZ-амин (экстракт казеина), мясной экстракт, дрожжевой экстракт, солодовый экстракт, жидкий кукурузный экстракт, гидролизаты казеина, рыба или продукты ее разложения и обезжиренный соевый жмых или продукты его разложения. Эти источники азота можно использовать в одиночку или в комбинации. Среда может включать дигидрофосфат калия, дикалия гидрофосфат или соответствующие натрийсодержащие соли в качестве источников фосфора. Возможные источники фосфора могут включать дигидрофосфат калия, дикалия гидрофосфат или соответствующие натрийсодержащие соли. Кроме того, можно использовать неорганические соединения, такие как хлорид натрия, хлорид кальция, хлорид железа, сульфат магния, сульфат железа, сульфат марганца и карбонат кальция. В дополнение к упомянутым выше веществам можно включать важнейшие ростовые вещества, такие как аминокислоты и витамины. В культуральные среды можно также добавлять подходящие предшественники. Вышеупомянутые вещества можно добавлять соответствующим образом к культуральным средам во время культивирования в периодическом режиме, в режиме с подачей субстрата или в непрерывном режиме, но, в частности, не ограничены этим. рН культуры можно регулировать путем добавления соответствующим образом основных соединений, таких как гидроксид натрия, гидроксид калия и аммиак, или кислых соединений, таких как фосфорная кислота и серная кислота.
Антивспениватель, такой как полигликолевые эфиры жирных кислот, можно применять для подавления развития пены. С целью сохранения аэробных условий в культуральный бульон вводят кислород или кислородсодержащий газ (например, воздух). Температура культурального бульона обычно составляет от 27 до 37°С, а именно от 30 до 35°С. Культивирование можно продолжать до достижения желаемого уровня получения D-молочной кислоты и обычно можно продолжать в течение от 10 до 100 часов. D-молочная кислота может высвобождаться в культуральную среду или может быть включена в клетки.
Кроме того, извлечение D-молочной кислоты из культурального бульона можно выполнять посредством способа, известного в данной области техники. Конкретно, известный способ извлечения D-молочной кислоты, в частности, не ограничен, при условии, что способом можно извлекать D-молочную кислоту в культуральном бульоне. Конкретно, можно использовать центрифугирование, фильтрацию, экстракцию, распыление, сушку, выпаривание, осаждение, кристаллизацию, электрофорез, фракционное растворение (например, осаждение сульфатом аммония и так далее) или хроматографию (например, ионообменную хроматографию, аффинную хроматографию, гидрофобную хроматографию и гельхроматографию и так далее).
Далее настоящее изобретение будет описано более подробно со ссылкой на примеры. Однако эти примеры предназначены только для иллюстративных целей, и подразумевают, что изобретение не ограничено этими примерами.
Пример 1. Анализ соотношения D- и L-молочных кислот штамма дикого типа Lactobacillus sp. при ферментации
Каждый из 10 типов штаммов дикого типа, продуцирующих молочную кислоту, инокулировали в 50 мл среды GY (5% декстрозы, 1% дрожжевого экстракта, 0,05% цитрата натрия, 3% СаСО3, 0,02% MgSO4, 0,001% MnSO4, 0,001% FeSO4 и 0,001% NaCl) и затем культивировали в анаэробных условиях при 37°С в течение 40 часов с последующим анализом ВЭЖХ (высокоэффективная жидкостная хроматография) на соотношение D-молочной кислоты и L-молочной кислоты в ферментативном бульоне (ФИГ. 1). На ФИГ. 1 показан график, представляющий результаты анализа соотношения D-молочной кислоты и L-молочной кислоты, которые были продуцированы 10 типами штаммов дикого типа, продуцирующими молочную кислоту.
Lactobacillus paracasei, Lactobacillus casei и Lactobacillus rhamnosus, демонстрирующие высокую производительность молочной кислоты и значительно большее соотношение L-молочных кислот, выбрали из 10 типов штаммов. Выбранные штаммы модифицировали для продуцирования D-молочной кислоты.
Пример 2. Сравнение нуклеотидных последовательностей L-лактатдегидрогеназы (L-LDH)
Для делеции гена, индуцирующего сверхпродукцию L-молочной кислоты в каждом из штаммов, выбранных в Примере 1, гомологию между L-LDH-кодирующими генами выбранных штаммов сравнивали и анализировали посредством поиска US National Center for Biotechnology Information (NCBI) (www.ncbi.nlm.nih.gov//www.ncbi.nlm.nih.gov) (Таблица 1).
Как показано в Таблице 1, L-LDH-кодирующие гены 3 типов штаммов, продуцирующих молочную кислоту, имеют очень похожие друг на друга нуклеотидные последовательности, и, в частности, ldh1 Lactobacillus casei известен как важный ген продуцирования L-молочной кислоты (J. Ind. Microbiotechnol., 2008, 35:579-586). Между тем ldh2 Lactobacillus casei представляет собой другой ген продуцирования L-молочной кислоты. Гены ldh1 и ldh2 делетировали для получения штамма, продуцирующего оптически чистую D-молочную кислоту. Таким образом, из всех 3 типов родительских штаммов, в качестве генов для делеции были выбраны гены ldh и ldh1 Lactobacillus paracasei, гены ldh1 и ldh2 Lactobacillus casei и 2 типа генов ldh Lactobacillus rhamnosus.
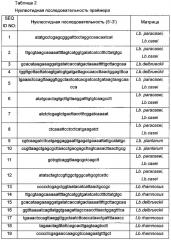
Пример 3. Конструирование векторов L-LDH-делеции/D-LDH-вставки
Получали векторы для делеции генов L-LDH Lactobacillus paracasei, Lactobacillus casei и Lactobacillus rhamnosus, которые были выбраны в Примере 2. С целью получения кассеты для делеции L-LDH и вставки D-LDH в одно и то же время, последовательности, расположенные рядом с открытой рамкой считывания (ORF) ldh и ldh1 Lactobacillus paracasei, ldh1 и ldh2 Lactobacillus casei и LGG02523 и LGG00606 Lactobacillus rhamnosus, использовали в качестве гомологичной нуклеотидной последовательности и получали праймеры SEQ ID NO: 1-24 (Таблица 2).
Последовательность из 700 пар основании в 5' области (ldh.pc_UP_700) и последовательность из 700 пар оснований в 3' области (ldh.pc_DOWN_700) ORF гена ldh амплифицировали, используя геном Lactobacillus paracasei в качестве матрицы и праймеры SEQ ID NO: 1 и 2, и праймеры SEQ ID NO: 5 и 6. Последовательность из 700 пар оснований в 5' области (ldh1.pc_UP_700) и последовательность из 700 пар оснований в 3' области (ldh1.pc_DOWN_700) ORF гена ldh1 также амплифицировали, используя праймеры SEQ ID NO: 7 и 8 и праймеры SEQ ID NO: 11 и 12.
Между тем для амплификации гена D-LDH получали фрагменты ДНК ldhA(Lb. db) и ldhD(Lb. pl), используя геномы Lactobacillus delbrueckii и Lactobacillus plantarum в качестве матрицы и праймеры SEQ ID NO: 3 и 4 и праймеры SEQ ID NO: 9 и 10.
Затем проводили ПЦР (полимеразная цепная реакция) с перекрывающимися праймерами, используя амплифицированные фрагменты ДНК, ldh.pc_UP_700, ldh.pc_DOWN_700 и ldhA(Lb. db), и праймеры SEQ ID NO: 1 и 6, чтобы получить кассету δldh.pc-ldhA(Lb. db). Кассета δldh.pc-ldhA(Lb. db) имеет нуклеотидную последовательность, гомологичную последовательностям, расположенным рядом с областью ORF ldh, и в середине кассеты располагали D-лактатдегидрогеназу. Далее ген ldh1 подвергали таким же процедурам для получения кассеты 6ldh1.pc-ldhD(Lb. pl). В связи с этим каждую кассету конструировали так, чтобы она содержала сайт рестрикции фермента XnoI на 5-конце и сайт рестрикции фермента Spel на 3'-конце.
Так как гены ldh1 и ldh2 Lactobacillus casei были очень схожи с генами ldh и ldh1 Lactobacillus paracasei, соответственно, использовали те же самые праймеры. Амплифицировали ldh1.ca_UP_700 и последовательность из 700 пар оснований в 3' области (ldh1.ca_DOWN_700), используя геном Lactobacillus casei в качестве матрицы и праймеры SEQ ID NO: 1 и 2 и праймеры SEQ ID NO: 5 и 6. Последовательность из 700 пар оснований в 5' области (ldh2.ca_UP_700) и последовательность из 700 пар оснований в 3' области (ldh2.ca_DOWN_700) ORF гена ldh2 также амплифицировали, используя праймеры SEQ ID NO: 7 и 8 и праймеры SEQ ID NO: 11 и 12.
Затем проводили ПЦР с перекрывающимися праймерами, используя ldh1.ca_UP_700, ldh1.ca_DOWN_700, ldhA(Lb. db) и праймеры SEQ ID NO: 1 и 6, чтобы получить кассету δldh1.ca-ldhA(Lb. db). Кассета δldh1.ca-ldhA(Lb. db) имеет нуклеотидную последовательность, гомологичную последовательностям, расположенным рядом с областью ORF ldh1, ив середине кассеты располагали D-лактатдегидрогеназу. Далее, ген ldh2 подвергали так