Антитела и иммуноконъюгаты и их применения
Иллюстрации
Показать всеИзобретение относится к области иммунологии. Предложено гуманизированное антитело, специфичное к STEAP-1, и его антигенсвязывающий фрагмент. Описаны: полинуклеотид, кодирующий антитело или его антигенсвязывающий фрагмент, вектор, клетка-хозяин, способ получения анти-STEAP-1-антитела. Также раскрыты: способ визуализации опухоли, фармацевтическая композиция, лекарственное средство для лечения клеточно-пролиферативного нарушения, иммуноконъюгаты и цистеин-встроенное антитело на основе указанного антитела. Данное изобретение обеспечивает новые антитела к STEAP-1 и может найти применение в медицине. 14 н. и 16 з.п. ф-лы, 29 ил., 2 табл., 9 пр.
Реферат
Область техники, к которой относится изобретение
Данное изобретение относится к анти-STEAP-1-антителам и их конъюгатам. Кроме того, изобретение относится к способам применения анти-STEAP-1-антител и их конъюгатов.
Уровень техники
У человека рак предстательной железы является одной из наиболее часто диагностируемых злокачественных опухолей у мужчин и является второй основной причиной рака, вызывающего смерть у мужчин. Американская ассоциация рака оценила, что в течение 2000 года будет диагностировано 180400 новых случаев рака предстательной железы, с 31900 смертными исходами от этого заболевания. На поздних стадиях, рак предстательной железы метастазирует в кость. Несмотря на достигнутые успехи в ранней диагностике и лечении локально ограниченных опухолей, рак предстательной железы после метастазирования является неизлечимым. У пациентов с метастазирующим раком предстательной железы при гормональной терапии будет в конечном счете развиваться не поддающееся лечению андрогеном (андроген-независимое) состояние, которое будет приводить к прогрессированию и смерти. В настоящее время простатический антиген (антиген предстательной железы) (PSA) является наиболее широко используемым опухолевым маркером для скрининга, диагностики и мониторинга рака предстательной железы. Однако широко распространенное применение PSA в качестве инструмента для скрининга является дискуссионным, так как PSA не дает возможности точно отличить доброкачественное заболевание предстательной железы от злокачественного.
В зависимости от стадии, лечение рака предстательной железы и мочевого пузыря включает в себя одно из следующих терапевтических воздействий или их комбинацию: хирургии для удаления раковой ткани, лучевой терапии, химиотерапии, депривации андрогена (например, гормональной терапии) в случае рака предстательной железы. Хотя хирургия или лучевая терапия существенно улучшают выживаемость пациентов с ранними стадиями этого заболевания, терапевтические возможности ограничены для запущенных случаев, в частности, для рецидивов опухолей после гормонального удаления. У большинства пациентов, которые подвергаются гормональной терапии, прогрессирует развитие андроген-независимого заболевания. В настоящее время нет эффективного лечения для 20-40% пациентов с раком предстательной железы, у которых развивается рецидивирующее заболевание после хирургии или лучевой терапии, или для пациентов, у которых обнаружены метастазы в момент установления диагноза. Химиотерапия имеет токсичные побочные действия, особенно у пожилых пациентов. Развитие новых форм терапии, особенно для заболевания, не поддающегося лечению депривацией андрогена, крайне необходимо для лечения рака предстательной железы.
Был идентифицирован новый антиген клеточной поверхности, STEAP-1 (см. патент США № 6329503). STEAP-1 является членом семейства поверхностных серпентиноподобных трансмембранных антигенов. Он экспрессируется преимущественно при раке предстательной железы, и, следовательно, члены этого семейства были названы “STEAP-1” (Шестидоменные Трансмембранные Эпителиальные Антигены Простаты). Белки STEAP человека обнаруживают высокую степень структурной консервативности в этом семействе, но не обнаруживают существенной структурной гомологии с каким бы то ни было из известных белков человека. По-видимому, STEAP-1 является мембранным белком типа IIIa, экспрессируемым преимущественно в клетках предстательной железы в тканях здорового человека. Структурно STEAP-1 является состоящим из 339 аминокислот белком, характеризующимся молекулярной топологией из шести трансмембранных доменов и внутриклеточных N- и С-концов, что позволяет предположить, что он уложен «серпентиноподобным» образом в три внеклеточные и две внутриклеточные петли. Экспрессия белка STEAP-1 поддерживается на высоком уровне при различных состояниях рака предстательной железы. STEAP-1 сверхэкспрессируется в высокой степени и при других типах рака у человека, таких как рак легкого и ободочной кишки. Были индуцированы мышиные антитела к фрагментам STEAP-1 человека, и было показано, что эти антитела связывают STEAP-1 на клеточной поверхности (см. патент США № 20040253232А1).
Терапия на основе антител оказалась очень эффективной в лечении различных типов рака. Например, HERCEPTIN® и RITUXAN® (оба из Genentech, S. San Francisco) успешно использовались для лечения рака молочной железы и не-ходжкинской лимфомы, соответственно. HERCEPTIN® является гуманизированным моноклональным антителом, полученным из рекомбинантной ДНК, и это антитело селективно связывается с внеклеточным доменом протоонкогена рецептора 2 эпидермального фактора роста (HER2) человека. Сверхэкспрессия HER2 наблюдается в 25-30% первичных раковых опухолей молочной железы. RITUXAN® является генетически сконструированным моноклональным химерным мышь/человек антителом, направленным против антигена CD20, обнаруживаемого на поверхности нормальных и злокачественных В-лимфоцитов. Оба эти антитела продуцируются в клетках СНО.
Применение конъюгатов антитело-лекарственное средство для локальной доставки цитотоксических и цитостатических агентов, т.е. лекарственных средств для уничтожения или ингибирования опухолевых клеток, в лечении рака (Syrigos and Epenetos (1999) Anticancer Research 19:605-614; Niculescu-Duvaz and Springer (1997) Adv. Drg Del. Rev. 26:151-172; Патент США 4975278) дает возможность нацеленной доставки лекарственной части молекулы в опухоль и внутриклеточного накопления в ней, когда системное введение этих неконъюгированных лекарственных агентов может приводить к неприемлемым уровням токсичности в отношении нормальных клеток, а также клеток опухоли, которые должны быть элиминированы (Baldwin et al., (1986) Lancet pp. (Mar. 15, 1986):603-05; Thrope, (1985) “Antinody Carriers Of Cytotoxic Agents In Cancer Therapy: A Rewiew,” in Monoclonal Antibodies ’84: Biological And Clinical Applications, A. Pinchera et al., (eds), pp. 475-506). Посредством этого добиваются максимальной эффективности с минимальной токсичностью. Сообщалось, что как поликлональные, так и моноклональные антитела применимы в этих стратегиях (Rowland et al., (1986) Cancer Immunol. Immunother., 21:183-87). Лекарственные средства, используемые в этих способах, включают в себя даунорубицин, доксорубицин, метотрексат и виндесин (Rowland et al., Cancer Immunol. Immunother., 21:183-87 (1986)). Токсины, используемые в конъюгатах антитело-токсин, включают в себя бактериальные токсины, такие как дифтерийный токсин, токсины растений, такие как рицин, токсины с малыми молекулами, такие как гелданамицин (Kerr et al. (1997) Bioconjugate Chem. 8(6):781-784; Mandler et al. (2000) Journal of the Nat. Cancer Inst. 92(19): 1573-1581; Mandler et al. (2000) Bioorganic & Med. Chem. Letters 10:1025-1028; Mandler et al. (2000) Bioconjugate Chem. 13:786-791), майтансиноиды (ЕР 1391213; Liu et al., (1996) Proc. Natl. Acad. Sci. USA 93:8618-8623) и калихеамицин (Lode et al. (1998) Cancer Res. 58:2928; Hinman et al. (19933) Cancer Res. 53:3336-3342). Эти токсины могут выполнять их цитотоксическое и цитостатическое действия с использованием механизмов, включающих в себя связывание тубулина, связывание ДНК или ингибирование топоизомеразы (Meyer, D.L. and Senter, P.D. “Recent Advances in Antibody Drug Conjugates for Cancer Therapy” in Annual Reports in Medicnal Chemistry, Vol 38 (2003) Chapter 23, 229-237). Некоторые терапевтические лекарственные средства имеют тенденцию быть неактивными или менее активными при конъюгации с большими антителами или лигандами рецепторов белков.
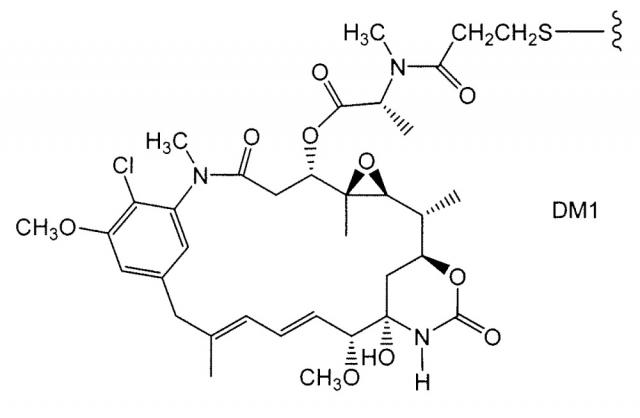
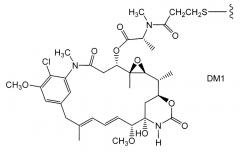
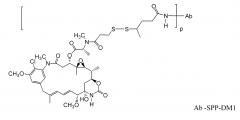
ZEVALIN® (ибритумомаб тиуксетан, Biogen/Idec) является конъюгатом антитело-радиоизотоп, состоящим из мышиного IgG1 каппа моноклонального антитела, направленного против антигена CD20, обнаруживаемого на поверхности нормальных и злокачественных В-лимфоцитов, и радиоизотопа 111In или 90Y, связанного линкером-хелатором тиомочевиной (Wiseman et al (2000) Eur. Jour. Nucl. Med. 27(7):766-77; Wiseman et al (2002) Blood 99(12):4336-42; Witzig et al (2002) J. Clin. Oncol. 20(10):2453-63; Witzig et al (2002) J. Clin. Oncol. 20(15):3262-69). Хотя ZEVALIN имеет активность против В-клеточной не-ходжкинской лимфомы (NHL), введение приводит к тяжелым и пролонгированным цитопениям у большинства пациентов. MYLOTARG™ (гемтуцумаб озогамицин, Wyeth Pharmaceuticals), конъюгат антитело-лекарственное средство, состоящее из huCD33-антитела, связанного с калихеамицином, был одобрен в 2000 году для лечения острого миелоидного лейкоза посредством инъекции (Drugs of the Future (2000) 25(7):686; Патенты США с номерами 4970198; 5079233; 5585089; 5606040; 5693762; 5739116; 5767285; 5773001). Кантуцумаб мертансин (Immunogen, Inc.), конъюгат антитело-лекарственное средство, состоящий из антитела huC242, связанного через дисульфидный линкер SPP с частью майтансиноидного лекарственного средства, DM1, разрабатывается для лечения типов рака, которые экспрессируют антиген CanAg, таких как рак ободочной кишки, рак поджелудочной железы, рак желудка и другие. MLN-2704 (Millennium Pharm., BZL Biologies, Immunogen Inc.), конъюгат антитело-лекарственное средство, состоящий из моноклонального антитела против специфического мембранного антигена (PSMA), связанного с частью майтансиноидного лекарственного средства, DM1, разрабатывается для потенциального лечения опухолей предстательной железы. Ту же самую часть майтансиноидного лекарственного средства, DM1, связывали через не-дисульфидный линкер, SMCC, с мышиным моноклональным антителом, TA.1 (Chari et al. (1992) Cancer Research 52: 127-131). Сообщалось, что этот конъюгат был в 200 раз более сильным, чем соответствующий конъюгат с дисульфидным линкером. Авторы этой ссылки считали, что линкер SMCC является “нерасщепляемым”.
Несколько коротких пептидных соединений были выделены из морского моллюска, Dolabella auricularia, и было обнаружено, что они имеют биологическую активность (Pettit et al (1993) Tetrahedron 49:9151; Nakamura et al (1995) Tetrahedron Letters 36:5059-5062; Sone et al (1995) Journal Org Chem. 60:4474). Были также получены аналоги этих соединений, и было обнаружено, что некоторые из них имеют биологическую активность (см. обзор Pettit et al (1998) Anti-Cancer Drug Design 13:243-277). Например, ауристатин E (US 5635483) является синтетическим аналогом морского природного продукта Доластатина 10, агента, который ингибирует полимеризацию тубулина связыванием с тем же сайтом на тубулине, что и противораковое лекарственное средство винкристин (G. R. Pettit, (1997) Prog. Chem. Org. Nat. Prod. 70: 1-79). Доластатин 10, ауристатин PE и ауристатин E являются линейными пептидами, имеющими 4 аминокислоты, три из которых являются уникальными для класса соединений доластатина, и С-концевой амид.
Эти ауристатиновые пептиды, ауристатин E (AE) и монометилауристатин (MMAE), синтетические аналоги доластатина, конъюгировали: (i) с химерными моноклональными антителами cBR96 (специфичными в отношении Lewis Y на карциномах); (ii) с cAC10, которые специфичны в отношении CD30 при гематологических злокачественных заболеваниях (Klussman, et al (2004), Bioconjugate Chemistry 15(4):765-773; Doronina et al (2003) Nature Biotechnology 21 (7):778-784; "Monomethylvaline Compounds Capable of Conjugation to Ligands"; Francisco et al (2003) Blood 102(4):1458- 1465; US 2004/0018194; (iii) анти-CD20-антителами, такими как RITUXAN® (ритуксимаб) (WO 04/032828), для лечения CD20-экспрессирующих раковых заболеваний и иммунных нарушений; (iv) анти-EphB2-антителами 2H9 и анти-IL-8-антителами для лечения колоректального рака (Mao, et al (2004) Cancer Research 64(3):781-788); (v) E-селектин-антителом (Bhaskar et al (2003) Cancer Res. 63:6387-6394); и (vi) другими анти-CD30-антителами (WO 03/043583). Монометилауристатин (MMAE) был также конъюгирован с 2H9, антителом против EphB2R, являющимся рецептором тирозинкиназы типа 1 TM с близкой гомологией между мышью и человеком и сверхэкспрессируется в клетках колоректального рака (Mao et al (2004) Cancer Res. 64:781-788).
Сообщалось, что монометилауристатин MMAF, вариант ауристатина E (MMAE) с фенилаланином на С-конце (US 5767237; US 6124431), является менее эффективным, чем MMAE, но более эффективным при конъюгации с моноклональными антителами (Senter et al, Proceedings of the American Association for Cancer Research, Volume 45, Abstract Number 623, presented March 28, 2004). Ауристатин F фенилендиамин (AFP); вариант с фенилаланином MMAE связывали с анти-CD70-mAb, 1F6, через С-конец посредством фенилендиаминового спейсера (Law et al, Proceedings of the American Association for Cancer Research, Volume 45, Abstract Number 625, presented March 28, 2004).
В данной области существует потребность в дополнительных лекарственных средствах для лечения различных типов рака, таких как раковые опухоли и метастазы раковых опухолей в предстательной железе, легком и ободочной кишке. Особенно полезные лекарственные средства для этой цели включают в себя нацеленные на клетки предстательной железы, легкого или ободочной кишки конъюгаты анти-STEAP-1-антитело-лекарственное средство, имеющие более низкую токсичность, но все еще полезную терапевтическую эффективность. Данное изобретение нацелено на эти и другие ограничения и проблемы, имеющиеся в прошлом.
Цитирование любой ссылки в этой заявке не является признанием того, что эта ссылка является прототипом этой заявки. Все цитированные здесь ссылки, в том числе патенты, заявки на патенты и публикации включены в качестве ссылки в их полном виде.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Это изобретение обеспечивает анти-STEAP-1-антитела и способы их применения.
В одном аспекте, обеспечено антитело, которое связывается с STEAP-1, причем это антитело содержит вариабельный домен легкой цепи, содержащий аминокислотную последовательность, показанную на фигуре 2А (SEQ ID NO:6), или вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность, показанную на фигуре 2В (SEQ ID NO:9). В одном аспекте, обеспечено антитело, которое связывается с STEAP-1, причем это антитело содержит вариабельный домен легкой цепи, содержащий аминокислотную последовательность, показанную на фигуре 2А (SEQ ID NO:6), и вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность, показанную на фигуре 2В (SEQ ID NO:9).
В одном аспекте, обеспечено антитело, которое связывается с STEAP-1, причем это антитело содержит вариабельный домен тяжелой цепи, имеющий по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности с аминокислотной последовательностью SEQ ID NO:9 или 10. В одном варианте осуществления, это антитело содержит каркасную область 1 вариабельного домена тяжелой цепи SEQ ID NO:9 или 10. В одном варианте осуществления, это антитело содержит каркасную область 1 вариабельного района тяжелой цепи SEQ ID NO:25 или каркасную область 2 вариабельного района тяжелой цепи SEQ ID NO:75 или 76 или 77 или каркасную область 3 вариабельного района тяжелой цепи SEQ ID NO:78 или 79.
В одном аспекте, это антитело содержит вариабельный домен легкой цепи, имеющий по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности с аминокислотной последовательностью SEQ ID NO:6. В одном варианте осуществления, это антитело содержит вариабельный домен легкой цепи SEQ ID NO:6.
В одном аспекте, обеспечено антитело, которое связывается с STEAP-1, причем это антитело содержит вариабельный домен тяжелой цепи, имеющий по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности с аминокислотной последовательностью SEQ ID NO:9 или 10. В одном варианте осуществления, это антитело содержит каркасную область 1 вариабельного домена тяжелой цепи SEQ ID NO:9 или 10. В одном варианте осуществления, это антитело содержит каркасную область 1 вариабельного района тяжелой цепи SEQ ID NO:25 или каркасную область 2 вариабельного района тяжелой цепи SEQ ID NO:75 или 76 или 77 или каркасную область 3 вариабельного района тяжелой цепи SEQ ID NO:78 или 79. В одном варианте осуществления, это антитело дополнительно содержит вариабельный домен легкой цепи, имеющий по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности с аминокислотной последовательностью SEQ ID NO:6. В одном варианте осуществления, это антитело содержит вариабельный домен легкой цепи SEQ ID NO:6.
В некоторых вариантах осуществления, обеспечен полинуклеотид, кодирующий любое из вышеуказанных антител. В одном варианте осуществления, обеспечен вектор, содержащий этот полинуклеотид. В одном варианте осуществления, обеспечена клетка-хозяин, содержащая этот вектор. В одном варианте осуществления, эта клетка-хозяин является эукариотической. В одном варианте осуществления, этой клеткой-хозяином является клетка яичника китайского хомячка (СНО). В одном варианте осуществления, обеспечен способ получения анти-STEAP-1-антитела, причем этот способ предусматривает культивирование клетки-хозяина при условиях, подходящих для экспрессии полинуклеотида, кодирующего это антитело, и выделение этого антитела.
В одном аспекте, обеспечено антитело, которое связывается с STEAP-1, экспрессируемым на поверхности клетки. В одном варианте осуществления, это антитело связывается с эпитопом в районе STEAP-1 человека или мыши. В одном варианте осуществления, эта клетка является клеткой млекопитающего. В одном варианте осуществления, эта клетка является клеткой человека. В одном варианте осуществления, эта клетка является раковой клеткой. В одном варианте осуществления, эта клетка является клеткой предстательной железы, легкого или ободочной кишки. В одном варианте осуществления, эта раковая клетка является клеткой рака предстательной железы. В другом варианте осуществления, эта клетка является клеткой из метастаза первичного рака предстательной железы, легкого или ободочной кишки.
В некоторых вариантах осуществления, любое из вышеуказанных антител является моноклональным антителом. В одном варианте осуществления, это антитело является фрагментом антитела, выбранным из фрагментов Fab, Fab’-SH, Fv, scFv или (Fab’)2. В одном варианте осуществления, это антитело является гуманизированным. В одном варианте осуществления, это антитело является антителом человека.
В одном аспекте, обеспечен способ детектирования присутствия STEAP-1 в биологической пробе, причем этот способ предусматривает контактирование биологической пробы с любым из вышеуказанных антител при условиях, пермиссивных для связывания этого антитела с STEAP-1, и детектирование, образуется ли комплекс между этим антителом и STEAP-1. В одном варианте осуществления, эта биологическая проба является пробой из млекопитающего, испытывающего или предположительно испытывающего нарушение клеток предстательной железы и/или клеточно-пролиферативное нарушение клеток или тканей, включающее в себя рак предстательной железы, легкого, ободочной кишки, мочевого пузыря и яичника и саркому Юинга, а также метастазы первичного рака предстательной железы, легкого, ободочной кишки, мочевого пузыря и яичника и саркомы Юинга. См., например, патент США No. 6329503; и Rodeberg, D.A. et al., Clin. Cancer Res. 11(12):4545-4552 (2005).
В одном аспекте, обеспечен способ диагностики клеточно-пролиферативного нарушения, ассоциированного с увеличенной экспрессией STEAP-1, предусматривающий контактирование тест-клетки с любым из вышеуказанных антител; определение уровня экспрессии STEAP-1 детектированием связывания этого антитела с STEAP-1 и сравнение уровня экспрессии STEAP-1 этой тест-клеткой с уровнем экспрессии STEAP-1 контрольной клеткой, причем более высокий уровень экспрессии STEAP-1 тест-клеткой в сравнении с контрольной клеткой указывает на присутствие клеточно-пролиферативного нарушения, ассоциированного с увеличенной экспрессией STEAP-1. В одном варианте осуществления, этой тест-клеткой является клетка из пациента, предположительно имеющего клеточно-пролиферативное нарушение, такое как пролиферативное нарушение предстательной железы. В одном варианте осуществления, этот способ предусматривает определение уровня экспрессии STEAP-1 на поверхности тест-клетки (такой как, например, раковая клетка предстательной железы) и сравнение уровня экспрессии STEAP-1 на поверхности тест-клетки с уровнем экспрессии STEAP-1 на поверхности контрольной клетки (такой как, например, нормальная клетка предстательной железы, другая, чем ненормально пролиферирующая клетка предстательной железы).
В одном аспекте, обеспечен способ диагностики клеточно-пролиферативного нарушения, ассоциированного с увеличением клеток, таких как клетки предстательной железы, экспрессирующие STEAP-1, предусматривающий контактирование тест-клеток в биологической пробе с любым из вышеуказанных антител; определение уровня антитела, связанного в тест-клетками в пробе, детектированием связывания этого антитела с STEAP-1 и сравнения этого уровня антитела, связанного с клетками в контрольной пробе, причем этот уровень связанного антитела нормализуют относительно количества STEAP-1-экспрессирующих клеток в тест-пробе и контрольной пробе, причем более высокий уровень связанного антитела в тест-пробе в сравнении с контрольной пробой указывает на присутствие клеточно-пролиферативного нарушения, ассоциированного с клетками, экспрессирующими STEAP-1.
В одном аспекте, обеспечен способ детектирования растворимого STEAP-1 в крови или сыворотке, предусматривающий контактирование тест-пробы крови или сыворотки из млекопитающего, предположительно испытывающего клеточно-пролиферативное нарушение предстательной железы, с анти-STEAP-1-антителом согласно изобретению и детектирование увеличения растворимого STEAP-1 в тест-пробе относительно контрольной пробы крови или сыворотки из здорового млекопитающего. В одном варианте осуществления, этот способ детектирования применим в качестве способа диагностики клеточно-пролиферативного нарушения предстательной железы, ассоциированного с увеличением растворимого STEAP-1 в крови или сыворотке млекопитающего.
В одном аспекте, антитела согласно изобретению включают в себя цистеин-встроенные антитела, где одна или несколько аминокислот исходного антитела заменены свободной аминокислотой цистеином, как описано в WO2006/034488 (включенном здесь в качестве ссылки в полном виде). Цистеин-встроенное антитело содержит одну или несколько аминокислот в виде свободного цистеина, имеющего величину реакционной способности (реактивности) тиола в диапазоне 0,6–1,0. Аминокислота свободный цистеин является остатком цистеина, который был встроен в исходное антитело и не является частью дисульфидного мостика. Цистеин-встроенные антитела применимы для присоединения цитотоксических и/или визуализирующих соединений в сайте встроенного цистеина, например, через малеимид или галогенацетил. Нуклеофильная реакционная способность (реактивность) тиоловой группы остатка цистеина с малеимидной группой является приблизительно в 1000 раз более высокой в сравнении с группой любой другой аминокислоты в белке, такой как аминогруппа остатков лизина или N-концевая аминогруппа. Тиол-специфическая функциональная группа в иодацетильных реагентах и малеимидных реагентах может взаимодействовать с аминными группами, но требуются более высокий рН (>9,0) и более продолжительные периоды времени реакции (Garman, 1997, Non-Radioactive Labelling: A Practical Approach, Academic Press, London).
Цистеин-встроенные антитела могут быть применимы в лечении рака и включают в себя антитела, специфичные в отношении поверхностных и трансмембранных рецепторов и опухоль-ассоциированных антигенов (ТАА). Такие антитела могут быть использованы в виде «голых» антител (не конъюгированных с лекарственным средством или меткой) или в виде конъюгатов антитело-лекарственное средство (ADC). Цистеин-встроенные антитела согласно изобретению могут быть сайт-специфическими и эффективно связанными с тиол-реактивным реагентом. Этим тиол-реактивным реагентом может быть мультифункциональный линкерный реагент, захватывающий меченый реагент, содержащий флуорофор реагент или промежуточный продукт лекарственное средство-линкер. Это цистеин-встроенное антитело может быть помечено детектируемой меткой, иммобилизовано на твердофазном носителе и/или конъюгировано с лекарственным средством. Реакционная способность тиола может быть придана любому антителу, где замена аминокислот реакционноспособными аминокислотами (цистеинами) может быть получена в диапазонах в легкой цепи, выбранных из диапазонов аминокислот: L-10-L-20; L-38-L-48; L-105-L-115; L-139-L-149; L-163-L-173; и в диапазонах в тяжелой цепи, выбранных из диапазонов аминокислот: H-35-H-45; H-83-H-93; H-114-H-127 и H-170-H-184, и в Fc-районе в диапазонах, выбранных из H-268-H-291; H-319-H-344; H-370-H-380 и H-395-H-405, где нумерация положений аминокислот начинается от положения 1 системы нумерации Кабата (Kabat et al. (1991) Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD) и продолжается последовательно после этого, как описано в WO 2006/034488. Реакционная способность тиола может быть также придана определенным доменам антитела, таким как константный домен легкой цепи (CL) и константные домены тяжелой цепи, CH1, CH2 и CH3. Цистеиновые замены, приводящие к величинам реакционной способности тиола 0,6 и более, могут быть получены в константных доменах тяжелой цепи α, δ, ε, γ и μ интактных антител: IgA, IgD, IgE, IgG и IgM, соответственно, в том числе в подклассах IgG: IgG1, IgG2, IgG3, IgG4, IgA и IgA2. Такие антитела и их применения описаны в WO 2006/034488.
Цистеин-встроенные антитела согласно изобретению предпочтительно сохраняют антигенсвязывающую способность их копий дикого типа, исходных антител. Таким образом, цистеин-встроенные антитела способны связываться, предпочтительно специфически, с антигенами. Такие антигены включают в себя, например, опухоль-ассоциированные антигены (ТАА), поверхностные рецепторные белки и другие поверхностные молекулы клеток, трансмембранные белки, белки передачи сигналов, регуляторные факторы выживания клеток, регуляторные факторы пролиферации клеток, молекулы, ассоциированные с развитием или дифференцировкой ткани (например, молекулы, о которых известно или предполагается, что они способствуют функционально развитию или дифференцировке ткани), лимфокины, цитокины, молекулы, участвующие в регуляции клеточного цикла, молекулы, участвующие в образовании и развитии сосудов, и молекулы, ассоциированные с ангиогенезом (например, молекулы, о которых известно или предполагается, что они способствуют функционально ангиогенезу).
Антитело согласно изобретению может быть конъюгировано с другими тиол-реактивными агентами, в которых реактивной группой является, например, малеимид, иодацетамид, пиридилдисульфид или другой тиол-реактивный партнер конъюгации (Haugland, 2003, Molecular Probes Handbook of Fluorescent Probes and Research Chemicals, Molecular Probes, Inc.; Brinkley, 1992, Bioconjugate Chem. 3:2; Garman, 1997, Non-Radioactive Labelling: A Practical Approach, Academic Press, London; Means (1990) Bioconjugate Chem. 1:2; Hermanson, G. in Bioconjugate Techniques (1996) Academic Press, San Diego, pp. 40-55, 643-671). Этим партнером может быть цитотоксический агент (например, токсин, такой как доксорубицин или коклюшный токсин), флуорофор, такой как флуоресцентный краситель, такой как флуоресцеин или родамин, хелатобразующий агент для визуализации или радиотерапевтического металла, пептидильная или непептидильная метка или метка детектирования или модифицирующий клиренс агент, такой как различные изомеры полиэтиленгликоля, пептид, который связывается с третьим компонентом, или другой углеводный или липофильный агент.
В одном аспекте, антитела согласно изобретению могут быть конъюгированы с любым фрагментом, который может быть ковалентно присоединен к антителу через реактивный фрагмент, активированный фрагмент или реакционноспособную тиоловую группу цистеина. (Singh et al (2002) Anal. Biochem. 304: 147-15; Harlow E. and Lane, D. (1999) Using Antibodies: A Laboratory Manual, Cold Springs Harbor Laboratory Press, Cold Spring Harbor, NY; Lundblad R.L. (1991) Chemical Reagents for Protein Modification, 2nd ed. CRC Press, Boca Raton, FL). Эта присоединенная метка может функционировать для: (i) обеспечения детектируемого сигнала; (ii) взаимодействия со второй меткой для модификации детектируемого сигнала, обеспечиваемого первой или второй меткой, например, для образования FRET (передачи энергии резонанса флуоресценции); (iii) стабилизации взаимодействий или увеличения аффинности связывания, с антигеном или лигандом; (iv) влияния на подвижность, например, электрофоретическую подвижность или проникаемость в клетку, посредством заряда, гидрофобности, формы или других физических параметров, или (v) обеспечения захватывающей части, для модуляции аффинности лигандов, связывания антитело/антиген, или комплексообразования ионов.
Меченые цистеин-встроенные антитела могут быть применимы в диагностических анализах, например, для детектирования экспрессии представляющего интерес антигена в конкретных клетках, тканях или сыворотке. Для диагностических применений, это антитело обычно метят детектируемой частью молекулы. Доступны многочисленные метки, которые могут быть обычно сгруппированы в следующие категории.
Радиоизотопы (радионуклиды), такие как 3H, 11C, 14C, 18F, 32P, 35S, 64Cu, 68Ga, 86Y, 99Tc, 111In, 123I, 124I, 125I, 131I, 133Xe, 177Lu, 211At или 213Bi. Меченные радиоизотопом антитела применимы в экспериментах визуализации с нацеливанием с использованием рецептора. Это антитело может быть помечено реагентами-лигандами, которые связывают, хелатируют или иным образом образуют комплекс с радиоизотопным металлом, где этот реагент является реактивным с тиолом встроенного цистеина, с использованием способов, описанных в Current Protocols in Immunology, Volumes 1 and 2, Coligen et al, Ed. Wiley- Interscience, New York, NY, Pubs. (1991). Хелатобразующие лиганды, которые могут образовывать комплекс с ионом металла, включают в себя DOTA, DOTP, DOTMA, DTPA и TETA (Macrocyclics, Dallas, TX). Радионуклиды могут быть нацелены посредством комплексообразования с конъюгатами антитело-лекарственное средство согласно изобретению (Wu et al (2005) Nature Biotechnology 23(9): 1 137-1 146).
Линкерные реагенты, такие как DOTA-малеимид (4-малеимидобутирамидобензил-DOTA), могут быть получены реакцией аминобензил-DOTA с 4-малеимидомасляной кислотой (Fluka), активированной изопропилхлорформиатом (Aldrich), согласно процедуре Axworthy et al (2000) Proc. Natl. Acad. Sci. USA 97(4): 1802-1807). Реагенты DOTA-малеимид взаимодействуют с аминокислотными остатками свободного цистеина цистеин-встроенных антител и обеспечивают комплексообразующий металл лиганд на этом антителе (Lewis et al (1998) Bioconj. Chem. 9:72-86). Хелатобразующие линкерные метящие реагенты, такие как DOTA-NHS (моно-(N-гидроксисукцинимидный эфир 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусной кислоты) коммерчески доступны (Macrocyclics, Dallas, TX). Визуализация с использованием рецептора-мишени с меченными радионуклидом антителами может обеспечивать маркер активации пути посредством детектирования и количественного определения прогрессивного накапливания антител в ткани опухоли (Albert et al (1998) Bioorg. Med. Chem. Lett. 8: 1207-1210). Эти конъюгированные радиоизотоп-металлы могут оставаться внутриклеточными после деградации лизосомами.
Комплексы хелатов металлов, подходящие в качестве меток антител для экспериментов визуализации описаны в: US 5,342,606; US 5,428,155; US 5,316,757; US 5,480,990; US 5,462,725; US 5,428,139; US 5,385,893; US 5,739,294; US 5,750,660; US 5,834,456; Hnatowich et al (1983) J. Immunol. Methods 65: 147-157; Meares et al (1984) Anal. Biochem. 142:68-78; Mirzadeh et al (1990) Bioconjugate Chem. 1:59-65; Meares et al (1990) J. Cancer l990, Suppl. 10:21-26; Izard et al (1992) Bioconjugate Chem. 3:346-350; Nikula et al (1995) Nucl. Med. Biol. 22:387-90; Camera et al (1993) Nucl. Med. Biol. 20:955-62; Kukis et al (1998) J. Nucl. Med. 39:2105-2110; Verel et al (2003) J. Nucl. Med. 44: 1663- 1670; Camera et al (1994) J. Nucl. Med. 21:640-646; Ruegg et al (1990) Cancer Res. 50:4221-4226; Verel et al (2003) J. Nucl. Med. 44: 1663-1670; Lee et al (2001) Cancer Res. 61:4474-4482; Mitchell, et al (2003) J. Nucl. Med. 44: 1 105-11 12; Kobayashi et al (1999) Bioconjugate Chem. 10: 103-1 11; Miederer et al (2004) J. Nucl. Med. 45: 129-137; DeNardo et al (1998) Clinical Cancer Research 4:2483-90; Blend et al (2003) Cancer Biotherapy & Radiopharmaceuticals 18:355-363; Nikula et al (1999) J. Nucl. Med. 40:166-76; Kobayashi et al (1998) J. Nucl. Med. 39:829-36; Mardirossian et al (1993) Nucl. Med. Biol. 20:65-74; Roselli et al (1999) Cancer Biotherapy & Radiopharmaceuticals, 14:209-20.
(b) Флуоресцентные метки, такие как хелаты редкоземельных металлов (хелаты европия), типы флуоресцеина, в том числе FITC, 5-карбоксифлуоресцеин, 6-карбоксифлуоресцеин; типы родамина, в том числе TAMRA; дансил; Лиссамин; цианины; фикоэритрины; Техасский красный; и их аналоги. Эти флуоресцентные метки могут быть конъюгированы с антителами с использованием способов, описанных, например, в Current Protocols in Immunology, supra. Флуоресцентные красители и флуоресцентные реагенты-метки включают в себя красители и метки, коммерчески доступные из Invitrogen/Molecular Probes (Eugene, OR) и Pierce Biotechnology, Inc. (Rockford, IL).
(c) Различные фермент-субстратные метки являются доступными или описанными (US 4275149). Фермент обычно катализирует изменение окраски в субстрате, которое может быть измерено спектрофотометрически. Альтернативно, этот фермент может изменять флуоресценцию или хемилюминесценцию субстрата. Способы количественного определения изменения флуоресценции описаны выше. Хемилюминесцентный субстрат становится электронно-возбужденным химической реакцией и может затем испускать свет, который может быть измерен (например, с использованием хемилюминометра), или отдает энергию флуоресцентному акцептору. Примеры ферментных меток включают в себя люциферазы (например, люциферазу светляков и бактериальную люциферазу; US 4,737,456), люциферин, 2,3-дигидрофталазиндионы, малатдегидрогеназу, уреазу, пероксидазу, такую как пероксидаза хрена (HRP), щелочную фосфатазу (AP), β-галактозидазу, глюкоамилазу, лизозим, сахаридоксидазы (например, глюкозооксидазу, галактозооксидазу и глюкозо-6-фосфатдегидрогеназу), гетероциклические оксидазы (такие как уриказа и ксантиноксидаза), лактопероксидазу, микоперокисдазу, и т.п.Способы конъюгации ферментов с антителами описаны в O'Sullivan et al (1981) "Methods for the Preparation of Enzyme-Antibody Conjugates for use in Enzyme Immunoassay", in Methods in Enzym. (ed J. Langone & H. Van Vunakis), Academic Press, New York, 73: 147-166.
Примеры фермент-субстратных комбинаций включают в себя, например:
(i) пероксидазу хрена (HRP) с пероксидазой водорода в качестве субстрата, причем эта пероксидаза водорода окисляет предшественник красителя (например, ортофенилендиамин (OPD) или гидрохлорид 3,3’,5,5’-тетраметилбензидина (TMB));
(ii) щелочную фосфатазу (AP) с пара-нитрофенилфосфатом в качестве хромогенного субстрата и
(iii) β-D-галактозидазу (β-D-Gal) с хромогенным субстратом (например, p-нитрофенил-β-D-галактозидазой) или флуорогенным субстратом 4-метилумбеллиферил-β-D-галактозидазой.
Многочисленные другие фермент-субстратные комбинации доступны квалифицированным в данной области специалистам. В отношении общего обзора см. US 4275149 и US 4318980.
Метка может быть опосредованно конъюгирована с боковой цепью аминокислоты, боковой цепью активированной аминокислоты, цистеин-встроенным антителом и т.п. Например, это антитело может быть конъюгировано с биотином, и любая из этих трех широких категорий меток, указанных выше, может быть конъюгирована с авидином или стрептавидином, или наоборот. Биотин связывается селективно со стрептавидином и, следовательно, эта метка может быть конъюгирована с антителом этим непрямым способом. Альтернативно, для достижения непрямой конъюгации этой метки с полипептидным вариантом, этот полипептидный вариант конъюгируют с малым гаптеном (например, дигоксином), и один из различных вышеуказанных типов меток конъюгируют с антителом против конъюгата гаптен-полипептидный вариант (например, анти-дигоксин-антителом). Таким образом, может быть достигнута непрямая конъюгация метки с этим полипептидным вариантом (Hermanson, G. (1996) in Bioconjugate Techniques Academic Press, San Diego).
Антитело данного изобретения может быть использовано в любом способе анализа, таком как ELISA, анализы конкурентного связывания, прямые и непрямые сэндвич-анализы и анализы иммунопреципитации (Zola, (1987) Monoclonal Antibodies: A Manual of Techniques, pp.147-158, CRC Press, Inc.).
Метка детектирования может быть использована для локализации, визуализации и количественного определения события связывания или узнавания. Меченые антитела согласно изобретению могут детектировать рецепторы клеточной поверхности. Другим применением для детектируемо меченых антител является способ иммунозахвата на основе гранул, предусматривающий конъюгацию гранулы с флуоресцентно меченым антителом и детектирование сигнала флуоресценции после связывания лиганда. Сходные методологии детектирования связывания используют действия резонанса поверхностных плазмонов (SPR) для измерения и детектирования взаимодействий антитело-антиген.
Метки детектирования, такие как флуоресцентные красители и хемилюминесцентные красители (Briggs et al (1997) "Synthesis of Functionalised Fluorescent Dyes and Their Coupling to Amines and Amino Acids," J. Chem. Soc, Perkin-Trans. 1:1051-1058), обеспечивают детектируемый сигнал и обычно применимы для мечения антител, предпочтительно имеющих следующие свойства: (i) это меченое антитело должно производить очень высокий сигнал с низким фоном, так что малые количества антител могут быть точно детектированы как в бесклеточных анализах, так и в анализах на основе клеток; и (ii) это меченое антитело должно быть фотохимически устойчивым, так что этот флуоресцентный сигнал может быть подвергнут наблюдению, мониторингу и регистрации без значимого фотообесцвечива