Биспецифические анти-vegf/анти-ang-2 антитела
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к биспецифическому антителу, специфически связывающемуся с фактором роста сосудистого эндотелия человека - VEGF и ангиопоэтином-2 человека - ANG-2, фармацевтической композиции его содержащей, а также к способу его получения. Также раскрыты нуклеиновая кислота, кодирующая вышеуказанное антитело, и вектор или клетка-хозяин, содержащие вышеуказанную нуклеиновую кислоту. Изобретение позволяет эффективно осуществлять лечение рака и/или сосудистых заболеваний. 7 н. и 5 з.п. ф-лы, 19 ил., 18 табл., 20 пр.
Реферат
Настоящее изобретение относится к биспецифическим антителам против фактора роста сосудистого эндотелия (human vascular endothelial growth factor - VEGF/VEGF-A) и против ангиопоэтина-2 человека (angiopoietin-2 - ANG-2), к способам их получения, фармацевтическим композициям, содержащим указанные антитела, и к их применению.
Предшествующий уровень техники
Ангиогенез присутствует в патогенезе различных заболеваний, в том числе солидных опухолей, внутриглазных неоваскулярных синдромов, например, пролиферативных ретинопатий или старческой дегенерации сетчатки (СДС), ревматоидного артрита и псориаза (Folkman J. и др., J. Biol. Chem. 267, 1992, сс. 10931-10934; Klagsbrun М. и др., Annu. Rev. Physiol. 53, 1991, сс. 217-239; и Garner А. в кн.: «Pathobiology of ocular disease, A dynamic approach)), 1994, под ред. Garner А. и Klintworth G.K., 2-е изд., изд-во Marcel Dekker, Нью-Йорк, сс. 1625-1710). При солидных опухолях неоваскуляризация обеспечивает опухолевым клеткам преимущество в росте и независимой пролиферации по сравнению с нормальными клетками. Таким образом, наблюдают корреляцию между плотностью микрососудов в срезах опухолей и выживаемостью пациента при раке груди, а также в некоторых других опухолях (Weidner N. и др., N Engl J Med. 324, 1991, сс. 1-8; Horak E.R. и др., Lancet 340, 1992, сс. 1120-1124; и Macchiarini Р. И др., Lancet 340, 1992, сс. 145-146).
VEGF и анти-VEGF антитела
Фактор роста сосудистого эндотелия человека (Human vascular endothelial growth factor - VEGF/VEGF-A) (SEQ ID No: 105) описан, например, в работах Leung D.W. и др., Science 246, 1989, сс. 1306-1309; Keck P.J. и др., Science 246, 1989, сс. 1309-1312; Connolly D.T. и др., J. Biol. Chem. 264, 1989, сс. 20017-20024. VEGF участвует в регуляции нормального и нарушенного ангиогенеза и неоваскуляризации, связанных с опухолевыми и внутриглазными расстройствами (Ferrara N. и др., Endocr. Rev. 18, 1997, сс. 4-25; Berkman R.A. и др., J. Clin. Invest. 91, 1993, сс. 153-159; Brown L.F. и др., Human Pathol. 26, 1995, сс. 86-91; Brown L.F. и др., Cancer Res. 53, 1993, cc. 4727-4735; Mattern J. и др., Brit. J. Cancer. 73, 1996, cc. 931-934; Dvorak H. и др., Am. J. Pathol. 146, 1995, cc. 1029-1039). VEGF является гомодимерным гликопротеином, который выделен из разных источников. VEGF проявляет высокоспецифичное митогенное действие в отношении клеток эндотелия. VEGF обладает важными регуляторными функциями при формировании новых кровеносных сосудов на протяжении эмбрионального образования и развития сосудов и в процессе ангиогенеза на протяжении взрослого периода жизни (Carmeliet Р. и др., Nature, 380, 1996, сс. 435-439; Ferrara N. и др., Nature, 380, 1996, сс. 439-442; обзор Ferrara и Davis-Smyth, Endocrine Rev., 18, 1997, сс. 4-25). Значение действия VEGF показано в исследованиях, выявивших, что инактивация одного аллеля VEGF приводит к гибели эмбриона из-за недостаточного развития сосудистой сети (Carmeliet Р. и др., Nature, 380, 1996, сс. 435-439; Ferrara N. и др., Nature, 380, 1996, сс. 439-442). Кроме того, VEGF обладает сильным хемоаттрактантным действием в отношении моноцитов и может индуцировать плазминогенный активатор и ингибитор плазминогенного активатора в клетках эндотелия, а также может индуцировать проницаемость микрососудов. Из-за указанной последней активности VEGF иногда относят к фактору проницаемости сосудов (vascular permeability factor - VPF). Выделение и свойства VEGF рассмотрены в обзорах; см. Ferrara N. и др., J. Cellular Biochem., 47, 1991, сс. 211-218, и Connolly J., Cellular Biochem., 47, 1991, cc. 219-223. В другом варианте сплайсинг иРНК одного гена VEGF дает до пяти изоформ VEGF.
Анти-VEGF нейтрализующие антитела супрессируют рост различных линий опухолевых клеток человека в мышах (Kim I. и др., Nature 362, 1993, сс. 841-844; Warren S.R. и др., J. Clin. Invest., 95, 1995, сс. 1789-1797; Borgstrom Р. и др., Cancer Res. 56, 1996, сс. 4032-4039; Melnyk О. и др., Cancer Res. 56, 1996, сс. 921-924). WO 94/10202, WO 98/45332, WO 2005/00900 и WO 00/35956 относятся к антителам против VEGF. Гуманизированное моноклональное антитело бевацизумаб (продаваемое под коммерческим названием продукта Avastin®) является анти-VEGF антителом, применяемым в лечении опухолей (WO 98/45331).
Ранибизумаб (коммерческое название продукта - Lucentis®) является фрагментом моноклонального антитела, производным от того же исходного антитела мыши, что и бевацизумаб (авастин). Его молекула намного меньше исходной молекулы и обладает сродством, достаточным для обеспечения более сильного связывания с VEGF-A (WO 98/45331). Этот продукт является анти-ангиогенным средством, одобренным для лечения «влажного» типа возрастной дегенерации желтого пятна (age-related macular degeneration - ARMD), обычной формы возрастной потери зрения. Другим анти-VEGF антителом является, например, антитело HuMab G6-31, описанное, например, в US 2007/0141065.
ANG-2 и анти-ANG-2 антитела
Ангиопоэтин-2 человека (Human angiopoietin-2 - ANG-2) (в другом варианте используют аббревиатуру ANGPT2 или ANG2) (SEQ ID No: 106) описан в работах Maisonpierre Р.С.и др., Science 277, 1997, сс. 55-60, и Cheung А.Н. и др., Genomics 48, 1998, сс. 389-391. Ангиопоэтины-1 и -2 (ANG-1 (SEQ ID No: 107) и ANG-2 (SEQ ID No: 106)) были обнаружены в качестве лигандов для Tie - семейства тирозинкиназ, которые избирательно экспрессируются в эндотелии сосудов. Yancopoulos G.D. и др., Nature 407, 2000, сс. 242-248. В настоящее время установлено четыре безусловных представителя семейства ангиопоэтина. Ангиопоэтин-3 и -4 (Ang-3 и Ang-4) могут представлять в высокой степени дивергентные аналоги одного и того же генного локуса у мыши и человека. Kim I. и др., FEBS Let, 443, 1999, сс. 353-56; Kim I. и др., J Biol Chem 274, 1999, cc. 26523-26528. ANG-1 и ANG-2 первоначально были идентифицированы в экспериментах с культурами тканей в качестве агониста и антагониста, соответственно (по ANG-1 см. Davis S. и др., Cell 87, 1996, сс. 1161-1169; по ANG-2 см. Maisonpierre Р.С.и др., Science 277, 1997, сс. 55-60). Все известные ангиопоэтины связываются в основном с Tie2, и оба, Ang-1 и -2, связываются с Tie2 со сродством 3 нМ (Kd). Maisonpierre Р.С.и др., Science 277, 1997, сс. 55-60. Установлено, что Ang-1 поддерживает выживаемость ЕС и стимулирует целостность эндотелия, Davis S. и др., Cell 87, 1996, сс. 1161-1169; Kwak H.J. и др., FEBS Lett 448, 1999, сс. 249-253; Suri С.и др., Science 282, 1998, сс. 468-471; Thurston G. и др., Science 286, 1999, сс. 251 1-14; Thurston G. и др., Nat. Med. 6, 2000, сс. 460-463, несмотря на то, что ANG-2 обладает противоположным эффектом и стимулирует дестабилизацию и регрессию кровеносных сосудов при отсутствии факторов выживания VEGF или основного фактора роста фибробластов. Maisonpierre Р.С.и др., Science 277, 1997, сс. 55-60. Однако в результате многих исследований функции ANG-2 был сделан вывод о более сложной ситуации. ANG-2 может быть сложным регулятором ремоделирования сосудов, которое играет роль и в распространении сосудов, и в регрессии сосудов. Подтверждая такие роли для ANG-2, исследование экспрессии показало, что ANG-2 быстро индуцируется вместе с VEGF у взрослых при распространении сосудов приангиогенезе, хотя ANG-2 индуцируется в отсутствии VEGF при регрессии сосудов. Holash J. и др., Science 284, 1999, сс. 1994-1998; Holash J. и др., Oncogene 18, 1999, сс. 5356-5362. Согласуясь с контекстно-зависимой ролью, ANG-2 специфически связывает с тем же специфическим для эндотелия рецептором, Tie-2, который активируется Ang-1, но оказывает контекстно-зависимые воздействия на его активирование. Maisonpierre Р.С. и др., Science 277, 1997, сс. 55-60.
Исследования ангиогенеза в роговице показали, что и ANG-1, и ANG-2, обладают сходными эффектами, действуя синергидно с VEGF по индукции роста новых кровеносных сосудов. Asahara Т. и др., Circ. Res. 83, 1998, сс. 233-240. Вероятность того, что это доза-зависимый ответ эндотелия, повышается за счет наблюдения, заключающегося в том, что in vitro при высокой концентрации ANG-2 может также быть про-ангиогененным. Kim I. и др., Oncogene 19, 2000, сс. 4549-4552. В высокой концентрации ANG-2 действует в качестве апоптозного фактора выживания для клеток эндотелия во время сывороточного депривационного апоптоза через активирование Tie2 через PI-3 киназу и метаболический путь Akt. Kim I. и др., Oncogene 19, 2000, сс. 4549-4552.
Кроме того, по результатам экспериментов in vitro был сделан вывод о том, что при продолжительном воздействии эффекты ANG-2 могут постепенно сдвигаться от эффекта антагониста к агонисту Tie2, и позднее может непосредственно участвовать в формировании сосудистых трубок и стабилизации новых сосудов. Teichert-Kuliszewska K. и др., Cardiovasc. Res. 49, 2001, сс. 659-670. Кроме того, если клетки эндотелия культивируют на фибриновом геле, также наблюдают активирование Tie2 за счет ANG-2, что предположительно означает, что действие ANG-2 может зависеть от состояния дифференциации клеток эндотелия. Teichert-Kuliszewska K. и др., Cardiovasc. Res. 49, 2001, сс. 659-670. В клетках эндотелия микрососудов, культивируемых в трехмерном геле, ANG-2 также может индуцировать активирование Tie2 и формирование структур типа капилляров. Mochizuki Y. и др., J. Cell. Sci. 115, 2002, сс. 175-183. Применение 3-D сферического совместного культивирования в качестве модели созревания сосудов in-vitro, показывает, что прямой контакт между клетками эндотелия и клетками мезенхимы аннулирует способность к реагированию на VEGF, хотя наличие VEGF и ANG-2 индуцирует распространение сосудов. Korff Т. и др., Faseb J. 15, 2001, сс. 447-457. Etoh Т.Н. и др. показали, что у клеток эндотелия, которые конститутивно экспрессируют Tie2, регуляция экспрессии ММР-1, -9 и u-РА сильно повышается за счет ANG-2 в присутствии VEGF. Etoh Т. и др., Cancer Res. 61, 2001, сс. 2145-2153. На модели зрачковой мембраны in vivo Lobov I.В. и др. показали, что ANG-2 в присутствии эндогенного VEGF индуцирует быстрое повышение диаметра капилляров, ремоделируя базальную пластинку, пролиферацию и миграцию клеток эндотелия и стимулирует распространение новых кровеносных сосудов. Lobov LB. и др., Proc. Natl. Acad. Sci. USA 99, 2002, cc. 11205-11210. Напротив, ANG-2 индуцирует гибель клеток эндотелия и регрессию сосудов без эндогенного VEGF. Lobov LB. и др., Proc. Natl. Acad. Sci. USA 99, 2002, cc. 11205-11210. Сходным образом на модели опухоли in vivo Vajkoczy P. и др. показали, что многоклеточные агрегаты инициируют рост сосудов путем ангиогенного распространения через одновременную экспрессию VEGFR-2 и ANG-2 эндотелием хозяина и опухоли. Vajkoczy Р. и др., J. Clin. Invest. 109, 2002, сс. 777-785. Эта модель показывает, что закончившая начальный рост микроциркуляторная часть растущих опухолей отличается непрерывным ремоделированием, предположительно опосредованным экспрессией VEGF и ANG-2. Vajkoczy Р. и др., J Clin. Invest. 09, 2002, сс. 777-785.
Исследования Tie-2 и ангиопоэтина-1 на модели нокаутных мышей показывают сходные фенотипы и подтверждают, что фосфорилирование Tie-2 после стимуляции ангиопоэтином-1 опосредует ремоделирование и стабилизацию формируемых сосудов, стимулируя полное развитие кровеносных сосудов во время ангиогенеза и поддержание адгезии клеток, поддерживающих клетки эндотелия (Dumont J. и др., Genes & Development, 8, 1994, сс. 1897-1909; Sato T.N., Nature, 376, 1995, сс. 70-74; Thurston G. и др., Nature Medicine, 6, 2000, cc. 460-463). Предположительно роль ангиопоэтина-1 сохраняется у взрослых, у которых он экспрессируется в разных местах и конститутивно (Hanahan D., Science, 277, 1997, сс. 48-50; Zagzag D. и др., Exp Neurology, 159, 1999, сс. 391-400). Напротив, экспрессия ангиопоэтина-2 в основном ограничивается сайтами сосудистого ремоделирования, в которых ангиопоэтин-2 предположительно блокирует конститутивную стабилизации или функцию созревания ангиопоэтина-1, позволяя сосудам ревертировать и остаться, пластическое состояние которых может быть в большей степени отвечающим на распространяющиеся сигналы (Hanahan D., 1997; Holash J. и др., Orzcogerze 18, 199, сс. 5356-5362; Maisonpierre Р.С, 1997). При экспрессии ангиопоэтина-2 при патологическом ангиогенезе установлено, что многие типы опухолей экспрессируют ангиопоэтин-2 (Maisonpierre Р.С. и др., Science 277, 1997, сс. 55-60). Функциональные исследования показали, что ангиопоэтин-2 вовлечен в опухолевый ангиогенез и установили ассоциацию сверхэкспрессии ангиопоэтина-2 с повышенным ростом опухолей на модели ксенотрансплантата у мышей (Ahmad S.A. и др., Cancer Res., 61, 2001, сс. 1255-1259). В других исследованиях связывают сверхэкспрессию ангиопоэтина-2 с опухолевой гиперваскулярностью (Etoh Т. и др., Cancer Res. 61, 2001, сс. 2145-2153; Tanaka F. и др., Cancer Res. 62, 2002, сс. 124-129).
В последнее время было предложено использовать ангиопоэтин-1, ангиопоэтин-2 и/или Tie-2 в качестве возможных мишеней в терапии опухолей. Например, в US 6166185, US 5650490 и US 5814464 описаны анти-Tie-2 лиганд и рецепторные антитела. Исследования с применением растворимого Tie-2 были описаны для снижения числа и размера опухолей у грызунов (Lin, 1997; Lin, 1998). Siemeister G. и др., Cancer Res. 59, 1999, cc. 3185-3191, получили линии клеток меланомы человека, экспрессирующие внеклеточный домен от Tie-2, ввели их инъекцией голым мышам и описали растворимый Tie-2 для получения существенного подавления роста опухоли и опухолевого ангиогенеза. Оба рассматриваемых вместе агента, ангиопоэтин-1 и ангиопоэтин-2, связываются с Tie-2, и из этих исследований неясно, является ли ангиопоэтин-1, ангиопоэтин-2 или Tie-2 привлекательной мишенью для противоопухолевой терапии. Однако, эффективная терапия против ангипоэтина-2 предположительно полезна в лечении заболеваний, например, рака, при котором прогрессирование зависит от аберрантного ангиогенеза, если блокируемый процесс может привести к предупреждению улучшения заболевания (Follunan J., Nature Medicine. 1, 1995, cc. 27-31).
Кроме того, некоторые группы исследователей сообщают о применении антител и пептидов, связывающихся с ангиопоэтином-2. См., например, US 6166185 и US 2003/10124129, WO 03/030833, WO 2006/068953, WO 03/057134 или US 2006/0122370.
Исследование воздействия очаговой экспрессии ангиопоэтина-2 показало, что противоборствующий ангиопоэтин 1/Tie-2 сигнал ослабляет плотную сосудистую структуру, тем самым, подвергая воздействию клетки эндотелия для активации сигналов от индукторов ангиогенеза, например, VEGF (Hanahan D., Science, 277, 1997, cc. 48-50). Такой проангиогенный эффект, возникающий из-за ингибирования ангиопоэтина-1, показывает, что терапия, направленная против ангиопоэтина-1, не будет эффективным противоопухолевым лечением.
ANG-2 экспрессируется во время развития в местах ремоделирования кровеносных сосудов. Maisonpierre Р.С. и др., Science 277, 1997, сс. 55-60. У взрослых индивидуумов экспрессия ANG-2 ограничена местами сосудистого ремоделирования, а также присутствует в высоко васкуляризованных опухолях, включая глиому, Osada Н. и др., Int. J. Oncol. 18, 2001, сс. 305-309); Koga K. и др., Cancer Res. 61, 2001, cc. 6248-6254, гепатоклеточную карциному, Tanaka S. и др., J. Clin. Invest. 103, 1999, cc. 341-345, бородавчатый рак желудка, Etoh Т. и др., Cancer Res. 61, 2001, сс. 2145-2153; Lee J.H. и др., Int. J. Oncol. 18, 2001, cc. 355-361, рак щитовидки, Bunone G. и др., Am J Pathol 155, 1999, cc. 1967-1976, немелкоклеточный рак легких, Wong M.P. и др., Lung Cancer 29, 2000, сс. 11-22, рак толстой кишки, Ahmad S.A. и др., Cancer 92, 2001, сс. 1138-1143, рак простаты Wurmbach J.H. и др., Anticancer Res. 20, 2000, сс. 5217-5220. Установлено, что некоторые опухолевые клетки экспрессируют ANG-2. Например, Tanaka S. и др., J. Clin. Invest. 103, 1999, сс. 341-345, обнаружили иРНК ANG-2 в 10 из 12 образцов гепатоклеточной карциномы человека (ГКК). Сотрудники группы Ellis установили, что ANG-2 экспрессируется повсеместно в эпителии опухоли. Ahmad S.A. и др., Cancer 92, 2001, 1138-1143. Другие исследователи опубликовали сходные результаты. Chen L. и др., J. Tongji Med. Univ. 21, 2001, сс. 228-235. Путем выявления уровней иРНК ANG-2 в архивированных образцах рака груди человека, Sfiligoi С. и др., Int. J. Cancer 103, 2003, сс. 466-474, установили, что иРНК ANG-2 существенным образом ассоциирована с инвазией вспомогательных лимфатических узлов, коротким периодом отсутствия болезни и плохой общей выживаемостью. Tanaka F. и др., Cancer Res. 62, 2002, сс. 7124-7129, проанализировали в общей сложности 236 пациентов с немелкоклеточным раком легких (НМКРЛ) на стадиях развития заболевания с I по IIIA, соответственно. С помощью иммуногистохимии они установили, что 16,9% пациентов НМКРЛ являются ANG-2-положительными. Плотность микрососудов для ANG-2-положительных опухолей существенно выше, чем плотность микрососудов у ANG-2-отрицательных опухолей. Такой ангиогенный эффект ANG-2 наблюдают только при высокой экспрессии VEGF. Кроме того, положительная экспрессия ANG-2 является существенным фактором прогнозирования послеоперационного выживания. Tanaka F. и др., Cancer Res. 62, 2002, сс. 7124-7129. Однако ими было установлено отсутствие существенной корреляции между экспрессией Ang-1 и плотностью микрососудов. Tanaka F. и др., Cancer Res. 62, 2002, сс. 7124-7129. Эти результаты означают, что ANG-2 является индикатором плохого прогноза для пациентов с тяжелыми формами некоторых типов рака.
Ранее, используя модель ANG-2 нокаутных мышей, группа под руководством Yancopoulo сообщила, что ANG-2 необходим для постнатального ангиогенеза. Gale N.W. и др., Dev. Cell 3, 2002, сс. 411-423. Ими было установлено, что запрограммированная в ходе развития регрессия сосудистой системы стекловидного тела не происходит у ANG-2 нокаутных мышей, и их кровеносные сосуды сетчатки не могут распространяться от центральной артерии сетчатки. Gale N.W. и др., Dev. Cell 3, 2002, сс. 411-423. Они также установили, что делеция ANG-2 приводит к серьезным дефектам в структуре и функции лимфатической сосудистой сети. Gale N.W. и др., Dev. Cell 3, 2002, сс. 411-423. Генетическое сохранение Ang-1 устраняет лимфатические дефекты, но не дефекты ангиогенеза. Gale N.W. и др., Dev. Cell 3, 2002, сс. 411-423.
Peters и др. сообщают, что растворимый Tie2, когда высвобождается либо в качестве рекомбинантного белка, либо в вирусном векторе экспрессии, ингибирует in vivo рост карциномы молочных желез мыши и меланому у модельных мышей. Lin Р. и др., Proc. Natl. Acad. Sci. USA 95, 1998, cc. 8829-8834; Lin P. и др., J. Clin. Invest. 100, 1997, cc. 2072-2078. Плотность сосудов в ткани опухоли, которую лечили указанным способом, существенно понизилась. Кроме того, растворимый Tie2 блокирует ангиогенез в роговице крысы, вызванный кондиционированными средами культур опухолевых клеток. Lin Р. и др., J. Clin. Invest. 100, 1997, сс. 2072-2078. Кроме того, Isner и др. показали, что добавление ANG-2 к VEGF индуцирует намного более длительный и в большей степени периферический процесс формирования новых сосудов, чем добавление только одного VEGF. Asahara Т. и др., Circ. Res. 83, 1998, сс. 233-240. Избыток рецептора Tie2 предотвращает модулирование за счет ANG-2 индуцированного VEGF процесса формирования новых сосудов. Asahara Т. и др., Circ. Res. 83, 1998, сс. 233-240. Siemeister G. и др., Cancer Res. 59, 1999, сс. 3185-3191, показали на голых мышах с ксенотрансплантатами, что сверхэкспрессия внеклеточных связывающих лиганды доменов, либо Flt-1, либо Tie2, у ксенотрансплантатов, приводящая к существенному подавлению метаболического пути, не может быть компенсирована сверхэкспрессией другого указанного домена, следовательно, метаболический путь рецептора VEGF и метаболический путь Tie2 не следует рассматривать в качестве двух независимых медиаторов, имеющих существенное значение для процесса ангиогенеза in vivo. Siemeister G. и др., Cancer Res. 59, 1999, cc. 3185-3191. Это подтверждено в нескольких последующих публикациях White R. и др., Proc. Natl. Acad. Sci. USA 100, 2003, cc. 5028-5033. В этих исследованиях было показано, что устойчивый к нуклеазе аптамер РНК, который специфически связывает и ингибирует ANG-2, в значительной степени подавляет процесс формирования новых сосудов, индуцированный bFGF, на модели ангиогенеза в микрокармане роговицы крысы.
Биспецифические антитела
В последнее время было создано много различных структур рекомбинантных антител, например, четырехвалентных биспецифических антител, путем гибридизации, например, структуры антитела и одноцепочечных доменов (см., например, Coloma M.J. и др., Nature Biotech 15, 1997, сс. 159-163; WO 2001/077342; и Morrison, S.L., Nature Biotech 25 (2007) 1233-1234).
Кроме того, несколько других новых форматов, в которых сердцевинная структура антитела (IgA, IgD, IgE, IgG или IgM) больше не сохраняется, например, диатела, триатела или тетратела, миниантитела, было создано несколько одноцепочечных структур (scFv, Bis-scFv), которые могут связывать два или несколько антигенов (Holliger Р. и др., Nature Biotech 23, 2005, сс. 1126-1136; Fischer N., Léger О., Pathobiology 74, 2007, cc. 3-14; Shen J. и др., Journal of Immunological Methods 318, 2007, cc. 65-74; Wu С.и др., Nature Biotech. 25, 2007, cc. 1290-1297).
Все такие форматы используют линкеры, или для гибридизации сердцевины антитела (IgA, IgD, IgE, IgG или IgM) с дополнительным связывающим белком (например, scFv), или для гибридизации, например, двух фрагментов Fab или scFv (Fischer N., Léger О., Pathobiology 74, 2007, cc. 3-14). Следует учитывать, что может быть желательно сохранение эффекторных функций, например, комплементзависимой цитотоксичности (complement-dependent cytotoxicity - CDC) или антителозависимой клеточной цитотоксичности (antibody-dependent cellular cytotoxicity - ADCC), которые опосредуются через связывание с рецептором Fc, путем поддержания высокой степени сходства с природными антителами.
В WO 2007/024715 сообщают об иммуноглобулинах с доменами двойной вариабельности в качестве сконструированных поливалентных и полиспецифичных связывающих белков. Способ получения димер антител с биологическим действием описан в US 6897044. Конструкция поливалентного Fy антитела, обладающая по меньшей мере четырьмя вариабельными доменами, которые связаны между собой через пептидные линкеры, описана в US 7129330. Димерные и полимерные антигенсвязывающие структуры описаны в US 2005/0079170. Трех- или четырехвалентный моноспецифический антигенсвязывающий белок, включающий три или четыре фрагмента Fab, связанные друг с другом через соединяющие структуры, который не является природным иммуноглобулином, описан в US 6511663. В WO 2006/020258 описаны четырехвалентные биспецифические антитела, которые могут эффективно экспрессироваться в прокариотических и эукариотических клетках и используются в лечении и методах диагностики. Способ разделения или преимущественного синтеза димеров, связанных через по меньшей мере одну внутрицепочечную дисульфидную связь, от димеров, которые не связаны через по меньшей мере одну внутрицепочечную дисульфидную связь, из смеси, включающей два типа полипептидных димеров, описан в US 2005/0163782. Биспецифические четырехвалентные рецепторы описаны в US 5959083. Сконструированные антитела с тремя или более функциональными сайтами связывания антигена описаны в WO 2001/077342.
Полиспецифичные и поливалентные антигенсвязывающие полипептиды описаны в WO 1997/001580. В WO 1992/004053 описаны гомоконъюгаты, обычно получаемые из моноклональных антител класса IgG, которые связываются с тем же антигенным детерминантом и являются ковалентно связанными синтетической перекрестной связью. Олигомерные моноклональные антитела с высокой авидностью в отношении антигена, описаны в WO 1991/06305, посредством чего олигомеры, обычно класса IgG, секретируются, имея два или несколько мономеров иммуноглобулина, связанных вместе для формирования четырехвалентных или шестивалентных молекул IgG. Полученные от овец антитела и сконструированные конструкции антител описаны в US 6350860, они могут применяться для лечения заболеваний, при которых действие интерферона гамма является патогенным. В US 2005/0100543 описаны нацеливаемые конструкции, которые являются поливалентными носителями биспецифичных антител, т.е. каждая молекула нацеливаемой конструкции может выступать в качестве носителя двух или нескольких биспецифичных антител. Генетически сконструированные биспецифические четырехвалентные антитела описаны в WO 1995/009917. В WO 2007/109254 описаны стабилизированные связывающие молекулы, которые состоят или включают стабилизированный фрагмент scFv.
Комбинация ингибиторов VEGF и ANG-2
WO 2007/068895 относится к комбинации антагониста ANG-2 и VEGF, KDR и/или FLTL антагонистов. WO 2007/089445 относится к комбинациям ингибиторов ANG-2 и VEGF.
WO 2003/106501 относится к гибридным белкам, связывающимся с ангиопоэтином и содержащим домен полимеризации. WO 2008/132568 гибридные белки связываются с ангиопоэтином и VEGF.
Краткое описание изобретение
Первым объектом по настоящему изобретению является биспецифическое антитело, специфически связывающееся с фактором роста сосудистого эндотелия человека (human vascular endothelial growth factor - VEGF) и с ангиопоэтином-2 человека (angiopoietin-2 - ANG-2), включающее первый сайт связывания антигена, который специфически связывается с VEGF человека, и второй сайт связывания антигена, который специфически связывается с ANG-2 человека.
В одном из вариантов осуществления настоящего изобретения биспецифическое антитело по настоящему изобретению отличается тем, что
i) каждый из указанных сайтов связывания антигена представляет пару вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела;
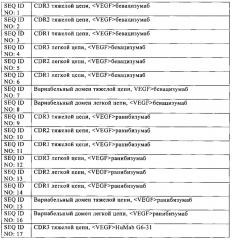
ii) указанный первый сайт связывания антигена, специфически связывающийся с VEGF, включает в вариабельный домен тяжелой цепи область CDR3 последовательности SEQ ID NO: 1, SEQ ID NO: 9, SEQ ID NO: 17 или SEQ ID NO: 94, область CDR2 последовательности SEQ ID NO: 2, SEQ ID NO: 10, SEQ ID NO: 18 или SEQ ID NO: 95, и область CDR1 последовательности SEQ ID NO: 3, SEQ ID NO: 11, SEQ ID NO: 19 или SEQ ID NO: 96, и в вариабельный домен легкой цепи область CDR3 последовательности SEQ ID NO: 4, SEQ ID NO: 12, SEQ ID NO: 20 или SEQ ID NO: 97, область CDR2 последовательности SEQ ID NO: 5, SEQ ID NO: 13, SEQ ID NO: 21 или SEQ ID NO: 98 и область CDR1 последовательности SEQ ID NO:6, SEQ ID NO: 14, SEQ ID NO: 22 или SEQ ID NO: 99;
iii) указанный второй сайт связывания антигена, специфически связывающийся с ANG-2, включает в вариабельный домен тяжелой цепи область CDR3 последовательности SEQ ID NO: 25, SEQ ID NO: 38, SEQ ID NO: 46, SEQ ID NO: 54, SEQ ID NO: 62, SEQ ID NO: 70, SEQ ID NO: 78 или SEQ ID NO: 86, область CDR2 последовательности SEQ ID NO: 26, SEQ ID NO: 39, SEQ ID NO: 47, SEQ ID NO: 55, SEQ ID NO: 63, SEQ ID NO: 71, SEQ ID NO: 79 или SEQ ID NO: 87 и область CDR1 последовательности SEQ ID NO: 27, SEQ ID NO: 40, SEQ ID NO: 48, SEQ ID NO: 56, SEQ ID NO: 64, SEQ ID NO: 72, SEQ ID NO: 80 или SEQ ID NO: 88, и в вариабельный домен легкой цепи область CDR3 последовательности SEQ ID NO: 28, SEQ ID NO: 28 с мутациями T92L, H93Q и W94T, SEQ ID NO: 41, SEQ ID NO: 49, SEQ ID NO: 57, SEQ ID NO: 65, SEQ ID NO: 73, SEQ ID NO: 81 или SEQ ID NO: 89, область CDR2 последовательности SEQ ID NO: 29, SEQ ID NO: 42, SEQ ID NO: 50, SEQ ID NO: 58, SEQ ID NO: 66, SEQ ID NO: 74, SEQ ID NO: 82 или SEQ ID NO: 90, область CDR1 последовательности SEQ ID NO: 30, SEQ ID NO: 43, SEQ ID NO: 51, SEQ ID NO: 59, SEQ ID NO: 67, SEQ ID NO: 75, SEQ ID NO: 83 или SEQ ID NO: 91.
В одном из вариантов осуществления настоящего изобретения биспецифическое антитело по настоящему изобретению отличается тем, что
i) каждый из указанных сайтов связывания антигена представляет пару вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела;
ii) указанный первый сайт связывания антигена, специфически связывающийся с VEGF, включает в вариабельный домен тяжелой цепи область CDR3 последовательности SEQ ID NO: 1, область CDR2 последовательности SEQ ID NO: 2 и область CDR1 последовательности SEQ ID NO: 3, и в вариабельный домен легкой цепи область CDR3 последовательности SEQ ID NO: 4, область CDR2 последовательности SEQ ID NO: 5 и область CDR1 последовательности SEQ ID NO: 6;
или указанный первый сайт связывания антигена, специфически связывающийся с VEGF, включает в вариабельный домен тяжелой цепи область CDR3 последовательности SEQ ID NO: 9, область CDR2 последовательности SEQ ID NO: 10 и область CDR1 последовательности SEQ ID NO: 11, и в вариабельный домен легкой цепи область CDR3 последовательности SEQ ID NO: 12, область CDR2 последовательности SEQ ID NO: 13 и область CDR1 последовательности SEQ ID NO: 14;
или указанный первый сайт связывания антигена, специфически связывающийся с VEGF, включает в вариабельный домен тяжелой цепи область CDR3 последовательности SEQ ID NO: 17, область CDR2 последовательности SEQ ID NO: 18 и область CDR1 последовательности SEQ ID NO: 19, и в вариабельный домен легкой цепи область CDR3 последовательности SEQ ID NO: 20, область CDR2 последовательности SEQ ID NO: 21 и область CDR1 последовательности SEQ ID NO: 22; и
iii) указанный второй сайт связывания антигена, специфически связывающийся с ANG-2, включает в вариабельный домен тяжелой цепи область CDR3 последовательности SEQ ID NO: 25, область CDR2 последовательности SEQ ID NO: 26, и область CDR1 последовательности SEQ ID NO: 27, и в вариабельный домен легкой цепи область CDR3 последовательности SEQ ID NO: 28 или SEQ ID NO: 28 с мутациями T92L, H93Q и W94T, область CDR2 последовательности SEQ ID NO: 29, и область CDR1 последовательности SEQ ID NO: 30.
В одном из вариантов осуществления настоящего изобретения биспецифическое антитело по настоящему изобретению отличается тем, что
i) каждый из указанных сайтов связывания антигена представляет пару вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела;
ii) указанный первый сайт связывания антигена, специфически связывающийся с VEGF, включает в качестве вариабельного домена тяжелой цепи последовательность SEQ ID NO: 7, SEQ ID NO: 15, SEQ ID NO: 23 или SEQ ID NO: 100, и в качестве вариабельного домена легкой цепи последовательность SEQ ID NO: 8, SEQ ID NO: 16, SEQ ID NO: 24 или SEQ ID NO: 101, и
iii) указанный второй сайт связывания антигена, специфически связывающийся с ANG-2, включает в вариабельный домен тяжелой цепи последовательность SEQ ID NO: 31, SEQ ID NO: 44, SEQ ID NO: 52, SEQ ID NO: 60, SEQ ID NO: 68, SEQ ID NO: 76, SEQ ID NO: 84 или SEQ ID NO: 92, и в качестве вариабельного домена легкой цепи последовательность SEQ ID NO: 32, SEQ ID NO: 32 с мутациями T92L, H93Q и W94T SEQ ID NO: 45, SEQ ID NO: 53, SEQ ID NO: 61, SEQ ID NO: 69, SEQ ID NO: 77, SEQ ID NO: 85 или SEQ ID NO: 93.
В одном из вариантов осуществления настоящего изобретения биспецифическое антитело по настоящему изобретению отличается тем, что
ii) указанный первый сайт связывания антигена, специфически связывающийся с VEGF, включает в вариабельный домен тяжелой цепи область CDR3 последовательности SEQ ID NO: 1 или SEQ ID NO: 94, область CDR2 последовательности SEQ ID NO: 2 или SEQ ID NO: 95 и область CDR1 последовательности SEQ ID NO: 3 или SEQ ID NO: 96, в вариабельный домен легкой цепи область CDR3 последовательности SEQ ID NO: 4 или SEQ ID NO: 97, область CDR2 последовательности SEQ ID NO: 5 или SEQ ID NO: 98, и область CDR1 последовательности SEQ ID NO: 6 или SEQ ID NO: 99;
iii) указанный второй сайт связывания антигена, специфически связывающийся с ANG-2, включает в качестве вариабельного домена тяжелой цепи область CDR3 последовательности SEQ ID NO: 38, SEQ ID NO: 46, SEQ ID NO: 54, SEQ ID NO: 62, SEQ ID NO: 70, SEQ ID NO: 78 или SEQ ID NO: 86, область CDR2 последовательности SEQ ID NO: 39, SEQ ID NO: 47, SEQ ID NO: 55, SEQ ID NO: 63, SEQ ID NO: 71, SEQ ID NO: 79 или SEQ ID NO: 87, и область CDR1 последовательности SEQ ID NO: 40, SEQ ID NO: 48, SEQ ID NO: 56, SEQ ID NO: 64, SEQ ID NO: 72, SEQ ID NO: 80 или SEQ ID NO: 88, и в вариабельный домен легкой цепи область CDR3 последовательности SEQ ID NO: 41, SEQ ID NO: 49, SEQ ID NO: 57, SEQ ID NO: 65, SEQ ID NO: 73, SEQ ID NO: 81 или SEQ ID NO: 89, область CDR2 последовательности SEQ ID NO: 42, SEQ ID NO: 50, SEQ ID NO: 58, SEQ ID NO: 66, SEQ ID NO: 74, SEQ ID NO: 82 или SEQ ID NO: 90, и область CDR1 последовательности SEQ ID NO: 43, SEQ ID NO: 51, SEQ ID NO: 59, SEQ ID NO: 67, SEQ ID NO: 75, SEQ ID NO: 83 или SEQ ID NO: 91.
В одном из вариантов осуществления настоящего изобретения биспецифическое антитело по настоящему изобретению отличается тем, что
ii) указанный первый сайт связывания антигена, специфически связывающийся с VEGF, включает в качестве вариабельного домена тяжелой цепи последовательность SEQ ID NO: 7 или SEQ ID NO: 100, и включает в качестве вариабельного домена легкой цепи последовательность SEQ ID NO: 8 или SEQ ID NO: 101, и
iii) указанный второй сайт связывания антигена, специфически связывающийся с ANG-2, включает в качестве вариабельного домена тяжелой цепи последовательность SEQ ID NO: 44, SEQ ID NO: 52, SEQ ID NO: 60, SEQ ID NO: 68, SEQ ID NO: 76, SEQ ID NO: 84 или SEQ ID NO: 92, и в качестве вариабельного домена легкой цепи последовательность SEQ ID NO: 45, SEQ ID NO: 53, SEQ ID NO: 61, SEQ ID NO: 69, SEQ ID NO: 77, SEQ ID NO: 85 или SEQ ID NO: 93.
В одном из вариантов осуществления настоящего изобретения биспецифическое антитело по настоящему изобретению отличается тем, что
iii) указанный второй сайт связывания антигена, специфически связывающийся с ANG-2, включает в вариабельный домен тяжелой цепи область CDR3 последовательности SEQ ID NO: 38, SEQ ID NO: 46, SEQ ID NO: 54, SEQ ID NO: 62, SEQ ID NO: 70, SEQ ID NO: 78 или SEQ ID NO: 86, область CDR2 последовательности SEQ ID NO: 39, SEQ ID NO: 47, SEQ ID NO: 55, SEQ ID NO: 63, SEQ ID NO: 71, SEQ ID NO: 79 или SEQ ID NO: 87, и область CDR1 последовательности SEQ ID NO: 40, SEQ ID NO: 48, SEQ ID NO: 56, SEQ ID NO: 64, SEQ ID NO: 72, SEQ ID NO: 80 или SEQ ID NO: 88, и в вариабельный домен легкой цепи область CDR3 последовательности SEQ ID NO: 41, SEQ ID NO: 49, SEQ ID NO: 57, SEQ ID NO: 65, SEQ ID NO: 73, SEQ ID NO: 81 или SEQ ID NO: 89, область CDR2 последовательности SEQ ID NO: 42, SEQ ID NO: 50, SEQ ID NO: 58, SEQ ID NO: 66, SEQ ID NO: 74, SEQ ID NO: 82 или SEQ ID NO: 90, и область CDR1 последовательности SEQ ID NO: 43, SEQ ID NO: 51, SEQ ID NO: 59, SEQ ID NO: 67, SEQ ID NO: 75, SEQ ID NO: 83 или SEQ ID NO: 91.
В одном из вариантов осуществления настоящего изобретения биспецифическое антитело по настоящему изобретению отличается тем, что
iii) указанный второй сайт связывания антигена, специфически связывающийся с ANG-2, включает в качестве вариабельного домена тяжелой цепи SEQ ID NO: 44, SEQ ID NO: 52, SEQ ID NO: 60, SEQ ID NO: 68, SEQ ID NO: 76, SEQ ID NO: 84 или SEQ ID NO: 92, и в качестве вариабельного домена легкой цепи последовательность SEQ ID NO: 45, SEQ ID NO: 53, SEQ ID NO: 61, SEQ ID NO: 69, SEQ ID NO: 77, SEQ ID NO: 85 или SEQ ID NO: 93.
В одном из вариантов осуществления настоящего изобретения биспецифическое антитело по настоящему изобретению отличается тем, что
ii) указанный первый сайт связывания антигена, специфически связывающийся с VEGF, включает в вариабельный домен тяжелой цепи область CDR3 последовательности SEQ ID NO: 1, область CDR2 последовательности SEQ ID NO: 2 и область CDR1 последовательности SEQ ID NO: 3, и в вариабельный домен легкой цепи область CDR3 последовательности SEQ ID NO: 4, область CDR2 последовательности SEQ ID NO: 5 и область CDR1 последовательности SEQ ID NO: 6; и
iii) указанный второй сайт связывания антигена, специфически связывающийся с ANG-2, включает в вариабельный домен тяжелой цепи CDR3 область последовательности SEQ ID NO: 46, область CDR2 последовательности SEQ ID NO: 47 и область CDR1 последовательности SEQ ID NO: 48, и в вариабельный домен легкой цепи область CDR3 последовательности SEQ ID NO: 49, область CDR2 последовательности SEQ ID NO: 50 и область CDR1 последовательности SEQ ID NO: 51.
В одном из вариантов осуществления настоящего изобретения биспецифическое антитело по настоящему изобретению отличается тем, что
ii) указанный первый сайт связывания антигена, специфически связывающийся с VEGF, включает в качестве вариабельного домена тяжелой цепи последовательность SEQ ID NO: 7, и в качестве вариабельного домена легкой цепи последовательность SEQ ID NO: 8, и
iii) указанный второй сайт связывания антигена, специфически связывающийся с ANG-2, включает в качестве вариабельного домена тяжелой цепи последовательность SEQ ID NO: 52, и в качестве вариабельного домена легкой цепи последовательность SEQ ID NO: 53.
В одном из вариантов осуществления настоящего изобретения биспецифическое антитело по настоящему изобретению отличается тем, что
ii) указанный первый сайт связывания антигена, специфически связывающийся с VEGF, включает в вариабельный домен тяжелой цепи область CDR3 последовательности SEQ ID NO: 1 или SEQ ID NO: 94, область CDR2 последовательности SEQ ID NO: 2 или SEQ ID NO: 95 и область CDR1 последовательности SEQ ID NO: 3 или SEQ ID NO: 96, и в вариабельный домен легкой цепи область CDR3 последовательности SEQ ID NO: 4, или SEQ ID NO: 97, область CDR2 последовательности SEQ ID NO: 5 или SEQ ID NO: 98, и область CDR1 последовательности SEQ ID NO: 6 или SEQ ID NO: 99;
iii) указанный второй сайт связывания антигена, специфически связывающийся с ANG-2, включает в вариабельный домен тяжелой цепи область CDR3 последовательности SEQ ID NO: 62 или SEQ ID NO: 86, область CDR2 последовательности SEQ ID NO: 63 или SEQ ID NO: 87 и область CDR1 последовательности SEQ ID NO: 64 или SEQ ID NO: 88, и в вариабельный домен легкой цепи область CDR3 последовательности SEQ ID NO: 65 или SEQ ID NO: 89, область CDR2 последовательности SEQ ID NO: 66 или SEQ ID NO: 90 и область CDR1 последовательности SEQ ID NO: 67 или SEQ ID NO: 91.
В одном из вариантов осуществления настоящего изобретения биспецифическое антитело по настоящему изобретению отличается тем, что
ii) указанный первый сайт связывания антигена, специфически связывающийся с VEGF, включает в качестве вариабельного домена тяжелой цепи последовательность SEQ ID NO: 7 или SEQ ID NO: 100, и в качестве вариабельного домена легкой цепи последовательность SEQ ID NO: 8 или SEQ ID NO: 101;и
iii) указанный второй сайт связывания антигена, специфически связывающийся с ANG-2, включает в качестве вариабельного домена тяжелой цепи последовательность SEQ ID NO: 68 или SEQ ID NO: 92, и в качестве вариабельного домена легкой цепи последовательность SEQ ID NO: 69, или SEQ ID NO: 93.
В одном из вариантов осуществления настоящего изобретения биспецифическое антитело по настоящему изобретению отличается тем, что
ii) указанный первый сайт связывания антигена, специфически связывающийся с VEGF, включает в вариабельный домен тяжелой цепи область CDR3 последовательности SEQ ID NO: 1, область CDR2 последовательности SEQ ID NO: 2 и область CDR1 последовательности SEQ ID NO: 3, и в вариабельный домен легкой цепи область CDR3 последовательности SEQ ID NO: 4, область CDR2 последовательности SEQ ID NO: 5 и область CDR1 последовательности SEQ ID NO: 6;
iii) указанный второй сайт связывания антигена, специфически связывающийся с ANG-2, включает в вариабельный домен тяжелой цепи область CDR3 последовательности SEQ ID NO: 62, область CDR2 последовательности SEQ ID NO: 63 и область CDR1 последовательности SEQ ID NO: 64, и в вариабельный домен легкой цепи область CDR3 последовательности SEQ ID NO: 65, область CDR2 последовательности SEQ ID NO: 66 и область CDR1 последовательности SEQ ID NO: 67.
В одном из вариантов осуществления настоящего изобретения биспецифическое антитело по настоящему изобретению отличается тем, что
ii) указанный первый сайт связывания антигена, специфически связывающийся с VEGF, включает в качестве вариабельного домена тяжелой цепи последовательность SEQ ID NO: 7, и в качестве вариабельного домена легкой цепи последовательность SEQ ID NO: 8; и
iii) указанный второй сайт связывания антигена, специфически связывающийся с ANG-2, включает в качестве вариабельного домена тяжелой цепи последовательность SEQ ID NO: 68, и в качестве вариабельного домена легкой цепи последовательность SEQ ID NO: 69.
Указанные биспецифические антитела являются по меньшей мере двухвалентными и могут быть трехвалентными, четырехвалентными или поливалентными. Предпочтительно биспецифическое антитело по настоящему изобретению является двухвалентным, трехвалентным или четырехвалентным.
Другой объект настоящего изобретения является молекулой нуклеиновой кислоты, кодирующей цепочку указанного биспецифического антитела.
Настоящее изобретение также предусматривает векторы экспрессии, содержащие указанную нуклеиновую кислоту по настоящему изобретению, способные экспрессировать указанную нуклеиновую кислоту в прокариотических или эук