Способ получения 3-ацилзамещенных 2-арил(гетерил)-1н-индол-5,6-дикарбонитрилов
Иллюстрации
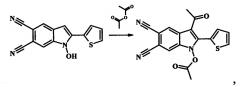
Показать всеИзобретение относится к способу получения новых 3-ацилзамещенных 2-арил(гетерил)-1H-индол-5,6-дикарбонитрилов, в которых R1=СОСН3, или СОС2Н5, или СОС3Н7; R2=С6Н5, или 4-СН3С6Н4, или 4-ОСН3С6Н4, или 2-тиенил; R3=СН3, или С2Н5, или С3Н7, которые могут быть использованы в качестве прекурсоров для синтеза биологически активных веществ, лекарственных препаратов, фталоцианинов, гексазоцикланов. Способ получения 1,2,3-тризамещенных 1H-индол-5,6-дикарбонитрилов заключается во взаимодействии 2-замещенных 1-гидрокси-1H-индол-5,6-дикарбонитрилов с соответствующими ангидридами алифатических карбоновых кислот в присутствии борфтортриэфирата, с последующим охлаждением полученной реакционной массы, растворением в десятикратном избытке холодной воды, отфильтровыванием выпавшего осадка 1,2,3-тризамещенных 1H-индол-5,6-дикарбонитрилов, промыванием водой, перекристаллизацией из ацетонитрила и сушкой на воздухе. 8 пр.
Реферат
Изобретение относится к способу получения новых азотсодержащих гетероциклических соединений, а именно 3-ацилзамещенных 2-арил(гетерил)-1H-индол-5,6-дикарбонитрилов, которые могут быть использованы в качестве прекурсоров для синтеза биологически активных веществ, лекарственных препаратов, фталоцианинов, гексазоцикланов.
Данные соединения являются новыми, из уровня техники нам не известны способы получения таких соединений.
Задачей изобретения является разработка способа получения 3-ацилзамещенных 2-арил(гетерил)-1H-индол-5,6-дикарбонитрилов общей структурной формулы:
где R1=СОСН3, или СОС2Н5, или СОС3Н7;
R2=C6H5, или 4-СН3С6Н4, или 4-OCH3C6H4, или 2-тиенил;
R3=СН3, или С2Н5, или С3Н7.
Поставленная задача достигается тем, что в качестве реагентов для синтеза 3-ацилзамещенных 2-арил(гетерил)-1H-индол-5,6-дикарбонитрилов используются 2-замещенные 1-гидрокси-1H-индол-5,6-дикарбонитрилы в среде ангидридов алифатических карбоновых кислот (уксусный, пропионовый, масляный) в присутствии борфтортриэфирата BF3Et2O (кислота Льюиса).
Вышеуказанные соединения получают следующей реакцией:
при условиях, описанных ниже.
2-Замещенные 1-гидрокси-1H-индол-5,6-дикарбонитрилы нагреваются в среде соответствующего ангидрида (уксусный, пропионовый, масляный) в присутствии борфтортриэфирата BF3Et2O при температуре 55…70°С в течение 5-20 мин. Затем полученную реакционную массу охлаждают, растворяют в десятикратном избытке холодной воды. Выпавший осадок 3-ацилзамещенных 2-арил(гетерил)-1H-индол-5,6-дикарбонитрилов отфильтровывают, промывают водой и перекристаллизовывают из ацетонитрила. Сушат на воздухе.
Все приведенные отличительные признаки являются существенными, и только заявляемая совокупность признаков позволяет достичь технического результата.
Строение полученных соединений подтверждено методами ИК, ЯМР Н1, ЯМР С13 спектроскопий и масс-спектрометрией.
Изобретение иллюстрируется следующими примерами.
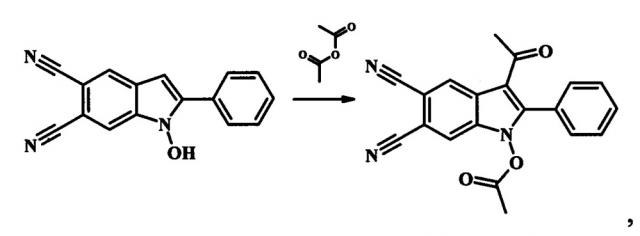
Пример 1. 3-ацетил-1-(ацетилокси)-2-фенил-1H-индол-5,6-дикарбонитрил
К 2 мл уксусного ангидрида прибавляют 0.002 моль 1-гидрокси-2-фенил-1H-индол-5,6-дикарбонитрил и 0.004 моль (0.5 мл) борфтортриэфирата BF3Et2O и нагревают при температуре 55°С при постоянном перемешивании в течение 5 мин. Затем реакционную массу охлаждают, растворяют в 20 мл холодной воды. Выпавший осадок отфильтровывают, промывают водой и перекристаллизовывают из ацетонитрила. Сушат на воздухе. Получают 0.59 г (86% от теории) 3-ацетил-1-(ацетилокси)-2-фенил-1H-индол-5,6-дикарбонитрила - кристаллический осадок белого цвета, Т.пл. 168-170°С. ИК (ν/cm-1): 2233 (CN), 1828 (АсО), 1654 (С=O), 1611 (Ar), 1151 (С-О). Масс-спектр (ЭУ, 70 эВ), m/z (%): 343 [М+] (100), 301 [М+-Ас] (100), 286 (53), 270 (20), 240 (10), 43 (40). ЯМР 1Н (CDCl3, J/Hz): 2.05 (s, 3Н, Ac), 2.19 (s, 3Н, OAc), 7.49 (t, J=7.4, 2H, Н(3'), H(5')), 7.60 (d, J=7.4, 2H, H(2'), Н(6')), 7.65 (t, J=7.4, 1Н, Н(4')), 7.71 (s, 1Н, H(7)), 9.00 (s, 1H, H(4)). ЯМР 13C (CDCl3): 17.48 (Me), 30.05 (Ac), 109.32, 109.84, 113.28, 114.60, 116.15, 116.39, 125.13, 126.90, 129.14 (2C), 130.01, 130.09 (2C), 131.28, 132.95, 146.89, 167.17, 193.78. Найдено (%): С, 69.84; H, 3.79; N, 12.21; C20H13N3O3. Вычислено (%): С, 69.96; Н, 3.82; N, 12.24.
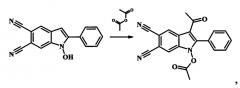
Пример 2. 3-ацетил-1-(ацетилокси)-2-(4-метилфенил)-1H-индол-5,6-дикарбонитрил
К 2 мл уксусного ангидрида прибавляют 0.002 моль 1-гидрокси-2-(4-метилфенил)-1H-индол-5,6-дикарбонитрил и 0.004 моль (0.5 мл) борфтортриэфирата BF3Et2O и нагревают при температуре 60°С при постоянном перемешивании в течение 10 мин. Затем реакционную массу охлаждают, растворяют в 20 мл холодной воды. Выпавший осадок отфильтровывают, промывают водой и перекристаллизовывают из ацетонитрила. Сушат на воздухе. Получают 0.68 г (95% от теории) 3-ацетил-1-(ацетилокси)-2-(4-метилфенил)-1H-индол-5,6-дикарбонитрила - кристаллический осадок белого цвета, Т.пл. 212-214°С. ИК (ν/cm-1): 2232 (CN), 1828 (АсО), 1653 (С=O), 1610, 1550 (Ar), 1147 (С-О). Масс-спектр (ЭУ, 70 эВ), m/z (%): 357 [М+] (33), 315 [М+-Ас] (100), 300 (57), 254 (27), 43 (51). ЯМР 1Н (CDCl3, J/Hz): 2.06 (s, 3Н, Ac), 2.20 (s, 3Н, Me), 2.49 (s, 3Н, OAc), 7.36 (d, J=7.9, 2H, Н(3'), Н(5')), 7.39 (d, J=7.9, 2Н, Н(2'), Н(6')), 7.70 (s, 1Н, Н(7)), 8.99 (s, 1Н, Н(4)). ЯМР 13С (CDCl3): 17.52 (Me), 21.60, 30.02, 109.22, 109.68, 113.20, 114.50, 116.20, 116.42, 123.78, 125.19, 129.82 (2С), 129.90, 129.93 (2С), 130.34, 132.93, 141.73, 167.17, 193.89 (С=O). Найдено (%): С, 70.43; Н, 4.18; N, 11.72; C21H15N3O3. Вычислено (%):С, 70.58; Н, 4.23; N, 11.76.
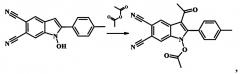
Пример 3. 3-ацетил-1-(ацетилокси)-2-(4-метоксифенил)-1H-индол-5,6-дикарбонитрил
К 2 мл уксусного ангидрида прибавляют 0.002 моль 1-гидрокси-2-(4-метоксифенил)-1H-индол-5,6-дикарбонитрил и 0.004 моль (0.5 мл) борфтортриэфирата BF3Et2O и нагревают при температуре 60°С при постоянном перемешивании в течение 15 мин. Затем реакционную массу охлаждают, растворяют в 20 мл холодной воды. Выпавший осадок отфильтровывают, промывают водой и перекристаллизовывают из ацетонитрила. Сушат на воздухе. Получают 0.68 г (91% от теории) 3-ацетил-1-(ацетилокси)-2-(4-метоксифенил)-1H-индол-5,6-дикарбонитрила - кристаллический осадок белого цвета, Т.пл. 208-209°С. ИК (ν/cm-1): 2230 (CN), 1819 (АсО), 1659 (С=O), 1609 (Ar), 1257, 1025 (ОМе). Масс-спектр (ЭУ, 70 эВ), m/z (%): 373 [М+] (99), 332 (92), 331 (98), 300 (100), 315 (62), 314 (99), 300 (65), 299 (89) 271 (99), 256 (52), 242 (50), 228 (100), 201 (82), 43 (99). ЯМР 1Н (CDCl3, J/Hz): 2.09 (s, 3Н, Ас), 2.21 (s, 3Н, ОАс), 3.92 (s, 3Н, ОМе), 7.09 (d, 2Н, J=8.7, Н(3'), H(5')), 7.40 (d, 2Н, J=8.7, Н(2'), Н(6')), 7.67 (s, 1H, Н(7)), 9.05 (s, 1Н, Н(4)). ЯМР 13С (CDCl3): 17.57, 30.01, 55.54, 109.11, 109.54, 113.14, 114.53, 114.63 (2С), 116.25, 116.48, 118.44, 125.22, 129.74, 131.68, 132.98 (2С), 147.25, 161.78, 167.23, 193.97 (С=O). Найдено (%): С, 67.41; Н, 4.01; N, 11.22; C21H15N3O4. Вычислено (%): С, 67.56; Н, 4.05; N, 11.25.
Пример 4. 3-ацетил-1-(ацетилокси)-2-(тиофен-2-ил)-1H-индол-5,6-дикарбонитрил
К 2 мл уксусного ангидрида прибавляют 0.002 моль 1-гидрокси-2-(2-тиенил)-1H-индол-5,6-дикарбонитрил и 0.004 моль (0.5 мл) борфтортриэфирата BF3Et2O и нагревают при температуре 65°С при постоянном перемешивании в течение 15 мин. Затем реакционную массу охлаждают, растворяют в 20 мл холодной воды. Выпавший осадок отфильтровывают, промывают водой и перекристаллизовывают из ацетонитрила. Сушат на воздухе. Получают 0.62 г (89% от теории) 3-ацетил-1-(ацетилокси)-2-(тиофен-2-ил)-1H-индол-5,6-дикарбонитрила - кристаллический осадок светло-желтого цвета, Т.пл. 198-200°С. ИК (ν/cm-1): 2227 (CN), 1817 (АсО), 1655 (С=O), 1607, 1553 (Ar), 1149 (С-О). Масс-спектр (ЭУ, 70 эВ), m/z (%): 349 [М]+ (70), 307 [M-Ac]+ (100), 292 (39), 290 (32), 275 (30), 246 (14), 43 (51). ЯМР 1Н (CDCl3, J/Hz): 2.20 (s, 3Н, Ас), 2.35 (s, 3Н, ОАс), 7.28 (dd, J=5.1, 3.6, 1Н, Н(4')) 7.37 (d.d, J=3.6 J=1.0, 1Н, Н(3')), 7.71 (s, 1Н, Н(7)), 7.75 (t, J=5.1, J=1.0, 1Н, Н(5')), 8.97 (s, 1Н, Н(4)). ЯМР 13С (CDCl3): 17.60, 29.56, 109.36, 110.20, 114.58, 114.85, 116.04, 116.28, 124.79, 125.30, 128.06, 130.00, 131.33, 133.07, 133.12, 139.35, 167.19, 193.65. Найдено (%):С, 61.75; Н, 3.13; N, 11.99; C18H11N3O3S. Вычислено (%): С, 61.88; Н, 3.17; N, 12.03.
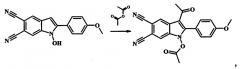
Пример 5. 5,6-дициано-3-пропил-2-(n-толил)-1H-индол-1-ил пропионат
К 2 мл пропионового ангидрида прибавляют 0.002 моль 1-гидрокси-2-(4-метилфенил)-1H-индол-5,6-дикарбонитрил и 0.004 моль (0.5 мл) бор-фтортриэфирата BF3Et2O и нагревают при температуре 65°С при постоянном перемешивании в течение 15 мин. Затем реакционную массу охлаждают, растворяют в 20 мл холодной воды. Выпавший осадок отфильтровывают, промывают водой и перекристаллизовывают из ацетонитрила. Сушат на воздухе. Получают 0.65 г (84% от теории) 5,6-дициано-3-пропил-2-(n-толил)-1H-индол-1-ил пропионата - кристаллический осадок белого цвета, Т.пл. 147-149°С. ИК (ν/cm-1): 2228 (CN), 1815 (АсО), 1660 (С=O), 1611 (Ar), 1142 (С-O). Масс-спектр (ЭУ, 70 эВ), m/z (%): 385 [М]+ (43), 329 (24), 300 (58), 284 (31), 254 (45), 57 (100). ЯМР 1Н (CDCl3, J/Hz): 21.04 (t, J=7.0, 3Н, Me), 1.12 (t, J=7.3, 3Н, Me), 2.37 (q, J=7.3, 2H, CH2), 2.50 (q, J=7.0, 2H, CH2), 7.38 (d, J=8.0, 2H, Н(3'), H(5')), 7.42 (d, J=8.0, 2H, H(2'), H(6')), 7.71 (s, 1H, H(7)), 9.05 (s, 1H, H(4)). ЯМР 13C (CDCl3): 8.09, 8.69, 21.60, 24.68, 35.08, 109.11, 109.57, 112.82, 114.47, 116.25, 116.45, 124.10, 125.32, 129.74 (2C), 129.87 (2C), 129.96, 133.03, 141.59, 146.60, 170.94, 197.22. Найдено (%):C, 71.51; H, 4.93; N, 10.88. C23H19N3O3. Вычислено (%): C, 71.67; H, 4.97; N, 10.90.
Пример 6. 5,6-дициано-3-пропил-2-(тиофен-2-ил)-1H-индол-1-ил пропионат
К 2 мл припионового ангидрида прибавляют 0.002 моль 1-гидрокси-2-(2-тиенил)-1H-индол-5,6-дикарбонитрил и 0.004 моль (0.5 мл) борфтортриэфирата BF3Et20 и нагревают при температуре 65°С при постоянном перемешивании в течение 15 мин. Затем реакционную массу охлаждают, растворяют в 20 мл холодной воды. Выпавший осадок отфильтровывают, промывают водой и перекристаллизовывают из ацетонитрила. Сушат на воздухе. Получают 0.61 г (81% от теории), 6-дициано-3-пропил-2-(тиофен-2-ил)-1H-индол-1-ил пропионата - кристаллический осадок светло-желтого цвета, Т.пл. 126-128°С. ИК (ν/cm-1): 2229 (CN), 1815 (АсО), 1709, 1661 (С=O), 1611 (Ar), 1044 (С-О). Масс-спектр (ЭУ, 70 эВ), m/z (%): 377 [М]+ (95), 321 (33), 304 (23), 292 (31), 276(31), 275 (29), 57 (100). ЯМР 1Н (CDCl3, J/Hz): 1.10 (t, J=7.3, 3Н, Me), 1.22 (t, J=7.3, 3Н, Me), 2.54 (q, J=7.2, 2H, CH2), 2.56-2.71 (m, 2Н, СН2), 7.31 (t, J=5.0, J=3.7, 1H, Н(4')), 7.39 (dd, J=3.7, 1.2, 1Н, H(3')), 7.73 (s, 1H, H(7)), 7.78 (d.d, J=5.0, 1.2, 1H, H(5')), 9.01 (s, 1H, H(4)). ЯМР 13C (CDCl3): 8.18, 8.72, 24.77, 34.76, 109.19, 110.05, 114.60, 116.10, 116.33, 124.89, 125.65, 127.97, 130.03, 131.09, 132.79, 133.17, 133.47, 138.75, 171.00, 197.04. Найдено (%): C, 63.53; H, 3.99; N, 11.11. C20H15N3O3S. Вычислено (%): C, 63.65; H, 4.01; N, 11.13.
Пример 7. 3-бутирил-5,6-дициано-2-(n-толил)-1H-индол-1-ил бутират
К 2 мл масляного ангидрида прибавляют 0.002 моль 1-гидрокси-2-(4-метилфенил)-1H-индол-5,6-дикарбонитрил и 0.004 моль (0.5 мл) борфтортриэфирата BF3Et2O и нагревают при температуре 70°С при постоянном перемешивании в течение 20 мин. Затем реакционную массу охлаждают, растворяют в 20 мл холодной воды. Выпавший осадок отфильтровывают, промывают водой и перекристаллизовывают из ацетонитрила. Сушат на воздухе. Получают 0.69 г (83% от теории) 3-бутирил-5,6-дициано-2-(n-толил)-1H-индол-1-ил бутирата - кристаллический осадок белого цвета, Т.пл. 131-133°С. ИК (ν/cm-1): 2227 (CN), 1813 (АсО), 1659 (С=O), 1610 (Ar), 1038 (С-О). Масс-спектр (ЭУ, 70 эВ), m/z (%): 413 [М]+ (58), 343 (19), 326 (15), 300 (28), 284 (39), 71 (100). ЯМР 1Н (CDCl3, J/Hz): 0.73 (t, J=7.3, 3Н, Me), 0.81 (t, J=7.3, 3Н, Me) 1.54 (m, J=7.3, 4H, CH2), 2.28 (t, J=7.3, 2H, CH2), 2.41 (t, J=7.3, 2H, CH2), 2.49 (s, 3H, Me), 7.34 (d, J=8.2, 2H, H(3'), H(5')), 7.37 (d, J=8.2, 2H, H(2'), H(6')), 7.64 (s, 1H, H(7)), 9.00 (s, 1H, H(4)). ЯМР 13C (CDCl3): 13.19, 13.62, 17.83, 18.06, 21.58, 32.76, 43.47, 109.13, 109.59, 113.01, 114.42, 116.26, 116.45, 124.05, 125.37, 129.66, 129.95 (2C), 130.01 (2C), 133.03, 141.59, 146.66, 170.01, 196.87. Найдено (%): C, 72.49; H, 5.57; N, 10.14. C25H23N3O3. Вычислено (%): C, 72.62; H, 5.61; N, 10.16.
Пример 8. 3-бутирил-5,6-дициано-2-(тиофен-2-ил)-1H-индол-1-ил бутират
К 2 мл масляного ангидрида прибавляют 0.002 моль 1-гидрокси-2-(2-тиенил)-1H-индол-5,6-дикарбонитрил и 0.004 моль (0.5 мл) борфтортриэфирата BF3Et2O и нагревают при температуре 70°С при постоянном перемешивании в течение 20 мин. Затем реакционную массу охлаждают, растворяют в 20 мл холодной воды. Выпавший осадок отфильтровывают, промывают водой и перекристаллизовывают из ацетонитрила. Сушат на воздухе. Получают 0.64 г (79% от теории) 3-бутирил-5,6-дициано-2-(тиофен-2-ил)-1H-индол-1-ил бутирата - кристаллический осадок светло-желтого цвета, Т.пл. 106-107°С. ИК (ν/cm-1): 2234 (CN), 1816 (АсО), 1662 (С=O), 1610, 1555 (Ar), 1050 (С-О). Масс-спектр (ЭУ, 70 эВ), m/z (%): 405 [М+] (58). ЯМР lH (CDCl3, J/Hz): 0.79 (t, J=7.3, 3Н, Me), 0.91 (t, J=7.2, 3Н, Me), 1.54-1.71 (m, 4H, CH2), 2.43 (t, J=7.3, 2Н, СН2), 2.52 (t, J=7.2, 2Н, СН2), 7.27 (dd, J=5.0, 3.6, 1Н, Н(4')), 7.35 (dd, J=3.6, 1.0, 1Н, Н(3')), 7.67 (s, 1Н, Н(7)), 7.74 (dd, J=5.0, 1.0, 1Н, Н(5')), 8.96 (s, 1Н, Н(4)). ЯМР 13С (CDCl3): 13.35, 13.66, 17.88, 18.10, 32.85, 43.27, 76.64, 77.06, 77.49, 109.20, 110.07, 114.57, 114.77, 116.11, 116.31, 124.94, 125.60, 127.92, 129.99, 131.11, 132.89, 133.18, 138.82, 170.04, 196.66. Найдено (%): С, 65.04; Н, 4.69; N, 10.33 C22H19N3O3S. Вычислено (%): С, 65.17; Н, 4.72; N, 10.36.
Техническим результатом изобретения является получение новых химических соединений достаточной степени чистоты, которые могут быть использованы в качестве прекурсоров для синтеза биологически активных веществ, лекарственных препаратов, фталоцианинов, гексазоцикланов.
Способ получения 3-ацилзамещенных 2-арил(гетерил)-1H-индол-5,6-дикарбонитрилов общей формулы:
где R1=СОСН3, или СОС2Н5, или СОС3Н7;
R2=С6Н5, или 4-СН3С6Н4, или 4-ОСН3С6Н4, или 2-тиенил;
R3=СН3, или С2Н5, или С3Н7,
заключающийся в нагревании 2-замещенных 1-гидрокси-1H-индол-5,6-дикарбонитрилов в среде ангидридов алифатических карбоновых кислот (уксусного, пропионового, масляного) в присутствии борфтортриэфирата (BF3Et2O) при температуре 55…70°С в течение 5-20 мин, с последующим охлаждением полученной реакционной массы, растворением в десятикратном избытке холодной воды, отфильтровыванием выпавшего осадка 1,2,3-тризамещенных 1H-индол-5,6-дикарбонитрилов, промыванием водой, перекристаллизацией из ацетонитрила и сушкой на воздухе.